Souhrnné informace o léku - MINESSE
1. NÁZEV PŘÍPRAVKU
MINESSE 0,060 mg/0,015 mg potahované tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna světle žlutá potahovaná (aktivní) tableta obsahuje gestodenum 0,060 mg a ethinylestradiolum 0,015 mg.
Bílé potahované tablety neobsahují žádné léčivé látky (placebo).
Pomocné látky se známým účinkem:
Tablety s léčivou látkou (aktivní) obsahují 39,84 mg monohydrátu laktózy.
Tablety bez léčivé látky (neaktivní) obsahují 39,90 mg monohydrátu laktózy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Potahované tablety.
Potahované tablety s léčivou látkou jsou světle žluté, kulaté, bikonvexní, na jedné straně mají vyraženo „60“, na druhé straně mají vyraženo „15“.
Potahované tablety bez léčivé látky jsou bílé, kulaté, bikonvexní, bez dalšího označení.
4. KLINICKÉ ÚDAJE
4.1. Terapeutické indikace
Prevence otěhotnění.
Rozhodnutí předepsat přípravek Minesse by mělo být provedeno po zvážení jednotlivých současných rizikových faktorů ženy, zvláště rizikových faktorů pro žilní tromboembolismus (VTE), a toho, jaké je riziko VTE u přípravku Minesse v porovnání s dalšími přípravky CHC (kombinovaná hormonální antikoncepce) (viz body 4.3 a 4.4).
4.2. Dávkování a způsob podání
Tablety 1–24 obsahují léčivé látky (aktivní tablety).
V 28-denním balení tablety 25–28 neobsahují žádnou léčivou látku (neaktivní tablety).
Tablety se musí užívat v pořadí uvedeném na balení každý den přibližně ve stejnou denní dobu. Užívá se jedna aktivní tableta denně po 24 po sobě jdoucích dní, dále pak 4 inaktivní tablety či 4-denní přestávka v užívání. Tablety z nového balení se začínají užívat následující den po poslední aktivní tabletě. Krvácení z hormonálního spádu obvykle 2.-3. den po užití poslední aktivní tablety a nemusí skončit do zahájení užívání z nového balení.
Pokud v předchozím měsíci nebyla podávána žádná hormonální antikoncepce
Začíná se prvním dnem menstruačního cyklu (tj. prvním dnem menstruačního krvácení). Užívání je možno zahájit také 2. – 7. den cyklu (např. v neděli), avšak po prvních 7 dnech užívání tablet se doporučuje používat ještě doplňkovou nehormonální antikoncepční metodu (např. kondom, spermicidy).
Přechod z jiné CHC (kombinovaná hormonální antikoncepce)
Preferenčně první tabletu přípravku Minesse má žena užít následující den po užití poslední účinné tablety CHC, nejpozději však následující den po obvyklém období bez užívání tablet, nebo po užívání tablet bez léčivé látky.
Přechod z čistě progestinové antikoncepce (mikrotableta, injekce, nitroděložní tělísko, implantát)
- Žena může přejít kterýkoli den z mikrotablet s obsahem samotného progestinu tak, že následující den začne místo nich užívat přípravek Minesse.
- Podávání přípravku Minesse musí být zahájeno v den odstranění implantátu či nitroděložního tělíska.
- Podávání přípravku Minesse musí být zahájeno v den, kdy má být podána další injekce.
Žena má být vždy upozorněna na nutnost použít ještě doplňkovou nehormonální metodu antikoncepce po dobu prvních 7 dní podávání přípravku Minesse.
Užívání po potratu v prvním trimestru
Užívání může začít okamžitě. Doplňková antikoncepce není nutná.
Užívání po porodu nebo potratu ve druhém trimestru
Vzhledem ke zvýšenému riziku tromboembolie v časném poporodním období by užívání přípravku Minesse nemělo začít dříve, než 28 dní po porodu u nekojících matek, nebo po potratu ve druhém trimestru Ženy mají být upozorněny, že po prvních 7 dní užívání tablet mají současně používat dodatečnou nehormonální metodu antikoncepce. Pokud však již došlo k pohlavnímu styku, je třeba před zahájením užívání přípravku Minesse vyloučit těhotenství nebo počkat na první menstruační krvácení (viz také bod 4.4 . Tromboembolická nemoc a arteriální tromboembolie, a bod 4.6.).
Pokud dojde k opomenutí užít tabletu a zvláště pokud zapomenuté aktivní tablety překročí do období užívání neaktivních účinných tablet, může dojít ke snížení antikoncepčního účinku.
- Když pacientka zapomene užít jednu aktivní tabletu, měla by si ji vzít nejpozději do 12 hodin od běžné doby užívání. Další tablety se užívají v obvyklou dobu.
- Jestliže doba od užití poslední aktivní tablety přesáhne 12 hodin, antikoncepční ochrana může být snížena. Poslední zapomenutá tableta se má užít co nejdříve, jakmile si to pacientka uvědomí. Další tablety se užívají v obvyklou dobu, a to i v případě, že by v jeden den měly být užity dvě tablety. Avšak po následujících 7 dní je nutné používat nějakou doplňkovou nehormonální antikoncepční metodu.
Dojde-li ke zvracení nebo průjmu do 4 hodin po užití tablety, nemusí dojít k úplnému vstřebání obsažených látek. V takovém případě se postupuje jako při zapomenuté tabletě (viz výše – Zapomenuté užití tablety). Žena musí užít samostatnou aktivní tabletu (tablety) z náhradního balení.
Prodloužení menstruačního cyklu pacientka docílí, jestliže začne místo neaktivních tablet užívat nové balení přípravku Minesse. Období bez menstruačního krvácení může trvat podle přání pacientky až do využívání druhého balení. V průběhu však může dojít ke krvácení z průniku nebo ke špinění. K pravidelnému užívání přípravku Minesse se pak pacientka vrací po užití 4 neaktivních tablet.
4.3. Kontraindikace
Kombinovaná hormonální antikoncepce (CHC) by se neměla používat u následujících stavů:
- Přítomnost nebo riziko žilního tromboembolismu (VTE)
o žilní tromboembolismus – současný žilní tromboembolismus (léčený pomocí antikoagulancií) nebo anamnéza VTE (např. hluboká žilní trombóza [DVT] nebo plicní embolie [PE])
o známá dědičná nebo získaná predispozice pro žilní tromboembolismus, jako je rezistence na APC (včetně faktoru V Leiden), deficit antitrombinu III, deficit proteinu C, deficit proteinu S o velký chirurgický zákrok s déletrvající imobilizací (viz bod 4.4)
o vysoké riziko žilního tromboembolismu v důsledku přítomnosti více rizikových faktorů (viz bod 4.4);
- Přítomnost nebo riziko arteriálního tromboembolismu (ATE)
o arteriální tromboembolismus – současný arteriální tromboembolismus, anamnéza arteriálního tromboembolismu (např. infarkt myokardu) nebo prodromální stav (např. angina pectoris);
o cerebrovaskulární onemocnění – současná cévní mozková příhoda, anamnéza cévní mozkové příhody nebo prodromálního stavu (např. tranzitorní ischemická ataka, TIA);
o známá hereditární nebo získaná predispozice k arteriálnímu tromboembolismu, jako je hyperhomocysteinemie a antifosfolipidové protilátky (antikardiolipinové protilátky, lupus antikoagulans);
o anamnéza migrény s fokálními neurologickými příznaky;
o vysoké riziko arteriálního tromboembolismu v důsledku vícečetných rizikových faktorů (viz bod 4.4) nebo přítomnosti jednoho závažného rizikového faktoru, jako je:
- diabetes mellitus s cévními příznaky;
- závažná hypertenze;
- závažná dyslipoproteinemie.
- Přecitlivělost na některou z léčivých či pomocných látek přípravku Minesse.
- Trombogenní valvulopatie.
- Trombogenní poruchy srdeční frekvence.
- Dědičná nebo získaná trombofilie.
- Diagnostikovaný nebo suspektní karcinom prsu, nebo jiný diagnostikovaný nebo suspektní estrogen-dependentní nádor
- Jaterní adenom nebo karcinom nebo akutní jaterní onemocnění, dokud se jaterní testy nevrátí k normálním hodnotám
- Vaginální krvácení neznámé etiologie .
- Zánět slinivky břišní spojený s hypertriglyceridemií (nyní nebo v minulosti)
- Diagnostikované nebo suspektní těhotenství.
Přípravek Minesse je kontraindikovaný při současném užívání léčivých přípravků obsahujících ombitasvir/paritaprevir/ritonavir a dasabuvir (viz body 4.4 a 4.5).
4.4. Zvláštní upozornění a opatření pro použití
Přípravek obsahuje laktózu. Pacientkám se vzácnými poruchami tolerance galaktózy, deficience laktázy, malabsorpce glukózy-galaktózy by přípravek neměl být podáván.
Kouření cigaret zvyšuje riziko závažných kardiovaskulárních nežádoucích účinků užíváním CHC. Toto riziko se zvyšuje s věkem a s mírou kouření a je zcela zřetelné u žen věku nad 35 let. Ženy, které užívají CHC, by měly být důrazně upozorněny, že nesmí kouřit.
Pokud jsou přítomna jakákoli onemocnění nebo rizikové faktory uvedené níže, měla by být vhodnost přípravku Minesse s ženou prodiskutována.
-
V případě zhoršení nebo prvního výskytu jakéhokoli z těchto stavů nebo rizikových faktorů by mělo být ženě doporučeno, aby kontaktovala svého lékaře, který stanoví, zda by měla užívání přípravku Minesse ukončit.
Riziko žilního tromboembolismu (VTE)
Užívání jakékoli kombinované hormonální antikoncepce (CHC) zvyšuje riziko žilního tromboembolismu (VTE) ve srovnání s jejím neužíváním. Přípravky, které obsahují levonorgestrel, norgestimát nebo norethisteron jsou spojovány s nejnižším rizikem VTE. Další přípravky, jako je přípravek Minesse mohou mít až dvakrát vyšší úroveň rizika. Rozhodnutí používat jakýkoli přípravek jiný než ten, který má nejnižší riziko VTE, by mělo být učiněno po diskusi se ženou, aby se zajistilo, že rozumí riziku VTE u přípravku Minesse, rozumí, jak její současné rizikové faktory toto riziko ovlivňují a že riziko VTE je nejvyšší v prvním roce užívání léku. Existují také některé důkazy, že riziko je zvýšené, když je CHC opětovně zahájena po pauze v užívání trvající 4 týdny nebo déle.
U žen, které neužívají CHC a nejsou těhotné, se asi u 2 z 10 000 vyvine VTE v průběhu jednoho roku. U každé jednotlivé ženy však může být riziko daleko vyšší v závislosti na jejích základních rizikových faktorech (viz níže).
Odhaduje se1, že z 10 000 žen, které používají CHC obsahující gestoden se u 9 až 12 žen vyvine VTE během jednoho roku; v porovnání s přibližně 6 případy2 u žen, které používají CHC obsahující levonorgestrel.
VTE může být fatální v 1–2 % případů.
1 Tyto incidence byly odhadnuty ze souhrnu dat z epidemiologických studií s použitím relativních rizik pro různé přípravky ve srovnání s CHC obsahující levonorgestrel.
2 Střední bod rozmezí 5–7 na 10 000 WY (žen-roků) na základě relativního rizika pro CHC obsahující levonorgestrel oproti jejímu nepoužívání přibližně 2,3 až 3,6
Počet příhod VTE na 10 000 žen za rok
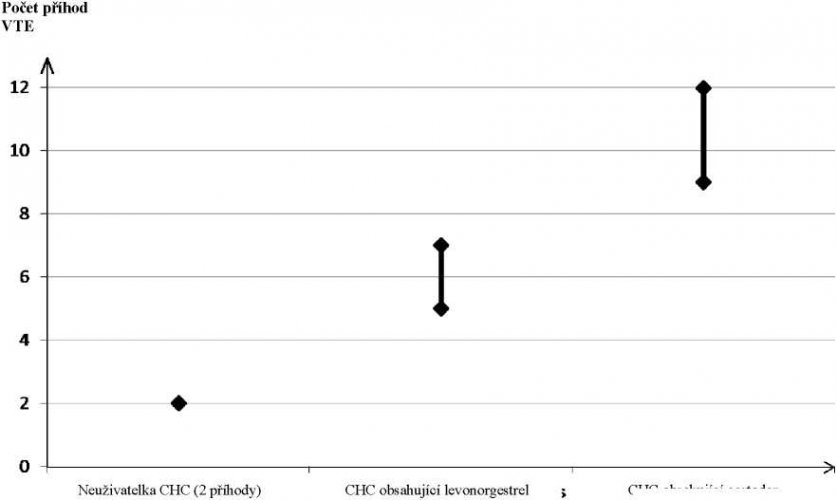
(5–7 příhod)
CHC ob<ahující gestoden (9–12 příhod)
Pokud se objeví příznaky, které svědčí o možných komplikacích: prudké a neobvyklé bolesti hlavy, poruchy vidění, zvýšený krevní tlak, klinické příznaky flebitidy a plicní embolie, je nutné užívání ukončit.
Užívání CHC zvyšuje riziko vzniku příhod tromboembolické nemoci.
Epidemiologické studie prokázaly, že výskyt tromboembolické nemoci u pacientek užívajících nízko-estrogenová kontraceptiva (do 50 mcg ethinylestradiolu) se pohybuje od 20 do 40 případů na 100 tisíc žen – roků. Tento odhad rizika se liší v závislosti na množství progestinu. Ve srovnání s 5 až 10 případy na 100 tisíc žen-roků u žen, které přípravky neužívají.
Údaje porovnávající riziko příhod tromboembolické nemoci u CHC s obsahem gestodenu a 15 mcg ethinylestradiolu (jako je přípravek Minesse) nejsou k dispozici.
Odhaduje se, že se celkové relativní riziko vzniku příhod tromboembolické nemoci po používání CHC obsahující 30 mcg ethinylestradiolu s desogestrelem nebo gestodenem ve srovnání s přípravky obsahující méně než 50 mcg ethinylestradiolu a levonorgestrel pohybuje mezi 1,5 až 2,0.
Incidence příhod tromboembolické nemoci po užívání CHC obsahující levonorgestrel v kombinaci s méně než 50 mcg ethinylestradiolu je přibližně 20 případů na 100 tisíc žen roků.
U CHC s obsahem 30 mcg ethinylestradiolu v kombinaci s desogestrelem nebo gestodenem je tato incidence přibližně 30–40 případů na 100 tisíc žen-roků., tj. o 10–20 případů na 100 tisíc žen-roků více. Extrémně vzácně byla hlášena trombóza u uživatelek CHC v dalších cévách, např. jaterních, mezenterických, renálních nebo retinálních žilách a tepnách.
Všechny uvedené informace mají být brány v úvahu při výběru vhodné antikoncepční metody a při předepisování CHC.
Riziko žilních tromboembolických komplikací u uživatelek CHC se může podstatně zvyšovat u ženy, která má další rizikové faktory, zvláště pokud je přítomno více rizikových faktorů (viz tabulka).
Přípravek Minesse je kontraindikován, pokud má žena více rizikových faktorů, které pro ni představují vysoké riziko žilní trombózy (viz bod 4.3). Pokud má žena více než jeden rizikový faktor, je možné, že zvýšení rizika je vyšší než součet jednotlivých faktorů – v tomto případě by mělo být zváženo její celkové riziko VTE. Pokud je poměr přínosů a rizik považován za negativní, neměla by být CHC předepisována (viz bod 4.3).
Tabulka: Rizikové faktory VTE
| Rizikový faktor | Poznámka |
| Obezita (index tělesné hmotnosti nad 30 kg/m2) | Při zvýšení BMI se významně zvyšuje riziko. Zvláště důležité je zvážit, zda jsou také přítomny další rizikové faktory. |
| Prodloužená imobilizace, velký chirurgický zákrok, jakýkoli chirurgický zákrok na nohách a pánvi, neurochirurgický zákrok nebo větší trauma. Poznámka: dočasná imobilizace, včetně cestování letadlem > 4 hodiny může být také rizikovým faktorem VTE, zvláště u žen s dalšími rizikovými faktory | V těchto situacích je doporučeno ukončit používání/užívání náplasti/pilulky/kroužku (v případě plánovaného chirurgického výkonu minimálně 4 týdny předem) a nezahajovat užívání/používání do dvou týdnů po kompletní remobilizaci. Měla by se použít další antikoncepční metoda pro zabránění nechtěnému těhotenství. Antitrombotická léčba by měla být zvážena, pokud přípravek Minesse nebyl předem vysazen. |
| Pozitivní rodinná anamnéza (žilní tromboembolismus kdykoli u sourozence nebo rodiče, zvláště v relativně nízkém věku např. do 50 let věku). | Pokud je suspektní hereditární predispozice, měla by být žena před rozhodnutím o používání jakékoli CHC odeslána k odborníkovi na konzultaci |
| Další onemocnění související s VTE | Zhoubné onemocnění, systémový lupus erythematodes, hemolyticko-uremický syndrom, chronické zánětlivé onemocnění střev (Crohnova choroba nebo ulcerózní kolitida) a srpkovitá anémie |
| Vyšší věk | Zvláště nad 35 let |
Není žádná shoda o možné roli varixů a povrchové tromboflebitidy v nástupu nebo progresi žilní trombózy.
Zvýšené riziko tromboembolismu v těhotenství a zvláště během šestinedělí musí být zváženo (pro informaci o „Těhotenství a kojení “ viz bod 4.6).
V případě příznaků by mělo být ženě doporučeno, aby vyhledala naléhavou lékařskou péči a informovala lékaře, že užívá CHC.
Příznaky hluboké žilní trombózy (DVT) mohou zahrnovat:
-
– jednostranný otok nohy a/nebo chodidla nebo podél žíly v noze;
-
– bolest nebo citlivost v noze, která může být pociťována pouze vstoje nebo při chůzi;
-
– zvýšenou teplotu postižené nohy, zarudnutí nebo změnu barvy kůže nohy.
-
– náhlý nástup nevysvětlitelné dušnosti nebo rychlého dýchání;
-
– náhlý kašel, který může být spojený s hemoptýzou;
-
– ostrou bolest na hrudi;
-
– těžké točení hlavy nebo závrať způsobené světlem;
-
– rychlý nebo nepravidelný srdeční tep.
Některé z těchto příznaků (např. „dušnost“, „kašel“) nejsou specifické a mohou být nesprávně interpretovány jako častější nebo méně závažné příhody (např. infekce dýchacího traktu).
Dalšími známkami cévní okluze mohou být: náhlá bolest, otok a světle modré zbarvení končetin.
Pokud nastane okluze v oku, mohou se příznaky pohybovat od nebolestivého rozmazaného vidění, které může přejít do ztráty zraku. Někdy může nastat ztráta zraku téměř okamžitě.
Epidemiologické studie spojovaly používání CHC se zvýšeným rizikem arteriálního tromboembolismu (infarkt myokardu) nebo cerebrovaskulární příhody (např. tranzitorní ischemická ataka, cévní mozková příhoda). Arteriální tromboembolické příhody mohou být fatální.
Riziko arteriálních tromboembolických komplikací nebo cerebrovaskulární příhody u uživatelek CHC se zvyšuje u žen s rizikovými faktory (viz tabulka). Přípravek Minesse je kontraindikován, pokud má žena jeden závažný rizikový faktor nebo více rizikových faktorů ATE, které pro ni představují riziko arteriální trombózy (viz bod 4.3). Pokud má žena více než jeden rizikový faktor, je možné, že zvýšení rizika je vyšší než součet jednotlivých faktorů – v tomto případě by mělo být zváženo její celkové riziko. Pokud je poměr přínosů a rizik považován za negativní, neměla by být CHC předepisována (viz bod 4.3).
Tabulka: Rizikové faktory ATE
| Rizikový faktor | Poznámka |
| Vyšší věk | Zvláště nad 35 let |
| Kouření | Ženě by mělo být doporučeno, aby nekouřila, pokud chce používat CHC. Ženám ve věku nad 35 let, které dále kouří, by mělo být důrazně doporučeno, aby používaly jinou metodu antikoncepce. |
| Hypertenze | |
| Obezita (index tělesné hmotnosti nad 30 kg/m2) | Při zvýšení BMI se významně zvyšuje riziko. Zvláště důležité u žen s dalšími rizikovými faktory |
| Pozitivní rodinná anamnéza (arteriální tromboembolismus kdykoli u sourozence nebo rodiče, zvláště v relativně nízkém věku např. do 50 let věku). | Pokud je suspektní hereditární predispozice, měla by být žena odeslána k odborníkovi na konzultaci před rozhodnutím o používání jakékoli CHC |
| Migréna | Zvýšení frekvence nebo závažnosti migrény během používání CHC (což může být prodromální známka cévní mozkové příhody) může být důvodem okamžitého ukončení léčby |
| Další onemocnění související s | Diabetes mellitus, hyperhomocysteinemie, chlopenní srdeční |
| nežádoucími cévními příhodami | vada a fibrilace síní, dyslipoproteinemie a systémový lupus erythematodes. |
V případě příznaků by mělo být ženě doporučeno, aby vyhledala naléhavou lékařskou péči a informovala lékaře, že užívá CHC.
Příznaky cévní mozkové příhody mohou zahrnovat:
-
– náhlou necitlivost nebo slabost obličeje, paže nebo nohy, zvláště na jedné straně těla;
-
– náhlé potíže s chůzí, závratě, ztrátu rovnováhy nebo koordinace;
-
– náhlou zmatenost, problémy s řečí nebo porozuměním;
-
– náhlé potíže se zrakem na jednom nebo obou očích;
-
– náhlou, závažnou nebo prodlouženou bolest hlavy neznámé příčiny;
-
– ztrátu vědomí nebo omdlení s nebo bez záchvatu.
-
– bolest, nepříjemný pocit, tlak, těžkost, pocit stlačení nebo plnosti na hrudi, v paži nebo pod hrudní kostí;
-
– nepříjemný pocit vyzařující do zad, čelisti, hrdla, paže, žaludku;
-
– pocit plnosti, poruchu trávení nebo dušení;
-
– pocení, nauzeu, zvracení nebo závratě;
-
– extrémní slabost, úzkost nebo dušnost;
-
– rychlý nebo nepravidelný srdeční tep.
Oční léze
U žen, užívajících CHC byla pozorována trombóza cév sítnice, která může vést k částečnému nebo úplnému oslepnutí. V případě příznaků jako jsou poruchy vidění, protruze nebo diplopie, edém papily nebo vaskulární léze sítnice, je třeba ihned přerušit užívání CHC a vyšetřit příčiny.
Krevní tlak
U žen, užívajících CHC bylo pozorováno zvýšení krevního tlaku.
U žen s hypertenzí, s hypertenzí v anamnéze nebo s chorobami spojenými s hypertenzí (včetně některých onemocnění ledvin) je lepší dát přednost jiné metodě antikoncepce. Pokud užívají CHC, doporučuje se jejich přísné sledování; při signifikantním zvýšení krevního tlaku je třeba okamžité přerušení užívání.
Používání CHC je kontraindikováno u žen s nezvládnutelnou hypertenzí (viz bod 4.3.).
Karcinom reprodukčních orgánů
Karcinom děložního čípku
Nejdůležitějším rizikovým faktorem pro rakovinu děložního hrdla je přetrvávající infekce lidským papilomavirem. Některé studie svědčí o možné spojitosti užívání CHC s rizikem intraepiteliálních nádorů nebo invazivní rakoviny děložního čípku v určité populaci žen. Stále však přetrvávají polemiky o tom, do jaké míry jsou tyto nálezy způsobeny rozdíly v sexuálním chování a dalšími faktory. V případě nenormálního genitálního krvácení neznámého původu, je třeba využít adekvátní diagnostické metody ke zjištění jeho příčiny.
Rakovina prsu
Rizikovými faktory pro tvorbu rakoviny prsu jsou vyšší věk, rodinná anamnéza, obezita, nulliparita a první těhotenství v pozdním věku.
Metaanalýza výsledků 54 epidemiologických studií prokazuje mírně zvýšené relativní riziko (1,24) diagnostikované rakoviny prsu u žen užívajících CHC v porovnání s těmi, které ji nikdy neužívaly.
Zvýšené riziko postupně mizí v průběhu 10 let od ukončení užívání CHC. Tyto studie neposkytují průkaz příčiny. Pozorované zvýšení rizika diagnostikované rakoviny prsu může být důsledkem časnějšího odhalení rakoviny prsu u uživatelek CHC (protože jsou pravidelněji klinicky sledovány), nebo důsledkem užívání CHC, nebo důsledkem obou kombinací. Protože rakovina prsu je u žen do 40 let věku vzácná, převýšení počtu diagnostikovaných případů u žen, které užívají nebo užívaly CHC je malé v porovnání s celoživotním rizikem rozvoje rakoviny prsu. U uživatelek perorální antikoncepce je diagnostikovaná rakovina prsu klinicky méně rozvinutá než u žen, které nikdy perorální antikoncepci neužívaly.
Jaterní neoplazie/Jaterní onemocnění
Užívání CHC je spojeno ve velmi vzácných případech s jaterním adenomem a v extrémně vzácných případech s hepatocelulárním karcinomem. Riziko se zvyšuje s délkou užívání CHC. Ruptura adenomu jater může skončit smrtí v důsledku intraabdominální hemoragie.
U pacientek s cholestázou v důsledku užívání CHC v anamnéze nebo u žen, které měly cholestázu v těhotenství, je rozvoj těchto stavů při užívání CHC pravděpodobnější. Jestliže tyto pacientky užívají CHC, mají být pozorně sledovány, a pokud se stavy vrátí, je třeba užívání CHC ukončit.
Po podávání CHC bylo hlášeno hepatocelulární poškození. Časné odhalení hepatocelulárního poškození, vyvolaného lékem, a vysazení léku může snížit závažnost hepatotoxicity. Je-li diagnostikováno hepatocelulární poškození, pacientky by měly ukončit užívání CHC, začít používat některou formu nehormonální antikoncepce a poradit se s lékařem.
Akutní nebo chronické poruchy jaterních funkcí si mohou vynutit přerušení užívání CHC dokud se funkce jater nevrátí k normálu.
Migréna/ bolest hlavy
Nástup nebo exacerbace migrény nebo rozvoj bolesti hlavy s novými příznaky, které se opakují, přetrvávají, nebo jsou závažné, vyžadují přerušení užívání CHC a vyšetření příčiny.
Ženy s migrénou (zvláště spojenou s aurou), které užívají CHC, mají zvýšené riziko iktu (viz také bod 4.3).
Imunitní
Angioedém
Exogenní estrogeny mohou vyvolat nebo zhoršit příznaky angioedému, a to zejména u žen s hereditárním angioedémem.
Lékařské vyšetření/konzultace
Před dalším zahájením léčby přípravkem Minesse by měla být získána kompletní anamnéza (včetně rodinné anamnézy) a musí být vyloučeno těhotenství. Měl by se změřit krevní tlak a mělo by být provedeno tělesné vyšetření při zvážení kontraindikací (viz bod 4.3) a varování (viz bod 4.4). Je důležité, aby byla žena upozorněna na informace o žilní a arteriální trombóze, včetně rizika přípravku Minesse v porovnání s dalšími typy CHC, na příznaky VTE a ATE, známé rizikové faktory a co by měla dělat v případě suspektní trombózy.
Žena by také měla být informována, aby si pečlivě přečetla příbalovou informaci pro uživatele a aby dodržovala uvedené instrukce. Frekvence a povaha vyšetření by měly být založeny na stanovených postupech a upraveny podle individuálních potřeb ženy.
Ženy by měly být informovány, že hormonální antikoncepce nechrání před HIV infekcí (AIDS) a dalšími sexuálně přenosnými chorobami.
Účinek na hladiny cukrů a lipidů
U uživatelek perorální antikoncepce byla pozorována glukózová intolerance. Pacientky s diabetem nebo s poruchou glukózové tolerance, které užívají CHC, mají být pečlivě monitorovány (viz bod 4.3).
Malý podíl žen má nežádoucí změny hladin tuků při užívání CHC. U žen s nezvládnutelnou dyslipidemií by se mělo uvažovat o nehormonální antikoncepci. U malého počtu uživatelek CHC se může rozvinout perzistentní hypertriglyceridemie. Zvýšení hladiny triglyceridů v krvi může vést k pankreatitidě a dalším komplikacím.
Estrogeny zvyšují sérové hladiny lipoproteinů s vysokou hustotou (HDL cholesterol), zatímco u řady progestinů bylo zjištěno snížení hladiny HDL cholesterolu. Některé progestiny mohou zvyšovat hladiny lipoproteinů s nízkou hustotou (LDL) a mohou ztížit zvládnutí hyperlipidemie. Výsledný účinek CHC závisí na vyváženosti dávek estrogenu a progestinu a na typu a celkovém množství progestinů v kontraceptivu. Při výběru vhodného CHC je třeba brát v úvahu dávky obou hormonů.
Pokud se pacientky léčené na hyperlipidemii rozhodnou užívat CHC, je třeba je pečlivě sledovat.
Zvýšené opatrnosti je třeba dbát u žen, u kterých se během těhotenství nebo užíváním CHC vyskytly nebo zhoršily stavy, především u pacientek, které mají nebo v minulosti trpěli: epilepsií, migrénou, otosklerózou, astmatem, cévními poruchami v rodinné anamnéze, křečovými žilami, herpes gestitationis, žlučovými kameny, SLE, srdeční, renální a jaterní nedostatečností, depresí, hypertenzí, choreou, hemolyticko uremickým syndromem.
V klinických studiích byla u 7% cyklů pozorována amenorea, která neměla souvislost s těhotenstvím (vyskytla se u 24% žen v průběhu celé doby trvání klinických studií) a u 3,6% žen byly pozorovány opakované amenoreické cykly.V klinických studiích byla amenorea příčinou ukončení užívání pouze u 1% žen.
Genitální krvácení
U některých žen se v době užívání tablet bez léčivé látky nemusí dostavit krvácení z hormonálního spádu. Pokud nebyl CHC správně užíván předtím, než došlo k prvnímu vynechání krvácení z hormonálního spádu, nebo pokud se nedostaví krvácení z hormonálního spádu 2× za sebou, je třeba ihned přerušit užívání a až do vyloučení možného otěhotnění používat náhradní nehormonální metodu antikoncepce.
U žen, užívajících CHC, se může objevit krvácení z průniku/špinění, a to zvláště v průběhu prvních 3 měsíců užívání. Jestliže tyto stavy přetrvávají nebo se opakují, je třeba uvažovat o nehormonální příčině a využít k tomu přiměřené diagnostické metody. Po vyloučení patologických jevů je možno pokračovat v užívání CHC, nebo zvážit užívání jiného přípravku.
U některých žen se po přerušení užívání může objevit amenorea (někdy s anovulací) nebo oligomenorea, zvláště, pokud se tyto stavy objevovaly již před užíváním přípravku.
Deprese
Uživatelky CHC s depresí v anamnéze mají být pečlivě sledovány, a pokud se deprese vrátí a má těžký průběh, je třeba užívání přípravku přerušit. Ženy, které se v průběhu užívání CHC stávají signifikantně depresivními mají přerušit užívání a používat alternativní metodu antikoncepce a pozorovat, zda příznaky mají příčinnou souvislost s užíváním antikoncepce.
Pokud se v průběhu těhotenství nebo při předchozím užívání CHC vyskytlo melazma/chloazma, je třeba se vyhýbat slunečnímu záření, čímž se minimalizuje možnost jejich exacerbace.
Ostatní
Průjem a/nebo zvracení může snížit absorpci léčivých látek, což může vést ke snížení jejich koncentrací v séru (viz také bod 4.2. a 4.5.).
Zvýšení hladiny ALT
Během klinických studií u pacientek léčených pro virovou hepatitidu C (HCV) léčivými přípravky obsahujícími ombitasvir/paritaprevir/ritonavir a dasabuvir s ribavirinem nebo bez ribavirinu, došlo k zvýšení aminotransferázy (ALT) na více než 5násobek horní hranice normálních hodnot (ULN) výrazně častěji u žen, které užívaly přípravky obsahující ethinylestradiol, jako jsou kombinovaná hormonální kontraceptiva (CHC) (viz body 4.3 a 4.5).
Pediatrická populace
Bezpečnost a účinnost CHC byla stanovena u žen v reprodukčním věku. Použití těchto přípravků před menarche není indikováno.
Starší pacienti
Užívání CHC není indikována u žen po menopauze.
4.5. Interakce s jinými léčivými přípravky a jiné formy interakce
Interakce ethinylestradiolu s některými látkami mohou vést ke snížení nebo zvýšení hladin ethinylestradiolu v séru.
Snížené hladiny ethinylestradiolu v séru mohou být příčinou zvýšené incidence krvácení z průniku a menstruačních nepravidelností a mohou snižovat účinnost CHC.
V průběhu současného užívání přípravků s obsahem ethinylestradiolu a látek, které mohou vést ke snížení jeho hladin v séru, se doporučuje současně s pravidelným užíváním CHC používat ještě náhradní nehormonální antikoncepční metodu (např. kondom, spermicid). V případě prolongovaného užívání těchto léků nelze takové užívání CHC považovat za primární antikoncepční metodu.
Ještě nejméně 7 dalších dní po ukončení užívání látek, které mohou vést ke snížení hladin ethinylestradiolu v séru, se doporučuje používat nějakou náhradní nehormonální antikoncepční metodu. Delší používání náhradní nehormonální antikoncepční metody je žádoucí po ukončení užívání látek, které vedly k indukci jaterních mikrosomálních enzymů, což vedlo ke snížení hladin ethinylestradiolu v séru. V závislosti na dávce, délce užívání a na míře eliminace induktora trvá někdy až několik týdnů, než indukce enzymů úplně přestane.
Příklady látek, které mohou snižovat hladinu ethinylestradiolu v séru:
-
– všechny látky snižující dobu průchodu gastrointestinálním traktem, a tím i absorpci (např. laxativa),
-
– látky indukující jaterní mikrosomální enzymy, např.: Rifampicin, rifabutin, barbituráty, primidon, fenylbutazon, fenytoin, dexametazon, griseofulvin, topiramát, některé inhibitory proteáz, modafinil
-
– třezalka tečkovaná (Hypericum perforatum) a ritonavir* (možná indukcí jaterních mikrosomálních enzymů),
-
– atorvastatin,
-
– kompetitivní inhibitory sulfationu ve stěně GIT, např. askorbová kyselina (vitamin C) a paracetamol (acetaminophen),
-
– látky, inhibující isoenzymy cytochromu P 450 3A4, např. indinavir, flukonazol a troleandomycin*
Troleandomycin při současném užívání CHC může zvyšovat riziko intrahepatální cholestázy.
Ethinylestradiol může spolupůsobit na metabolizaci jiných léčiv inhibicí jaterních mikrosomálních enzymů, nebo indukcí konjugace léčiv v játrech, především glukuronidace. Podle toho mohou být plazmatické a tkáňové koncentrace buď zvýšené (např. cyklosporin, teofylin, kortikosteroidy), nebo snížené (např.lamotrigin).
U pacientů léčených flunarizinem při užívání CHC bylo zaznamenáno zvýšení rizika galactorey.
Při předepisování léků, které se mají užívat současně, je třeba konzultovat dostupné informace, aby se předešlo potenciálním interakcím.
*Ačkoliv ritonavir je inhibitorem cytochromu P450 3A4, léčba ritonavirem ukázala snížení hladin ethinylestradiolu v séru. Viz výše.
Farmakodynamické interakce
Souběžné podávání s léčivými přípravky obsahujícími ombitasvir/paritaprevir/ritonavir a dasabuvir s ribavirinem nebo bez ribavirinu může zvýšit riziko zvýšení hladiny ALT (viz body 4.3 a 4.4).
Proto je třeba uživatelky přípravku Minesse před zahájením léčby tímto kombinovaným léčebným režimem převést na alternativní antikoncepční metodu (např. antikoncepcí obsahující jen gestagen nebo nehormonální metody antikoncepce). Přípravek Minesse je možné znovu začít užívat 2 týdny po ukončení léčby tímto kombinovaným léčebným režimem.
Užívání CHC může způsobit určité fyziologické změny, které se mohou promítnout do výsledků některých laboratorních testů, včetně:
- biochemických parametrů jaterních funkcí (včetně snížení bilirubinu a alkalické fosfatázy), funkcí štítné žlázy (zvýšený celkový T3 a T4 v důsledku zvýšení TBG, snížení volného T3), funkcí nadledvin (zvýšená hladina kortizolu v plazmě, zvýšení kortizol vážícího globulinu, snížení dehydroepiandrosteron sulfátu, (DHEAS), a funkcí ledvin (zvýšená hladina kreatininu a zvýšení clearance kreatininu),
- plazmatických hladin transportních bílkovin, jako jsou kortikosteroidy vážící globuliny a lipidy/lipoproteinové frakce,
- parametrů metabolismu cukrů,
- parametrů koagulace a fibrinolýzy,
- poklesu hladiny folátů v séru.
4.6. Fertilita, těhotenství a kojení
Před zahájením užívání přípravku Minesse je třeba vyloučit těhotenství. Pokud dojde k početí v průběhu užívání CHC, přípravek se musí okamžitě přestat užívat. Neexistuje žádný přesvědčivý důkaz, že estrogen a progestin obsažený v CHC poškodí vyvíjející se dítě v případě nechtěného početí během užívání CHC. Viz bod 4.3
Zvýšené riziko VTE během poporodního období je třeba brát v úvahu při znovuzahájení užívání přípravku Minesse (viz bod 4.2 a 4.4).
V mléce kojících matek byla identifikována malá množství antikoncepčních steroidů a/nebo metabolitů a u kojených dětí bylo pozorováno několik nežádoucích účinků, např. žloutenka a zvětšení prsů. CHC mohou ovlivnit kojení tak, že může snížit produkci a změnit složení mateřského mléka.
Užívání CHC v době kojení se obecně nedoporučuje.
4.7. Účinky na schopnost řídit a obsluhovat stroje
Nepředpokládá se.
4.8. Nežádoucí účinky
Nežádoucí účinky jsou seřazeny podle kategorií četnosti:
| Velmi časté Časté Méně časté Vzácné Velmi vzácné Není známo | > 1/10
< 1/10 000 z dostupných údajů nelze určit |
Popis vybraných nežádoucích účinků
Podávání CHC vyvolávalo:
- zvýšené riziko arteriálních a žilních trombotických a tromboembolických příhod včetně infarktu myokardu, cévní mozkové příhody, tranzitorních ischemických atak, žilní trombózy a plicní embolie a je podrobněji popsáno v bodě 4.4,
- zvýšené riziko rozvoje intraepiteliálních nádorů a rakoviny děložního čípku,
- zvýšené riziko diagnózy rakoviny prsu
- zvýšené riziko benigních jaterních nádorů (např. fokální nodulární hyperplazie, jaterní adenom).
Zánět pochvy včetně vaginální kandidózy
Velmi vzácné Hepatocelulární karcinom
| Poruchy imunitního systému Vzácné | Anafylaktické/anafylaktoidní reakce, včetně velmi vzácných případů kopřivky, angioedém a závažné reakce s respiračními a oběhovými příznaky |
| Velmi vzácné | Exacerbace systémového lupus erythematodes |
| Poruchy metabolismu a výživy Časté Méně časté | Změny hmotnosti (zvýšení nebo snížení) Změny hladin sérových lipidů, včetně hypertriglyceridemie, změny chuti k jídlu (zvýšení nebo snížení) |
| Vzácné | Snížení sérové hladiny kyseliny listové*, intolerance glukózy |
| Velmi vzácné | Exacerbace porfyrie |
Časté
Velmi časté
Časté
Velmi vzácné
Vzácné
Velmi vzácné
Méně časté
Vzácné
Velmi vzácné
Časté
Méně časté
Velmi vzácné
Není známo
Změny nálady, včetně deprese; změny libida
Bolest hlavy, včetně migrény
Nervozita; závratě
Exacerbace chorey
Nesnášenlivost kontaktních čoček Neuritida optiku**; trombóza cév sítnice
Zvýšení krevního tlaku
Vzácné
Velmi vzácné
Není známo
Žilní tromboembolismus (VTE), arteriální
tromboembolismus (ATE)
Zhoršení křečových žil
Nauzea, zvracení, bolest břicha
Křeče břicha; nadýmání
Pankreatitis, ischemická kolitida
Zánětlivé onemocnění střev (Crohnova choroba, ulcerózní kolitida)
Cholestatická žloutenka
Onemocnění žlučníku, včetně cholelitiázy*** Hepatocelulární poškození (např. hepatitida, porucha funkce jater)
Časté
Méně časté
Vzácné
Velmi vzácné
Velmi vzácné
Velmi časté
Časté
Akné
Exantém; chloasma (melasma), která může přetrvávat; hirsutismus, alopecie
Erythema nodosum
Erythema multiforme
Hemolyticko-uremický syndrom
Krvácení z průniku/špinění
Bolest prsů; citlivost prsů; zvětšení prsů; výtok; dysmenorea, změna menstruačního krvácení; změna ektropia děložního čípku a sekrece; amenorea
Celkové poruchy a reakce v místě aplikace
Velmi časté
Zadržování tekutin/edém
* Užívání CHC může snížit hladiny folátů v séru. To může být klinicky významné, pokud žena otěhotní
krátce po vysazení CHC.
** Zánět očního nervu může vést k částečnému nebo úplnému oslepnutí.
*** CHC může zhoršit existující poruchy žlučníku a může urychlit rozvoj těchto nemocí u žen, které byly předtím bez příznaků.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky:
4.9. Předávkování
Příznaky předávkování perorální antikoncepce u dospělých a dětí mohou zahrnovat nauzeu, zvracení, citlivost a bolestivost prsů, závratě, bolesti břicha, ospalost/únavu; u žen se může objevit krvácení z hormonálního spádu. Neexistuje specifické antidotum a další léčení, je-li nezbytné, se řídí příznaky.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1. Farmakodynamické vlastnosti
Farmakoterapeutická skupina: pohlavní hormony a modulátory genitálního systému, hormonální antikoncepce pro systémové použití, progestogeny a estrogeny, fixní kombinace.
ATC kód: G03AA10
Mechanismus účinku
CHC účinkují tak, že potlačují gonadotropiny. Ačkoli primárním mechanismem tohoto účinku je inhibice ovulace, spolupůsobí i další faktory, jako je změna cervikální sekrece (která činí přístup spermií do dělohy obtížnějším) a změny endometria (snižuje se pravděpodobnost nidace vajíčka).
Pokud se CHC užívají důsledně a správně, pravděpodobné selhání je 0,1% ročně, ale míra selhání během obvyklého použití je 5% ročně pro všechny druhy perorální antikoncepce. Účinnost většiny metod antikoncepce závisí na spolehlivosti, s níž jsou používány. Selhání je pravděpodobnější, jestliže se vynechá užití tablet.
5.2. Farmakokinetické vlastnosti
Absorpce
Gestoden se rychle a úplně absorbuje z gastrointestinálního traktu. Po perorální aplikaci má téměř úplnou biologickou dostupnost (99%). Maximální koncentrace v séru 2–6 mg/ml se dosáhne přibližně hodinu po užití.
Distribuce
V séru se gestoden primárně váže (50–70%) na proteiny (SHBG) a v menší míře na albumin. Pouze minimální podíl gestodenu (1–2%) je v plazmě přítomen ve formě volné látky. Ta má obzvláště vysokou afinitu ke specifické vazbě na SHBG. Po opakovaném podání je možno v plasmě pozorovat akumulaci gestodenu. Ustáleného stavu látky se dosahuje ve druhé polovině léčebného cyklu
Metabolismus
Gestoden je plně metabolizován redukcí 3-keto skupiny a A-4 dvojné vazby a postupnou hydroxylací. Průměrná clearance séra je 0,8 – 1,0 ml/min/kg. Přítomnost gestodenu neměla žádný signifikantní účinek na kinetiku ethinylestradiolu při současném podání gestodenu s ethinylestradiolem
Eliminace
Sérové hladiny gestodenu se snižují ve dvou fázích. Celkový poločas eliminace gestodenu je přibližně 1720 hodin. Po opakovaném perorálním podání přípravku Minesse se zvyšuje celkový poločas gestodenu na 20–28 hodin. Metabolity gestodenu jsou vyloučeny z velké míry močí a dále stolicí.
Absorpce
Ethinylestradiol se rychle a úplně absorbuje z gastrointestinálního traktu. V důsledku výrazného first-pass metabolismu jeho průměrná biologická dostupnost je asi 40–60% a značně závisí na individuální variabilitě. Po jednotlivé dávce se dosahuje maximální sérové koncentrace do 1–2 hodin.
Distribuce
Ethinylestradiol se silně váže na sérový albumin (přibližně 98 %), a indukuje zvýšení sérové koncentrace SHBG. Po opakované perorální dávce se zvyšuje plasmatická koncentrace ethinylestradiolu asi o 25–50% a ustáleného stavu se dosahuje v průběhu druhé poloviny léčebného cyklu.
Metabolismus
Ethinylestradiol podléhá presystémové konjugaci a prochází enterohepatickým oběhem. Je primárně metabolizován aromatickou hydroxylací enzymy cytochromu P450 za vzniku celé řady hydroxyl- a metylderivátů, které jsou přítomny jako volné metabolity a jako konjugáty s kyselinou glukuronovou a sírovou.
Eliminace
Pokles sérových hladin ethinylestradiolu probíhá ve dvou fázích. Celkový poločas eliminace ethinylestradiolu v ustáleném stavu je přibližně 16 – 18 hodin. Metabolity jsou vyloučeny ve větší míře stolicí než močí.
5.3. Předklinické údaje vztahující se k bezpečnosti přípravku
Toxikologické studie byly provedeny pro jednotlivé složky přípravku samostatně a v kombinaci.
Studie akutní toxicity na zvířatech neprokázaly riziko akutních příznaků v případech náhodného předávkování.
Studie obecné toxicity neprokázaly při opakovaném dávkování přítomnost žádných účinků, které by pro člověka mohly představovat nějaké neočekávané riziko.
Dlouhodobé studie karcinogenity po opakovaném podávání neprokázaly karcinogenní potenciál; je třeba však mít na paměti, že pohlavní steroidní hormony mají schopnost podpořit rozvoj určitých tkání na hormon-dependentní tumory.
Studie teratogenity neprokázaly žádné zvláštní riziko, pokud byla kombinace estrogenu s progestinem užívána správně; avšak v případě nevědomého podávání přípravku na začátku těhotenství je třeba užívání zastavit ihned po prokázání těhotenství.
Studie mutagenity neprokázaly žádný mutagenní potenciál ethinylestradiolu a gestodenu.
6. FARMACEUTICKÉ ÚDAJE
6.1. Seznam pomocných látek
Aktivní tablety
Jádro tablety:
Monohydrát laktosy
Mikrokrystalická celulosa
Draselná sůl polakrilinu
Magnesium-stearát
Potah tablety:
Hypromelosa 2910/6
Oxid titaničitý (E171)
Žlutý oxid železitý (E172)
Červený oxid železitý (E172)
Makrogol 1500
Montanglykolový vosk
Neaktivní tablety
Jádro tablety:
Monohydrát laktosy
Mikrokrystalická celulosa
Draselná sůl polakrilinu
Magnesium-stearát
nebo
Monohydrát laktosy
Kukuřičný škrob
Magnesium-stearát
Potah tablety:
Hypromelosa 2910/3
Hypromelosa 2910/6
Hyprolosa
Oxid titaničitý (E171)
Hypromelosa 2910/50
Makrogol 400Makrogol 1500,
Montanglykolový vosk
6.2. Inkompatibility
Neuplatňuje se.
6.3. Doba použitelnosti
3 roky.
6.4. Zvláštní opatření pro uchovávání
Tento přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.5. Druh obalu a velikost balení
PVC/Al blistr. Blistry jsou uloženy v zataveném hliníkovém sáčku s vysoušedlem silikagel. Jeden blistr obsahuje 24 světle žlutých a 4 bílé potahované tablety.
Přípravek Minesse je k dispozici v balení s 1 × 28, 3 × 28 potahovanými tabletami.
Na trhu nemusí být všechny velikosti balení.
6.6. Návod k použití přípravku, zacházení s ním a k jeho likvidaci
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Pfizer, spol.s r.o.
Stroupežnického 17
150 00 Praha 5
Česká republika
8. REGISTRAČNÍ ČÍSLO(A)
17/123/00-C
9. DATUM PRVNÍ REGISTRACE/ PRODLOUŽENÍ REGISTRACE
1.3.2000 / 23.3.2011
Další informace o léčivu MINESSE
Jak
se MINESSE
podává: perorální podání - potahovaná tableta
Výdej
léku: na lékařský předpis
Balení: Blistr
Velikost
balení: 1X28 II
Držitel rozhodnutí o registraci daného léku v České republice:
Pfizer, spol. s r.o., Praha
E-mail: Medicalinfo.cz@pfizer.com
Telefon: 283 004 111
