Souhrnné informace o léku - LEVOSERT
1. NÁZEV PŘÍPRAVKU
Levosert 20 mikrogramů/24 hodin intrauterinní inzert
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Léčivou látkou je levonorgestrelum.
Intrauterinní inzert obsahuje levonorgestrelum 52 mg. Počáteční rychlost uvolňování je přibližně 20 mikrogramů za den a snižuje se po 3 letech na přibližně 12 mikrogramů za den.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Intrauterinní inzert (IUS).
Přípravek se skládá ze zavaděče a IUS s levonorgestrelem, který je umístěn na hrotu zavaděče. Součástí zavaděče je zaváděcí trubička, píst, patka, tělo a posuvná část. Inzert se skládá bílého nebo téměř bílého hormon-elastomerového jádra umístěného na tělísku ve tvaru T. Jádro je kryto neprůhlednou trubičkou, která řídí uvolňování levonorgestrelu. Tělísko ve tvaru T má na jednom konci vertikální části smyčku a na druhém konci dvě horizontální raménka. Ke smyčce jsou připojena vlákna pro vyjmutí.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Kontracepce.
Léčba silného menstruačního krvácení. Přípravek Levosert může být zvláště vhodný u žen se silným menstruačním krvácením, které požadují (reverzibilní) kontracepci.
4.2 Dávkování a způsob podání
Začátek léčby
U žen ve fertilním věku se má přípravek Levosert zavést do dutiny děložní během prvních sedmi dnů od začátku menstruace. Může být nahrazen novým systémem kdykoli během cyklu.
Zavedení po porodu: Aby se snížilo riziko perforace, je třeba zavedení po porodu odložit až do kompletní involuce dělohy. Nesmí být zavedeno dříve, než 6 týdnů po porodu. Pokud má pacientka silné poporodní krvácení a/nebo bolest, je třeba před zavedením vyloučit infekci nebo jiné příčiny. Přípravek Levosert může být zaveden také ihned po potratu v prvním trimestru.
V indikaci kontracepce a silného menstruačního krvácení je přípravek Levosert účinný po dobu 4 let. Proto je třeba jej po 4 letech používání odstranit.
Pokud si uživatelka přeje ve stejné metodě pokračovat, může být ihned zaveden nový systém a v tomto případě není třeba žádná další ochrana.
Pediatrická populace
Přípravek Levosert nebyl studován u pacientek mladších než 16 let. Přípravek Levosert nemá být použitý před začátkem menarche.
Porucha funkce jater
Přípravek Levosert je kontraindikovaný u pacientek s nádory jater nebo s jiným akutním nebo závažným onemocněním jater (viz bod 4.3).
Návod k použití přípravku a zacházení s ním
Levosert je dodáván ve sterilním obalu, který nesmí být otevřen, dokud to není třeba z důvodu jeho zavedení. S přípravkem je třeba po otevření sterilního obalu zacházet asepticky. Pokud je uzávěr sterilního balení narušený, přípravek je třeba znehodnotit (viz bod 6.6 informace pro likvidaci přípravku).
Jak se přípravek Levosert zavádí
Důrazně se doporučuje, aby přípravek Levosert zaváděl jen lékař/zdravotnický pracovník, který má již zkušenosti se zaváděním IUS s levonorgestrelem a/nebo je v zavádění IUS s levonorgestrelem dostatečně proškolený.
V případě obtížného zavádění a/nebo neobvyklé bolesti či krvácení během zavádění nebo následně po něm postupujte podle bodu 4.4.
Přípravek Levosert se dodává sterilní, sterilizace se provádí pomocí etylenoxidu. Přípravek znovu nesterilizujte. Jen pro jednorázové užití. Nepoužívejte, pokud je vnitřní obal poškozený nebo otevřený. Nezavádějte po datu uvedeném na štítku.
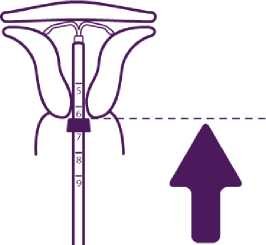
Přípravek Levosert se zavádí do dutiny děložní za použití přiloženého zavaděče (obrázek 1) a je třeba pečlivě dodržovat pokyny pro zavádění.
Následující pokyny pro zavádění jsou uložené také v krabičce s IUS.
Popis
válec obsahující levonorgestrel
O kroužek
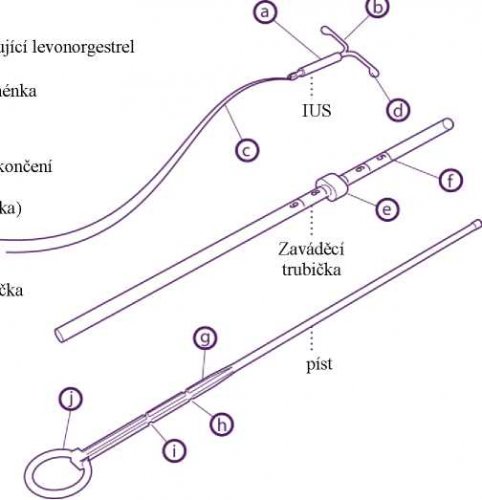
© laterální raménka © vlákna
zaoblená zakončení
patka (zarážka)
stupnice
© zesílená značka
první zářez
druhý zářez
Podmínky pro použití
-
1. U žen ve fertilním věku se má přípravek Levosert zavést do dutiny děložní během prvních sedmi dnů od začátku menstruace. Může být nahrazen novým systémem kdykoli během cyklu.
-
2. Důrazně se doporučuje, aby přípravek Levosert zaváděl jen lékař/zdravotnický pracovník, který je v zavádění dostatečně proškolený a který si před zaváděním přípravku Levosert pečlivě pročetl tyto pokyny.
-
3. Přípravek Levosert se dodává ve sterilním balení, které nesmí být otevřeno, dokud to není z důvodu zavedení nutné. S rozbaleným přípravkem je třeba manipulovat tak, aby byla zajištěna asepse. Nepoužívejte jej, pokud je vnitřní obal poškozený nebo otevřený.
-
4. Gynekologickým vyšetřením určete pozici dělohy (anteverze, retroverze) a její velikost. Vylučte těhotenství a kontraindikace.
-
5. Zaveďte do pochvy poševní zrcadla, použijte vhodný dezinfekční roztok k výplachu vaginy a očištění hrdla děložního.
-
6. Pokud je diagnostikována cervikální stenóza, užijte cervikální dilatátory. Neužívejte násilí, abyste překonali rezistenci.
-
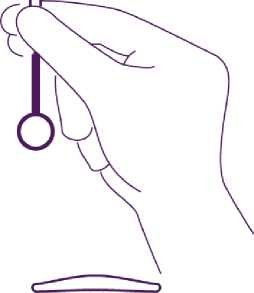
7. Uchopte cervix vhodným nástrojem a mírným tahem stáhněte hrdlo a narovnejte dělohu.
-
8. Změřte délku dutiny děložní hysterometrií. Pokud je délka dělohy < 5,5 cm, ukončete proceduru.

■:
–
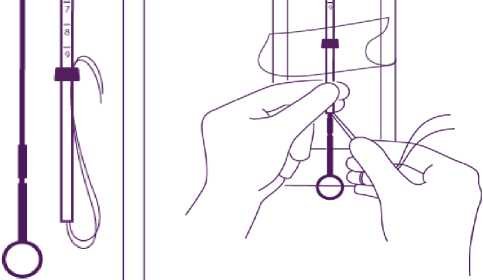
Zaveďte píst a IUS do zaváděcí trubičky
Částečně otevřete blistr (asi do 1/3 od spodní strany) a zaveďte píst do zaváděcí trubičky. Uvolněte vlákna z patky. Tahem za vlákna zatáhněte IUS do trubičky. Raménka tělíska musí zůstat v horizontální poloze, rovnoběžně s plochou stranou patky (zarážky).
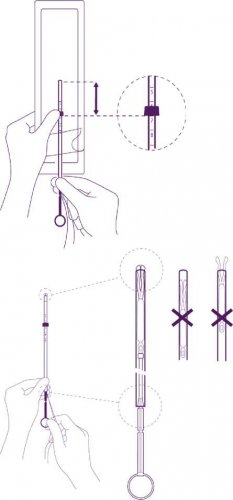
Zavádění
Umístěte spodní hranu patky (zarážky) na správné místo
Pozice modré patky (zarážky) a spodní hrany patky (zarážky) označuje hodnotu zjištěnou při hysterometrii. Plochá strana patky musí vždy zůstat paralelně s raménky. To umožní správné otevření ramének v dutině děložní.
Upravte pozici IUS v zaváděcí trubičce
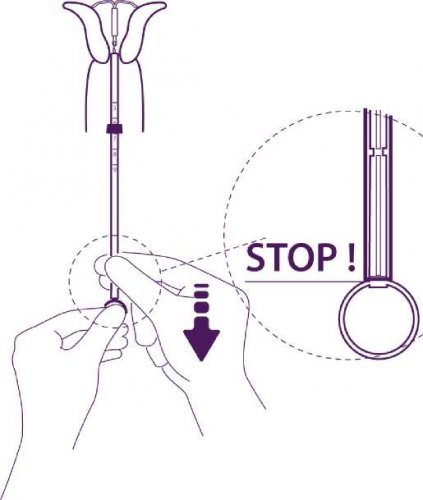
Pro upravení pozice IUS držte pevně píst a táhněte za vlákna a pohybujte trubičkou.
Zaoblená zakončení laterálních ramének musí být těsně proti sobě, mírně nad horním okrajem zaváděcí trubičky (viz detailní obrázek č. 1) a distální okraj trubičky musí být v místě prvního zářezu na pístu (viz detailní obrázek č. 2). Pokud není trubička v úrovni prvního zářezu na pístu, musíte zatáhnout za vlákna silněji.
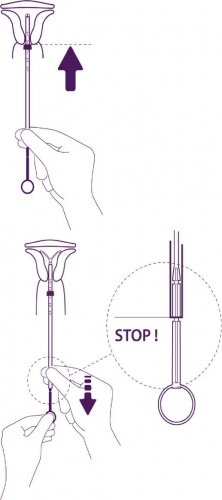
Zavedení tělíska do cervikálního kanálu až je modrá patka v kontaktu s cervixem
Vytáhněte celé tělísko z blistru a přitom držte pevně píst a trubičku spolu ve správně upravené pozici.
Zaveďte soustavu do cervikálního kanálu až se modrá patka (zarážka) dotýká hrdla.
Uvolnění ramének nitroděložního tělíska
Držte píst, uvolněte vlákno a táhněte zaváděcí trubičku dolů, až její dolní konec dosáhne druhého zářezu na pístu.
Zatlačte IUS proti fundu
Pro umístění IUS v děložní dutině zatlačte současně na zaváděcí trubičku a píst, až se modrá patka (zarážka) opět dotkne hrdla.
Přípravek Levosert je pak v dutině děložní správně umístěn.
Uvolnění IUS z trubičky do dutiny děložní
Aniž byste pohybovali pístem, zatáhněte zaváděcí trubičku dolů až ke kroužku pístu.
Mírný odpor znamená průchod rozšířené
X
části pístu. Nicméně zatáhněte trubičku až dolů ke kroužku.
I
I
Přípravek Levosert je pak zcela uvolněný ze
/
zaváděcí trubičky.
f
/
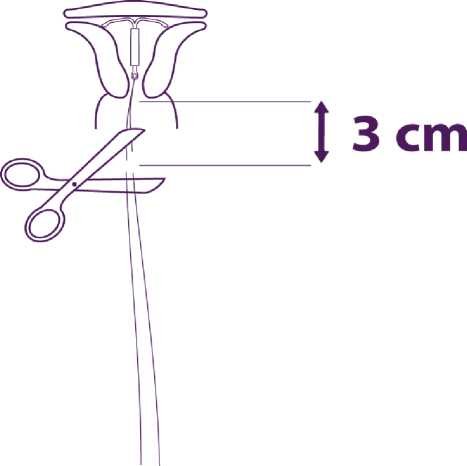
Odstraňte postupně součásti zavaděče a ustřihněte vlákna
Odstraňte postupně nejdříve píst a poté zaváděcí trubičku,
Ustřihněte vlákna asi 3 cm od cervixu.
V případě obtížného zavádění a/nebo neobyčejně silné bolesti nebo krvácení během zavádění nebo po něm je třeba provést fyzikální a ultrasonografické vyšetření k vyloučení perforace těla dělohy nebo cervixu. V případě potřeby systém odstraňte a zaveďte nový, sterilní systém.
Prosím nahlaste jakýkoli případ perforace dělohy nebo problémy se zaváděním na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky:
Jak přípravek Levosert vyjmout
Přípravek Levosert se odstraňuje jemným tahem za vlákna pomocí peanu. Pokud nejsou vlákna viditelná a tělísko je v dutině děložní, může být odstraněno za použití úzkého peanu. To si může vyžádat dilataci děložního kanálu.
Pokud žena nechce otěhotnět, je třeba inzert u ženy ve fertilním věku vyjmout během menstruace, za předpokladu, že u ní dochází k menstruačnímu krvácení. Pokud je inzert odstraněný uprostřed cyklu a žena měla v předchozím týdnu pohlavní styk, je zde riziko otěhotnění, pokud není ihned po vyjmutí zavedený nový inzert.
Po vyjmutí přípravku Levosert je třeba zkontrolovat, zda je systém intaktní. Při obtížném vyjímání byly hlášeny jednotlivé případy, kdy váleček obsahující hormon sklouzl přes horizontální raménka a ta byla tímto spolu ukryta uvnitř válečku. Pokud bylo ověřeno, že je systém kompletní, není v této situaci třeba žádný další zásah. Kuličky na konci ramének obvykle zabrání kompletnímu oddělení válečku od T-těla systému.
4.3 Kontraindikace
-
– Těhotenství nebo suspektní těhotenství;
-
– Současná nebo rekurentní infekce v oblasti pánve;
-
– Záněty v oblasti genitálu;
-
– Poporodní endometritida;
-
– Infikovaný potrat během posledních 3 měsíců;
-
– Cervicitida, cervikální dysplazie;
-
– Suspektní nebo potvrzené zhoubné bujení dělohy nebo děložního hrdla;
-
– Tumor jater nebo jiné akutní nebo závažné onemocnění jater;
-
– Vrozené nebo získané anomálie dělohy včetně myomů, pokud deformují děložní dutinu;
-
– Diagnosticky neobjasněné abnormální děložní krvácení;
-
– Stavy spojené se zvýšenou náchylností k infekcím;
-
– Potvrzené nebo suspektní hormonálně dependentní tumory, jako je karcinom prsu (viz bod 4.4);
-
– Akutní malignity postihující krev nebo leukemie kromě období remise;
-
– Nedávná trofoblastická nemoc, dokud jsou hladiny hCG zvýšené;
-
– Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Lékařské vyšetření
Před zavedením je třeba odebrat kompletní osobní a rodinnou anamnézu. Na základě této anamnézy, kontraindikací a upozornění pro použití je třeba provést fyzikální vyšetření. Je třeba změřit puls a krevní tlak a bimanuálním vyšetřením určit polohu dělohy. Pacientku je třeba opakovaně vyšetřit 6 týdnů po zavedení přípravku a další vyšetření je třeba provádět v případě klinické indikace a přizpůsobit je spíše každé ženě individuálně, než je provádět rutinně. Před zavedením je třeba vyloučit těhotenství a řádně vyléčit genitální infekce. Ženu je třeba poučit, že přípravek Levosert nechrání před HIV (AIDS) a jinými sexuálně přenosnými nemocemi (prosím, podívejte se do bodu níže týkajícího se infekcí v oblasti pánve).
Ženu je třeba poučit, aby se dostavovala na screeningové vyšetření hrdla děložního a prsů, které odpovídá jejímu věku.
Stavy, kdy je třeba použít přípravek Levosert s opatrností
Pokud je přítomen kterýkoli z následujících stavů nebo dojde-li během léčby k jeho prvnímu výskytu, je třeba užít přípravek Levosert s opatrností po konzultaci s odborníkem nebo je třeba zvážit odstranění přípravku:
-
– Migréna, fokální migrenózní záchvaty s asymetrickou ztrátou zorného pole nebo jiné symptomy tranzitorní mozkové ischemie
-
– Neobvykle silná nebo častá bolest hlavy
-
– Žloutenka
-
– Výrazné zvýšení krevního tlaku
-
– Malignity postihující krev nebo leukemie v remisi
-
– Užívání dlouhodobé kortikosteroidní léčby
-
– Symptomatické funkční ovariální cysty v anamnéze
-
– Závažné arteriální onemocnění aktivní nebo v anamnéze, jako je cévní mozková příhoda nebo infarkt myokardu
-
– Závažné nebo vícečetné rizikové faktory pro arteriální onemocnění
-
– Trombotické arteriální nebo jakékoli současné embolické onemocnění
-
– Akutní venózní tromboembolismus
S opatrností může být přípravek Levosert použit u žen s vrozeným onemocněním srdce nebo s chlopenním srdečním onemocněním, kde existuje riziko infekční endokarditidy. Nepravidelné krvácení může skrývat některé symptomy a příznaky endometriálních polypů nebo karcinomu a v těchto případech je třeba zvážit diagnostická opatření.
Obecně je třeba ženy používající přípravek Levosert vést k tomu, aby přestaly kouřit.
Upozornění a opatření pro zavedení/vyjmutí
Obecná informace: Zavedení a vyjmutí tělíska může být spojeno s bolestí a krvácením. V případě obtížného zavádění a/nebo neobyčejně silné bolesti nebo krvácení během zavádění nebo po něm, je třeba provést fyzikální a ultrasonografické vyšetření k vyloučení perforace těla dělohy nebo cervixu (viz také „Perforace“).
Výkon může navodit mdlobu v důsledku vazovagální reakce nebo záchvat u pacientek s epilepsií V případě časných příznaků vazovagální ataky může být potřeba zavádění přerušit nebo systém odstranit. V případě potřeby je třeba ženu uložit do polohy na zádech, s hlavou níže a dolními končetinami zdviženými do vertikální polohy, aby se obnovil cerebrální průtok krve. Je třeba udržovat volné dýchací cesty; musí být stále po ruce dýchací přístroj (ambuvak). Přetrvávající bradykardii je možné korigovat intravenózním podáním atropinu. Je možné podat kyslík, je-li dostupný.
Perforace: Může dojít k perforaci děložního těla nebo hrdla, nejčastěji během zavádění, ačkoli to může být někdy zjištěno až později. To může být spojeno se silnou bolestí a neustávajícím krvácením. Pokud je podezření na perforaci, systém musí být co nejdříve odstraněn; může být potřeba i chirurgický zákrok. Incidence perforace během zavádění nebo po zavedení přípravku Levosert v klinické studii, ze které byly vyloučeny kojící ženy, byla 0,1 %.
V rozsáhlé prospektivní srovnávací neintervenční kohortové studii u uživatelek IUS/IUD (N=61 448 žen) byla incidence perforace v celé studijní kohortě 1,3 na 1000 zavedení (95% CI: 1,1–1,6); 1,4 v kohortě jiných LNG-IUS (95 % CI: 1,1–1,8) a 1,1 na 1000 zavedení v kohortě IUD s mědí (95% CI: 0,7–1,6).
Studie ukázala, že jak kojení v době zavedení, tak zavedení do 36 týdnů po porodu bylo spojeno se zvýšeným rizikem perforace (viz tabulka 1). Tyto rizikové faktory byly nezávislé na typu zavedeného IUS/IUD.
Tabulka 1: Incidence perforace na 1000 zavedení pro celou studijní kohortu, rozdělená podle kojení a doby od porodu v době zavedení (rodící ženy).
| Kojení v době zavedení | Bez kojení v době zavedení | |
| Zavedení < 36 týdnů po porodu | 5,6 (95% CI: 3,9–7,9; n=6047 zavedení) | 1,7 (95% CI: 0,8–3,1; n=5927 zavedení) |
| Zavedení > 36 týdnů po porodu | 1,6 (95% CI: 0,0–9,1; n=608 zavedení) | 0,7 (95% CI: 0,5–1,1; n=41910 zavedení) |
Riziko perforace může být zvýšeno při poporodním zavádění (viz bod 4.2), u kojících žen a u žen s fixní retroverzí dělohy.
Opětovné vyšetření po zavedení se má řídit pokyny uvedenými pod nadpisem „Lékařské vyšetření“ výše, které mohou být u žen s rizikovými faktory pro vznik perforace dělohy v případě klinické indikace upraveny.
Infekční onemocnění v oblasti pánve: U pacientek s intrauterinním tělískem s mědí (IUD) je nejvyšší výskyt infekčního onemocnění v oblasti pánve během prvního měsíce po zavedení a později se snižuje. Mezi známé rizikové faktory zánětlivého onemocnění pánve patří sexuální promiskuita, častý sexuální styk a mladý věk. Zánětlivá onemocnění pánve mohou mít závažné důsledky, protože mohou poškodit fertilitu a zvýšit riziko vzniku mimoděložního těhotenství. Stejně jako u jiných gynekologických nebo chirurgických výkonů může dojít po zavedení IUS k závažné infekci nebo sepsi (včetně sepse způsobené streptokoky skupiny A), ale stává se to velmi vzácně.
U žen používajících přípravek Levosert, u kterých se objeví příznaky a známky naznačující zánětlivé onemocnění pánve, je indikováno bakteriologické vyšetření a je doporučené monitorování i diskrétních symptomů a je třeba nasadit vhodnou antibiotickou léčbu. Není třeba Levosert vyjímat, ledaže by příznaky nezačaly ustupovat do 72 hodin nebo si žena přála Levosert vyjmout. Pokud žena trpí rekurentní endometritidou nebo rekurentními infekcemi v oblasti pánve nebo pokud je akutní infekce závažná, je třeba tělísko Levosert odstranit.
Komplikace vedoucí k selhání
Vypuzení tělíska: K příznakům částečného nebo úplného vypuzení jakéhokoli IUS patří krvácení nebo bolest. Systém však může být z děložní dutiny vypuzen, aniž by si toho žena všimla, což vede ke ztrátě antikoncepční ochrany. I částečné vypuzení systému může snížit účinnost přípravku Levosert. Vzhledem k tomu, že tělísko Levosert snižuje intenzitu menstruačního krvácení, zesílené krvácení může svědčit o jeho vypuzení.
Systém Levosert, který se nenachází ve správné poloze, by měl být vyjmut a měl by být zaveden nový systém. Ženu je třeba poučit, jak má kontrolovat vlákna přípravku Levosert a že má neprodleně navštívit svého lékaře, pokud vlákna necítí.
Ztracená vlákna: Jestliže kontrolní vlákna nejsou při následném vyšetření viditelná, je třeba nejprve vyloučit možnost těhotenství. Vlákna mohou být vtažena do dělohy nebo do cervikálního kanálu a mohou se znovu objevit během další menstruace. Pokud se vlákna nenajdou, je možné, že byla odtržena, že tělísko bylo vypuzeno nebo vzácně že tělísko je mimo dělohu poté, co ji perforovalo. Stanovení polohy IUS se provádí ultrazvukem a mezitím je třeba doporučit alternativní antikoncepci. Pokud není možné ultrazvukem tělísko lokalizovat a nejsou známky vypuzení tělíska, je třeba provést prosté rentgenové vyšetření břicha pro vyloučení extrauterinní lokalizace tělíska.
Nepravidelnosti krvácení
Nepravidelné krvácení: S přípravkem Levosert je obvykle dosaženo během 3 až 6 měsíců léčby významného snížení ztráty krve menstruací. Silnější menstruace nebo neočekávané krvácení může naznačovat vypuzení tělíska. Pokud menoragie přetrvává, je třeba ženu opět vyšetřit. Je třeba zkontrolovat dutinu děložní pomocí ultrazvuku. Je třeba také zvážit potřebu endometriální biopsie.
Riziko u premenopauzálních žen
Protože se během prvních měsíců léčby může objevit u premenopauzálních žen nepravidelné krvácení/špinění, doporučuje se před zavedením přípravku Levosert vyloučit patologii endometria.
Kdy je třeba u žen ve fertilním věku zvážit možnost těhotenství: Pokud se menstruace nedostaví do 6 týdnů od začátku předchozí menstruace, je třeba zvážit, zda nedošlo k otěhotnění. Opakovaný těhotenský test není nutný u pacientek s amenoreou, pokud pro těhotenství nesvědčí další symptomy. U žen ve fertilním věku se postupně u přibližně 20 % uživatelek rozvíjí oligomenorea a/nebo amenorea.
Posouzení léčby menoragie: S přípravkem Levosert je obvykle dosaženo během 3 až 6 měsíců léčby významného snížení ztráty krve menstruací. Pokud není v tomto časovém horizontu dosaženo významné redukce ztráty krve, je třeba vzít v úvahu alternativní způsoby léčby.
Ostatní rizika během používání
Mimoděložní těhotenství: Absolutní riziko vzniku mimoděložního těhotenství u uživatelek IUS s levonorgestrelem je nízké. Nicméně pokud žena otěhotní s přípravkem Levosert in situ, pravděpodobnost výskytu mimoděložního těhotenství se zvyšuje. Jestliže se vyskytne bolest v podbřišku, měla by se vzít v úvahu možnost mimoděložního těhotenství, zvláště pokud se zároveň nedostaví menstruace nebo pokud žena s amenoreou začne krvácet.
-
V provedené klinické studii byl celkový výskyt mimoděložního těhotenství u přípravku Levosert přibližně 0,16 na 100 žen za rok. Ženy, které uvažují o zvedení přípravku Levosert, je třeba poučit o známkách, symptomech a rizicích mimoděložního těhotenství. U žen, které otěhotněly během používání přípravku Levosert, je třeba zvážit a zhodnotit možnost vzniku mimoděložního těhotenství. U žen, které mají v anamnéze mimoděložní těhotenství, chirurgický výkon na vejcovodech nebo infekci v oblasti pánve, je zvýšené riziko vzniku mimoděložního těhotenství. Riziko vzniku mimoděložního těhotenství u žen, které mají mimoděložní těhotenství a používání přípravku Levosert v anamneze, není známé.
-
V případě bolesti v podbřišku je třeba vzít v úvahu možnost mimoděložního těhotenství, zvláště ve spojení s vynechanou menstruací, nebo pokud u žena s amenoreou začne krvácet. Mimoděložní těhotenství si může vyžádat chirurgický zákrok a může vést ke ztrátě fertility.
Ovariální cysty: U žen ve fertilním věku zůstává obvykle zachován ovulační cyklus s rupturou folikulů. Atrézie folikulu je někdy opožděná a folikulogeneze pokračuje. Tyto zvětšené folikuly nelze klinicky odlišit od ovariálních cyst. Ve většině případů jsou asymptomatické, některé mohou být spojeny s bolestí v oblasti pánve a dyspareunií.
-
V klinické studii s přípravkem Levosert, do které bylo zařazeno 280 žen se silným menstruačním krvácením, z nichž 141 použilo přípravek Levosert, byla během 12 měsíců zavedení hlášena ovariální cysta (symptomatická a asymptomatická) u 9,9 % pacientek. V klinické studii s přípravkem Levosert, do které bylo zařazeno 1751 subjektů, se vyskytla symptomatická ovariální cysta přibližně u 4,2 % subjektů používajících přípravek Levosert a 0,3 % subjektů z důvodu ovariální cysty ukončilo používání přípravku Levosert.
Ve většině případů ovariální cysty spontánně zmizí během dvou až tří měsíců. Pokud se tak nestane, doporučuje se pokračovat v kontrole ultrazvukem a učinit další diagnostická/ terapeutická opatření. Vzácně může být nezbytné provést chirurgický zákrok.
Karcinom prsu
Riziko u premenopauzálních žen
Meta-analýza 54 epidemiologických studií hovoří o lehce zvýšeném relativním riziku (RR = 1,24) diagnózy karcinomu prsu v průběhu užívání kombinovaných perorálních kontraceptiv, a to hlavně u přípravků s obsahem kombinace estrogen-progestogen. Toto zvýšené riziko postupně mizí během 10 let od ukončení užívání kombinovaných perorálních kontraceptiv. Vzhledem k tomu, že karcinom prsu je vzácný u žen do 40 let, zvýšení počtu diagnostikovaných případů karcinomu prsu u současných a dřívějších uživatelek kombinovaných perorálních kontraceptiv je nízké ve srovnání s celkovým rizikem výskytu karcinomu prsu.
Riziko u žen užívajících kontraceptiva obsahující pouze progestogen (antikoncepční tablety obsahující jen progestogen, implantáty a injekční přípravky), včetně přípravku Levosert, je možná podobného rozsahu jako riziko spojené s kombinovanými perorálními kontraceptivy. Nicméně u přípravků obsahujících jen progestogen je průkaz založen na mnohem menší populaci uživatelek, a tak je méně přesvědčivý než u kombinovaných perorálních kontraceptiv.
Obecná informace
Glukosová tolerance: Levonorgestrel v nízkých dávkách může ovlivnit glukosovou toleranci a u diabetiček používajících přípravek Levosert je třeba sledovat koncentraci glukosy v krvi.
Postkoitální antikoncepce: přípravek Levosert není určený k použití jako postkoitální antikoncepce.
Raménka tělíska přípravku Levosert, ve tvaru T, obsahují síran barnatý, takže je lze zobrazit na rentgenu.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Metabolismus progestagenů může být zvýšený současným užíváním látek, o kterých je známo, že indukují enzymy metabolizující léky, zvláště enzymy cytochromu P-450, jako jsou antikonvulziva (např. fenobarbital, fenytoin, karbamazepin) a antiinfektiva (např. griseofulvin, rifampicin, rifabutin, nevirapin, efavirenz). Na druhou stranu látky, o kterých je známo, že inhibují enzymy metabolizující léky (např. intrakonazol, ketokonazol) mohou zvýšit sérové koncentrace levonorgestrelu. Vliv těchto léků na antikoncepční účinnost přípravku Levosert není známý, ale domníváme se, že nemají velký význam vzhledem k lokálnímu mechanismu účinku.
4.6 Fertilita, těhotenství a kojení
Těhotenství
Použití přípravku Levosert v těhotenství nebo při podezření na těhotenství je kontraindikováno. Pokud žena otěhotní s přípravkem Levosert in situ (viz bod 5), je třeba vyloučit mimoděložní těhotenství (viz bod 4.4), je třeba odstranit přípravek a zvážit ukončení těhotenství, protože je zde zvýšené riziko, že těhotenství bude komplikované (potrat, infekce a sepse). Odstranění přípravku Levosert nebo sondáž dělohy může vyvolat spontánní potrat. Pokud nelze tyto postupy uskutečnit nebo pokud si žena přeje, aby těhotenství pokračovalo, je třeba ženu o těchto rizicích informovat a následně je třeba tato těhotenství pečlivě sledovat. Ženu je třeba poučit, aby hlásila všechny symptomy, které by mohly znamenat komplikace těhotenství, jako je křečovitá bolest břicha s horečkou.
Lokální expozice levonorgestrelu
Vzhledem k nitroděložnímu podání a lokální expozici hormonu je třeba vzít v úvahu možný výskyt virilizačních účinků na plod. Klinické zkušenosti s těhotenstvím při zavedeném IUS s levonorgestrelem jsou vzhledem k vysoké antikoncepční účinnosti omezené, ale je třeba ženu informovat, že dosud není žádný důkaz pro vznik vrozených vad způsobených lokálním použitím IUS s levonorgestrelem z případů, kdy těhotenství pokračovalo do termínu porodu s IUS in situ.
Kojení
Levonorgestrel při použití IUS s levonorgestrelem je vylučován ve velmi malých množstvích do mateřského mléka. Vzhledem k tomu, že není očekáváno žádné riziko pro dítě, kojení může během používání přípravku Levosert pokračovat.
Vzácně bylo u žen používajících IUS s levonorgestrelem během kojení hlášeno děložní krvácení.
Fertilita
Používání IUS s levonorgestrelem nemění po odstranění IUS fertilitu ženy.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Není známý žádný vliv přípravku Levosert na schopnost řídit motorová vozidla nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Nežádoucí účinky jsou častější během prvních měsíců po zavedení a s délkou používání klesají.
Velmi častými nežádoucími účinky (vyskytují se u více než 10% uživatelek) jsou děložní/vaginální krvácení včetně špinění, oligomenorea, amenorea (viz bod 5.1) a benigní ovariální cysty.
Frekvence výskytu benigních ovariálních cyst závisí na použité diagnostické metodě, v klinických studiích byly diagnostikovány zvětšené folikuly u 12% subjektů používajících IUS s levonorgestrelem. Většina folikulů byla asymptomatická a vymizela během 3 měsíců.
V tabulce níže jsou uvedeny nežádoucí účinky podle tříd orgánových systémů MedDRA (MedDRA SOCs). Frekvence výskytu jsou založeny na údajích z klinických studií.
| Třídy orgánových systémů | Nežádoucí účinky | |||
| velmi časté: >1/10 | časté: mén >1/100 až <1/10 | ě časté: >1/1 000 až <1/100 | vzácné: >1/10 000 až <1/1 000 | |
| Infekce a infestace | Vaginální bakteriální infekce, vulvovaginální mykotické infekce | |||
| Poruchy imunitního systému | hypersenzitivita včetně vyrážky, kopřivky a angioedému | |||
| Psychiatrické poruchy | depresivní nálada, nervozita, snížení libida | |||
| Poruchy nervového systému | bolest hlavy, migréna, presynkopa | synkopa | ||
| Gastrointestinální poruchy | bolest/diskomfort břicha, nevolnost, abdominální distenze, zvracení | |||
| Poruchy kůže a podkožní tkáně | akné | alopecie, hirsutismus, pruritus, ekzém, chloasma/kožní hyperpigmentace | vyrážka, kopřivka | |
| Poruchy svalové a kosterní soustavy a pojivové tkáně | bolest zad | |||
| Poruchy reprodukčního systému a prsu | děložní/vaginální krvácení včetně špinění, oligomenorea, amenorea, benigní ovariální cysty | pánevní bolest, dysmenorea, vaginální výtok, vulvovaginitida, citlivost prsů, bolest prsů, dyspareunie, cer spasmus dělohy | zánětlivé onemocnění pánve, endometritida, cervicitida, normální Pap stěr, třída II | perforace dělohy* |
| Stavy spojené s těhotenstvím, šestinedělím a perinatálním obdobím | mimoděložní těhotenství | |||
| Celkové poruchy a reakce v místě aplikace | bolest v místě aplikace | vypuzení nitroděložního kontracepčního tělíska | edém | |
| Vyšetření | zvýšení tělesné hmotnosti | |||
* Četnost je založena na klinických studiích, ze kterých byly vyloučeny kojící ženy. V rozsáhlé komparativní neintervenční kohortové studii u uživatelek IUS/IUD, byla četnost perforace u žen, které kojily nebo u kterých bylo zavedení do 36 týdnů po porodu, „méně časté“ (viz bod 4.4)
Infekce a infestace Po zavedení IUS byly hlášeny případy sepse (včetně sepse způsobené streptokoky skupiny A) (viz bod 4.4).
Stavy v těhotenství, šestinedělí a perinatálním období
Pokud žena otěhotní se zavedeným přípravkem Levosert, relativní riziko mimoděložního těhotenství je zvýšeno (viz „Zvláštní upozornění a opatření pro použití“ a „Fertilita, těhotenství a kojení“).
Poruchy reprodukčního systému a prsu
U uživatelek IUS s levonorgestrelem byly hlášeny případy rakoviny prsu (frekvence není známa, viz bod 4.4).
Následující nežádoucí účinky byly hlášeny v souvislosti s procesem zavádění nebo vyjímání přípravku Levosert: bolest, krvácení, vasovagální reakce související se zaváděním se závratí nebo synkopou (viz bod 4.4). Proces může u pacientek s epilepsií vyvolat epileptický záchvat.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky:
4.9 Předávkování
Neuplatňuje se.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: nitroděložní kontraceptiva, plastové IUD s progestogenem
ATC kód: G02BA03
Levonorgestrel je progestogen, který je používaný v gynekologii různými způsoby: jako progestogenní část perorálních kontraceptiv, v hormonální substituční léčbě a samostatně jako kontraceptivum v „minipilulkách“ (perorální antikoncepční tablety obsahující jen progestogen) a v podkožních implantátech. Levonorgestrel může být také podáván přímo do dutiny děložní formou IUS. To umožňuje velmi nízké denní dávky, protože hormon je uvolňován přímo do cílového orgánu.
Kontracepční mechanismus účinku IUS s obsahem levonorgestrelu je založen hlavně na hormonálních účincích vyvolávajících následující změny:
-
– Prevence proliferace endometria
-
– Zahuštění cervikálního hlenu, které brání průniku spermií
-
– U některých žen suprese ovulace.
5.2 Farmakokinetické vlastnosti
Počáteční rychlost uvolňování levonorgestrelu z přípravku Levosert in vivo 19,5 mikrogramů/den se snižuje během prvního roku na 17,0 mikrogramů/den, během druhého roku na 14,8 mikrogramů/den, během třetího roku na 12,9 mikrogramů/den a během čtvrtého roku na 11,3 mikrogramů/den. Levonorgestrel se uvolňuje přímo do dutiny děložní s nízkými plasmatickými koncentracemi (310±140 pg/ml po zavedení a 139±42 mg/ml po čtyřech letech), což vede jen k minimálním systémovým účinkům.
Farmakokinetika samotného levonorgestrelu byla důkladně zkoumána a popsána v literatuře. Za nejlepší odhad poločasu může být považována hodnota 20 hodin, ačkoli některé studie uvádějí hodnoty krátké, jako je 9 hodin, a jiné dlouhé, jako je 80 hodin. Mezi důležitý nález, ačkoli je v souladu se zkušeností s jinými systémovými steroidy, jsou významné rozdíly v rychlosti metabolické clearance mezi jednotlivci, i při podání intravenózní cestou. Levonorgestrel se ve velké míře váže na proteiny (hlavně na pohlavní hormony vázající globulin [SHBG]) a je ve velké míře metabolizovaný na velké množství inaktivních metabolitů.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje neodhalily žádné jiné zvláštní riziko pro člověka, než jsou informace uvedené v jiných částech SPC. Tyto údaje jsou založeny na konvenčních studiích bezpečné farmakologie, toxicity po opakovaných dávkách, genotoxicity, karcinogenního potenciálu a reprodukční toxicity a toxicity vývoje.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Dimetikon
Tetrapropoxysilan Stannosium-oktanoát
Dimetikonový elastomer
Dimetikonová trubička
Raménka tělíska ve tvaru T z polyethylenu nízké hustoty s 20–24 % síranu barnatého Polypropylenové vlákno obarvené ftalocyaninovou modří
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
5 let
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v původním obalu. Uchovávejte sáček v krabičce, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
Intrauterinní inzert Levosert a zavaděč jsou jednotlivě zataveny v blistru (polyester) s odtrhovacím uzávěrem (TYVEK-polyethylen).
6.6 Zvláštní opatření pro likvidaci přípravku
Technika zavádění se liší od jiných nitroděložních tělísek, je třeba se věnovat nacvičení správné techniky zavádění. Speciální instrukce pro zavádění jsou uloženy v balení.
Přípravek Levosert je dodáván ve sterilním balení, které nemá být otevřeno, dokud to zavádění nevyžaduje. S každým systémem je třeba zacházet asepticky. Pokud je uzávěr sterilního obalu poškozen, je třeba systém zlikvidovat v souladu s místními požadavky pro zacházení s nebezpečným odpadem. Stejně tak je třeba zlikvidovat zavaděč tělíska Levosert. S vnějším papírovým obalem a vnitřním blistrem je možné zacházet jako s domácím odpadem.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Gedeon Richter Plc.
Gyómrói út 19–21
1103 Budapešť,
Maďarsko
8. REGISTRAČNÍ ČÍSLO
17/285/13-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
3. 7. 2013
Další informace o léčivu LEVOSERT
Jak
se LEVOSERT
podává: intrauterinní podání - intrauterinní inzert
Výdej
léku: na lékařský předpis
Balení: Blistr
Velikost
balení: 1
Držitel rozhodnutí o registraci daného léku v České republice:
Gedeon Richter Plc., Budapešť
E-mail: info@richtergedeon.cz
Telefon: 261141200
