Souhrnné informace o léku - APREPITANT SANDOZ
1. NÁZEV PŘÍPRAVKU
Aprepitant Sandoz 125 mg tvrdé tobolky + Aprepitant Sandoz 80 mg tvrdé tobolky
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Aprepitant Sandoz 80 mg tvrdé tobolky
Jedna tvrdá tobolka obsahuje aprepitantum 80 mg.
Pomocná látka se známým účinkem
Jedna tobolka obsahuje 80 mg sacharózy (v 80mg tvrdé tobolce).
Aprepitant Sandoz 125 mg tvrdé tobolky
Jedna tvrdá tobolka obsahuje aprepitantum 125 mg.
Pomocná látka se známým účinkem
Jedna tobolka obsahuje 125 mg sacharózy (v 125mg tvrdé tobolce).
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Tvrdá tobolka.
Aprepitant Sandoz 80 mg tvrdé tobolky
Neprůhledné tvrdé želatinové tobolky velikosti 2 s bílým tělem a víčkem, obsahující bílé až téměř bílé pelety.
Aprepitant Sandoz 125 mg tvrdé tobolky
Neprůhledné tvrdé želatinové tobolky velikosti 1 s bílým tělem a růžovým víčkem, obsahující bílé až téměř bílé pelety.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Prevence nauzey a zvracení spojených s vysoce a středně silně emetogenní protinádorovou chemoterapií u dospělých a dospívajících od 12 let věku.
Aprepitant Sandoz (125 mg/80 mg) se podává jako součást kombinované terapie (viz bod 4.2).
4.2 Dávkování a způsob podání
Dávkování
Dospělí
Aprepitant Sandoz se podává po dobu 3 dní jako součást léčebného režimu zahrnujícího kortikosteroid a antagonistu 5-HT3. Doporučená dávka je 125 mg perorálně jednou denně jednu hodinu před zahájením chemoterapie 1. den a 80 mg perorálně jednou denně 2. a 3. den ráno.
K prevenci nauzey a zvracení v souvislosti s emetogenní protinádorovou chemoterapií se u dospělých doporučují následující režimy:
Vysoce emetogenní chemoterapeutický režim
| 1. den | 2. den | 3. den | 4. den | |
| Aprepitant | 125 mg perorálně | 80 mg perorálně | 80 mg perorálně | žádný |
| Dexamethason | 12 mg perorálně | 8 mg perorálně | 8 mg perorálně | 8 mg perorálně |
| Antagonisté 5-HT3 | Standardní dávka antagonistů 5-HT3. Ohledně příslušného dávkování zvoleného antagonisty 5-HT3 viz informace o daném přípravku | žádný | žádný | žádný |
Dexamethason se musí podávat 1. den 30 minut před zahájením chemoterapie a 2. až 4. den ráno. Dávka dexamethasonu bere v úvahu interakce léčivých látek.
Středně emetogenní chemoterapeutický režim
| 1. den | 2. den | 3. den | |
| Aprepitant | 125 mg perorálně | 80 mg perorálně | 80 mg perorálně |
| Dexamethason | 12 mg perorálně | žádný | žádný |
| Antagonisté 5-HT3 | Standardní dávka antagonistů 5-HT3. Ohledně příslušného dávkování zvoleného antagonisty 5-HT3 viz informace o daném přípravku | žádný | žádný |
| Dexamethason se musí podávat 1. den 30 minut před zahájením chemoterapie. Dáv | ka dexamethasonu | ||
bere v úvahu interakce léčivých látek.
Pediatrická populace
Dospívající (ve věku 12 až 17 let)
Přípravek Aprepitant Sandoz se podává 3 dny jako součást režimu, který zahrnuje antagonistu 5-HT3. Doporučené dávkování tobolek přípravku Aprepitant Sandoz je 125 mg perorálně 1. den a 80 mg perorálně 2. a 3. den. Přípravek Aprepitant Sandoz se podává perorálně 1 hodinu před chemoterapií 1., 2. a 3. den. Pokud se 2. a 3. den nepodává žádná chemoterapie, má se přípravek Aprepitant Sandoz podat ráno. Ohledně správného dávkování zvoleného antagonisty 5-HT3 viz příslušný souhrn údajů o přípravku (SmPC). Pokud se s přípravkem Aprepitant Sandoz podává současně kortikosteroid, jako je dexamethason, má se podat 50 % obvyklé dávky kortikosteroidu (viz body 4.5 a 5.1).
Bezpečnost a účinnost přípravku Aprepitant Sandoz 80 mg a Aprepitant Sandoz 125 mgtobolky nebyla u dětí mladších 12 let prokázána. K dispozici nejsou žádné údaje. Pokud jde o vhodné dávkování u kojenců, batolat a dětí ve věku od 6 měsíců do méně než 12 let, viz SmPC prášku pro perorální suspenzi.
Obecně
Údaje o účinnosti při kombinaci s jinými kortikosteroidy a antagonisty 5-HT3 jsou omezené.
Další informace o současném podávání s kortikosteroidy jsou uvedeny v bodu 4.5. U současně podávaných léčivých přípravků obsahujících antagonistu 5-HT3 viz příslušné SmPC.
Zvláštní populace
Starší osoby (> 65 let)
U starších osob není nutno dávku upravovat (viz bod 5.2).
Pohlaví
S ohledem na pohlaví není nutno dávku upravovat (viz bod 5.2).
Porucha funkce ledvin
U pacientů s poruchou funkce ledvin ani u pacientů v terminálním stádiu renálního onemocnění podstupujících hemodialýzu není nutno dávku upravovat (viz bod 5.2).
Porucha funkce jater
U pacientů s lehkou poruchou funkce jater není nutno dávku upravovat. Pokud se týče pacientů se středně těžkou poruchou funkce jater, jsou k dispozici pouze omezené údaje a u pacientů s těžkou poruchou funkce jater nejsou dostupné žádné údaje. Těmto pacientům se aprepitant musí podávats opatrností (viz body 4.4 a 5.2).
Způsob podání
Tvrdou tobolku je nutno polknout vcelku.
Přípravek Aprepitant Sandoz lze užívat nezávisle na jídle.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Současné podávání s pimozidem, terfenadinem, astemizolem nebo cisapridem (viz bod 4.5).
4.4 Zvláštní upozornění a opatření pro použití
Pacienti se středně těžkou až těžkou poruchou funkce jater
U pacientů se středně těžkou poruchou funkce jater existují pouze omezené údaje a u pacientů s těžkou poruchou funkce jater nejsou k dispozici žádné údaje . U těchto pacientů je nutno aprepitant používat s opatrností (viz bod 5.2).
Interakce na CYP3A4
Aprepitant je nutno podávat s opatrností pacientům současně užívajícím perorálně podávané léčivé látky, které se primárně metabolizují cestou CYP3A4 a které mají úzké terapeutické rozmezí, jako je cyklosporin, takrolimus, sirolimus, everolimus, alfentanil, deriváty námelových alkaloidů, fentanyl a chinidin (viz bod 4.5). Navíc je nutno k podávání současně s irinotekanem přistupovat obzvlášť opatrně, protože uvedená kombinace může mít za následek zvýšenou toxicitu.
Současné podávání s warfarinem (substrát CYP2C9)
U pacientů dlouhodobě léčených warfarinem je nutno během léčby aprepitantem a po dobu 14 dnů po každé 3denní léčbě aprepitantem pozorně sledovat hodnotu mezinárodního normalizovaného poměru (INR) (viz bod 4.5).
Současné podávání s hormonální antikoncepcí
Účinnost hormonální antikoncepce může být během podávání aprepitantu a 28 dní poté snížena. Během léčby aprepitantem a ještě 2 měsíce po poslední dávce aprepitantu je třeba používat alternativní nehormonální dodatečné antikoncepční metody (viz bod 4.5).
Tobolky přípravku Aprepitant Sandoz obsahují sacharózu.
Pacienti se vzácnými dědičnými problémy s intolerancí fruktózy, malabsorpcí glukózy a galaktózy nebo se sacharázo-izomaltázovou deficiencí nemají tento přípravek užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Aprepitant (125 mg/80 mg) je substrát, středně silný inhibitor a induktor CYP3A4. Aprepitant je také induktor CYP2C9. Během léčby aprepitantem je CYP3A4 inhibován. Po ukončení léčby aprepitant vyvolává přechodnou mírnou indukci CYP2C9, CYP3A4 a glukuronidaci. Nezdá se, že by aprepitant interagoval s P glykoproteinovým transportérem, jak naznačuje nepřítomnost interakce aprepitantu s digoxinem.
Účinek aprepitantu na farmakokinetiku dalších léčivých látek
Inhibice CYP3A4
Jako středně silný inhibitor CYP3A4 může aprepitant (125 mg/80 mg) zvýšit plazmatické koncentrace současně podávaných léčivých látek, které se metabolizují cestou CYP3A4. Celková expozice perorálně podávaným substrátům CYP3A4 se může zvýšit přibližně 3násobně během 3denní léčby aprepitantem; předpokládá se, že účinek aprepitantu na plazmatické koncentrace intravenózně podávaných substrátů CYP3A4 bude menší. Aprepitant se nesmí podávat současně s pimozidem, terfenadinem, astemizolem nebo cisapridem (viz bod 4.3). Inhibice CYP3A4 aprepitantem může mít za následek zvýšené plazmatické koncentrace uvedených léčivých látek, což může vyvolat závažné nebo život ohrožující reakce. Při současném podávání aprepitantu a perorálně podávaných léčivých látek, které jsou metabolizovány převážně prostřednictvím CYP3A4 a které mají úzké terapeutické rozmezí, jako je cyklosporin, takrolimus, sirolimus, everolimus, alfentanil, diergotamin, ergotamin, fentanyl a chinidin, se doporučuje dbát opatrnosti (viz bod 4.4).
Kortikosteroidy
Dexamethason: Obvyklou dávku perorálně podaného dexamethasonu je nutno při současném podávání s aprepitantem v režimu 125 mg/80 mg snížit přibližně o 50 %. Dávka dexamethasonu
v klinických studiích nauzey a zvracení vyvolaných chemoterapií byla vybrána s ohledem na interakce léčivých látek (viz bod 4.2). Pokud se aprepitant podával v léčebném režimu v dávce 125 mg spolu s dexamethasonem 20 mg perorálně první den, a poté v dávce 80 mg/den spolu s dexamethasonem 8 mg perorálně druhý až pátý den, došlo první a pátý den k 2,2násobnému zvýšení hodnoty AUC dexamethasonu, který je substrátem CYP3A4.
Methylprednisolon: Při současném podávání s aprepitantem v režimu 125 mg/80 mg je třeba obvyklou dávku intravenózně aplikovaného methylprednisolonu snížit přibližně o 25 %, a obvyklou dávku perorálně podávaného methylprednisolonu přibližně o 50 %. Pokud se aprepitant podával v léčebném režimu v dávce 125 mg první den a 80 mg/den 2. a 3. den, zvýšil hodnotu AUC methylprednisolonu, který je substrátem CYP3A4, 1. den 1,3násobně a 3. den 2,5násobně v případě, že se methylprednisolon podával současně intravenózně v dávce 125 mg první den a perorálně v dávce 40 mg 2. a 3. den.
-
V kontinuální léčbě methylprednisolonem se může hodnota AUC methylprednisolonu koncem 2týdenního období po zahájení podávání aprepitantu snížit v důsledku indukčního účinku aprepitantu na CYP3A4. Lze očekávat, že tento účinek bude u perorálně podávaného methylprednisolonu výraznější.
Chemoterapeutika
Ve farmakokinetických studiích neměl aprepitant, při podávání v režimu 125 mg 1. den a 80 mg/den 2. a 3. den, vliv na farmakokinetiku docetaxelu podaného intravenózně 1. den nebo vinorelbinu podaného intravenózně 1. nebo 8. den. Protože účinek aprepitantu na farmakokinetiku perorálně podávaných substrátů CYP3A4 je větší než účinek aprepitantu na farmakokinetiku intravenózně podávaných substrátů CYP3A4, nelze vyloučit interakce s perorálně podávanými chemoterapeutiky, které se metabolizují převážně nebo částečně cestou CYP3A4 (např. etoposid, vinorelbin). U pacientů léčených přípravky, které se metabolizují především nebo částečně cestou CYP3A4, se doporučuje dbát opatrnosti a tyto pacienty dodatečně sledovat (viz bod 4.4). Po uvedení na trh byly hlášeny při současném podávání aprepitantu a ifosfamidu případy neurotoxicity, potenciální nežádoucí účinek ifosfamidu.
Imunosupresiva
-
V průběhu 3denního léčebného režimu nauzey a zvracení vyvolaných chemoterapií (CINZ) se předpokládá přechodný středně velký nárůst následovaný mírným poklesem expozice imunosupresivům metabolizovaným prostřednictvím CYP3A4 (např. cyklosporin, takrolimus, everolimus a sirolimus).
S ohledem na krátké trvání 3denního režimu a na času závislých omezených změnách v expozici se během 3 dnů současného podávání s aprepitantem snížení dávky imunosupresiv nedoporučuje.
Midazolam
Je nutno vzít v úvahu možné účinky zvýšených plazmatických koncentrací midazolamu nebo jiných benzodiazepinů metabolizovaných cestou CYP3A4 (alprazolam, triazolam) při současném podávání s aprepitantem (125 mg/80 mg) .
Aprepitant zvýšil hodnotu AUC midazolamu, který je citlivým substrátem CYP3A4, a to 2,3násobně 1. den a 3,3násobně 5. den, pokud byl midazolam podán perorálně v jednorázové dávce 2 mg 1. a 5. den léčebného režimu spolu s aprepitantem v dávce 125 mg 1. den a 80 mg/den 2. až 5. den.
-
V jiné studii s intravenózní aplikací midazolamu se aprepitant podával v dávce 125 mg 1. den
a 80 mg/den 2. a 3. den, a midazolam se aplikoval intravenózně v dávce 2 mg před zahájením 3denního léčebného režimu s aprepitantem, a dále 4., 8., a 15. den. Aprepitant zvýšil 4. den hodnotu AUC midazolamu o 25 % , 8. den snížil hodnotu AUC midazolamu o 19 % a 15. den o 4 %. Tyto účinky nebyly považovány za klinicky významné.
Ve třetí studii s intravenózní a perorální aplikací midazolamu se aprepitant podával v dávce 125 mg 1. den a 80 mg/den 2. a 3. den společně s ondansetronem 32 mg 1. den, dexamethasonem 12 mg 1. den a 8 mg 2. až 4. den. Tato kombinace (tedy aprepitant, ondansetron a dexamethason) snížila 6. den hodnotu AUC perorálního midazolamu o 16 %, 8. den o 9 %, 15. den o 7 % a 22. den o 17 %. Tyto účinky nebyly považovány za klinicky významné.
Byla provedena dodatečná studie s intravenózním podáváním midazolamu a aprepitantu.
Midazolam v dávce 2 mg byl podán intravenózně 1 hodinu po jednorázové perorálně podané 125mg dávce aprepitantu. Plazmatická hodnota AUC midazolamu se zvýšila 1,5násobně. Tento účinek nebyl považován za klinicky významný.
Indukce
Jako mírný induktor CYP2C9, CYP3A4 a glukuronidace může aprepitant během dvou týdnů po zahájení a léčbě snižovat plazmatické koncentrace substrátů eliminovaných těmito cestami. Tento účinek se může projevit až po skončení třídenní léčby aprepitantem. U substrátů CYP2C9 a CYP3A4 je indukce přechodná s dosažením maxima účinku 3 až 5 dní po skončení třídenní léčby aprepitantem. Účinek se zachovává po dobu několika dní, poté se zvolna snižuje a dva týdny po skončení léčby aprepitantem je již klinicky nevýznamný. Mírnou indukci glukuronidace lze pozorovat i při perorálním podávání aprepitantu v dávce 80 mg po dobu 7 dní. Údaje ohledně účinku na CYP2C8 a CYP2C19 nejsou k dispozici. Dbát opatrnosti se doporučuje , pokud se v daném období podávají warfarin, acenokumarol, tolbutamid, fenytoin nebo jiné léčivé látky, o nichž je známo, že jsou metabolizovány cestou CYP2C9.
Warfarin
U pacientů dlouhodobě léčených warfarinem je třeba pečlivě sledovat protrombinový čas (INR), a to během léčby aprepitantem a po dobu 2 týdnů po každé 3denní léčbě aprepitantem pro chemoterapií vyvolanou nauzeu a zvracení (viz bod 4.4). Pokud byla zdravým jedincům ve stabilizovaném stavu na dlouhodobé léčbě warfarinem podána jednorázová 125mg dávka aprepitantu 1. den a dávka 80 mg/den 2. a 3. den, neměl aprepitant 3. den žádný účinek na hodnotu plazmatické AUC pro R(+) ani S(-) warfarin, nicméně 5 dní po skončení podávání aprepitantu došlo ke 34% snížení minimální koncentrace S(-) warfarinu (substrátu CYP2C9) spolu se 14% poklesem hodnoty INR.
Tolbutamid
Aprepitant podávaný v dávce 125 mg 1. den a v dávce 80 mg/den 2. a 3. den snížil 4. den hodnotu AUC tolbutamidu (substrátu CYP2C9) o 23 %, 8. den o 28 %, a 15. den o 15 % v případě, že jednorázová perorální 500mg dávka tolbutamidu byla podána před zahájením 3denní léčby s aprepitantem a pak 4., 8., a 15. den.
Hormonální antikoncepce
Účinnost hormonální antikoncepce může být během podávání aprepitantu a 28 dní poté snížena. Během léčby aprepitantem a ještě 2 měsíce po poslední dávce aprepitantu je třeba používat alternativní nehormonální dodatečné antikoncepční metody.
-
V klinické studii byly 1. až 21. den podávány jednorázové dávky perorální antikoncepce obsahující ethinylestradiol a norethisteron spolu s aprepitantem, podávaným v režimu v dávce 125 mg
8. den a 80 mg/den 9. a 10. den společně s ondansetronem v dávce 32 mg podaným intravenózně 8. den a s dexamethasonem v dávce 12 mg podaným perorálně 8. den a dále v dávce 8 mg/den 9., 10. a 11. den. V této
studii se 9. až 21. den snížily minimální koncentrace ethinylestradiolu až o 64 % a minimální koncentrace norethisteronu až o 60 %.
Antagonisté 5-HT3
V klinických studiích lékových interakcí nevykazoval aprepitant žádné klinicky významné účinky na farmakokinetiku ondansetronu, granisetronu nebo hydrodolasetronu (aktivní metabolit dolasetronu).
Účinky jiných léčivých přípravků na farmakokinetiku aprepitantu
K současnému podávání aprepitantu s léčivými látkami, které inhibují aktivitu CYP3A4
(např. ketokonazol, itrakonazol, vorikonazol, posakonazol, klarithromycin, telithromycin, nefazodon a inhibitory proteázy), je třeba přistupovat s opatrností, protože se předpokládá, že tato kombinace povede k několikanásobnému zvýšení plazmatické koncentrace aprepitantu (viz bod 4.4).
Je nutno se vyvarovat současného podávání aprepitantu s léčivými látkami, které silně indukují aktivitu CYP3A4 (např. s rifampicinem, fenytoinem, karbamazepinem, fenobarbitalem), protože tato kombinace vede ke snížení plazmatických koncentrací aprepitantu, což může vést ke snížení účinnosti aprepitantu. Současné podávání aprepitantu s rostlinnými přípravky obsahujícími třezalku tečkovanou (Hypericum perforatum) se nedoporučuje.
Ketokonazol
Jestliže se podal aprepitant v jediné 125mg dávce 5. den 10denního léčebného režimu s ketokonazolem, silným inhibitorem CYP3A4, podaným v dávce 400 mg/den, zvýšila se hodnota AUC aprepitantu přibližně 5násobně a průměrná hodnota terminálního poločasu aprepitantu se zvýšila přibližně 3násobně.
Rifampicin
Jestliže se podal aprepitant v jediné 375 mg dávce 9. den 14denního léčebného režimu s rifampicinem, silným induktorem CYP3A4, podaným v dávce 600 mg/den, snížila se hodnota AUC aprepitantu o 91 % a průměrná hodnota terminálního poločasu aprepitantu se snížila o 68 %.
Pediatrická populace
Studie interakcí byly provedeny pouze u dospělých.
4.6 Fertilita, těhotenství a kojení
Antikoncepce u mužů a žen
Účinnost hormonální antikoncepce může být během podávání aprepitantu a 28 dní poté snížena. Během léčby aprepitantem a 2 měsíce po poslední dávce aprepitantu je nutno používat alternativní nehormonální dodatečné antikoncepční metody (viz body 4.4 a 4.5).
Těhotenství
Nejsou dostupné žádné klinické údaje týkající se těhotenství exponovaných aprepitantu. Potenciál pro reprodukční toxicitu aprepitantu nebyl zcela stanoven, protože ve studiích na zvířatech nebylo možno dosáhnout vyšší úrovně expozice než terapeutické expozice u člověka při dávce 125 mg/80 mg. Tyto studie nenaznačily žádné přímé ani nepřímé škodlivé účinky na průběh těhotenství, embryonální/fetální vývoj, porod nebo postnatální vývoj (viz bod 5.3). Možné účinky na reprodukci změn v regulaci neurokininů nejsou známy. Aprepitant nemá být během těhotenství podáván, pokud to není nezbytně nutné.
Kojení
Aprepitant se vylučuje do mléka kojících potkaních samic. Není známo, zda se aprepitant vylučuje do lidského mateřského mléka, a proto se kojení během léčby aprepitantem nedoporučuje.
Fertilita
Potenciál aprepitantu vyvolat účinky na fertilitu nebyl dosud plně stanoven, protože ve studiích na zvířatech nebylo možno dosáhnout vyšší míry expozice než terapeutické expozici u člověka . Tyto studie fertility neukazují na přímé nebo nepřímé škodlivé účinky týkající se páření, fertility, embryonálního/fetálního vývoje či počtu a motility spermií (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Aprepitant může mít mírný vliv na schopnost řídit, jezdit na kole nebo obsluhovat stroje. Po užití aprepitantu se mohou objevit závratě a únava (viz bod 4.8).
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Profil bezpečnosti aprepitantu byl hodnocen přibližně u 6 500 dospělých ve více než 50 studiích a 184 dětí a dospívajících ve 2 pivotních pediatrických klinických studiích.
Nejčastějšími nežádoucími účinky, uváděnými s vyšší incidencí u dospělých léčených režimem s aprepitantem než při podávání standardní terapie u pacientů léčených vysoce emetogenní chemoterapií (HEC) byly: škytavka (4,6 % oproti 2,9 %), zvýšení ALT (2,8 % oproti 1,1 %), dyspepsie (2,6 % oproti 2,0 %), zácpa (2,4 % oproti 2,0 %), bolest hlavy (2,0 % oproti 1,8 %) a snížení chuti k jídlu (2,0 % oproti 0,5 %). Nejčastějším nežádoucím účinkem uváděným s vyšší incidencí u pacientů léčených režimem s aprepitantem než při podávání standardní terapie u pacientů léčených středně emetogenní chemoterapií (MEC) byla únava (1,4 % oproti 0,9 %).
Nejčastějšími nežádoucími účinky hlášenými s vyšší incidencí u pediatrických pacientů léčených režimem aprepitantu než u kontrolního režimu během léčby emetogenní protinádorovou chemoterapií byla škytavka (3,3 % oproti 0,0 %) a zrudnutí (1,1 % oproti 0,0 %).
Tabulkový seznam nežádoucích účinků
Následující nežádoucí účinky byly pozorovány v souhrnné analýze studií s vysoce emetogenní chemoterapií (HEC) a středně emetogenní chemoterapií (MEC) u pacientů léčených režimem s aprepitantem s vyšší incidencí než při standardní terapii dospělých nebo pediatrických pacientů nebo po uvedení přípravku na trh. Kategorie frekvencí uvedené v tabulce jsou založeny na studiích u dospělých; pozorované frekvence v pediatrických studiích byly podobné nebo nižší, nejsou-li v tabulce uvedeny. Některé méně časté nežádoucí účinky v dospělé populaci nebyly pozorovány v pediatrických studiích.
Frekvence jsou definovány jako: velmi časté (> 1/10), časté (> 1/100 až < 1/10), méně časté (> 1/1 000 až < 1/100), vzácné (> 1/10 000 až < 1/1 000) a velmi vzácné (< 1/10 000), není známo (z dostupných údajů nelze určit).
| Třída orgánových systémů | Nežádoucí účinek | Frekvence |
| Infekce a infestace | kandidóza, stafylokokové infekce | vzácné |
| Poruchy krve a lymfatického systému | febrilní neutropenie, anemie | méně časté |
| Poruchy imunitního systému | hypersenzitivní reakce včetně anafylaktických reakcí | není známo |
| Poruchy metabolismu a výživy | snížení chuti k jídlu | časté |
| polydipsie | vzácné |
| Třída orgánových systémů | Nežádoucí účinek | Frekvence |
| Psychiatrické poruchy | úzkost | méně časté |
| dezorientace, euforická nálada | vzácné | |
| Poruchy nervového systému | bolest hlavy | časté |
| závrať, somnolence | méně časté | |
| kognitivní poruchy, letargie, porucha chuti | vzácné | |
| Poruchy oka | konjunktivitida | vzácné |
| Poruchy ucha a labyrintu | tinitus | vzácné |
| Srdeční poruchy | palpitace | méně časté |
| bradykardie, kardiovaskulární porucha | vzácné | |
| Cévní poruchy | návaly horka/zrudnutí | méně časté |
| Respirační, hrudní a mediastinální poruchy | škytavka | časté |
| bolest v orofaryngu, kýchání, kašel, postnazální rinitida, podráždění hrdla | vzácné | |
| Gastrointestinální poruchy | zácpa, dyspepsie | časté |
| říhání, nauzeaf, zvracení^, gastroesofageální refluxní choroba, bolest břicha, sucho v ústech, flatulence | méně časté | |
| perforace duodenálního vředu, stomatitida, abdominální distenze, tvrdá stolice, neutropenická kolitida | vzácné | |
| Poruchy kůže a podkožní tkáně | vyrážka, akné | méně časté |
| fotosenzitivní reakce, hyperhidróza, seborea, kožní léze, svědivá vyrážka, Stevensův-Johnsonův syndrom/toxická epidermální nekrolýza | vzácné | |
| svědění, kopřivka | není známo | |
| Poruchy svalové a kosterní soustavy a pojivové tkáně | svalová slabost, svalové spasmy | vzácné |
| Poruchy ledvin a močových cest | dysurie | méně časté |
| polakisurie | vzácné |
| Třída orgánových systémů | Nežádoucí účinek | Frekvence |
| Celkové poruchy a reakce v místě aplikace | únava | časté |
| astenie, malátnost | méně časté | |
| edém, hrudní diskomfort, poruchy chůze | vzácné | |
| Vyšetření | zvýšení ALT | časté |
| zvýšení AST, zvýšení alkalické fosfatázy v krvi | méně časté | |
| hematurie, hyponatremie, pokles tělesné hmotnosti, neutropenie, glykosurie, zvýšený výdej moči | vzácné |
Nauzea a zvracení byly parametry účinnosti v prvních 5 dnech následujících po chemoterapii a byly hlášeny jako nežádoucí příhody až následně.
Popis vybraných nežádoucích účinků
Profily nežádoucích účinků u dospělých v prodloužených studiích s vysoce (HEC) nebo středně emetogenní chemoterapií (MEC) s opakovanými až 6 dalšími cykly chemoterapie byly celkově podobné jako profily pozorované v 1. cyklu.
-
V další aktivně kontrolované klinické studii u 1 169 dospělých pacientů léčených
aprepitantem a vysoce emetogenní chemoterapií (HEC) byl profil nežádoucích účinků obecně podobný profilu, který byl pozorovaný v ostatních studiích s vysoce emetogenní chemoterapií (HEC) s aprepitantem.
U dospělých pacientů léčených aprepitantem pro pooperační nauzeu a zvracení (PONZ) byly pozorovány další nežádoucí účinky s vyšší incidencí než u ondansetronu: bolest horní poloviny břicha, abnormální střevní zvuky, zácpa*, dysartrie, dušnost, hypestezie, insomnie, mióza, nauzea, smyslové poruchy, břišní diskomfort, subileus*, snížená zraková ostrost, sípot.
* Hlášeno u pacientů užívajících vyšší dávky aprepitantu.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv, Šrobárova 48, 100 41 Praha 10, webové stránky:
4.9 Předávkování
Aprepitant nelze odstranit hemodialýzou.
5.
FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antiemetika, jiná antiemetika, ATC kód: A04AD12
Aprepitant je u lidí selektivním antagonistou substance P s vysokou afinitou k NK1 receptorům (neurokininové receptory).
Třídenní režim aprepitantu u dospělých
Ve 2 randomizovaných, dvojitě zaslepených studiích zahrnujících celkem 1 094 dospělých léčených chemoterapií obsahující cisplatinu > 70 mg/m2, byl aprepitant v kombinaci s léčebným režimem ondansetron/dexamethason (viz bod 4.2) srovnáván se standardním režimem (placebo plus ondansetron 32 mg aplikovaný intravenózně 1. den plus dexamethason 20 mg podaný perorálně 1. den a dexamethason 8 mg podaný perorálně dvakrát denně 2. až 4. den). I když se v klinických hodnoceních používal ondansetron v dávce 32 mg intravenózně, nejedná se již o doporučenou dávku. Ohledně příslušného dávkování zvoleného antagonisty 5-HT3 viz informace o daném přípravku.
Účinnost se hodnotila pomocí následujícího souhrnného parametru: úplná odpověď (definovaná jako žádné emetické epizody, bez použití „záchranné“ terapie) primárně v 1. cyklu. Výsledky se hodnotily v každé studii jednotlivě a pro 2 studie dohromady.
Přehled hlavních výsledků studií z kombinované analýzy je uveden v tabulce 1.
Tabulka 1
Procento dospělých pacientů léčených vysoce emetogenní chemoterapií s odpovědí na léčbu podle léčebných skupin a fáze – 1. cyklus
Bez signifikantní nauzey (maximálně VAS <25 mm na stupnici 0–100) mm)
| Celkem (0–120 hodin) | 72,1 | 64,9 | 7,2 | (1,6; 12,8) |
| 25–120 hodin | 74,0 | 66,9 | 7,1 | (1,.5; 12,6) |
* Intervaly spolehlivosti (CI) byly vypočítány bez korekce pro pohlaví a současně podávanou chemoterapii, které byly zahrnuty do primární analýzy míry pravděpodobnosti a logistických modelů.
Ť
| Režim | Standardní | Rozdíly* | |
| s aprepitantem | terapie | ||
| SOUHRNNÝ PARAMETR | (n= 521) Ť | (n= 524) Ť | % (95% CI) |
| % | % | ||
Úplná odpověď (bez zvracení a „záchranné“ terapie)
| Celkem (0–120 hodin) | 67,7 | 47,8 | 19,9 | (14,0; 25,8) |
| 0–24 hodin | 86,0 | 73,2 | 12,7 | (7,9; 17,6) |
| 25–120 hodin | 71,5 | 51,2 | 20,3 | (14,5; 26,1) |
| JEDNOTLIVÁ KRITÉRIA | ||||
| Bez zvracení (žádné emetické epizody bez | ohledu na použití | „záchranné“ | terapie) | |
| Celkem (0–120 hodin) | 71,9 | 49,7 | 22,2 | (16,4; 28,0) |
| 024 hodin | 86,8 | 74,0 | 12,7 | (8,0; 17,5) |
| 25–120 hodin | 76,2 | 53,5 | 22,6 | (17,0; 28,2) |
U jednoho pacienta v režimu pouze s aprepitantem byla k dispozici pouze data v akutní fázi a tento pacient byl vyřazen z celkové analýzy a analýzy prodloužené fáze; u jednoho pacienta ve standardním režimu byla k dispozici pouze data v prodloužené fázi a tento pacient byl vyřazen z celkové analýzy a analýzy akutní fáze.
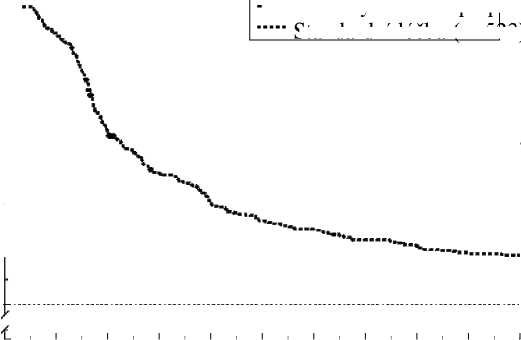
Odhad doby první epizody zvracení v kombinované analýze je zobrazen vynesením hodnot metodou Kaplana-Meiera v grafu 1.
Graf 1
Procento dospělých pacientů léčených vysoce emetogenní chemoterapií, u nichž nedošlo k epizodě zvracení – 1. cyklus
100% --
— Léčebný režim s aprep|itantem (n=520) Standardní léčba (n=523)
O
4—' £Z
Q
O G5
Q_
O
4—' £Z (D O
O
CL
40%
90%
80%
70%
60%
50%
0
0 12 24 36 48 60 72 84 96 108 120
Čas (v hodinách)
Statisticky významné rozdíly v účinnosti byly rovněž pozorovány v každé z těchto 2 jednotlivých studií.
-
V těchto stejných 2 klinických studiích pokračovalo 851 dospělých pacientů v prodloužené studii s opakovanými až 5 dalšími cykly chemoterapie. Účinnost režimu s aprepitantem zůstala během všech cyklů zřejmě zachována.
-
V randomizované, dvojitě zaslepené studii s celkovým počtem 866 dospělých pacientů (864 žen, 2 muži) léčených chemoterapií, která zahrnovala cyklofosfamid 750–1 500 mg/m2; nebo
cyklofosfamid 500–1 500 mg/m2 a doxorubicin (< 60 mg/m2) nebo epirubicin (< 100 mg/m2), byl aprepitant v kombinaci s režimem obsahujícím ondansetron/dexamethason (viz bod 4.2) srovnáván se standardní terapií (placebo plus ondansetron 8 mg perorálně (dvakrát 1. den a každých 12 hodin 2. a 3. den) plus dexamethason 20 mg perorálně 1. den).
Účinnost se hodnotila pomocí souhrnného parametru: úplná odpověď (definovaná jako žádné emetické epizody a nepoužití záchranné terapie) primárně během 1. cyklu.
Přehled hlavních výsledků studie je uveden v Tabulce 2.
Tabulka 2
Procento dospělých pacientů odpovídajících na léčbu podle léčebné skupiny a fáze – 1. cyklus
středně emetogenní chemoterapie
| Režim s | Standard | Rozdíly* | |
| aprepitant | ní | ||
| SOUHRNNÝ PARAMETR | em | terapie | |
| (n= 433) Ť | (n= 424) | ||
| % | % | % (95 % CI) | |
| Úplná odpověď (bez zvracení a „záchranné“ terapie) | ||||
| Celkem (0–120 hodin) | 50,8 | 42,5 | 8,3 | (1,6; 15,0) |
| 0–24 hodin | 75,7 | 69,0 | 6,7 | (0,7; 12,7) |
| 25–120 hodin | 55,4 | 49,1 | 6,3 | (-0,4; 13,0) |
JEDNOTLIVÁ KRITÉRIA
Bez zvracení (žádné emetické epizody bez ohledu na použití „záchranné“ terapie)
| Celkem (0–120 hodin) | 75,7 | 58,7 | 17,0 | (10,8; 23,2) |
| 0–24 hodin | 87,5 | 77,3 | 10,2 | (5,1; 15,3) |
| 25–120 hodin | 80,8 | 69,1 | 11,7 | (5,9; 17,5) |
| Bez signifikantní nauzey (maximálně VAS <25 mm | na stupnici 0–100 mm) | |||
| Celkem (0–120 hodin) | 60,9 | 55,7 | 5,3 | (-1,3; 11,9) |
| 0–24 hodin | 79,5 | 78,3 | 1,3 | (-4,2; 6,8) |
| 25–120 hodin | 65,3 | 61,5 | 3,9 | (-2,6; 10,3) |
* Intervaly spolehlivosti byly vypočítány bez korekce na věkovou kategorii (<55 let, >55 let) a skupinu hodnotitelů, které byly zahrnuty do primární analýzy míry pravděpodobnosti a logistických modelů.
Ť
U jednoho pacienta v režimu pouze s aprepitantem byla k dispozici pouze data v akutní fázi a tento pacient byl vyřazen z celkové analýzy a analýzy prodloužené fáze.
Ve stejné klinické studii pokračovalo 744 dospělých pacientů v prodloužené studii s opakovanými až 3 dalšími cykly chemoterapie. Účinnost režimu s aprepitantem zůstala během všech cyklů zřejmě zachována.
Ve druhé multicentrické, randomizované, dvojitě zaslepené studii s paralelní skupinou byl režim s aprepitantem porovnáván se standardní léčbou u 848 dospělých pacientů (652 žen, 196 mužů), kterým byl podáván chemoterapeutický režim, který zahrnoval jakékoli intravenózní dávky oxaliplatiny, karboplatiny, epirubicinu, idarubicinu, ifosfamidu, irinotekanu, daunorubicinu, doxorubicinu; cyklofosfamid intravenózně (< 1 500 mg/m2) nebo cytarabin intravenózně (>1 g/m2). Pacientům, kterým byl podáván režim s aprepitantem, byla chemoterapie podávána pro různé typy nádorů, včetně nádorů prsu u 52 %, gastrointestinálních nádorů u 21 % včetně kolorektálního karcinomu, nádorů plic u 13 % a gynekologických nádorů u 6 %. Režim s aprepitantem v kombinaci s režimem ondansetron/dexamethason (viz bod 4.2) byl porovnáván se standardní léčbou (placebo v kombinaci s ondansetronem 8 mg perorálně (dvakrát 1. den a každých 12 hodin 2. a 3. den) plus dexamethason 20 mg perorálně 1. den).
Účinnost byla založena na vyhodnocení následujících primárních a klíčových sekundárních cílových parametrů: žádné zvracení za celé období (0 až 120 hodin po chemoterapii), vyhodnocení bezpečnosti a snášenlivosti režimu s aprepitantem při chemoterapií vyvolané nauzee a zvracení (CINZ) a úplná odpověď (definovaná jako žádné zvracení a žádné použití záchranné léčby) za celé období (0 až 120 hodin po chemoterapii). Navíc jako exploratorní cílový parametr účinnosti byla sledována „žádná signifikantní nauzeaza celé období (0 až 120 hodin po chemoterapii)”, a v akutní i prodloužené fázi formou post-hoc analýzy.
Souhrn klíčových výsledků studie je uveden v Tabulce 3.
Tabulka 3
Procento dospělých pacientů odpovídajících na léčbu podle léčebné skupiny a fáze pro studii 2 -cyklus 1
středně emetogenní chemoterapie
| Režim s aprepitantem (n= 425) | Standard ní léčba (n= 406) | Rozdíly* |
| % | % % | (95 % CI) |
Úplná odpověď (žádné zvracení a žádná záchranná léčba)
| Celkem (0–120 hodin) | 68,7 | 56,3 | 12,4 | (5,9; 18,9) |
| 0–24 hodin | 89,2 | 80,3 | 8,9 | (4,0; 13,8) |
| 25–120 hodin | 70,8 | 60,9 | 9,9 | (3,5; 16,3) |
| Žádné zvracení (žádné emetické epizody bez ohledu | na použití záchranné léčby) | |||
| Celkem (0–120 hodin) | 76,2 | 62,1 | 14,1 | (7,9; 20,3) |
| 0–24 hodin | 92,0 | 83,7 | 8,3 | (3,9; 12,7) |
| 15–120 hodin | 77,9 | 66,8 | 11,1 | (5,1;17,1) |
Žádná signifikantní nauzea (maximální VAS <25 mm na stupnici 0–100 mm)
| Celkem (0–120 hodin) | 73,6 | 66,4 | 7,2 | (1,0; 13,4) |
| 0–24 hodin | 90,9 | 86,3 | 4,6 | (0,2; 9,0) |
| 15–120 hodin | 74,9 | 69,5 | 5,4 | (-0,7;11,5) |
Intervaly spolehlivosti byly vypočteny bez úpravy podle pohlaví a oblasti, které byly zařazeny v primární analýze za použití logistických modelů.
Přínos kombinované terapie s aprepitantem u celé hodnocené populace byl dán zejména výsledky pozorovanými u pacientů s nedostatečnou úpravou při standardním režimu, stejně jako u žen, i když výsledky byly početně lepší bez ohledu na věk, typ nádoru nebo pohlaví. Úplné odpovědi bylo dosaženo u 209/324 (65 %) žen v případě režimu s aprepitantem a u 161/320 (50 %) žen při standardní terapii, u mužů šlo v případě režimu s aprepitantem o 83/101 (82 %) mužů a při standardní terapii o 68/87 (78 %) mužů.
Pediatrická populace
V randomizované, dvojitě zaslepené klinické studii, kontrolované aktivním komparátorem, která zahrnovala 302 dětí a dospívajících (ve věku 6 měsíců až 17 let), kterým se podávala středně silně nebo vysoce emetogenní chemoterapie, byl režim s aprepitantem porovnáván s kontrolním režimem prevence CINZ. Účinnost režimu s aprepitantem byla hodnocena v jednom cyklu (cyklus 1). Pacienti měli v následných cyklech (volitelné cykly 2 až 6) možnost dostávat aprepitant v otevřeném uspořádání; v těchto volitelných cyklech však účinnost hodnocena nebyla. Režim s aprepitantem u dospívajících ve věku 12 až 17 let (n = 47) sestával z tobolek aprepitantu, 125 mg podávaných perorálně 1. den a 80 mg/den 2. a 3. den v kombinaci s ondansetronem 1. den. Režim s aprepitantem u dětí ve věku 6 měsíců až méně než 12 let (n = 105) sestával z aprepitantu, prášek pro perorální suspenzi, podávaného v dávce 3,0 mg/kg (do dávky 125 mg) perorálně 1. den a v dávce 2,0 mg/kg (do dávky 80 mg) perorálně 2. a 3. den v kombinaci s ondansetronem 1. den. Kontrolní režim u dospívajících ve věku 12 až 17 let (n = 48) a dětí ve věku 6 měsíců až méně než 12 let (n = 102) sestával z placeba místo aprepitantu 1., 2. a 3. den v kombinaci s ondansetronem 1. den. Aprepitant se podával 1 hodinu před zahájením chemoterapie, placebo a ondansetron se podávaly 30 minut před zahájením chemoterapie. Jako součást antiemetického režimu pro pediatrické pacienty byl u obou věkových skupin povolen intravenózní dexamethason, a to podle rozhodnutí lékaře. U pediatrických pacientů léčených aprepitantem bylo požadováno snížení (50%) dávky dexamethasonu. U pediatrických pacientů léčených kontrolním režimem nebylo snížení dávky požadováno. Z pediatrických pacientů používalo v 1. cyklu ve skupině léčené režimem s aprepitantem dexamethason 29 % pacientů a ve skupině s kontrolním režimem 28 % pacientů.
Antiemetická aktivita aprepitantu byla hodnocena během 5denního (120 hodin) období po zahájení chemoterapie v 1. dnu. Primárním cílovým parametrem byla úplná odpověď v pozdní fázi (25 až 120 hodin po zahájení chemoterapie) v 1. cyklu. Souhrn klíčových výsledků studie je uveden v Tabulce 4.
Tabulka 4
Počet (%) pediatrických pacientů s úplnou odpovědí a bez zvracení podle léčebné skupiny a fáze – 1.
cyklus (populace se záměrem k léčbě)
| Režim s aprepitantem n/m (%) | Kontrolní režim n/m (%) | |
| PRIMÁRNÍ CÍLOVÝ PARAMETR | ||
| Úplná odpověď – pozdní fáze | 77/152 (50,7)' | 39/150 (26,0) |
| DALŠÍ PŘEDEM DEFINOVANÉ CÍLOVÉ PARAMETRY | ||
| Úplná odpověď* – akutní fáze | 101/152 (66,4)' | 78/150 (52,0) |
| Úplná odpověď* – celkové období | 61/152 (40,1)' | 30/150 (20,0) |
| Bez zvracení§ – celkové období | 71/152 (46,7)' | 32/150 (21,3) |
| *Úplná odpověď = žádné zvracení ani říhání nebo pocit na zvracení naprázdno a žádné použití záchranné medikace. 'p < 0,01 v porovnání s kontrolním režimem 'p < 0,05 v porovnání s kontrolním režimem §Žádné zvracení = žádné zvracení ani říhání nebo pocit na zvracení n/m = počet pacientů s žádoucí odpovědí/počet pacientů zařazených v daný okamžik. Akutní fáze: 0 až 24 hodin po zahájení chemoterapie. Pozdní fáze: 25 až 120 hodin po zahájení chemoterapie. Celkové období: 0 až 120 hodin po zahájení chemoterapie. | ||
Odhadovaná doba do prvního zvracení po zahájení chemoterapie byla u režimu s aprepitantem delší (odhadovaný medián doby do prvního zvracení byl 94,5 hodiny) v porovnání se skupinou s kontrolním režimem (odhadovaný medián doby do prvního zvracení byl 26,0 hodiny), jak je uvedeno Kaplan-Meierovými křivkami v Grafu 2.
Graf 2
Doba do první epizody zvracení od začátku podávání chemoterapie pediatrickým pacientům v celkovém
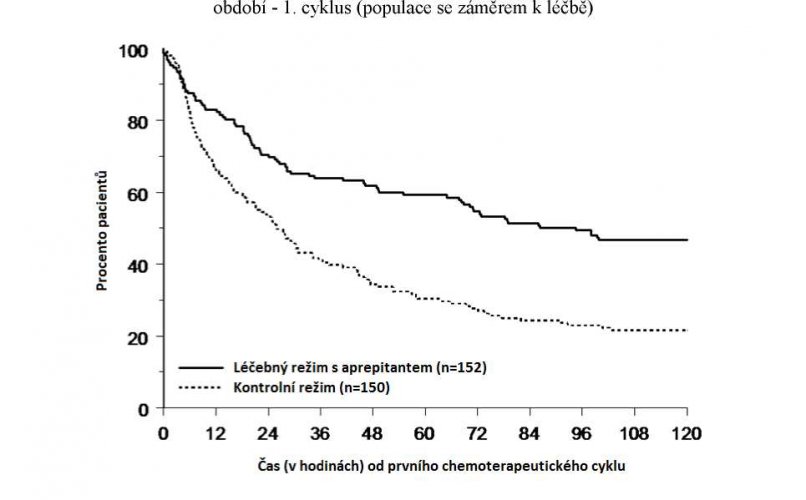
Analýza účinnosti u subpopulací v 1. cyklu prokázala, že režim s aprepitantem poskytoval lepší kontrolu než kontrolní režim, pokud jde o cílový parametr úplná odpověď, a to bez ohledu na věkovou kategorii, pohlaví, podání dexamethasonu k antiemetické profylaxi a emetogenitu chemoterapie.
5.2 Farmakokinetické vlastnosti
Farmakokinetika aprepitantu má nelineární charakter. Clearance i absolutní biologická dostupnost se se zvyšováním dávky snižují.
Absorpce
Průměrná hodnota biologické dostupnosti perorálně podaného aprepitantu činí 67 % u 80mg tobolky a 59 % u 125mg tobolky. Průměrná maximální plazmatická koncentrace (Cmax) aprepitantu byla dosažena přibližně po 4 hodinách (tmax). Perorální podání tobolky spolu se standardní snídaní s kalorickou hodnotou přibližně 800 kcal vedlo až ke 40% zvýšení hodnoty AUC aprepitantu. Toto zvýšení se nepovažuje za klinicky významné.
Farmakokinetika aprepitantu má nelineární charakter v celém rozsahu klinických dávek. U mladých zdravých dospělých jedinců bylo zvýšení hodnoty AUCu-v o 26 % větší, než byla proporcionální dávka mezi jednotlivými 80mg a 125mg dávkami podanými po jídle.
Po perorálním podání jedné 125mg dávky aprepitantu 1. den a dávky 80 mg jednou denně
- 2. a 3. den dosáhla hodnota AUC0–24h (průměrná hodnota ± standardní odchylka) 19,6 ± 2,5 pg hod/ml 1. den a 21,2 ± 6,3 pg hod/ml 3. den. Hodnota Cmax činila 1. den 1,6 ± 0,36 pg/ml a 3. den 1,4 ± 0,22 pg/ml.
Distribuce
Aprepitant se ve vysoké míře váže na proteiny, s průměrnou hodnotou 97 %. Geometrická průměrná hodnota zdánlivého distribučního objemu v rovnovážném stavu (Vdss) je u člověka přibližně 66 litrů.
Biotransformace
Aprepitant prochází rozsáhlou biotransformací. U zdravých mladých dospělých jedinců vykazuje aprepitant po dobu 72 hodin po jednorázové intravenózní aplikaci 100 mg [14C]-fosaprepitantu, což je proléčivo aprepitantu, v plazmě přibližně 19 % radioaktivity, což ukazuje na značnou přítomnost metabolitů v plazmě. V lidské plazmě bylo zjištěno dvanáct metabolitů aprepitantu. Metabolismus aprepitantu probíhá ve velké míře cestou oxidace v morfolinovém kruhu a jeho postranních řetězcích a výsledné metabolity jsou pouze slabě aktivní. In vitro studie s lidskými jaterními mikrozomy ukazují, že aprepitant je metabolizován primárně cestou CYP3A4, případně s malým podílem CYP1A2 a CYP2C19.
Eliminace
Aprepitant se v nezměněné podobě močí nevylučuje. Metabolity se vylučují močí a stolicí cestou biliární exkrece.
Po jednorázové intravenózně aplikované dávce 100 mg [14C]-fosaprepitantu, což je proléčivo aprepitantu, zdravým jedincům bylo 57 % radioaktivity zjištěno v moči a 45 % ve stolici.
Plazmatická clearance aprepitantu závisí na dávce, se zvyšující se dávkou se snižuje a v rozmezí terapeutických dávek se pohybovala přibližně na hodnotách od 60 do 72 ml/min. Terminální poločas se pohyboval v rozmezí přibližně od 9 do 13 hodin.
Farmakokinetika u zvláštních populací
Starší osoby:
Po perorálním podání jedné 125mg dávky aprepitantu 1. den a dávky 80 mg jednou denně 2. až 5. den byla hodnota AUC0–24h aprepitantu 1. den o 21 % vyšší a 5. den o 36 % vyšší u starších osob (> 65 let) v porovnání s mladšími dospělými. Hodnota Cmax byla u starších osob ve srovnání s mladšími dospělými 1. den o 10 % vyšší a 5. den o 24 % vyšší. Tyto rozdíly se nepovažují za klinicky významné. U starších pacientů není třeba dávku upravovat.
Pohlaví:
Po perorálním podání jedné 125mg dávky aprepitantu byla hodnota Cmax aprepitantu o 16 % vyšší u žen v porovnání s muži. Poločas aprepitantu je o 25 % nižší u žen v porovnání s muži a k dosažení tmax dochází zhruba ve stejnou dobu. Tyto rozdíly nejsou považovány za klinicky významné. Dávku aprepitantu není nutno podle pohlaví pacienta upravovat.
Porucha funkce jater:
Lehká porucha funkce jater (Childova-Pughova klasifikace, třída A) neovlivňuje farmakokinetiku aprepitantu v klinicky významné míře. U pacientů s lehkou poruchou funkce jater není třeba dávkování upravovat.
Z dostupných dat nelze činit žádné závěry ohledně vlivu středně těžké poruchy funkce jater (Childova-Pughova klasifikace, třída B) na farmakokinetiku aprepitantu.
K dispozici nejsou žádné klinické ani farmakokinetické údaje od pacientů s těžkou poruchou funkce jater (Childova-Pughova klasifikace, třída C).
Porucha funkce ledvin:
Pacientům s těžkou poruchou funkce ledvin (ClCr < 30 ml/min) a pacientům s terminálním renálním onemocněním (end stage renal disease, ESRD) s potřebou hemodialýzy byla podána jednorázová 240mg dávka aprepitantu.
U pacientů s těžkou poruchou funkce ledvin se hodnota AUCC-v celkového aprepitantu (nevázaného i vázaného na proteiny) ve srovnání se zdravými jedinci snížila o 21 % a hodnota Cmax se snížila o 32 %. U pacientů s ESRD podstupujících hemodialýzu se hodnota AUCu-v celkového aprepitantu snížila o 42 % a hodnota Cmax se snížila o 32 %. Vzhledem k mírnému poklesu vazby aprepitantu na proteiny u pacientů s renálním onemocněním nebyla hodnota AUC farmakologicky aktivní části nenavázaného aprepitantu u pacientů s poruchou funkce ledvin ve srovnání se zdravými jedinci signifikantně ovlivněna. Hemodialýza prováděná 4 nebo 48 hodin po podání dávky neměla na farmakokinetiku aprepitantu signifikantní účinek; v dialyzátu bylo zjištěno méně než 0,2 % dávky.
U pacientů s poruchou funkce ledvin ani u pacientů s ESRD podstupujících hemodialýzu není zapotřebí dávkování aprepitantu upravovat.
Pediatrická populace:
V rámci 3denního režimu s dávkováním aprepitantu v tobolkách (125/80/80 mg) u dospívajících pacientů (ve věku 12 až 17 let) se u většiny pacientů první den dosáhlo AUC0–24h nad 17 pg^hod/ml s koncentracemi (Cmin) na konci 2. a 3. dne nad 0,4 pg/ml. Medián maximální plazmatické koncentrace (C max ) byl 1. den přibližně 1,3 pg/ml a tato koncentrace se objevila za přibližně 4 hodiny. V rámci 3denního režimu s dávkováním aprepitantu v prášku pro perorální suspenzi (3/2/2 mg/kg) u pacientů ve věku 6 měsíců až méně než 12 let se u většiny pacientů první den dosáhlo AUC0–24h nad 17 pg^hod/ml s koncentracemi (Cmin) na konci 2. a 3. dne nad 0,1 pg/ml. Medián maximální plazmatické koncentrace (C max ) byl první den přibližně 1,2 pg/ml a tato koncentrace se objevila za 5 až 7 hodin.
Populační farmakokinetická analýza aprepitantu u pediatrických pacientů (ve věku 6 měsíců až 17 let) naznačuje, že pohlaví a rasa nemají klinicky významný vliv na farmakokinetiku aprepitantu .
Vztah mezi koncentrací a účinkem
Studie využívající pozitronovou emisní tomografii (PET) s použitím vysoce specifického značení receptorů NK1 u zdravých mladých mužů ukázaly, že aprepitant prostupuje do mozku a obsazuje receptory NK1 v závislosti na dávce a koncentraci v plazmě. Předpokládá se, že plazmatické koncentrace aprepitantu dosažené při 3denním léčebném režimu s aprepitantem u dospělých zajišťují více než 95% obsazení receptorů NK1 v mozku.
5.3 Předklinické údaje vztahující se k bezpečnosti
Předklinické údaje získané na základě konvenčních studií toxicity, genotoxicity, hodnocení kancerogenního potenciálu, reprodukční a vývojové toxicity po jednorázovém a opakovaném podání přípravku neodhalily žádné zvláštní riziko pro člověka. Je však nutno mít na paměti, že systémová expozice u hlodavců byla podobná nebo dokonce nižší, než terapeutická expozice u člověka při dávce 125 mg/80 mg. I když nebyly v reprodukčních studiích s expozičními hodnotami pro člověka zjištěny žádné nežádoucí účinky, nelze zejména na základě hodnot expozice použitých u zvířat dostatečně posoudit riziko pro člověka.
Ve studii juvenilní toxicity na potkanech, kterým se podával aprepitant postnatálně od 10. do 63. dne, docházelo u samic k časnému vaginálnímu otevírání od dávek 250 mg/kg dvakrát denně a u samců k opožděné separaci předkožky, a to od dávek 10 mg/kg dvakrát denně. Nebyl zde žádný odstup od klinicky relevantní expozice. Nedošlo k žádným s léčbou souvisejícím účinkům ohledně páření, fertility či přežití embryí/fetů a nevyskytly se žádné patologické změny reprodukčních orgánů. Ve studii juvenilní toxicity u psů léčených od 14. do 42. postnatálního dne, byla u samců při dávce 6 mg/kg/den pozorována snížená hmotnost varlat a velikosti Leydigových buněk a u samic při dávkách od 4 mg/kg/den byla pozorována zvýšená hmotnost dělohy, hypertrofie dělohy a děložního hrdla a otok vaginálních tkání. Nebyl zde žádný odstup od klinicky relevantní expozice aprepitantu. Při krátkodobé léčbě podle doporučeného dávkovacího režimu se klinický význam těchto zjištění nepovažuje za pravděpodobný.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Obsah tobolky
Sacharóza
Mikrokrystalická celulóza 500 (E 460)
Hyprolóza (HPC-SL) (E 463)
Natrium-lauryl-sulfát
Tobolka (125 mg)
Želatina
Oxid titaničitý (E 171)
Červený oxid železitý (E 172)
Tobolka (80 mg)
Želatina
Oxid titaničitý (E 171)
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky pro uchovávání.
6.5 Druh obalu a obsah balení
Aluminium-OPA/Al/PVC blistr obsahující jednu 125mg tobolku.
Aluminium-OPA/Al/PVC blistr obsahující dvě 80mg tobolky.
6.6 Zvláštní opatření pro likvidaci přípravku
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Sandoz s.r.o., Na Pankráci 1724/129, 140 00 Praha 4 – Nusle, Česká republika
8. REGISTRAČNÍ ČÍSLO
20/1038/16-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 21. 2. 2018
Další informace o léčivu APREPITANT SANDOZ
Jak
se APREPITANT SANDOZ
podává: perorální podání - tvrdá tobolka
Výdej
léku: na lékařský předpis
Balení: Blistr
Velikost
balení: 1+2
Držitel rozhodnutí o registraci daného léku v České republice:
Sandoz s.r.o., Praha
E-mail: office.cz@sandoz.com
Telefon: 221 421 611
