Souhrnné informace o léku - VITAROS
1 NÁZEV PŘÍPRAVKU
Vitaros 3 mg/g krém
2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden aplikátor obsahuje alprostadilum 300 mikrogramů ve 100 mg krému (3 mg/g). Úplný seznam pomocných látek viz bod 6.1.
3 LÉKOVÁ FORMA
krém
Přípravek Vitaros je bílý až téměř bílý krém dodávaný v jednorázovém aplikátoru AccuDose. AccuDose je aplikátor skládající se z pístu, zásobníku a ochranného krytu zabalený v ochranném sáčku.
4 KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Léčba mužů starších 18 let s erektilní dysfunkcí, kteří nejsou schopni dosáhnout nebo udržet erekci dostatečnou pro uspokojivý sexuální výkon.
4.2 Dávkování a způsob podání
Přípravek Vitaros se aplikuje na špičku glans penis v místě vyústění močové trubice. Přípravek Vitaros se má aplikovat v případě potřeby dosažení erekce. Aplikátor AccuDose s přípravkem Vitaros je určen pouze k jednorázovému použití a má být po použití řádně zlikvidován. K nástupu účinku dojde během 5 až 30 minut po aplikaci. Účinek přetrvává po dobu 1 až 2 hodin. Skutečná doba se bude lišit individuálně podle pacienta. Každý pacient má být poučen zdravotnickým pracovníkem o správné technice aplikace přípravku Vitaros před jeho použitím. Frekvence používání je maximálně 2–3 krát týdně a pouze jednou za 24 hodin. Počáteční dávku má doporučit lékař. Počáteční dávka 300 mikrogramů je vhodná zejména u pacientů s vážnou erektilní dysfunkcí, komorbiditou nebo nedostatkem inhibitorů PDE-5. Pacienti, kteří netolerují dávku 300 mikrogramů v důsledku lokálních nežádoucích účinků, mohou být titrováni na nižší dávku 200 mikrogramů.
Pacienti mají být informováni o správném použití přípravku, o možných vedlejších účincích (jako jsou např. závratě, mdloby) a mají se vyhnout řízení a obsluze strojů do doby, než dojde k toleranci léku. V klinických studiích ukončilo léčbu 30 % léčených pacientů s dávkou 300 mikrogramů, zatímco u pacientů s dávkou 200 mikrogramů došlo k ukončení léčby u 20 % pacientů.
Doporučuje se vymočit před aplikací přípravku. Po sejmutí víčka aplikujte celý obsah přípraveku Vitaros na špičku penisu v místě otvoru vyústění močové trubice (ostium urethrae externum) podle následujících instrukcí, 5 – 30 minut před sexuálním stykem:
-
1) Umyjte si ruce před použitím přípravku Vitaros. Roztrhněte sáček v horní části a vyjměte aplikátor AccuDose (viz obr. 1). Odložte sáček pro pozdější uložení použitého aplikátoru AccuDose.
-
2) Rolováním aplikátoru mezi oběma rukama (viz obr. 2) dosáhnete pokojové teploty jednorázové dávky obsažené v aplikátoru. Tomuto kroku se lze vyhnout v případě, že vyjmete sáček s aplikátorem z chladničky dříve před aplikací (za dodržení limitů uvedených v bodě 6.4 Zvláštní opatření pro skladování)
-
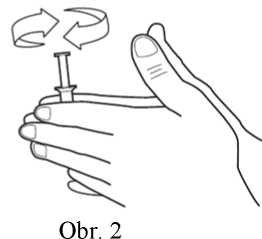
3) Otočte několikrát pístem, abyste se ujistili, že bude lehce klouzat (viz obr. 3), a poté odstraňte krytku z hrotu aplikátoru AccuDose.

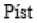

Zásobník
V Hrot 0
Obr. 1

-
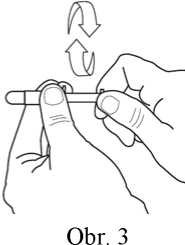
4) Držte penis ve vzpřímené svislé poloze, uchopte špičku penisu jednou rukou tak, abyste dosáhli rozšíření vyústění močové trubice na jeho špičce (viz obr. 4). (Poznámka: pokud není penis obřezaný, je třeba před rozšířením otvoru na špičce penisu stáhnout předkožku).
-
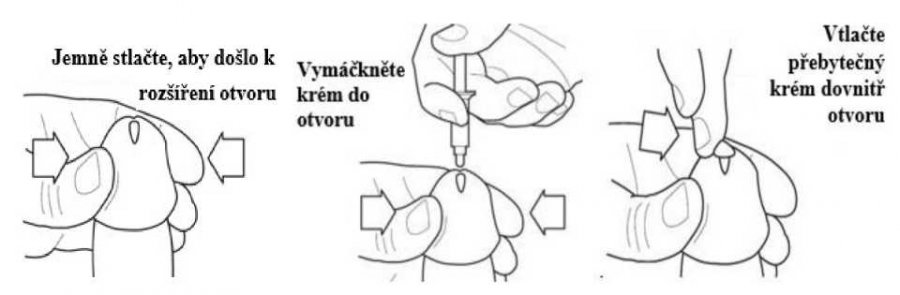
5) Přidržte aplikátor AccuDose mezi prsty, umístěte jeho špičku co nejblíže otvoru na špičce penisu a aniž byste zasunuli jeho hrot do penisu, nechte ztéct krém do močové trubice (viz obr. 5). Neopomeňte vytlačit veškerý krém ze zásobníku AccuDose. Pomalu, ale pevně zatlačte na píst palcem nebo prstem dokud není krém vytlačen z aplikátoru do otvoru na špičce penisu a močové trubice. Poznámka: I když je důležité, aby všechen krém stekl do močové trubice, dávejte pozor abyste nevkládali hrot aplikátoru AccuDose do otvoru na špičce penisu.
-
6) Držte penis ve vzpřímené poloze po dobu asi 30 sekund, aby krém mohl proniknout. Na špičce penisu pravděpodobně zůstane část krému, která se nevejde do ústí močové trubice na penisu. Jakýkoliv přebytek krému na špičce penisu by měl být zasunut do ústí močové trubice bříškem prstu (viz obr. 6). Nepoužívejte další aplikátor AccuDose k doplnění množství krému, který nebyl vtlačen do ústí
-
-
7) Pamatujte si, že každá dávka přípravku Vitaros je určena pouze pro jednorázové podání. Nasaďte kryt na hrot aplikátoru AccuDose a vložte do otevřeného sáčku a zlikvidujte v souladu s místními požadavky.
-
8) Přípravek Vitaros může dráždit oči. Umyjte si ruce po použití přípravku Vitaros.
4.3 Kontraindikace
Přípravek Vitaros nesmí být používán u pacientů v případě:
-
– hypesenzitivity na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1
-
– ortostatické hypotenze, infarktu myokardu a synkopy
-
– onemocnění, která mohou vést k predispozici priapismu, jako jsou např. srpkovitá anemie, trombocytemie, polycytemie, mnohočetný myelom nebo leukemie pacientů s abnormální anatomií penisu, jako je závažná hypospadie, u pacientů s anatomickou deformací penisu, např. zakřivení a u pacientů
s uretritidou a balanitidou.
-
– pacientů se sklonem k žilní trombóze
-
– pacientů, kteří trpí syndromem hyperviskozity, a proto jsou vystaveni zvýšenému riziku priapismus (rigidní erekce trvající 4 nebo více hodin).
-
– přípravek Vitaros nemají používat pacienti, pro které není sexuální aktivita vhodná, jako jsou muži s kardiovaskulárním nebo cerebrovaskulárním onemocněním
-
– přípravek Vitaros se nemá používat bez použití kondomu při pohlavnímu styku s ženou ve fertilním věku
4.4 Zvláštní upozornění a opatření pro
Prodloužené erekce trvající déle než 4 hodiny (priapismus), i když jsou vzácné, byly pozorovány s použitím přípravku Vitaros. Priapismus byl pozorován ve dvou 3měsíčních studiích u 1 pacienta (0,06%) a ve studii delší než 6 měsíců u 5 pacientů (0,4%), a to u 4 pacientů (0,3%) s dávkou 200 mikrogramů a u jednoho pacienta (0,1%) s dávkou 300 mikrogramů. Pokud dojde k priapismu, pacient má okamžitě vyhledat lékařskou pomoc.
Není-li léčba priapismu zahájena včas, může dojít k poškození tkáně penisu a trvalé ztrátě potence.
Symptomatická hypotenze (závratě) a synkopy se vyskytly ve 3. fázi studie u malého procenta pacientů [respektive u 2/459 (0,4%), 6/1591 (0,4%) a 6/1280 (0,5%)] při dávkování 100, 200 a 300 mikrogramů alprostadilu. Pacienti mají být upozorněni na riziko vzniku hypotenze nebo synkopy po podání přípravku Vitaros při činnostech jako je řízení či ovládání strojů, které by mohly vést k poranění. Před zahájením léčby přípravkem Vitaros, mají být vhodnými diagnostickými metodami vyloučeny jiné příčiny erektilní dysfunkce.
Kromě toho pacienti s ortostatickou hypotenzí, infarktem myokardu a synkopami, nesmí přípravek Vitaros používat (viz kontraindikace bod 4.3).
Klinické studie nebyly provedeny u pacientů s anamnézou neurologického onemocnění nebo poraněním míchy.
Farmakokinetika přípravku Vitaros nebyla formálně studována u pacientů s hepatální a/nebo renální insuficiencí. U těchto pacientů může být nutné dávku snížit v důsledku zhoršeného metabolismu.
Aplikace přípravku Vitaros má být prováděna v souladu s výše uvedenými pokyny. Neúmyslná intrauretrální expozice může vést k pálení nebo brnění a bolesti penisu. Údaje k opakované dlouhodobé, intrauretrální expozici přípravkem Vitaros nejsou známé. Pacienti mají být informováni, že přípravek Vitaros, neposkytuje ochranu před sexuálně přenosnými chorobami. Pacienti a jejich sexuální partnerky, kteří používají přípravek Vitaros, mají být poučeni o ochranných opatřeních, která jsou nezbytná pro zabránění šíření pohlavně přenosných onemocnění, včetně viru lidské imunodeficience (HIV).
Zdravotničtí pracovníci mají upozornit své pacienty, aby informovali sexuální partnerky, že používají přípravek Vitaros. U partnerek pacientů používajících přípravek Vitaros se mohou vyskytnout nežádoucí účinky, k nimž nejčastěji patří vaginální podráždění. Proto se doporučuje použití kondomu.
Nebyly studovány účinky přípravku Vitaros na orální nebo anální sliznice. Kondom se má použít při orálním (felace) nebo análním sexu.
Přípravek Vitaros nemá antikoncepční účinky. Doporučuje se, aby páry, kdy partner používá přípravek Vitaros, používaly vhodná kontraceptiva, pokud je partnerka ve fertilním věku.
Nejsou dostupné žádné informace od partnerek pacientů používajících přípravek Vitaros na počáteční fázi těhotenství. Při pohlavním styku s ženami ve fertilním věku, těhotnými nebo kojícími ženami se má používat kondom.
Studie byly prováděny pouze s latexovými kondomy. Není známo, zda může dojít k poškození kondomů vyrobených z jiných materiálů.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Farmakokinetické nebo farmakodynamické studie interakcí s přípravkem Vitaros nebyly provedeny. Vzhledem k povaze metabolismu (viz bod 5.2) jsou lékové interakce považovány za nepravděpodobné.
Účinek interakce
Bezpečnost a účinnost přípravku Vitaros v kombinaci s dalšími přípravky používanými k léčbě erektilní dysfunkce, zejména inhibitory fosfodiesterázy-5 (PDE-5) jako sildenafil, tadalafil a vardenafil, nebyla studována. Z tohoto důvodu nemá být přípravek Vitaros používán v kombinaci s inhibitory PDE-5. Jak přípravek Vitaros, tak i inhibitory PDE-5 mají vliv na kardiovaskulární systém a nelze vyloučit zvýšení kardiovaskulárního rizika.
Nebyly provedeny žádné studie interakcí přípravku Vitaros v kombinaci s penilními implantáty, relaxancii hladké svaloviny jako je papaverinem, léky používanými k navození erekce jako jsou alfa-blokátory (např. intrakavernózní fentolamin, thymoxamine). Hrozí zde riziko vzniku priapismu (bolestivá, abnormálně dlouhá erekce), pokud je přípravek Vitaros použit ve výše uvedené kombinaci.
Nebyly provedeny žádné studie interakcí přípravku Vitaros v kombinaci se sympatomimetiky, dekongestanty a přípravky na potlačení chuti k jídlu. Při použití v této kombinaci může být snížen účinek alprostadilu (léková interakční inhibice).
Nebyly provedeny žádné studie interakcí přípravku Vitaros v kombinaci s antikoagulancii a inhibitory agregace trombocytů. Při použití ve výše uvedené kombinaci může být zvýšené riziko uretrálního krvácení (hematurie).
Pacienti (zejména starší pacienti) léčení současně antihypertenzivy a vazoaktivními léky mohou mít zvýšené riziko hypotenze.
4.6 Fertilita, těhotenství a kojení
Nejsou žádné údaje o použití přípravku Vitaros u těhotných žen. Nepřímá expozice alprostadilem u žen je nízká.
Studie na zvířatech při vyšších dávkách alprostadilu ukazují na reprodukční toxicitu (viz bod 5.3).
Těhotné ženy nemají být vystaveny působení přípravku Vitaros.
Není známo, zda nepřímá expozice alprostadilem při použití přípravku Vitaros povede k výraznému vylučování do mateřského mléka. Proto se nedoporučuje používat přípravek Vitaros při kojení.
U samců králíků, byla pozorována atrofie semenných kanálků varlat po opakovaném podávání přípravku Vitaros obsahujícího pomocnou látku hydrochlorid dodecyl-dimethylaminopropionát (viz bod 5.3 „Předklinické údaje vztahující se k bezpečnosti“). Není známo, zda přípravek Vitaros ovlivňuje fertilitu u mužů.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Nebyly provedeny žádné studie o účincích na schopnost řídit a obsluhovat stroje. V klinických studiích byly vzácně hlášeny nežádoucí účinky související s přípravkem Vitaros jako jsou závratě a synkopa (mdloby). Při používání přípravku Vitaros se pacienti 1 až 2 hodiny po podání přípravku mají vyvarovat činnostem jako je řízení nebo obsluha strojů, protože by v případě synkopy mohlo dojít ke zranění.
4.8 Nežádoucí účinky
Tabulkový přehled nežádoucích účinků
Nejčastěji hlášené nežádoucí účinky při léčbě přípravkem Vitaros jsou uvedeny v následující tabulce. (Velmi časté > 1/10, časté > 1/100, <1/10; méně časté >1 / 1 000, <1/100; vzácné >1 / 10 000, <1/1 000; velmi vzácné <1/10 000)
Priapismus (erekce trvající déle než 4 hodiny) je závažný stav, který vyžaduje neodkladnou léčbu lékařem.
| Tabulka 1. Nežádoucí účin | y | |
| Třídy orgánových systémů (dle MedDRA) | Frekvence | Nežádoucí účinek |
| Poruchy nervového systému | méně časté | hyperestezie |
| Cévní poruchy* | méně časté | vertigo synkopa hypotense |
| Poruchy kůže a podkožní tkáně | časté | vyrážka |
| Poruchy svalové a kosterní soustavy a pojivové tkáně | méně časté | bolest končetin |
| Poruchy ledvin a | časté | bolest močové trubice |
| močových cest | méně časté | uretrální stenóza zánět močových cest |
| Poruchy reprodukčního systému a prsu | časté | pálení penisu bolest penisu erytém penisu bolest genitálu genitální diskomfort erytém genitálu zvýšená erekce pruritus genitálu edém penisu balanitida brnění penisu pulzování v penisu necitlivost penisu U partnerek: pocity vulvovaginálního pálení vaginitida |
| Méně časté | pruritus penisu vyrážka na genitálu bolest šourku pnutí v genitálu nadměrná tuhost nedostatečná citlivost penisu prodloužená doba erekce/priapismus U partnerek: vulvovaginální pruritus | |
| Celkové poruchy a reakce v místě aplikace | Méně časté | bolest v místě aplikace |
* Není jasné, zda alprostadil přes vasodilatační účinky zvyšuje riziko kardiovaskulárních příhod, ale nelze vyloučit, že pacienti s přítomnou nemocí nebo rizikovými faktory jsou ve zvýšeném riziku v souvislosti s vyšší sexuální nebo tělesnou aktivitou, která je s používáním alprostadilu spojena (viz body 4.3 a 4.4).
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležitá. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41, Praha 10
Webové stránky:
4.9 Předávkování
Vitaros 3 mg/g krém
2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden aplikátor obsahuje alprostadilum 300 mikrogramů ve 100 mg krému (3 mg/g). Úplný seznam pomocných látek viz bod 6.1.
3 LÉKOVÁ FORMA
krém
Přípravek Vitaros je bílý až téměř bílý krém dodávaný v jednorázovém aplikátoru AccuDose. AccuDose je aplikátor skládající se z pístu, zásobníku a ochranného krytu zabalený v ochranném sáčku.
4 KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Léčba mužů starších 18 let s erektilní dysfunkcí, kteří nejsou schopni dosáhnout nebo udržet erekci dostatečnou pro uspokojivý sexuální výkon.
4.2 Dávkování a způsob podání
Přípravek Vitaros se aplikuje na špičku glans penis v místě vyústění močové trubice. Přípravek Vitaros se má aplikovat v případě potřeby dosažení erekce. Aplikátor AccuDose s přípravkem Vitaros je určen pouze k jednorázovému použití a má být po použití řádně zlikvidován. K nástupu účinku dojde během 5 až 30 minut po aplikaci. Účinek přetrvává po dobu 1 až 2 hodin. Skutečná doba se bude lišit individuálně podle pacienta. Každý pacient má být poučen zdravotnickým pracovníkem o správné technice aplikace přípravku Vitaros před jeho použitím. Frekvence používání je maximálně 2–3 krát týdně a pouze jednou za 24 hodin. Počáteční dávku má doporučit lékař. Počáteční dávka 300 mikrogramů je vhodná zejména u pacientů s vážnou erektilní dysfunkcí, komorbiditou nebo nedostatkem inhibitorů PDE-5. Pacienti, kteří netolerují dávku 300 mikrogramů v důsledku lokálních nežádoucích účinků, mohou být titrováni na nižší dávku 200 mikrogramů.
Pacienti mají být informováni o správném použití přípravku, o možných vedlejších účincích (jako jsou např. závratě, mdloby) a mají se vyhnout řízení a obsluze strojů do doby, než dojde k toleranci léku. V klinických studiích ukončilo léčbu 30 % léčených pacientů s dávkou 300 mikrogramů, zatímco u pacientů s dávkou 200 mikrogramů došlo k ukončení léčby u 20 % pacientů.
Způsob použití:
Doporučuje se vymočit před aplikací přípravku. Po sejmutí víčka aplikujte celý obsah přípraveku Vitaros na špičku penisu v místě otvoru vyústění močové trubice (ostium urethrae externum) podle následujících instrukcí, 5 – 30 minut před sexuálním stykem:
-
1) Umyjte si ruce před použitím přípravku Vitaros. Roztrhněte sáček v horní části a vyjměte aplikátor AccuDose (viz obr. 1). Odložte sáček pro pozdější uložení použitého aplikátoru AccuDose.
-
2) Rolováním aplikátoru mezi oběma rukama (viz obr. 2) dosáhnete pokojové teploty jednorázové dávky obsažené v aplikátoru. Tomuto kroku se lze vyhnout v případě, že vyjmete sáček s aplikátorem z chladničky dříve před aplikací (za dodržení limitů uvedených v bodě 6.4 Zvláštní opatření pro skladování)
-
3) Otočte několikrát pístem, abyste se ujistili, že bude lehce klouzat (viz obr. 3), a poté odstraňte krytku z hrotu aplikátoru AccuDose.


Zásobník
V Hrot 0
Obr. 1



-
4) Držte penis ve vzpřímené svislé poloze, uchopte špičku penisu jednou rukou tak, abyste dosáhli rozšíření vyústění močové trubice na jeho špičce (viz obr. 4). (Poznámka: pokud není penis obřezaný, je třeba před rozšířením otvoru na špičce penisu stáhnout předkožku).
-
5) Přidržte aplikátor AccuDose mezi prsty, umístěte jeho špičku co nejblíže otvoru na špičce penisu a aniž byste zasunuli jeho hrot do penisu, nechte ztéct krém do močové trubice (viz obr. 5). Neopomeňte vytlačit veškerý krém ze zásobníku AccuDose. Pomalu, ale pevně zatlačte na píst palcem nebo prstem dokud není krém vytlačen z aplikátoru do otvoru na špičce penisu a močové trubice. Poznámka: I když je důležité, aby všechen krém stekl do močové trubice, dávejte pozor abyste nevkládali hrot aplikátoru AccuDose do otvoru na špičce penisu.
-
6) Držte penis ve vzpřímené poloze po dobu asi 30 sekund, aby krém mohl proniknout. Na špičce penisu pravděpodobně zůstane část krému, která se nevejde do ústí močové trubice na penisu. Jakýkoliv přebytek krému na špičce penisu by měl být zasunut do ústí močové trubice bříškem prstu (viz obr. 6). Nepoužívejte další aplikátor AccuDose k doplnění množství krému, který nebyl vtlačen do ústí
-
-
7) Pamatujte si, že každá dávka přípravku Vitaros je určena pouze pro jednorázové podání. Nasaďte kryt na hrot aplikátoru AccuDose a vložte do otevřeného sáčku a zlikvidujte v souladu s místními požadavky.
-
8) Přípravek Vitaros může dráždit oči. Umyjte si ruce po použití přípravku Vitaros.

-
– hypesenzitivity na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1
-
– ortostatické hypotenze, infarktu myokardu a synkopy
-
– onemocnění, která mohou vést k predispozici priapismu, jako jsou např. srpkovitá anemie, trombocytemie, polycytemie, mnohočetný myelom nebo leukemie pacientů s abnormální anatomií penisu, jako je závažná hypospadie, u pacientů s anatomickou deformací penisu, např. zakřivení a u pacientů
-
– pacientů se sklonem k žilní trombóze
-
– pacientů, kteří trpí syndromem hyperviskozity, a proto jsou vystaveni zvýšenému riziku priapismus (rigidní erekce trvající 4 nebo více hodin).
-
– přípravek Vitaros nemají používat pacienti, pro které není sexuální aktivita vhodná, jako jsou muži s kardiovaskulárním nebo cerebrovaskulárním onemocněním
-
– přípravek Vitaros se nemá používat bez použití kondomu při pohlavnímu styku s ženou ve fertilním věku
4.4 Zvláštní upozornění a opatření pro
použití Lokální účinky:
Prodloužené erekce trvající déle než 4 hodiny (priapismus), i když jsou vzácné, byly pozorovány s použitím přípravku Vitaros. Priapismus byl pozorován ve dvou 3měsíčních studiích u 1 pacienta (0,06%) a ve studii delší než 6 měsíců u 5 pacientů (0,4%), a to u 4 pacientů (0,3%) s dávkou 200 mikrogramů a u jednoho pacienta (0,1%) s dávkou 300 mikrogramů. Pokud dojde k priapismu, pacient má okamžitě vyhledat lékařskou pomoc.
Není-li léčba priapismu zahájena včas, může dojít k poškození tkáně penisu a trvalé ztrátě potence.
Symptomatická hypotenze (závratě) a synkopy se vyskytly ve 3. fázi studie u malého procenta pacientů [respektive u 2/459 (0,4%), 6/1591 (0,4%) a 6/1280 (0,5%)] při dávkování 100, 200 a 300 mikrogramů alprostadilu. Pacienti mají být upozorněni na riziko vzniku hypotenze nebo synkopy po podání přípravku Vitaros při činnostech jako je řízení či ovládání strojů, které by mohly vést k poranění. Před zahájením léčby přípravkem Vitaros, mají být vhodnými diagnostickými metodami vyloučeny jiné příčiny erektilní dysfunkce.
Kromě toho pacienti s ortostatickou hypotenzí, infarktem myokardu a synkopami, nesmí přípravek Vitaros používat (viz kontraindikace bod 4.3).
Klinické studie nebyly provedeny u pacientů s anamnézou neurologického onemocnění nebo poraněním míchy.
Farmakokinetika přípravku Vitaros nebyla formálně studována u pacientů s hepatální a/nebo renální insuficiencí. U těchto pacientů může být nutné dávku snížit v důsledku zhoršeného metabolismu.
Všeobecná bezpečnostní opatření:
Aplikace přípravku Vitaros má být prováděna v souladu s výše uvedenými pokyny. Neúmyslná intrauretrální expozice může vést k pálení nebo brnění a bolesti penisu. Údaje k opakované dlouhodobé, intrauretrální expozici přípravkem Vitaros nejsou známé. Pacienti mají být informováni, že přípravek Vitaros, neposkytuje ochranu před sexuálně přenosnými chorobami. Pacienti a jejich sexuální partnerky, kteří používají přípravek Vitaros, mají být poučeni o ochranných opatřeních, která jsou nezbytná pro zabránění šíření pohlavně přenosných onemocnění, včetně viru lidské imunodeficience (HIV).
Zdravotničtí pracovníci mají upozornit své pacienty, aby informovali sexuální partnerky, že používají přípravek Vitaros. U partnerek pacientů používajících přípravek Vitaros se mohou vyskytnout nežádoucí účinky, k nimž nejčastěji patří vaginální podráždění. Proto se doporučuje použití kondomu.
Nebyly studovány účinky přípravku Vitaros na orální nebo anální sliznice. Kondom se má použít při orálním (felace) nebo análním sexu.
Přípravek Vitaros nemá antikoncepční účinky. Doporučuje se, aby páry, kdy partner používá přípravek Vitaros, používaly vhodná kontraceptiva, pokud je partnerka ve fertilním věku.
Nejsou dostupné žádné informace od partnerek pacientů používajících přípravek Vitaros na počáteční fázi těhotenství. Při pohlavním styku s ženami ve fertilním věku, těhotnými nebo kojícími ženami se má používat kondom.
Studie byly prováděny pouze s latexovými kondomy. Není známo, zda může dojít k poškození kondomů vyrobených z jiných materiálů.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Farmakokinetické nebo farmakodynamické studie interakcí s přípravkem Vitaros nebyly provedeny. Vzhledem k povaze metabolismu (viz bod 5.2) jsou lékové interakce považovány za nepravděpodobné.
Účinek interakce
Bezpečnost a účinnost přípravku Vitaros v kombinaci s dalšími přípravky používanými k léčbě erektilní dysfunkce, zejména inhibitory fosfodiesterázy-5 (PDE-5) jako sildenafil, tadalafil a vardenafil, nebyla studována. Z tohoto důvodu nemá být přípravek Vitaros používán v kombinaci s inhibitory PDE-5. Jak přípravek Vitaros, tak i inhibitory PDE-5 mají vliv na kardiovaskulární systém a nelze vyloučit zvýšení kardiovaskulárního rizika.
Nebyly provedeny žádné studie interakcí přípravku Vitaros v kombinaci s penilními implantáty, relaxancii hladké svaloviny jako je papaverinem, léky používanými k navození erekce jako jsou alfa-blokátory (např. intrakavernózní fentolamin, thymoxamine). Hrozí zde riziko vzniku priapismu (bolestivá, abnormálně dlouhá erekce), pokud je přípravek Vitaros použit ve výše uvedené kombinaci.
Nebyly provedeny žádné studie interakcí přípravku Vitaros v kombinaci se sympatomimetiky, dekongestanty a přípravky na potlačení chuti k jídlu. Při použití v této kombinaci může být snížen účinek alprostadilu (léková interakční inhibice).
Nebyly provedeny žádné studie interakcí přípravku Vitaros v kombinaci s antikoagulancii a inhibitory agregace trombocytů. Při použití ve výše uvedené kombinaci může být zvýšené riziko uretrálního krvácení (hematurie).
Pacienti (zejména starší pacienti) léčení současně antihypertenzivy a vazoaktivními léky mohou mít zvýšené riziko hypotenze.
4.6 Fertilita, těhotenství a kojení
Těhotenství
Nejsou žádné údaje o použití přípravku Vitaros u těhotných žen. Nepřímá expozice alprostadilem u žen je nízká.
Studie na zvířatech při vyšších dávkách alprostadilu ukazují na reprodukční toxicitu (viz bod 5.3).
Těhotné ženy nemají být vystaveny působení přípravku Vitaros.
Kojení
Není známo, zda nepřímá expozice alprostadilem při použití přípravku Vitaros povede k výraznému vylučování do mateřského mléka. Proto se nedoporučuje používat přípravek Vitaros při kojení.
Fertilita
U samců králíků, byla pozorována atrofie semenných kanálků varlat po opakovaném podávání přípravku Vitaros obsahujícího pomocnou látku hydrochlorid dodecyl-dimethylaminopropionát (viz bod 5.3 „Předklinické údaje vztahující se k bezpečnosti“). Není známo, zda přípravek Vitaros ovlivňuje fertilitu u mužů.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Nebyly provedeny žádné studie o účincích na schopnost řídit a obsluhovat stroje. V klinických studiích byly vzácně hlášeny nežádoucí účinky související s přípravkem Vitaros jako jsou závratě a synkopa (mdloby). Při používání přípravku Vitaros se pacienti 1 až 2 hodiny po podání přípravku mají vyvarovat činnostem jako je řízení nebo obsluha strojů, protože by v případě synkopy mohlo dojít ke zranění.
4.8 Nežádoucí účinky
Tabulkový přehled nežádoucích účinků
Nejčastěji hlášené nežádoucí účinky při léčbě přípravkem Vitaros jsou uvedeny v následující tabulce. (Velmi časté > 1/10, časté > 1/100, <1/10; méně časté >1 / 1 000, <1/100; vzácné >1 / 10 000, <1/1 000; velmi vzácné <1/10 000)
Priapismus (erekce trvající déle než 4 hodiny) je závažný stav, který vyžaduje neodkladnou léčbu lékařem.
| Tabulka 1. Nežádoucí účin | y | |
| Třídy orgánových systémů (dle MedDRA) | Frekvence | Nežádoucí účinek |
| Poruchy nervového systému | méně časté | hyperestezie |
| Cévní poruchy* | méně časté | vertigo synkopa hypotense |
| Poruchy kůže a podkožní tkáně | časté | vyrážka |
| Poruchy svalové a kosterní soustavy a pojivové tkáně | méně časté | bolest končetin |
| Poruchy ledvin a | časté | bolest močové trubice |
| močových cest | méně časté | uretrální stenóza zánět močových cest |
| Poruchy reprodukčního systému a prsu | časté | pálení penisu bolest penisu erytém penisu bolest genitálu genitální diskomfort erytém genitálu zvýšená erekce pruritus genitálu edém penisu balanitida brnění penisu pulzování v penisu necitlivost penisu U partnerek: pocity vulvovaginálního pálení vaginitida |
| Méně časté | pruritus penisu vyrážka na genitálu bolest šourku pnutí v genitálu nadměrná tuhost nedostatečná citlivost penisu prodloužená doba erekce/priapismus U partnerek: vulvovaginální pruritus | |
| Celkové poruchy a reakce v místě aplikace | Méně časté | bolest v místě aplikace |
Zvláštní populace
* Není jasné, zda alprostadil přes vasodilatační účinky zvyšuje riziko kardiovaskulárních příhod, ale nelze vyloučit, že pacienti s přítomnou nemocí nebo rizikovými faktory jsou ve zvýšeném riziku v souvislosti s vyšší sexuální nebo tělesnou aktivitou, která je s používáním alprostadilu spojena (viz body 4.3 a 4.4).
Hlášení o podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležitá. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41, Praha 10
Webové stránky:
4.9 Předávkování
Předávkování přípravkem Vitaros vyžadující léčbu nebylo hlášeno. Předávkování přípravkem Vitaros může vést k hypotenzi, synkopě, závrati, bolesti penisu a případnému priapismu (rigidní erekce trvající více jak 4 hodiny). Priapismus může mít za následek trvalé zhoršení erektilní funkce. Pacienti s podezřením na předávkování, u kterých se tyto příznaky rozvinou, musí být pod lékařským dohledem, dokud nebudou vyřešeny systémové nebo lokální příznaky.
Pacient má být poučen, že v případě, kdy dojde k prodloužení erekce trvající déle než
-
4 hodiny, je nutné vyhledat lékařskou pomoc. Mají být přijata následující opatření:
- Pacient má ležet na zádech nebo na boku. Má se použít ledový obklad střídavě po dobu dvou minut v horní oblasti vnitřní strany stehen (což může způsobit reflexní otevření žilních chlopní). Pokud nedojde po 10 minutách k pozitivní reakci, je třeba ledování přerušit
- Pokud je tato léčba neefektivní a rigidní erekce trvá déle než 6 hodin, má být provedena penilní aspirace. Asepticky se zavede kanyla s křidélky velikosti 1921 do corpus cavernosum a odsaje se 20 – 50 ml krve. To může vést
- Dále může být podáno 0,5 až 1,0 ml roztoku fenylefrinu (200 mikrogramů/ml) injekčně každých 5–10 minut. Dále může být použit roztok adrenalinu (20 mikrogramů/ml). Pokud je to nutné, může následovat další odebrání krve kanylou s křidélky z corpus cavernosum. Maximální dávka fenylefrinu je 1 mg, adrenalinu je 100 mikrogramů (5 ml roztoku).
- Dále je rovněž možné použít metaraminol, ale je známo, že byly zaznamenány fatální případy hypertenzní krize. Pokud se stále nedaří vyřešit priapismus, pacient má být okamžitě odeslán k operační léčbě.
5 FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Léčiva používaná při poruchách erekce.
ATC kód: G04BE01
Mechanismus účinku:
Alprostadil je chemicky totožný s prostaglandin E1, který působí vazodilataci krevních cév erektilní tkáně v corpus cavernosum a zvýšení průtoku krve kavernózní arterií, což způsobuje penilní rigiditu.
Po aplikaci přípravku Vitaros dochází k nástupu erekce během 5 až 30 minut. Alprostadil má u mužů krátký biologický poločas a zlepšení erekce může trvat 1 až 2 hodiny po podání.
Účinnost:
Účinnost přípravku Vitaros byla hodnocena v třetí fázi klinického hodnocení dvou pivotních studiích u pacientů s erektilní dysfunkcí. Ve srovnání s placebem, docházelo ke statisticky významnému celkovému zlepšení pozorovanému ve skupinách léčených alprostadilem v dávkách 100 mikrogramů, 200 mikrogramů a 300 mikrogramů v každém z primárních parametrů účinnosti erektilní funkci (EF), tj. IIEF skóre (International Index of Erectile Function), zvýšení schopnosti vaginální penetrace a ejakulace. Navíc došlo ke statisticky významnému celkovému zlepšení v několika sekundárních parametrech účinnosti včetně dalších parametrů IIEF skóre (průběhu orgasmu, spokojenosti se souloží a celkové spokojenosti), Patient Self-Assessment of Erection ( PSAE) a Global Assessment Questionnaire (GAQ) u pacientů léčených alprostadilem v porovnání s placebem.
Srovnatelné zlepšení u pacientů bylo pozorováno i v rámci subpopulace (diabetické, kardiologické, po prostatektomii, u pacientů s hypertenzí a u pacientů, u kterých selhala předchozí léčba Viagrou) a ve dvou věkových skupinách (do 65 let a nad 65 let) v parametrech EF IIEF skóre.
5.2 Farmakokinetické vlastnosti
Absorpce:
Absolutní biologická dostupnost u topického podání nebyla stanovena. U pacientů s erektilní dysfunkcí léčených 100 mg přípravku Vitaros krém v dávkách 100 mikrogramů, 200 mikrogramů a 300 mikrogramů alprostadilu proběhla farmakokinetická studie. Hodnoty farmakokinetických parametrů plazmatické hladiny PGE1 a jeho metabolitu, PGE0 byly u většiny odebraných vzorků krve po aplikaci uvedených dávek u většiny pacientů nevyhodnotitelné z důvodu nízkých nebo nedetekovatelných hladin. Hodnoty Cmax a AUC 15-keto-PGE0 byly nízké a vykazovaly nižší nárůst ve srovnání s nárůstem úměrným dávkovému rozmezí 100 – 300 mikrogramů. Maximální plazmatické koncentrace 15-keto-PGE0 bylo dosaženo v průběhu jedné hodiny po podání.
Tabulka 2
Směrodatné odchylky farmakokinetických parametrů pro 15-keto-PGE0
| Placebo | Vitaros | Vitaros | Vitaros | |
| Parametr | (N=5) | 100 Mg | 200 gg | 300 gg |
| (N=5) | (N=5) | (N=5) |
| AUCa (pg*h/ml) | 388 (256) | 439 (107) | 504 (247) | 960 (544) |
| Cmax (pg/ml) | 23 (19) | 202 (229) | 120 (103) | 332 (224) |
| Tmax (h) | 6 (8) | 0.6 (0.4) | 1 (0.7) | 0.7 (0.3) |
| T1/2 (h) | 4 (–)b | 5 (3) | 3 (1)c | 6 (6) |
| a AUC je plocha pod křivkou plazmatické koncentrace od času nula do 24 hodin b pouze 1 subjekt měl dostatečné údaje pro odhad poločasu c pouze 3 subjekty měly dostatečné údaje pro odhad poločasu SD = směrodatná odchylka | ||||
Distribuce:
Alprostadil je po aplikaci na glans penis v místě vyústění močové trubice rychle vstřebáván do corpus spongiosum a corpora cavernosa přes kolaterální cévy. Zbývající část odchází do pánevního žilního oběhu žílami z corpus spongiosum.
Biotransformace:
Po topickém podání se PGE1 rychle metabolizuje enzymatickou oxidací 15-hydroxylové skupiny na 15-keto-PGE1. 15-keto-PGE1 si uchovává pouze 1–2% z biologické aktivity PGE1 a rychle se redukuje na nejvíce zastoupené neaktivní metabolity 13, 14-dihydro, 15-keto-PGE, které jsou vylučovány primárně ledvinami a játry.
Eliminace:
Po intravenózním podání alprostadilu značeného tritiem u mužů je léčivo rychle eliminováno z krve v prvních 10 minutách po podání a po 1 hodině je měřitelná pouze nízká hladina radioaktivity v krvi. Metabolity alprostadilu jsou vylučovány převážně ledvinami a cca 90% podané intravenózní dávky se vyloučí močí během 24 hodin po podání. Zbývající část se vyloučí stolicí. Neexistuje žádný důkaz o retenci alprostadilu nebo jeho metabolitů po intravenózním podání v tkáni.
Farmakokinetika u zvláštních skupin pacientů:
Plicní onemocnění: pacienti s plicním onemocněním mohou mít sníženou schopnost eliminovat léčivo. Plicní extrakce nitrožilně podaného PGE1u pacientů se syndromem respirační tísně dospělých byla snížena přibližně o 15% v porovnání s kontrolní skupinou pacientů s normální respirační funkcí.
Pohlaví:
Farmakokineticky efekt přípravku Vitaros na pohlaví nebyl studován a farmakokinetické studie u partnerek nebyly provedeny.
Starší pacienti a pediatrická populace:
Nebyly studovány farmakokinetické účinky lokální aplikace alprostadilu v souvislosti s věkem. Přípravek Vitaros není indikován pro použití u dětí a dospívajících do 18 let.
5.3 Předklinické údaje vztahující se k bezpečnosti
Alprostadil, hydrochlorid dodecyl-dimethylaminopropionátu a přípravek Vitaros (včetně hydrochlorid dodecyl-dimethylaminopropionátu) neprokázaly genotoxický potenciál. Studie karcinogenity nebyly provedeny s alprostadilem nebo přípravkem Vitaros. Dlouhodobé studie karcinogenity pomocné látky hydrochlorid dodecyl-dimethylaminopropionátu nepotvrdily tvorbu nádorů při lokálním podání myším a podkožní aplikaci u potkanů. Aplikace hydrochlorid dodecyl-dimethylaminopropionátu TgAC transgenním myším o koncentraci 1,0% a 2,5% (50 a 125 mg / kg / den) indukovala vznik papilomů u samic a samců, resp. není pravděpodobné, že tento efekt bude relevantní pro člověka, jedná se o reakci na podráždění.
Alprostadil nemá vliv na počet spermií nebo jejich morfologii. Nicméně, pomocná látka hydrochlorid dodecyl-dimethylaminopropionátu v koncentraci 5% a při dávkování 25 mg, 5 mg a 10 mg /kg /den způsobuje atrofii semenných kanálků varlat u králíků při lokálním podání na glans penis. Přímý spermatotoxický účinek hydrochlorid dodecyl-dimethylaminopropionátu nebyl testován a případný dopad na mužské plodnosti není znám. Hydrochlorid dodecyl-dimethylaminopropionátu subkutánně aplikovaný potkanům neměl vliv na jejich fertilitu.
Embryotoxicita alprostadilu při podávání formou podkožního bolusu u březích potkanů při nízkých dávkách byla prokázána, důsledkem bylo snížení hmotnosti plodu. Vyšší dávky vedly ke zvýšení resorpce, snížení počtu živých plodů, zvýšení výskytu viscerálních a kosterních změn a malformací a toxicitě pro matku. Při intravaginálním podání PGE1 březím králíkům nedochází k poškozením plodu.
-
5 hydrochlorid dodecyl-dimethylaminopropionátem subkutánně podaným potkanům
6 FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Čištěná voda Bezvodý ethanol Ethyl-laurát Guaraprolosa
Hydrochlorid dodecyl-dimethylaminopropionátu
Dihydrogenfosforečnan draselný Hydroxid sodný (k úpravě pH) Kyselina fosforečná (k úpravě pH)
6.2 Inkompatibility
Neuplatňují se.
6.3 Doba použitelnosti
1 rok
Po otevření okamžitě spotřebujte, nespotřebované množství přípravku zlikvidujte.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C – 8 °C). Chraňte před mrazem. Neotevřené sáčky mohou být z chladničky vyjmuty pacientem až 3 dny před použitím a uchovávány při teplotě do 25°C. Na konci tohoto období, má být přípravek zlikvidován. Uchovávejte v původním sáčku, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
Přípravek Vitaros se dodává v jednotlivých sáčcích, které obsahují jeden (1) aplikátor AccuDose. Jeden aplikátor obsahuje 100 mg krému. Přípravek Vitaros je k dispozici v krabičce obsahujících čtyři (4) jednotlivě balené aplikátory. Sáčky jsou složeny z laminované hliníkové fólie. Aplikátor je vyroben z polypropylenu a polyethylenu.
6.6 Zvláštní opatření pro likvidaci
Každý aplikátor je určen pouze k jednorázovému použití.
Veškerý nepoužitý léčivý přípravek nebo související odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Recordati Ireland Limited
Raheens East, Ringaskiddy Co. Cork, Irsko Tel
+353 (0) 21 4379 400
Fax +353 (0) 21 4379 2800
Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci:
Herbacos Recordati s.r.o. Česká republika Tel:
+ 420 466 741 927
8 . REGISTRAČNÍ ČÍSLO
83/550/15-C
9 . DATUM PRVNÍ REGISTRACE / PRODLOUŽENÍ REGISTRACE
Datum první registrace: 18. 11. 2015
Další informace o léčivu VITAROS
Jak
se VITAROS
podává: kožní podání - krém
Výdej
léku: na lékařský předpis
Balení: Aplikátor
Velikost
balení: 4X100MG
Držitel rozhodnutí o registraci daného léku v České republice:
RECORDATI Ireland Limited, Ringaskiddy Co. Cork
E-mail: petr.simerda@recordati.cz
Telefon: 721211559
