Souhrnné informace o léku - VISTABEL
1. NÁZEV PŘÍPRAVKU
VISTABEL 4 jednotky definované dle Allerganu/0,1 ml prášek pro injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Toxinum botulinicum typus A1....................4 jednotky definované dle Allerganu na 0,1 ml
rekonstituovaného roztoku.
1Clostridium botulinum
Jednotky Allerganu nejsou použitelné pro jiné přípravky obsahující botulotoxin.
Injekční lahvička s 50 jednotkami.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek pro injekční roztok.
Popis přípravku: bílý lyofilizát
VISTABEL vypadá jako jemná bílá usazenina na dně lahvičky, která může být obtížně viditelná.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
VISTABEL je indikován k dočasnému zlepšení vzhledu:
- Středně výrazných až výrazných svislých vrásek mezi obočím, které jsou patrné při maximálním zamračení (glabelární vrásky), a/nebo
- Středně výrazných až výrazných vějířkovitých vrásek, které jsou patrné při širokém úsměvu (tzv. havraní stopy), a/nebo
- Středně výrazných až výrazných vrásek na čele, které jsou patrné při maximálně zvednutém obočí,
když má závažnost vrásek na obličeji důležitý psychologický dopad u dospělých pacientů.
4.2 Dávkování a způsob podání
Dávkování
Viz konkrétní doporučení pro jednotlivé indikace uvedené níže.
Jednotky botulotoxinu nejsou u jednotlivých přípravků obsahujících botulotoxin zaměnitelné. Dávky doporučené v jednotkách definovaných dle Allerganu se liší od jiných přípravků obsahujících botulotoxin.
Starší pacienti
Klinické údaje z fáze 3 pro VISTABEL jsou u pacientů starších 65 let omezené (viz bod 5.1).
Při použití u starších pacientů není třeba dávku upravovat.
Pediatrická populace
Bezpečnost a účinnost přípravku VISTABEL při léčbě svislých (glabelárních) vrásek mezi obočím, které jsou patrné při maximálním zamračení, nebo vějířkovitých vrásek, které jsou patrné při širokém úsměvu, nebo vrásek na čele patrných při maximálně zvednutém obočí u osob mladších 18 let nebyla prokázána. Použití přípravku VISTABEL se u osob mladších 18 let nedoporučuje (viz bod 4.4).
Způsob podání
VISTABEL mají podávat pouze lékaři s příslušnou kvalifikací, doloženou odbornou znalostí léčby a s použitím požadovaného vybavení.
Po rekonstituci se VISTABEL musí používat pouze pro jedno podání injekce(í) na pacienta. Přebytek nevyužitého přípravku se musí zlikvidovat způsobem podrobně popsaným v bodě 6.6.
Měla by být přijata zvláštní opatření pro přípravu přípravku, stejně tak jako pro jeho podání a inaktivaci a likvidaci zbývajícího nepoužitého roztoku (viz bod 4.4 a 6.6).
Doporučený objem injekce na jedno svalové místo je 0,1 ml. Viz rovněž rekonstituční tabulka v bodě 6.6.
Pokyny k použití injekčních lahviček, zacházení s nimi a k jejich likvidaci jsou uvedeny v bodě 6.6.
Je třeba ujistit se, zda VISTABEL není aplikován do krevního řečiště při jeho aplikaci do svislých vrásek mezi obočím, které jsou patrné při maximálním zamračení (glabelární vrásky), do vějířkovitých vrásek, které jsou patrné při širokém úsměvu (tzv. havraní stopy), nebo vrásek na čele patrných při maximálně zvednutém obočí viz bod 4.4.
Léčebné intervaly nemají být častější než každé tři měsíce.
Návod k aplikaci injekcí k léčbě glabelárních vrásek, které , jsou patrné při maximálním zamračení:
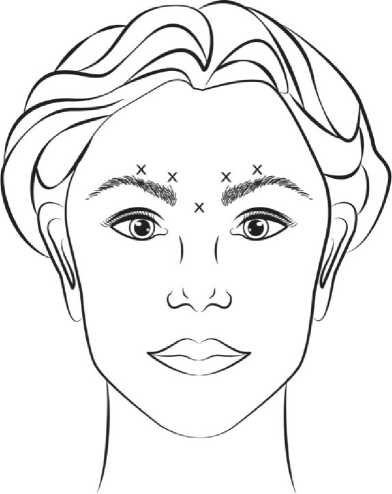
Rekonstituovaný VISTABEL (50 jednotek/1,25 ml) je injekčně podáván sterilní jehlou o síle 30 G. 0,1 ml (4 jednotky) do každého z pěti míst vpichu (viz obrázek č. 1): 2 injekce do každého musculus corrugator a 1 injekce do musculus procerus v celkové dávce 20 jednotek.
Před injekcí je nutné pevně přiložit palec nebo ukazováček pod okraj orbity, aby se pod ní zabránilo extravazaci. Jehla by měla být během injekce orientována superiorně a mediálně. Aby se snížilo riziko ptózy očního víčka, nesmí být překročena dávka 4 jednotky do jednoho místa vpichu a rovněž nesmí být překročen počet míst vpichu. Navíc se musíte vyhnout injekci v blízkosti levator palpebrae superioris, zvláště u pacientů s většími komplexy obočí a depresoru (depressor supercilii). Injekce do musculus corrugator se musí provádět v centrální části tohoto svalu, ve vzdálenosti nejméně 1 cm nad obloukem obočí.
Obrázek č. 1:
Zlepšení závažnosti glabelárních vrásek, které jsou patrné při maximálním zamračení, obecně nastává do jednoho týdne po léčbě. Účinek se prokázal až do 4 měsíců od injekce.
Návod k aplikaci injekcí k léčbě vějířkovitých vrásek, které jsou patrné při širokém úsměvu:
Rekonstituovaný VISTABEL (50 jednotek/1,25 ml) je injekčně podáván sterilní jehlou o síle 30 G. 0,1 ml (4 jednotky) do každého ze 3 míst vpichu na každé straně (celkem 6 míst vpichu) do laterálního musculus orbicularis oculi v celkové dávce 24 jednotek s celkovým objemem 0,6 ml (12 jednotek na každou stranu).
Aby se snížilo riziko ptózy očního víčka, nesmí být překročena maximální dávka 4 jednotky do jednoho místa vpichu a rovněž tak nesmí být překročen počet míst vpichu. Navíc injekce má být vedena temporálně k okraji orbity tak, aby byla zajištěna bezpečná vzdálenost od svalů, které jsou odpovědné za elevaci víčka.
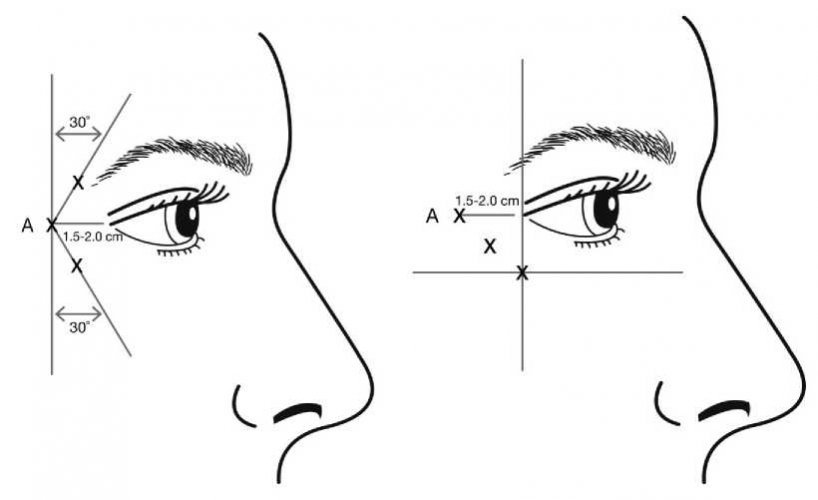
Injekce mají být podány s hrotem jehly zkoseným směrem vzhůru a od oka. První injekce (A) má být aplikována přibližně 1,5 až 2,0 cm temporálně od zevního očního koutku a od okraje orbity. Jestliže jsou vějířkovité vrásky nad zevním koutkem a pod ním, aplikujte injekci podle zobrazení na obrázku č. 2. Pokud jsou vějířkovité vrásky především pod zevním koutkem, aplikujte injekci podle zobrazení na obrázku č. 3.
Obrázek č. 2
Obrázek č. 3
Při léčbě glabelárních vrásek, které jsou patrné při maximálním zamračení, a vějířkovitých vrásek, které jsou patrné při širokém úsměvu současně, je dávka pro léčbu vějířkovitých vrásek 24 jednotek a pro léčbu glabelárních vrásek 20 jednotek (viz Návod k aplikaci injekcí k léčbě glabelárních vrásek a obrázek č. 1) v celkové dávce 44 jednotek s celkovým objemem 1,1 ml.
Ke zlepšení výraznosti vějířkovitých vrásek, které jsou patrné při širokém úsměvu, při hodnocení zkoušejícím, došlo během jednoho týdne po léčbě. Léčebný účinek byl prokázán v mediánu 4 měsíců po aplikaci injekce.
Návod k aplikaci injekcí k léčbě vrásek na čele patrných při maximálně zvednutém obočí:
Rekonstituovaný přípravek VISTABEL (50 jednotek/1,25 ml) se aplikuje v injekci pomocí sterilní jehly 30 G. Do každého z 5 míst podání injekce ve frontálním svalu se podává 0,1 ml (4 jednotky) s celkovou dávkou 20 jednotek v celkovém objemu 0,5 ml (viz obrázek 4).
Celková dávka na léčbu vrásek na čele (20 jednotek) ve spojení s glabelárními vráskami (20 jednotek) je 40 jednotek/1,0 ml.
K určení místa vhodného k aplikaci injekce do vyhodnoťte celkový vztah mezi velikostí čela pacienta a rozložením aktivity frontálního svalu.
Následné horizontální léčebné řady lokalizujte lehkým pohmatem čela v klidu a při maximálně zvednutém obočí:
- Horní okraj aktivity : přibližně 1 cm nad nejhořejším záhybem čela
- Dolní léčebná řada: uprostřed mezi horním okrajem aktivity frontálního svalu a obočím, nejméně 2 cm nad obočím
- Horní léčebná řada: uprostřed mezi horním okrajem aktivity frontálního svalu a dolní léčebnou řadou
- V dolní léčebné řadě ve střední linii obličeje a 0,5 – 1,5 cm mediálně k palpované temporální spojovací linii (temporální hřeben); opakujte na druhé straně.
-
V případě selhání léčby po první léčebné návštěvě, tj. za jeden měsíc po injekci nedojde k významnému zlepšení vůči výchozímu stavu, je možné zvážit následující přístupy:
- Analýza příčin selhání, např. injekce do nesprávného svalu, nesprávná injekční technika, tvorba protilátek neutralizujících toxin, nedostatečná dávka;
- Přehodnocení významnosti léčby botulotoxinem typu A;
Pokud nedojde k výskytu žádných nežádoucích účinků v souvislosti s prvním léčebným zákrokem, proveďte druhý léčebný zákrok, přičemž je nutné zachovat nejméně tříměsíční interval mezi dvěma léčebnými zákroky.
-
V případě nedostatečné dávky u léčby glabelárních vrásek, které jsou patrné při maximálním zamračení, zahajte druhý léčebný zákrok úpravou celkové dávky až na 40 či 50 jednotek, přičemž vezměte v úvahu analýzu selhání předchozí léčby.
Účinnost a bezpečnost opakovaného podání přípravku VISTABEL nad rámec 12 měsíců nebyla hodnocena.
4.3 Kontraindikace
VISTABEL je kontraindikován
-
– u osob se známou hypersenzitivitou na botulotoxin typ A nebo na kteroukoliv pomocnou látku uvedenou v bodě 6.1;
-
– v případě myastenia gravis nebo Eatonova – Lambertova syndromu
– v přítomnosti infekce v navrhovaných místech injekce.
4.4 Zvláštní upozornění a opatření pro použití
Konkrétní opatření je zapotřebí přijmout pro přípravu a podání přípravku společně s inaktivací a likvidací zbývajícího nepoužitého roztoku (viz bod 4.2 a 6.6).
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) v jedné dávce, to je v podstatě “bez obsahu sodíku“.
Před podáním přípravku VISTABEL je nutné znát všechny důležité anatomické vztahy a změny způsobené dřívějšími operačními výkony a je nutné se vyhnout aplikaci do zranitelných anatomických struktur.
Nesmí se překračovat doporučené dávkování ani zkracovat intervaly mezi aplikacemi přípravku VISTABEL.
Velmi vzácně se po podání injekce botulotoxinu může vyskytnout anafylaktická reakce. Proto by měl být připraven epinefrin (adrenalin) a další prostředky pro zvládnutí anafylaktického šoku.
Pacienti s nerozpoznaným neuromuskulárním onemocněním mohou být ohroženi zvýšeným rizikem klinicky význmných systémových účinků včetně závažné dysfagie a respiračního selhání a to při obvyklých dávkách botulotoxinu typu A. V někrerých z těchto případů dysfagie trvala několik měsíců a vyžadovala umístění žaludeční sondy (viz bod 4.3).
Zvýšené opatrnosti při použití přípravku VISTABEL je rovněž zapotřebí při léčbě pacientů s amyotrofickou laterální sklerózou nebo s periferními neuromuskulárními poruchami.
Velmi vzácně byly u botulotoxinu hlášeny nežádoucí účinky pravděpodobně spojené s rozšířením toxinu daleko od místa podání (viz bod 4.8). U pacientů léčených terapeutickými dávkami se může projevit nadměrná svalová slabost. Polykací a dechové obtíže jsou závažné a mohou vést k úmrtí. Injekce přípravku VISTABEL se nedoporučuje u pacientů s dysfagií a aspirací v anamnéze.
Pacienti nebo ošetřovatelé by měli být upozorněni, aby vyhledali okamžitě lékařskou pomoc, pokud vzniknou poruchy polykání, řeči nebo dýchání.
Příliš časté nebo vysoké dávky mohou zvýšit riziko tvorby protilátek. Tvorba protilátek může vést k selhání léčby botulotoxinu typu A i při jiných indikacích.
Jak lze očekávat u jakéhokoliv injekčního výkonu, může být injekce spojena s bolestí v místě vpichu, zánětem, parestézií, hypoestézií, citlivostí, otokem/edémem, erytémem, lokalizovanou infekcí, krvácením a/nebo podlitinami. Bolest a/nebo strach z injekce mohou vyvolat vasovagální odpovědi včetně přechodné symptomatické hypotenze a synkopy.
Opatrnost při použití přípravku VISTABEL je nutná, pokud je v místě plánované injekce zánět nebo je v cílovém svalu přítomna výrazná slabost nebo atrofie.
Je třeba zajistit, aby VISTABEL nebyl aplikován do krevního řečiště a to jak v případě aplikace do glabelárních vrásek, které jsou patrné při maximálním zamračení, při aplikaci do havraních stop, které jsou patrné při širokém úsměvu, nebo vrásek na čele patrných při maximálně zvednutém obočí, viz bod 4.2.
Po léčbě může hrozit riziko ptózy očního víčka, viz bod 4.2 ohledně návodu k aplikaci injekcí a minimalizace tohoto rizika.
Použití přípravku VISTABEL se nedoporučuje u osob mladších 18 let. U pacientů starších 65 let jsou pro přípravek Vistabel k dispozici omezené údaje z klinických studií fáze 3.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Účinek botulotoxinu může být teoreticky potencován aminoglykosidovými antibiotiky, spectinomycinem nebo jinými přípravky, které interferují s neuromuskulárním přenosem (např. neuromuskulární blokátory).
Vzájemný účinek různých botulotoxinových serotypů podaných ve stejnou dobu nebo během několika měsíců není známý. Nadměrná neuromuskulární slabost může být exacerbována při podání jiného botulotoxinu a to v době, kdy ještě nebyl rozpoznán účinek botulotoxinu podaného dříve.
Nebyly provedeny žádné specifické testy, které by doložily možnost klinických interakcí s jinými přípravky. U této indikace nebyly hlášeny žádné další klinicky významné interakce.
4.6 Fertilita, těhotenství a kojení
Těhotenství
Adekvátní údaje o podávání botulotoxinu typu A těhotným ženám nejsou k dispozici. Studie se zvířaty prokázaly reprodukční toxicitu (viz bod 5.3). Potenciální riziko pro člověka není známé.
VISTABEL se nedoporučuje podávat v těhotenství a u žen ve fertilním věku, které nepoužívají antikoncepci.
Kojení
Není známo, zda se VISTABEL vylučuje do lidského mateřského mléka. Během kojení se nedoporučuje VISTABEL používat.
Fertilita
Nejsou k dispozici odpovídající údaje o účincích používání botulotoxinu typu A na plodnost žen ve fertilním věku. Studie na potkaních samcích a samicích prokázaly snížení plodnosti (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Nebyly provedeny žádné studie týkající se účinku na schopnost řídit a používat stroje.
Nicméně, VISTABEL může způsobovat astenii, svalovou slabost, závratě a poruchy vidění, které mohou mít vliv na řízení a obsluhování strojů.
4.8 Nežádoucí účinky
1. NÁZEV PŘÍPRAVKU
VISTABEL 4 jednotky definované dle Allerganu/0,1 ml prášek pro injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Toxinum botulinicum typus A1....................4 jednotky definované dle Allerganu na 0,1 ml
rekonstituovaného roztoku.
1Clostridium botulinum
Jednotky Allerganu nejsou použitelné pro jiné přípravky obsahující botulotoxin.
Injekční lahvička s 50 jednotkami.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek pro injekční roztok.
Popis přípravku: bílý lyofilizát
VISTABEL vypadá jako jemná bílá usazenina na dně lahvičky, která může být obtížně viditelná.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
VISTABEL je indikován k dočasnému zlepšení vzhledu:
- Středně výrazných až výrazných svislých vrásek mezi obočím, které jsou patrné při maximálním zamračení (glabelární vrásky), a/nebo
- Středně výrazných až výrazných vějířkovitých vrásek, které jsou patrné při širokém úsměvu (tzv. havraní stopy), a/nebo
- Středně výrazných až výrazných vrásek na čele, které jsou patrné při maximálně zvednutém obočí,
když má závažnost vrásek na obličeji důležitý psychologický dopad u dospělých pacientů.
4.2 Dávkování a způsob podání
Dávkování
Viz konkrétní doporučení pro jednotlivé indikace uvedené níže.
Jednotky botulotoxinu nejsou u jednotlivých přípravků obsahujících botulotoxin zaměnitelné. Dávky doporučené v jednotkách definovaných dle Allerganu se liší od jiných přípravků obsahujících botulotoxin.
Starší pacienti
Klinické údaje z fáze 3 pro VISTABEL jsou u pacientů starších 65 let omezené (viz bod 5.1).
Při použití u starších pacientů není třeba dávku upravovat.
Pediatrická populace
Bezpečnost a účinnost přípravku VISTABEL při léčbě svislých (glabelárních) vrásek mezi obočím, které jsou patrné při maximálním zamračení, nebo vějířkovitých vrásek, které jsou patrné při širokém úsměvu, nebo vrásek na čele patrných při maximálně zvednutém obočí u osob mladších 18 let nebyla prokázána. Použití přípravku VISTABEL se u osob mladších 18 let nedoporučuje (viz bod 4.4).
Způsob podání
VISTABEL mají podávat pouze lékaři s příslušnou kvalifikací, doloženou odbornou znalostí léčby a s použitím požadovaného vybavení.
Po rekonstituci se VISTABEL musí používat pouze pro jedno podání injekce(í) na pacienta. Přebytek nevyužitého přípravku se musí zlikvidovat způsobem podrobně popsaným v bodě 6.6.
Měla by být přijata zvláštní opatření pro přípravu přípravku, stejně tak jako pro jeho podání a inaktivaci a likvidaci zbývajícího nepoužitého roztoku (viz bod 4.4 a 6.6).
Doporučený objem injekce na jedno svalové místo je 0,1 ml. Viz rovněž rekonstituční tabulka v bodě 6.6.
Pokyny k použití injekčních lahviček, zacházení s nimi a k jejich likvidaci jsou uvedeny v bodě 6.6.
Je třeba ujistit se, zda VISTABEL není aplikován do krevního řečiště při jeho aplikaci do svislých vrásek mezi obočím, které jsou patrné při maximálním zamračení (glabelární vrásky), do vějířkovitých vrásek, které jsou patrné při širokém úsměvu (tzv. havraní stopy), nebo vrásek na čele patrných při maximálně zvednutém obočí viz bod 4.4.
Léčebné intervaly nemají být častější než každé tři měsíce.
Návod k aplikaci injekcí k léčbě glabelárních vrásek, které , jsou patrné při maximálním zamračení:
Rekonstituovaný VISTABEL (50 jednotek/1,25 ml) je injekčně podáván sterilní jehlou o síle 30 G. 0,1 ml (4 jednotky) do každého z pěti míst vpichu (viz obrázek č. 1): 2 injekce do každého musculus corrugator a 1 injekce do musculus procerus v celkové dávce 20 jednotek.
Před injekcí je nutné pevně přiložit palec nebo ukazováček pod okraj orbity, aby se pod ní zabránilo extravazaci. Jehla by měla být během injekce orientována superiorně a mediálně. Aby se snížilo riziko ptózy očního víčka, nesmí být překročena dávka 4 jednotky do jednoho místa vpichu a rovněž nesmí být překročen počet míst vpichu. Navíc se musíte vyhnout injekci v blízkosti levator palpebrae superioris, zvláště u pacientů s většími komplexy obočí a depresoru (depressor supercilii). Injekce do musculus corrugator se musí provádět v centrální části tohoto svalu, ve vzdálenosti nejméně 1 cm nad obloukem obočí.
Obrázek č. 1:

Zlepšení závažnosti glabelárních vrásek, které jsou patrné při maximálním zamračení, obecně nastává do jednoho týdne po léčbě. Účinek se prokázal až do 4 měsíců od injekce.
Návod k aplikaci injekcí k léčbě vějířkovitých vrásek, které jsou patrné při širokém úsměvu:
Rekonstituovaný VISTABEL (50 jednotek/1,25 ml) je injekčně podáván sterilní jehlou o síle 30 G. 0,1 ml (4 jednotky) do každého ze 3 míst vpichu na každé straně (celkem 6 míst vpichu) do laterálního musculus orbicularis oculi v celkové dávce 24 jednotek s celkovým objemem 0,6 ml (12 jednotek na každou stranu).
Aby se snížilo riziko ptózy očního víčka, nesmí být překročena maximální dávka 4 jednotky do jednoho místa vpichu a rovněž tak nesmí být překročen počet míst vpichu. Navíc injekce má být vedena temporálně k okraji orbity tak, aby byla zajištěna bezpečná vzdálenost od svalů, které jsou odpovědné za elevaci víčka.
Injekce mají být podány s hrotem jehly zkoseným směrem vzhůru a od oka. První injekce (A) má být aplikována přibližně 1,5 až 2,0 cm temporálně od zevního očního koutku a od okraje orbity. Jestliže jsou vějířkovité vrásky nad zevním koutkem a pod ním, aplikujte injekci podle zobrazení na obrázku č. 2. Pokud jsou vějířkovité vrásky především pod zevním koutkem, aplikujte injekci podle zobrazení na obrázku č. 3.
Obrázek č. 2
Obrázek č. 3

Při léčbě glabelárních vrásek, které jsou patrné při maximálním zamračení, a vějířkovitých vrásek, které jsou patrné při širokém úsměvu současně, je dávka pro léčbu vějířkovitých vrásek 24 jednotek a pro léčbu glabelárních vrásek 20 jednotek (viz Návod k aplikaci injekcí k léčbě glabelárních vrásek a obrázek č. 1) v celkové dávce 44 jednotek s celkovým objemem 1,1 ml.
Ke zlepšení výraznosti vějířkovitých vrásek, které jsou patrné při širokém úsměvu, při hodnocení zkoušejícím, došlo během jednoho týdne po léčbě. Léčebný účinek byl prokázán v mediánu 4 měsíců po aplikaci injekce.
Návod k aplikaci injekcí k léčbě vrásek na čele patrných při maximálně zvednutém obočí:
Rekonstituovaný přípravek VISTABEL (50 jednotek/1,25 ml) se aplikuje v injekci pomocí sterilní jehly 30 G. Do každého z 5 míst podání injekce ve frontálním svalu se podává 0,1 ml (4 jednotky) s celkovou dávkou 20 jednotek v celkovém objemu 0,5 ml (viz obrázek 4).
Celková dávka na léčbu vrásek na čele (20 jednotek) ve spojení s glabelárními vráskami (20 jednotek) je 40 jednotek/1,0 ml.
K určení místa vhodného k aplikaci injekce do vyhodnoťte celkový vztah mezi velikostí čela pacienta a rozložením aktivity frontálního svalu.
Následné horizontální léčebné řady lokalizujte lehkým pohmatem čela v klidu a při maximálně zvednutém obočí:
- Horní okraj aktivity : přibližně 1 cm nad nejhořejším záhybem čela
- Dolní léčebná řada: uprostřed mezi horním okrajem aktivity frontálního svalu a obočím, nejméně 2 cm nad obočím
- Horní léčebná řada: uprostřed mezi horním okrajem aktivity frontálního svalu a dolní léčebnou řadou
- V dolní léčebné řadě ve střední linii obličeje a 0,5 – 1,5 cm mediálně k palpované temporální spojovací linii (temporální hřeben); opakujte na druhé straně.
-
V případě selhání léčby po první léčebné návštěvě, tj. za jeden měsíc po injekci nedojde k významnému zlepšení vůči výchozímu stavu, je možné zvážit následující přístupy:
- Analýza příčin selhání, např. injekce do nesprávného svalu, nesprávná injekční technika, tvorba protilátek neutralizujících toxin, nedostatečná dávka;
- Přehodnocení významnosti léčby botulotoxinem typu A;
-
V případě nedostatečné dávky u léčby glabelárních vrásek, které jsou patrné při maximálním zamračení, zahajte druhý léčebný zákrok úpravou celkové dávky až na 40 či 50 jednotek, přičemž vezměte v úvahu analýzu selhání předchozí léčby.
-
– u osob se známou hypersenzitivitou na botulotoxin typ A nebo na kteroukoliv pomocnou látku uvedenou v bodě 6.1;
-
– v případě myastenia gravis nebo Eatonova – Lambertova syndromu
– v přítomnosti infekce v navrhovaných místech injekce.
4.4 Zvláštní upozornění a opatření pro použití
Konkrétní opatření je zapotřebí přijmout pro přípravu a podání přípravku společně s inaktivací a likvidací zbývajícího nepoužitého roztoku (viz bod 4.2 a 6.6).
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) v jedné dávce, to je v podstatě “bez obsahu sodíku“.
Před podáním přípravku VISTABEL je nutné znát všechny důležité anatomické vztahy a změny způsobené dřívějšími operačními výkony a je nutné se vyhnout aplikaci do zranitelných anatomických struktur.
Nesmí se překračovat doporučené dávkování ani zkracovat intervaly mezi aplikacemi přípravku VISTABEL.
Velmi vzácně se po podání injekce botulotoxinu může vyskytnout anafylaktická reakce. Proto by měl být připraven epinefrin (adrenalin) a další prostředky pro zvládnutí anafylaktického šoku.
Pacienti s nerozpoznaným neuromuskulárním onemocněním mohou být ohroženi zvýšeným rizikem klinicky význmných systémových účinků včetně závažné dysfagie a respiračního selhání a to při obvyklých dávkách botulotoxinu typu A. V někrerých z těchto případů dysfagie trvala několik měsíců a vyžadovala umístění žaludeční sondy (viz bod 4.3).
Zvýšené opatrnosti při použití přípravku VISTABEL je rovněž zapotřebí při léčbě pacientů s amyotrofickou laterální sklerózou nebo s periferními neuromuskulárními poruchami.
Velmi vzácně byly u botulotoxinu hlášeny nežádoucí účinky pravděpodobně spojené s rozšířením toxinu daleko od místa podání (viz bod 4.8). U pacientů léčených terapeutickými dávkami se může projevit nadměrná svalová slabost. Polykací a dechové obtíže jsou závažné a mohou vést k úmrtí. Injekce přípravku VISTABEL se nedoporučuje u pacientů s dysfagií a aspirací v anamnéze.
Pacienti nebo ošetřovatelé by měli být upozorněni, aby vyhledali okamžitě lékařskou pomoc, pokud vzniknou poruchy polykání, řeči nebo dýchání.
Příliš časté nebo vysoké dávky mohou zvýšit riziko tvorby protilátek. Tvorba protilátek může vést k selhání léčby botulotoxinu typu A i při jiných indikacích.
Jak lze očekávat u jakéhokoliv injekčního výkonu, může být injekce spojena s bolestí v místě vpichu, zánětem, parestézií, hypoestézií, citlivostí, otokem/edémem, erytémem, lokalizovanou infekcí, krvácením a/nebo podlitinami. Bolest a/nebo strach z injekce mohou vyvolat vasovagální odpovědi včetně přechodné symptomatické hypotenze a synkopy.
Opatrnost při použití přípravku VISTABEL je nutná, pokud je v místě plánované injekce zánět nebo je v cílovém svalu přítomna výrazná slabost nebo atrofie.
Je třeba zajistit, aby VISTABEL nebyl aplikován do krevního řečiště a to jak v případě aplikace do glabelárních vrásek, které jsou patrné při maximálním zamračení, při aplikaci do havraních stop, které jsou patrné při širokém úsměvu, nebo vrásek na čele patrných při maximálně zvednutém obočí, viz bod 4.2.
Po léčbě může hrozit riziko ptózy očního víčka, viz bod 4.2 ohledně návodu k aplikaci injekcí a minimalizace tohoto rizika.
Použití přípravku VISTABEL se nedoporučuje u osob mladších 18 let. U pacientů starších 65 let jsou pro přípravek Vistabel k dispozici omezené údaje z klinických studií fáze 3.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Účinek botulotoxinu může být teoreticky potencován aminoglykosidovými antibiotiky, spectinomycinem nebo jinými přípravky, které interferují s neuromuskulárním přenosem (např. neuromuskulární blokátory).
Vzájemný účinek různých botulotoxinových serotypů podaných ve stejnou dobu nebo během několika měsíců není známý. Nadměrná neuromuskulární slabost může být exacerbována při podání jiného botulotoxinu a to v době, kdy ještě nebyl rozpoznán účinek botulotoxinu podaného dříve.
Nebyly provedeny žádné specifické testy, které by doložily možnost klinických interakcí s jinými přípravky. U této indikace nebyly hlášeny žádné další klinicky významné interakce.
4.6 Fertilita, těhotenství a kojení
Těhotenství
Adekvátní údaje o podávání botulotoxinu typu A těhotným ženám nejsou k dispozici. Studie se zvířaty prokázaly reprodukční toxicitu (viz bod 5.3). Potenciální riziko pro člověka není známé.
VISTABEL se nedoporučuje podávat v těhotenství a u žen ve fertilním věku, které nepoužívají antikoncepci.
Kojení
Není známo, zda se VISTABEL vylučuje do lidského mateřského mléka. Během kojení se nedoporučuje VISTABEL používat.
Fertilita
Nejsou k dispozici odpovídající údaje o účincích používání botulotoxinu typu A na plodnost žen ve fertilním věku. Studie na potkaních samcích a samicích prokázaly snížení plodnosti (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Nebyly provedeny žádné studie týkající se účinku na schopnost řídit a používat stroje.
Nicméně, VISTABEL může způsobovat astenii, svalovou slabost, závratě a poruchy vidění, které mohou mít vliv na řízení a obsluhování strojů.
4.8 Nežádoucí účinky
a)
-
V kontrolovaných klinických studiích glabelárních vrásek, které jsou patrné při maximálním zamračení, byly nežádoucí účinky po léčbě přípravkem VISTABEL hlášeny u 23,5 % pacientů (placebo: 19,2 %). V léčebném cyklu 1 z pivotních kontrolovaných klinických studií vějířkovitých vrásek, které jsou patrné při širokém úsměvu (tzv. havraních stop), byly takové příhody hlášeny u 7,6 % (24 jednotek k léčbě pouze vějířkovitých vrásek) a 6,2 % (44 jednotek: 24 jednotek k léčbě vějířkovitých vrásek podávaných současně s 20 jednotkami k léčbě glabelárních vrásek) pacientů v porovnání s 4,5 % u placeba.
-
V léčebném cyklu 1 z klinických studií u vrásek na čele patrných při maximálně zvednutém obočí byly nežádoucí příhody považované zkoušejícím lékařem za související s přípravkem VISTABEL hlášeny u 20,6 % pacientů léčených dávkou 40 jednotek (20 jednotek do frontálního svalu
s 20 jednotkami do glabelárního komplexu) a u 14,3 % pacientů léčených pomocí 64 jednotek (20 jednotek do frontálního svalu s 20 jednotkami do glabelárního komplexu a 24 jednotkami do oblastí vějířkovitých vrásek) v porovnání s 8,9 % u pacientů, kteří dostali placebo.
Nežádoucí účinky mohou souviset s léčbou, injekční technikou nebo s obojím. Obecně se nežádoucí účinky objevují během několika prvních dní po injekci a jsou přechodné. Většina nežádoucích hlášených příhod má mírnou až střední závažnost.
Očekávané farmakologické působení botulotoxinu se projevuje lokální svalovou slabostí. Nicméně, byla hlášena slabost přilehlých svalů a/nebo svalů vzdálených od místa vpichu injekce.
Blefaroptóza, která může souviset s injekční technikou, je ve shodě s farmakologickým působením VISTABELU. Jak lze očekávat u jakéhokoliv injekčního výkonu, lze pozorovat v souvislosti s injekcí bolest/pálení/štípání, edém a/nebo modřiny. Po injekci botulotoxinu byly hlášena také horečka a chřipkový syndrom.
b)
Nežádoucí účinky jsou klasifikovány podle třídy orgánových systémů a podle frekvence výskytu do následujících kategorií:
Velmi časté (> 1/10); Časté (> 1/100, < 1/10); Méně časté (> 1/1 000, < 1/100); Vzácné (> 1/10 000, < 1/1 000); Velmi vzácné (< 1/10 000).
Glabelární vrásky
Následující nežádoucí účinky byly hlášeny ve dvojitě zaslepených, placebem kontrolovaných klinických studiích po injekci přípravku VISTABEL 20 jednotek u glabelárních vrásek samotných:
| Třídy orgánových systémů | Preferovaná terminologie | Frekvence |
| Infekce a infestace | Infekce | Méně časté |
| Psychiatrické poruchy | Úzkost | Méně časté |
| Poruchy nervového systému | Bolest hlavy, parestézie | Časté |
| Závratě | Méně časté | |
| Poruchy oka | Ptóza očního víčka | Časté |
| Blefaritida, bolest oka, poruchy vidění (včetně rozmazaného vidění) | Méně časté | |
| Gastrointestinální poruchy | Nauzea | Časté |
| Sucho v ústech | Méně časté | |
| Poruchy kůže a podkožní tkáně | Erytém, napětí kůže | Časté |
| Otoky (obličeje, očního víčka, periorbitální otoky), fotosenzitivita, svědění, suchá kůže | Méně časté | |
| Poruchy svalové a kosterní soustavy a pojivové tkáně | Lokalizovaná svalová slabost | Časté |
| Záškuby svalů | Méně časté | |
| Celkové poruchy a reakce v místě aplikace | Bolest v obličeji, otok v místě injekce, ekchymóza, bolest v místě injekce, podráždění v místě injekce | Časté |
| Chřipkové příznaky, astenie, horečka | Méně časté |
Vějířkovité vrásky s nebo bez glabelárních vrásek
Následující nežádoucí účinky byly hlášeny ve dvojitě zaslepených, placebem kontrolovaných klinických studiích po injekci přípravku VISTABEL u léčby vějířkovitých vrásek současně s glabelárními vráskami nebo vějířkovitých vrásek samotných:
| Třídy orgánových systémů | Preferovaná terminologie | Frekvence |
| Poruchy oka | Edém očního víčka | Méně časté |
| Celkové poruchy a reakce v místě aplikace | Krevní výron v místě injekce* | Časté |
| Krvácení v místě injekce* | Méně časté | |
| Bolest v místě injekce* | Méně časté | |
| Parestézie v místě injekce | Méně časté |
nežádoucí účinky související se zákrokem
Vrásky na čele a glabelární vrásky s nebo bez vějířkovitých vrásek
Následující nežádoucí účinky byly hlášeny ve dvojitě zaslepených, placebem kontrolovaných klinických studiích po injekci přípravku VISTABEL u současné léčby vrásek na čele a glabelárních vrásek s nebo bez vějířkovitých vrásek:
| Třída orgánového systému | Preferovaný termín | Frekvence |
| Poruchy nervového systému | Bolest hlavy | Časté |
| Poruchy oka | Ptóza očního víčka1 | Časté |
| Poruchy kůže a podkožní tkáně | Napětí kůže | Časté |
| Ptóza obočí2 | Méně časté | |
| Celkové poruchy a reakce v místě aplikace | Podlitina v místě injekce | Časté |
| Krevní výron v místě injekce* | Časté | |
| Bolest v místě injekce* | Méně časté |
1Medián doby do nástupu ptózy víčka byl 9 dnů po léčbě 2Medián doby do nástupu ptózy obočí byl 5 dnů po léčbě *nežádoucí účinky související se zákrokem
Nebyly pozorovány žádné změny týkající v celkovém bezpečnostním profilu po opakovaném podání.
c)
Po uvedení přípravku na trh pro léčbu glabelárních vrásek, vějířkovitých vrásek a v jiných klinických indikacích byly hlášeny následující nežádoucí reakce nebo lékařsky relevantní nežádoucí účinky:
| Třída orgánových systémů | Preferovaná terminologie |
| Poruchy imunitního systému | Anafylaxe, angioedém, sérová nemoc, kopřivka |
| Poruchy metabolismu a výživy | Anorexie |
| Poruchy nervového systému | Brachiální plexopatie, dysfonie, dysartrie, paréza lícního nervu, hypestezie, svalová slabost, myastenia gravis, periferní neuropatie, parestezie, radikulopatie, synkopa, faciální paréza |
| Poruchy oka | Glaukom s uzavřeným úhlem (při léčbě blefarospasmu), ptóza očního víčka, lagoftalmus, strabismus, rozmazané vidění, poruchy zraku, suché oči |
| Poruchy ucha a labyrintu | Hypoakuze, tinnitus, závratě |
| Respirační, hrudní a mediastinální poruchy | Aspirační pneumonie, dušnost, bronchospasmus, respirační deprese a respirační selhání |
| Gastrointestinální poruchy | Bolest břicha, průjem, sucho v ústech, dysfagie, nauzea, zvracení |
| Poruchy kůže a podkožní tkáně | Alopecie, ptóza obočí, psoriatiformní dermatitida, multiformní erytém, hyperhidróza, madaróza, svědění, vyrážka |
| Poruchy svalové a kosterní soustavy a pojivové tkáně | Svalová atrofie, myalgie, lokalizované svalové fascikulace / mimovolní svalové kontrakce |
| Celkové poruchy a reakce v místě aplikace | Denervační atrofie, malátnost, horečka |
Velmi vzácně byly u botulotoxinu hlášeny nežádoucí účinky pravděpodobně spojené s rozšířením toxinu daleko od místa podání (například svalová slabost, dysfagie, zácpa nebo aspirační pneumonie, která může být smrtelná) (viz bod 4.4).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky:
4.9 Předávkování
Předávkování přípravkem VISTABEL je relativní pojem a závisí na dávce, oblasti vpichu a vlastnostech podkožní tkáně. Nebyly pozorovány žádné případy systémové toxicity vyplývající z náhodné injekce botulotoxinu typu A. Zvýšené dávky mohou způsobit lokální nebo vzdálenou celkovou a silnou neuromuskulární paralýzu. Nebyl hlášen žádný případy požití botulotoxinu typu A.
Bezprostředně po injekci nejsou patrny známky předávkování. Pokud dojde k náhodné injekci nebo požití přípravku, je nutné u pacienta několik dní sledovat známky a příznaky systémové slabosti nebo svalové paralýzy. Hospitalizace je nutná u pacientů s příznaky otravy botulotoxinem typu A (generalizovaná slabost, ptóza, diplopie, poruchy řeči a polykání nebo parézy respiračních svalů).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Myorelaxans, periferně účinná látka
ATC kód: M03A X01.
Botulotoxin typu A (neurotoxin Clostridium botulinum) blokuje periferní uvolňování acetylcholinu na presynaptických zakončeních cholinergních nervů štěpením SNAP-25, proteinu nezbytného k úspěšnému spojení a uvolnění acetylcholinu z vesikul v nervových zakončeních, což vede k denervaci svalu a tím k paralýze.
Po injekci se toxin rychle a s vysokou afinitou váže na specifické receptory buněčného povrchu. Potom následuje přenos toxinu přes plasmatickou membránu receptory zprostředkovanou endocytózou. Nakonec se toxin uvolňuje do cytosolu. Tento pozdější proces je provázen postupnou inhibicí uvolňování acetylcholinu, klinické příznaky se projevují během 2–3 dnů, s maximálním účinkem patrným 5–6 týdnů po injekci.
Zotavení po intramuskulární injekci nastává obvykle během 12 týdnů, když nervové zakončení vyroste a znovu se spojí s koncovou ploténkou.
Glabelární vrásky
Do klinických studií bylo zařazeno 537 pacientů se středně až silně závažnými glabelárními vráskami, které jsou patrné při maximálním zamračení.
Injekce přípravku VISTABEL významně snížily závažnost glabelárních vrásek, které jsou patrné při maximálním zamračení až na 4 měsíce podle měření zkoušejícího, které spočívalo v hodnocení glabelární vrásky při maximálním zamračení a podle globálního hodnocení změny vzhledu jeho/jejích glabelárních vrásek, které jsou patrné při maximálním zamračení, subjektem studie. Žádný z klinických koncových bodů nezahrnoval objektivní hodnocení psychologického dopadu. Třicet dnů po injekci považovali zkoušející 80 % (325/405) pacientů léčených VISTABELEM za respondenty na léčbu (žádná nebo mírná závažnost při maximálním svraštění) v porovnání se 3 % (4/132) pacientů léčených placebem. V témže časovém bodě mělo 89 % (362/405) pacientů léčených VISTABELEM pocit, že mají střední či větší zlepšení v porovnání se 7 % (9/132) pacientů léčených placebem.
Injekce VISTABELU rovněž významně snížily závažnost glabelárních vrásek v klidu. Z 537 zařazených pacientů mělo 39 % (210/537) středně až silně závažné glaberální vrásky v klidu (15 % nemělo v klidu žádné vrásky). Z nich bylo za třicet dnů po injekci 74 % (119/161) pacientů léčených VISTABELEM považováno za respondenty na léčbu (žádná nebo mírná závažnost) v porovnání se 20 % (10/49) pacientů léčených placebem.
Klinické údaje z fáze 3 pro VISTABEL jsou u pacientů starších 65 let omezené. Pouze 6,0 % (32/537) subjektů bylo starších 65 let a účinnost získaných výsledků byla u této populace nižší.
Vějířkovité vrásky
Do studií bylo zařazeno 1362 pacientů buď pouze se středně výraznými až výraznými vějířkovitými vráskami patrnými při širokém úsměvu (N = 445, studie 191622–098) nebo spolu se středně výraznými až výraznými glabelárními vráskami patrnými při maximálním zamračení (N = 917, studie 191622–099).
Injekce přípravku VISTABEL výrazně snížily závažnost vějířkovitých vrásek, patrných při širokém úsměvu, v porovnání s placebem ve všech časových okamžicích (p < 0,001) až po dobu 5 měsíců. Měření vycházelo z podílu pacientů dosahujících stupně závažnosti vějířkovitých vrásek hodnocených jako žádné nebo mírně výrazné vrásky patrné při širokém úsměvu v obou pivotních studiích, a to do 150. dne (konec studie) ve studii 191622–098 a do 120. dne (konec prvního léčebného cyklu) ve studii 191622–099). U obou hodnocení, jak hodnocení zkoušejícím tak hodnocení samotným subjektem, byl podíl subjektů dosahujících stupně závažnosti vějířkovitých vrásek patrných při širokém úsměvu, hodnocené jako žádné nebo mírně výrazné vrásky, vyšší u pacientů se středně výraznými vějířkovitými vráskami, které jsou patrné při širokém úsměvu při výchozím stavu v porovnání s pacienty se závažně výraznými vějířkovitými vráskami, které jsou patrné při širokém úsměvu při výchozím stavu. V tabulce č. 1 jsou shrnuty výsledky ve 30. dni, tj. časovém okamžiku primárního cílového parametru účinnosti.
Do studie 191622–104 (navázání na studii 191622–099) bylo zařazeno 101 pacientů dříve randomizováných do skupiny s placebem, během které obdrželi první léčbu v dávce 44 jednotek. Pacienti léčení přípravkem VISTABEL měli statisticky významný přínos z léčby při primárním cílovém parametru účinnosti v porovnání s placebem ve 30. dni po první aktivní léčbě. Míra léčebné odpovědi byla podobná míře odpovědi u skupiny s dávkou 44 jednotek ve 30. dni po první aktivní léčbě ve studii 191622–099. Celkem 123 pacientů obdrželo čtyři cykly přípravku VISTABEL v dávce 44 jednotek k léčbě vějířkovitých a glabelárních vrásek.
Tabulka č. 1.: 30. Den; Hodnocení vějířkovitých vrásek při širokém úsměvu podle zkoušejícího a samotného pacienta – míra respondentů (% pacientů dosahujících stupně závažnosti vějířkovitých vrásek hodnocených jako žádné nebo mírné vrásky)
| Klinická studie | Dávka | VISTABEL | Placebo | VISTABEL | Placebo |
| Hodnocení zkoušejícím | Hodnocení samotným pacientem | ||||
| 191622–098 | 24 jednotek (vějířkovité vrásky) | 66,7 %* (148/222) | 6,7 % (15/223) | 58,1 %* (129/222) | 5,4 % (12/223) |
| 191622–099 | 24 jednotek (vějířkovité vrásky) | 54,9 %* (168/306) | 3,3 % (10/306) | 45,8 %* (140/306) | 3,3 % (10/306) |
| 44 jednotek (24 jednotek vějířkovité vrásky; 20 jednotek glabelární vrásky) | 59,0 %* (180/305) | 3,3 % (10/306) | 48,5 %* (148/305) | 3,3 % (10/306) | |
| *p < 0,001 (VI | STABEL oproti placebu) | ||||
Zlepšení vzhledu vějířkovitých vrásek, patrných při širokém úsměvu, oproti výchozímu stavu hodnocené samotným subjektem bylo pozorováno u přípravku VISTABEL (24 jednotek a 44 jednotek) v porovnání s placebem ve 30. dni a ve všech časových okamžicích v každém léčebném cyklu u obou pivotních studií (p < 0,001).
Léčba přípravkem VISTABEL v dávce 24 jednotek rovněž významně snížila závažnost vějířkovitých vrásek v klidu. Z 528 léčených pacientů mělo 63 % (330/528) středně výrazné až výrazné vějířkovité vrásky v klidu při výchozím stavu. Z toho bylo 58 % (192/330) pacientů léčených přípravkem VISTABEL považováno za respondenty na léčbu (žádné nebo mírné vrásky) 30 dní po aplikaci injekce v porovnání s 11 % (39/352) pacientů léčených placebem.
U přípravku VISTABEL (24 jednotek a 44 jednotek) bylo také pozorováno zlepšení ohledně věku a atraktivity hodnocené samotným subjektem v porovnání s placebem za použití dotazníku o výsledcích obličejových vrásek (Facial Line Outcomes, FLO-11) při primárním cílovém parametru ve 30. dni (p < 0,001) a ve všech následujících časových okamžicích u obou pivotních studií.
V pivotních studiích bylo 3,9 % (53/1362) pacientů starších 65 let. Pacienti v této věkové skupině vykazovali 36% odpověď (ve 30. dni) na léčbu přípravkem VISTABEL (24 jednotek a 44 jednotek), hodnocenou zkoušejícím. Při analýze podle věkových skupin < 50 let a > 50 let vykázaly obě populace statisticky významné zlepšení v porovnání s placebem. Odpověď na léčbu přípravkem VISTABEL v dávce 24 jednotek, hodnocená zkoušejícím, byla nižší u skupiny subjektů ve věku > 50 let než u subjektů ve věku < 50 let (42,0% a 71,2%, v uvedeném pořadí).
Celková odpověď na léčbu vějířkovitých vrásek přípravkem VISTABEL, patrných při širokém úsměvu je nižší (60%) než bylo pozorováno u léčby glabelárních vrásek, patrných při maximálním zamračení (80%).
U 916 pacientů (517 pacientů s dávkou 24 jednotek a 399 pacientů s dávkou 44 jednotek) léčených přípravkem VISTABEL byl proveden rozbor vzorků ke stanovení tvorby protilátek proti hodnocenému léčivu. U žádného pacienta nedošlo k vytvoření neutralizujících protilátek.
Vrásky na čele
822 pacientů se středně závažnými až závažnými vráskami na čele a glabelárními vráskami patrnými při maximální kontrakci buď samotnými (N=254, studie 191622–142), nebo také se středně výraznými až výraznými vějířkovitými vráskami patrnými při širokém úsměvu (N=568, studie 191622–143) bylo také zařazeno do primární populace k analýze všech primárních a sekundárních cílových ukazatelů účinnosti. V klinických studiích byly vrásky na čele léčeny ve spojení s glabelárními vráskami..
Jak při posouzení zkoušejícím lékařem, tak pacientem, byl podíl pacientů, kteří dosáhli žádných nebo mírných vrásek na čele patrných při maximálně zvednutém obočí po injekcích přípravku VISTABEL, větší než podíl pacientů ošetřených placebem v den 30, časovém bodě primárního cílového ukazatele účinnosti (tabulka 2). Jsou také uvedeny podíly pacientů, kteří dosáhli minimálního zlepšení o 1 stupeň v závažnosti vrásek na čele od výchozího stavu v klidu a nedosáhli žádné nebo mírné závažnosti vrásek na obličeji při maximální kontrakci.
Tabulka 2: Den 30: Hodnocení vrásek na čele a vrásek v horní části obličeje při maximální kontrakci a v klidu provedené zkoušejícím lékařem a pacientem
| Klinická studie | Cílový ukazatel | VISTABEL | Placebo | VISTABEL | Placebo |
| Hodnocení z | koušejícím | Hodnocení pacientem | |||
| lékařem | |||||
| Studie 191622–142 | Vrásky na čele při | 94,8 % | 1,7% | 87,6% | 0,0% |
| 40 jednotek | maximální | (184/194) | (1/60) | (170/194) | (0/60) |
| (20 jednotek vrásky | kontrakci3 | p<0,0005 | p<0,0005 | ||
| na čele + | Vrásky na čele v | 86,2% | 22,4% | 89,7 % | 10,2% |
| 20 jednotek | klidub | (162/188) | (13/58) | (174/194) | (6/59) |
| glabelární vrásky) | p<0,0001 | p<0,0001 | |||
| Studie 191622–143 | Vrásky na čele při | 90,5% | 2,7% | 81,5% | 3,6% |
| 40 jednotek | maximální | (201/222) | (3/111) | (181/222) | (4/111) |
| (20 jednotek vrásky | kontrakcia | p<0,0005 | p<0,0005 | ||
| na čele + | Vrásky na čele v | 84,1% | 15,9% | 83,6% | 17,4% |
| 20 jednotek | klidub | (185/220) | (17/107) | (184/220) | (19/109) |
| glabelární vrásky) | p<0,0001 | p<0,0001 | |||
| Studie 191622–143 | Vrásky na čele při | 93,6% | 2,7% | 88,9% | 3,6% |
| 64 jednotek | maximální | (220/235) | (3/111) | (209/235) | (4/111) |
| (20 jednotek vrásky | kontrakcia | p<0,0005 | p<0,0005 | ||
| na čele + | Vrásky v horní | 56,6% | 0,9% | ||
| 20 jednotek | části obličeje při | (133/235) | (1/111) | Není použitelné | |
| glabelární vrásky + | maximální | p < 0,0001 | |||
| 24 jednotek | kontrakcic | ||||
| vějířkovité vrásky) | |||||
a Podíl pacientů, kteří dosáhnou žádné nebo mírné závažnosti vrásek na čele při maximálně zvednutém obočí
b Podíl pacientů s minimálním zlepšením o 1 stupeň od výchozího stavu u závažnosti vrásek na čele
v klidu
c Podíl respondérů je definovaný jako stejný pacient, který dosáhne žádných nebo mírných vrásek na čele, glabelárních vrásek a vějířkovitých vrásek v každé oblasti obličeje při maximální kontrakci
Injekce přípravku VISTABEL významně snížily závažnost vrásek na obličeji patrných při maximálně zvednutém obočí v porovnání s placebem po dobu až 6 měsíců (p < 0,05): to bylo měřeno podle podílu pacientů, kteří dosáhli hodnocení závažnosti vrásek na obličeji žádné nebo mírné při maximální elevaci obočí v obou pivotních studiích; do dne 150 ve studii 191622–142 (21,6 % pacientů léčených přípravkem VISTABEL v porovnání s 0 % pacientů ošetřených placebem) a do dne 180 ve studii 191622–143 (6,8 % pacientů léčených přípravkem VISTABEL v porovnání s 0 % pacientů ošetřených placebem).
Když byly všechny 3 oblasti léčeny současně ve studii 191622–143 (VISTABEL, skupina
64 jednotek), snížily injekce přípravku VISTABEL významně závažnost glabelárních vrásek až po dobu 6 měsíců (5,5 % pacientů léčených přípravkem VISTABEL v porovnání s 0 % pacientů ošetřeních placebem) a vrásek na čele až po dobu 6 měsíců (9,4 % pacientů léčených přípravkem VISTABEL v porovnání s 0 % pacientů ošetřených placebem).
Celkem 116 a 150 pacientů dostalo během 1 roku 3 cykly léčby přípravkem VISTABEL 40 jednotek (20 jednotek u vrásek na čele s 20 jednotkami u glabeláríních vrásek) a 64 jednotek (20 jednotek u vrásek na čele, 20 jednotek u glabelárních vrásek a 24 jednotek u vějířkovitých vrásek), v uvedeném pořadí. Četnost odpovědí u zlepšení vrásek na čele byla podobná napříč všemi léčebnými cykly.
Pomocí dotazníku FLO-11 bylo pozorováno zlepšení u pocitů obtěžování vráskami na čele, pocitů, že vypadají starší než skutečně jsou, a přitažlivosti udávané pacientem u významně (p < 0,001) vyššího podílu pacientů léčených přípravkem VISTABEL 40 jednotek (20 jednotek u vrásek na čele s 20 jednotkami u glabelárních vrásek) a 64 jednotek (20 jednotek u vrásek na čele, 20 jednotek u glabelárních vrásek a 24 jednotek u vějířkovitých vrásek) v porovnání s placebem v primárním časovém bodě dne 30 ve studiích 191622–142 a 191622–143.
Pomocí dotazníku FLSQ (Facial Lines Satisfaction Questionnaire) udávalo 78,1 % (150/192) pacientů ve studii 191622–142 a 62,7 % (138/220) pacientů ve studii 191622–143 zlepšení dopadů souvisejících se vzhledem a emočních dopadů (definované podle položek týkajících se pocitu vyššího věku, negativního sebevědomí, unaveného vzhledu, pocitu smutku, rozhněvaného vzhledu) při léčbě přípravkem VISTABEL 40 jednotek (20 jednotek u vrásek na čele s 20 jednotkami u glabelárních vrásek) v porovnání s pacienty ošetřenými placebem 19,0 % (11/58) ve studii 191622–142 a 18,9 % (21/111) ve studii 191622–143 v den 30 (p < 0,0001 v obou studiích).
Ve stejném dotazníku udávalo 90,2 % (174/193) pacientů ve studii 191622–142 a 79,2 % (175/221, 40 jednotek) nebo 86,4 % (203/235, 64 jednotek) pacientů ve studii 191622–143, že byli „velmi spokojení“/„většinou spokojeni“ s přípravkem VISTABEL 40 jednotek nebo 64 jednotek v porovnání s pacienty ošetřenými placebem (1,7 % [1/58], 3,6 % [4/110] ve studii 191622–142 a ve studii 191622143, v uvedeném pořadí), v primárním časovém bodě dne 60 s použitím FLSQ (p < 0,0001 v obou studiích).
-
V pivotních studiích bylo 3,7 % (22/587) pacientů starších než 65 let. Pacienti v této věkové skupině měli léčebnou odpověď hodnocenou zkoušejícím lékařem 86,7 % (13/15) (v den 30) u přípravku VISTABEL v porovnání s 28,6 % (2/7) pacientů na placebu. Četnosti odpovědí v této podskupině léčebné přípravkem VISTABEL byly podobné jako u celkové populace, ale ale nebyla dosažena statistická významnost a porovnání oproti placebu je obtížné v důsledku malého počtu pacientů.
5.2 Farmakokinetické vlastnosti
Studie distribuce u potkanů naznačují pomalou difusi botulotoxinu typu A označeného I125 po injekci do m. gastrocnemius, po které následoval rychlý systémový metabolismus a vyloučení močí. Množství radioaktivně značeného materiálu ve svalu se snížilo na polovinu za přibližně 10 hodin. V místě vpichu se radioaktivita vázala na velké molekuly proteinů, zatímco v plazmě se vázala na malé molekuly, což naznačuje rychlý systémový metabolismus substrátu. Během 24 hodin od podání dávky bylo 60 % radioaktivity vyloučeno močí. Toxin se pravděpodobně metabolizuje proteázami a molekulární složky se opětovně využijí v normální metabolické cestě.
Klasické studie absorpce, distribuce, biotransformace a eliminace (ADME) léčivé látky nebyly vzhledem k povaze přípravku prováděny.
Je pravděpodobné, že může nastat malá systémová distribuce terapeutických dávek VISTABELU. Klinické studie používající elektromyografickou techniku s jedním vláknem ukázaly zvýšení elektrofyziologické neuromuskulární aktivity ve svalech vzdálených od místa injekce, která nebyla provázena klinickými příznaky či symptomy.
5.3 Předklinické údaje vztahující se k bezpečnosti
Studie na akutní toxicitu, toxicitu po opakovaném podání, lokální toleranci, mutagenicitu, antigenicitu a krevní kompatibilitu neprokázaly při podávání klinicky relevantních dávek žádné neobvyklé místní nebo celkové nežádoucí účinky.
6.
FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Lidský albumin
Chlorid sodný
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
3 roky.
Po rekonstituci se doporučuje roztok okamžitě použít. Nicméně byla prokázána chemická a fyzikální stabilita po dobu 24 hodin při teplotě 2 °C – 8 °C.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C – 8 °C).
Podmínky uchovávání tohoto léčivého přípravku po jeho rekonstituci jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení
Prášek v injekční lahvičce (sklo typu I) se zátkou (chlorbutylová pryž) a těsněním (hliník);
Injekční lahvička 50 jednotek definovaných dle Allerganu botulotoxinu typu A — balení s jednou nebo balení se dvěma lahvičkami
NA TRHU NEMUSÍ BÝT VŠECHNY VELIKOSTI BALENÍ
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Rekonstituce má být provedena v souladu s pravidly správné praxe, zvlášte pak s ohledem na aseptické podmínky. VISTABEL se musí rekonstituovat sterilním fyziologickým roztokem bez konzervačních látek (0,9% roztok chloridu sodného pro injekci). Podle dále uvedené rekonstituční tabulky se musí do injekční stříkačky natáhnout požadované množství sterilního fyziologického roztoku bez konzervačních látek (0,9% roztoku chloridu sodného pro injekci), aby se získal rekonstituovaný roztok o koncentraci 4 jednotky/0,1 ml;
| Množství rozpouštědla přidaného do injekční lahvičky 50 jednotek (sterilní fyziologický roztok bez konzervačních látek (0,9% roztok chloridu sodného pro injekci)) | Výsledná dávka (jednotek na 0,1 ml) |
| 1,25 ml | 4,0 jednotky |
Střední část pryžové zátky se musí očistit alkoholem.
Aby se zabránilo denaturaci přípravku VISTABEL, je roztok připraven pomalým injekčním vstřikováním rozpouštědla do injekční lahvičky a jemným otáčením injekční lahvičky, aby se zabránilo tvorbě bublin. Injekční lahvička se musí zlikvidovat, pokud vakuum nevytáhne rozpouštědlo do injekční lahvičky. Jakmile dojde k rekonstituci, roztok je nutné před použitím vizuálně prohlédnout. Podán může být pouze čirý, bezbarvý až slabě žlutý roztok bez částic.
Je nutné, aby se VISTABEL používal pouze pro léčbu jednoho jediného pacienta během jediného léčebného zákroku
Bezprostředně po použití a před likvidací se musí inaktivovat nepoužitý rekonstituovaný roztok VISTABEL v injekční lahvičce a/nebo injekční stříkačce 2 ml roztoku chlornanu sodného naředěného na 0,5% nebo 1% a musí se zlikvidovat v souladu s místními požadavky.
Použité injekční lahvičky, injekční stříkačky a materiály by se neměly vyprazdňovat a musí se ukládat do vhodných nádob a likvidovat jako zdravotnický biorizikový materiál v souladu s místními požadavky.
V případě nehody při manipulaci s přípravkem, lyofilizovaným práškem či rekonstituovaným roztokem, se musí neprodleně zahájit příslušná opatření popsaná dále.
- Toxin je velmi citlivý na teplo a určité chemické látky.
- Jakékoliv rozlité množství se musí vytřít: buď absorpčním materiálem napuštěným roztokem chlornanu sodného (roztok Javel) v případě vakuově vysušeného přípravku nebo suchým absorpčním materiálem v případě rekonstituovaného přípravku.
- Kontaminované povrchy se musí vyčistit absorpčním materiálem napuštěným roztokem chlornanu sodného (roztok Javel) a poté osušit.
- Jestliže bude injekční lahvička rozbita, posbírejte kusy skla a vytřete přípravek, jak je shora uvedeno, dejte pozor, abyste se nepořezali.
- Jestliže se rozlije, omyjte roztokem chlornanu sodného, poté důkladně opláchněte velkým množstvím vody.
- Při vniknutí do očí důkladně oči propláchněte velkým množstvím vody nebo roztokem pro výplach
- Jestliže dojde k poranění obsluhy (pořezání, bodnutí), postupujte, jak je uvedeno shora a podnikněte příslušná lékařská opatření podle injekčně podané dávky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
ALLERGAN PHARMACEUTICALS IRELAND
Westport
County Mayo
Irsko
8. REGISTRAČNÍ ČÍSLO(A)
63/688/07-C
Další informace o léčivu VISTABEL
Jak
se VISTABEL
podává: intramuskulární podání - prášek pro injekční roztok
Výdej
léku: na lékařský předpis
Balení: Injekční lahvička
Velikost
balení: 1
Držitel rozhodnutí o registraci daného léku v České republice:
Allergan Pharmaceuticals Ireland, Westport
Telefon: 800 18 88 18
