Souhrnné informace o léku - URIKOSTAD
1. NÁZEV PŘÍPRAVKU
Urikostad 80 mg potahované tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna potahovaná tableta obsahuje febuxostatum 80 mg.
Pomocná látka se známým účinkem
Jedna tableta obsahuje 76,50 mg laktosy (bezvodé).
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Potahovaná tableta.
Světle žluté, kulaté potahované tablety o rozměru 11 × 11 mm s půlicí rýhou na jedné straně.
Půlicí rýha není určena k rozlomení tablety.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Léčba chronické hyperurikémie u stavů, kdy již došlo k vytvoření urátových depozit (včetně anamnézy nebo přítomnosti dnavých tofů a/nebo dnavé artritidy).
Urikostad je indikován u dospělých pacientů.
4.2 Dávkování a způsob podání
Dávkování
Doporučená perorální dávka přípravku Urikostad je 80 mg jednou denně nezávisle na jídle. Pokud je hladina kyseliny močové v séru po 2 až 4 týdnech vyšší než 6 mg/dl (357 mikromolů/l), může být zvážena dávka 120 mg přípravku Urikostad jednou denně.
Urikostad účinkuje dostatečně rychle, aby umožnil opakované testování hladiny kyseliny močové v séru po dvou týdnech. Terapeutickým cílem je snížit a udržet hladinu kyseliny močové v séru pod 6 mg/dl (357 mikromolů/l).
Doporučuje se profylaxe dnavých záchvatů po dobu minimálně 6 měsíců (viz bod 4.4).
Starší pacienti
U starších pacientů není nutná žádná úprava dávkování (viz bod 5.2).
Porucha funkce ledvin
Účinnost a bezpečnost nebyla plně hodnocena u pacientů s těžkou poruchou funkce ledvin (clearance kreatininu <30 ml/min, viz bod 5.2).
U pacientů s mírnou nebo středně těžkou poruchou funkce ledvin není nutná žádná úprava dávkování.
Porucha funkce jater
Účinnost a bezpečnost febuxostatu nebyla hodnocena u pacientů s těžkou poruchou funkce jater (Child-Pugh skóre C).
Doporučené dávkování u pacientů s mírnou poruchou funkce jater je 80 mg. U pacientů se středně těžkou poruchou funkce jater jsou k dispozici omezené informace.
Pediatrická populace
Bezpečnost a účinnost febuxostatu u dětí mladších 18 let nebyla stanovena. Nejsou dostupná žádná data.
Způsob podání
Perorální podání. Urikostad se užívá ústy a lze ho užívat s jídlem nebo bez jídla.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1 (viz také bod 4.8).
4.4 Zvláštní upozornění a opatření pro použití
Kardiovaskulární poruchy
Léčba febuxostatem se u pacientů s ischemickou chorobou srdeční nebo městnavým srdečním selháním nedoporučuje.
Ve studiích APEX a FACT byl v celkové skupině febuxostatu pozorován početně vyšší výskyt kardiovaskulárních příhod APTC hlášených zkoušejícím (definované cílové parametry dle Anti-Platelet Trialists‘ Collaboration (APTC) zahrnující kardiovaskulární úmrtí, nefatální infarkt myokardu, nefatální cévní mozkovou příhodu) než ve skupině alopurinolu (1,3 oproti 0,3 příhod na 100 pacientoroků). Ve studii CONFIRMS tomu však tak nebylo (podrobné údaje o studii viz bod 5.1). Incidence kardiovaskulárních příhod APTC hlášených zkoušejícím v kombinovaných studiích fáze 3 (studie APEX, FACT a CONFIRMS) byla 0,7 oproti 0,6 příhod na 100 pacientoroků. V dlouhodobých prodloužených studiích byl výskyt kardiovaskulárních příhod APTC hlášených zkoušejícím 1,2 příhod pro febuxostat a 0,6 příhod pro alopurinol na 100 pacientoroků. Nebyly nalezeny žádné statisticky významné rozdíly a žádná příčinná souvislost s febuxostatem nebyla stanovena. Mezi identifikované rizikové faktory mezi těmito pacienty patřily anamnéza aterosklerózy a/nebo infarkt myokardu nebo městnavé srdeční selhání.
Léková alergie/hypersenzitivita
Po uvedení přípravku na trh byla shromážděna hlášení vzácně se vyskytujících alergických/ hypersenzitivních reakcí včetně život ohrožujícího Stevensova-Johnsonova syndromu, toxické epidermální nekrolýzy a akutních anafylaktických reakcí/šoku. Tyto reakce nastaly ve většině případů během prvního měsíce léčby febuxostatem. Někteří, ale ne všichni pacienti, hlásili i poškození ledvin a/nebo předchozí přecitlivělost na alopurinol. V některých případech byly závažné hypersenzitivní reakce, včetně polékových reakcí s eozinofilií a systémovými příznaky (DRESS) spojeny s horečkou, hematologickou, ledvinovou nebo jaterní účastí.
Pacienti mají být upozorněni na známky a příznaky alergických/hypersenzitivních reakcí, a pro tyto příznaky pečlivě sledováni (viz bod 4.8). Pokud se objeví závažné alergické/hypersenzitivní reakce, včetně Stevensova-Johnsonova syndromu, měla by být léčba febuxostatem ihned ukončena, jelikož brzké ukončení léčby je spojováno s lepší prognózou. Pokud se u pacienta objeví alergické/hypersenzitivní reakce včetně Stevensova-Johnsonova syndromu a akutní anafylaktické reakce/šok, léčba febuxostatem nesmí být u tohoto pacienta nikdy obnovena.
Akutní záchvaty dny (dnavý záchvat)
Léčba febuxostatem nemá být zahájena, dokud akutní záchvat dny úplně neodezněl. Během zahájení léčby se mohou objevit záchvaty dny v důsledku změny hladin kyseliny močové v séru, která je způsobena mobilizací kyseliny močové z tkáňových depozit (viz bod 4.8 a 5.1). Při zahájení léčby febuxostatem je doporučena profylaxe záchvatů dny nesteroidními antiflogistiky nebo kolchicinem pod dobu minimálně šesti měsíců (viz bod 4.2).
Pokud se objeví záchvat dny během léčby febuxostatem, léčba nemá být přerušena. Záchvat dny má být léčen současně v závislosti na individuálním stavu pacienta. Kontinuální léčba febuxostatem snižuje frekvenci a intenzitu záchvatů dny.
Depozita xanthinu
U pacientů, u kterých je výrazně zvýšená rychlost tvorby urátů (např. maligní onemocnění a jeho léčba, Lesch-Nyhanův syndrom), by se mohla absolutní koncentrace xanthinu v moči ve vzácných případech dostatečně zvýšit, aby umožnila jeho ukládání v močovém traktu. Protože u těchto pacientů není žádná zkušenost s febuxostatem, není zde jeho použití doporučeno.
Merkaptopurin/azathioprin
Užívání febuxostatu není doporučeno u pacientů, kteří jsou současně léčeni merkaptopurinem / azathioprinem. Pokud se nelze současnému užívání vyhnout, pacienti musí být pečlivě sledováni. Aby se předešlo možným hematologickým účinkům, doporučuje se snížit dávky merkaptopurinu nebo azathioprinu (viz bod 4.5).
Pacienti po orgánové transplantaci
Vzhledem k chybějícím zkušenostem u pacientů po orgánové transplantaci není febuxostat u těchto skupin pacientů doporučen (viz bod 5.1).
Theofylin
U zdravých subjektů neukázalo současné podávání febuxostatu 80 mg a theofylinu 400 mg v jednorázové dávce žádné farmakokinetické interakce (viz bod 4.5). Febuxostat 80 mg se může používat u pacientů, kteří jsou současně léčeni theofylinem bez rizika zvýšení plazmatické hladiny theofylinu. Údaje pro febuxostat 120 mg nejsou k dispozici.
Poruchy jater
Ve fázi 3 kombinovaných klinických studií byly u pacientů léčených febuxostatem pozorovány mírné abnormality funkce jater (5,0 %). Před zahájením léčby febuxostatem a periodicky poté je podle uvážení lékaře doporučeno pravidelné provádění jaterních testů (viz bod 5.1).
Poruchy štítné žlázy
U pacientů léčených dlouhodobě febuxostatem (5,5 %) bylo v dlouhodobých otevřených prodloužených studiích pozorováno zvýšení hladin TSH (> 5,5 |jIU/ml). U pacientů se změnou funkce štítné žlázy je při léčbě febuxostatem doporučována opatrnost (viz bod 5.1).
Laktóza
Urikostad obsahuje laktózu. Pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, úplným nedostatkem laktázy nebo malabsorpcí glukózy a galaktózy nemají tento léčivý přípravek užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Merkaptopurin/azathioprin
Na základě mechanismu účinku febuxostatu na inhibici XO není současné použití doporučeno. Inhibice XO febuxostatem může vyvolat zvýšení plazmatických koncentrací těchto léčiv, což by vedlo k toxicitě (viz bod 4.4). Studie lékových interakcí febuxostatu s jinými léčivy, která jsou metabolizována XO, nebyly provedeny.
Interakční studie u febuxostatu a cytotoxické chemoterapie nebyly provedeny.
Nejsou k dispozici údaje týkající se bezpečnosti febuxostatu během cytotoxické léčby.
Rosiglitazon/CYP2C8 substráty
Febuxostat se ukázal být slabým inhibitorem CYP2C8 in vitro. Ve studii u zdravých subjektů nemělo současné podání denní dávky 120 mg febuxostatu se 4 mg rosiglitazonu v jednorázové perorální dávce žádný vliv na farmakokinetiku rosiglitazonu ani jeho metabolitu N-desmetyl rosiglitazonu, což značí, že febuxostat není inhibitorem enzymu CYP2C8 in vivo. Proto se předpokládá, že současné podávání febuxostatu s rosiglitazonem či jinými CYP2C8 substráty nevyžaduje žádnou úpravu dávkování těchto látek.
Theofylin
U zdravých subjektů byla provedena interakční studie s febuxostatem, která hodnotila, zda může inhibice XO vyvolat zvýšení hladiny theofylinu v oběhu, stejně, jako je hlášeno u jiných inhibitorů XO. Výsledky studie ukázaly, že současné podání denní dávky febuxostatu 80 mg s theofylinem 400 mg v jednorázové dávce nemá žádný vliv na farmakokinetiku ani na bezpečnost theofylinu. Proto není nutná zvláštní opatrnost při současném podání febuxostatu 80 mg a theofylinu. Údaje pro febuxostat 120 mg nejsou k dispozici.
Naproxen a další inhibitory glukuronidace
Metabolismus febuxostatu závisí na uridinglukuronosyltransferázových (UGT) enzymech. Léčivé přípravky, které inhibují glukuronidaci, jako jsou nesteroidní antiflogistika a probenecid, by mohly teoreticky ovlivnit eliminaci febuxostatu. U zdravých subjektů bylo současné užívání febuxostatu a naproxenu v dávce 250 mg dvakrát denně spojeno se zvýšením expozice febuxostatu (Cmax 28 %, AUC 41 % a t1/2 26 %). V klinických studiích nesouviselo užívání naproxenu nebo dalších nesteroidních antiflogistik/Cox-2 inhibitorů s žádným klinicky významným zvýšením nežádoucích účinků.
Febuxostat může být současně podáván s naproxenem bez nutnosti jakékoli úpravy dávky febuxostatu nebo naproxenu.
Induktory glukuronidace
Silné induktory UGT enzymů mohou vést ke zvýšenému metabolismu a snížené účinnosti febuxostatu. 1 až 2 týdny po zahájení léčby silným induktorem glukuronidace je tudíž doporučeno sledování hladiny kyseliny močové v séru. Naopak ukončení léčby induktorem může vést ke zvýšení plazmatických hladin febuxostatu.
Kolchicin/indometacin/hydrochlorothiazid/warfarin
Febuxostat může být současně podáván s kolchicinem nebo indometacinem bez nutnosti úpravy dávky febuxostatu nebo současně podávané léčivé látky.
Při podávání febuxostatu s hydrochlorothiazidem není nutná žádná úprava dávkování.
Není nutná úprava dávkování současně podávaného warfarinu. U zdravých jedinců nemělo souběžné podávání febuxostatu (80 mg nebo 120 mg jednou denně) s warfarinem žádný vliv na farmakokinetiku warfarinu. Při současném podávání warfarinu s febuxostatem nebyl ovlivněn INR ani aktivita faktoru VII.
Desipramin/CYP2D6 substráty
Bylo prokázáno, že in vitro je febuxostat slabým inhibitorem CYP2D6. Ve studii u zdravých dobrovolníků vyvolalo 120 mg febuxostatu podávaného jednou denně průměrně 22% zvýšení AUC desipraminu, substrátu CYP2D6, což ukazuje na možný slabý inhibiční účinek febuxostatu na enzym CYP2D6 in vivo. Proto se neočekává, že současné podávání febuxostatu s jinými CYP2D6 substráty bude vyžadovat jakoukoli úpravu dávkování těchto látek.
Antacida
Bylo prokázáno, že současné užití antacida obsahujícího hydroxid hořečnatý a hlinitý prodlužuje absorpci febuxostatu (přibližně 1 hodina) a vyvolává 32% snížení Cmax, ale nebyla pozorována žádná významná změna AUC. Febuxostat může být tudíž užíván bez ohledu na užívání antacida.
4.6 Fertilita, těhotenství a kojení
Těhotenství
Údaje u velmi omezeného počtu těhotenství neprokázaly žádné nežádoucí účinky febuxostatu na těhotenství nebo na zdraví plodu/novorozence. Studie na zvířatech neukazují přímé ani nepřímé nežádoucí účinky s ohledem na březost, vývoj embrya/plodu nebo porod (viz bod 5.3). Potenciální riziko pro člověka není známo. Febuxostat nemá být užíván během těhotenství.
Kojení
Není známo, zda se febuxostat vylučuje do mateřského mléka. Studie na zvířatech prokázaly vylučování této léčivé látky do mateřského mléka a poruchu vývoje kojených mláďat. Riziko pro kojené dítě není možné vyloučit. Febuxostat nemá být užíván během kojení.
Fertilita
Reprodukční studie s dávkou až 48 mg/kg/den provedené na zvířatech neukázaly žádné na dávce závislé nežádoucí účinky na fertilitu (viz bod 5.3). Účinek febuxostatu na fertilitu u lidí není znám.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Po užití febuxostatu byly hlášeny somnolence, závratě, parestézie a rozmazané vidění. Pacienti mají být opatrní před řízením vozidel, obsluhou strojů nebo při provádění nebezpečných aktivit, dokud si neověří, že febuxostat neovlivňuje nežádoucím způsobem jejich výkonnost.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Mezi nejčastěji hlášené nežádoucí účinky v klinických studiích (4 072 subjektů léčených nejméně jednou dávkou od 10 mg do 300 mg) a po uvedení přípravku na trh patří dnavé záchvaty, abnormality funkce jater, průjem, nauzea, bolest hlavy, vyrážka a edém. Tyto nežádoucí účinky byly převážně mírné nebo střední intenzity. Po uvedení přípravku na trh se objevily vzácné závažné hypersenzitivní reakce na febuxostat, z nichž některé byly spojovány se systémovými příznaky.
Tabulkový přehled nežádoucích účinků
Časté (>1/100 až <1/10), méně časté (>1/1 000 až <1/100) a vzácné (>1/10 000 až <1/1 000) nežádoucí účinky objevující se u pacientů léčených febuxostatem jsou uvedeny níže.
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Tabulka 1: Nežádoucí účinky související s léčbou v kombinovaných dlouhotrvajících rozšířených klinických studiích fáze 3 a po uvedení přípravku na trh
| Poruchy krve a lymfatického systému | Vzácné Pancytopenie, trombocytopenie |
| Poruchy imunitního systému | Vzácné Anafylaktická reakce*, léková hypersenzitivita* |
| Endokrinní poruchy | Méně časté Zvýšení hladiny TSH v krvi |
| Poruchy oka | Vzácné Rozmazané vidění |
| Poruchy metabolismu a výživy | Časté Dnavé záchvaty Méně časté Diabetes mellitus, hyperlipidemie, snížení chuti k jídlu, zvýšení tělesné hmotnosti Vzácné Snížení tělesné hmotnosti, zvýšení chuti k jídlu, anorexie |
| Psychiatrické poruchy | Méně časté Snížení libida, nespavost Vzácné Nervozita |
| Poruchy nervového systému | Časté Bolest hlavy Méně časté Závratě, parestézie, hemiparéza, somnolence, změny chuti, hypestézie, hyposmie |
| Poruchy ucha a labyrintu | Vzácné Tinitus |
| Srdeční poruchy | Méně časté Síňové fibrilace, palpitace, abnormální EKG |
| Cévní poruchy | Méně časté Hypertenze, návaly, návaly horka |
| Respirační, hrudní a mediastinální poruchy | Méně časté Dušnost, bronchitida, infekce horních cest dýchacích, kašel |
| Gastrointestinální poruchy | Časté Průjem, nauzea Méně časté Bolest břicha, břišní distenze, gastroezofageální refluxní choroba, zvracení, sucho v ústech, dyspepsie, zácpa, časté stolice, nadýmání, gastrointestinální potíže Vzácné Zánět slinivky břišní, ulcerace dutiny ústní |
| Poruchy jater a žlučových cest | Časté Abnormality jaterních testů Méně časté Cholelithiáza Vzácné Hepatitida, žloutenka*, poškození jater* |
| Poruchy kůže a podkožní tkáně | Časté Vyrážka (včetně různých typů vyrážek hlášených s nižší frekvencí, viz níže) Méně časté Dermatitida, kopřivka, pruritus, změna barvy kůže, kožní léze, petechie, makulární vyrážka, makulopapulární vyrážka, papulární vyrážka Vzácné Toxická epidermální nekrolýza*, Stevensův-Johnsonův syndrom*, angioedém*, polékové reakce s eozinofilií a systémovými příznaky*, generalizovaná vyrážka (závažné), erytém, exfoliativní vyrážka, folikulární vyrážka, vezikulární vyrážka, pustulární vyrážka, pruritická vyrážka, erytematózní vyrážka, morbiliformní vyrážka, alopecie, hyperhidróza |
| Poruchy svalové a kosterní soustavy a pojivové tkáně | Méně časté Artralgie, artritida, myalgie, bolest svalů a kostí, svalová slabost, svalový spasmus, svalové napětí, burzitida Vzácné Rhabdomyolýza*, ztuhlost kloubů, ztuhlost kosterního svalstva |
| Poruchy ledvin a močových cest | Méně časté Selhání ledvin, nefrolitiáza, hematurie, polakisurie, proteinurie Vzácné Tubulointersticiální nefritida*, nucení na močení |
| Poruchy reprodukčního systému a prsu | Méně časté Erektilní dysfunkce |
| Celkové poruchy a reakce v místě aplikace | Časté Otok Méně časté Únava, bolest na prsou, hrudní potíže Vzácné Žízeň |
| Vyšetření | Méně časté Zvýšení hladiny amylázy v krvi, snížení počtu trombocytů, snížení počtu bílých krvinek, snížení počtu lymfocytů, zvýšení kreatinu v krvi, zvýšení kreatininu v krvi, snížení hemoglobinu, zvýšení hladiny močoviny v krvi, zvýšení triglyceridů v krvi, zvýšení cholesterolu v krvi, snížení hematokritu, zvýšení laktát dehydrogenázy v krvi, zvýšení draslíku v krvi Vzácné Zvýšení hladiny glukózy v krvi, prodloužení aPTT, snížení počtu červených krvinek, zvýšení alkalické fosfatázy v krvi, zvýšení kreatinfosfokinázy v krvi* |
* Nežádoucí účinky zjištěné po uvedení přípravku na trh
** U pacientů, kteří jsou současně léčeni kolchicinem, se v kombinovaných studiích fáze 3 častěji vyskytují neinfekční průjmy vyvolané léčbou a abnormální výsledky testů jaterních funkcí
Výskyt záchvatů dny v jednotlivých randomizovaných kontrolovaných studiích fáze 3 viz bod 5.1.
Popis vybraných nežádoucích účinků
Po uvedení přípravku na trh se vzácně objevily závažné hypersenzitivní reakce na febuxostat, včetně Stevensova-Johnsonova syndromu, toxické epidermální nekrolýzy a anafylaktických reakcí/šoku. Stevensův-Johnsonův syndrom a toxická epidermální nekrolýza jsou charakterizovány progresivní kožní vyrážkou spojenou s puchýři nebo slizničními lézemi a podrážděním očí. Hypersenzitivní reakce na febuxostat mohou být spojené s následujícími příznaky: kožní reakce charakterizované infiltrovanou makulopapulární erupcí, generalizovanou nebo exfoliativní vyrážkou, ale také kožními lézemi, otokem obličeje, horečkou, hematologickými abnormalitami jako trombocytopenie a eozinofilie a poškozením jednoho nebo více orgánů (jaterní nebo ledvinové poškození včetně tubulointersticiální nefritidy) (viz bod 4.4).
Brzy po začátku léčby a během prvních měsíců byly často pozorovány dnavé záchvaty. Poté se v závislosti na čase frekvence dnavých záchvatů snižuje. Doporučuje se profylaxe dnavých záchvatů (viz bod 4.2 a 4.4).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky:
4.9 Předávkování
Pacienti s předávkováním mají být léčeni pomocí symptomatické a podpůrné léčby.
5.
FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Přípravky pro léčbu dny, přípravky inhibující tvorbu kyseliny močové, ATC kód: M04AA03
Mechanismus účinku
Kyselina močová je cílový produkt metabolismu purinů u člověka a vytváří se v kaskádě hypoxanthin xanthin kyselina močová. Oba kroky ve výše uvedených transformacích jsou katalyzovány xanthinoxidázou (XO). Febuxostat je 2-arylthiazolový derivát, který dosahuje svého terapeutického účinku, snížení hladiny kyseliny močové v séru, prostřednictvím selektivní inhibice XO. Febuxostat je silný, nonpurinový selektivní inhibitor XO (NP-SIXO) s hodnotou Ki in vitro nižší než jeden nanomol. Bylo prokázáno, že febuxostat silně inhibuje jak oxidované tak redukované formy XO. Při terapeutických koncentracích febuxostat neinhibuje další enzymy účastnící se metabolismu purinů a pyrimidinů, jako jsou guanindeamináza, hypoxanthin guaninfosforibosyltransferáza, orotát fosforibosyltransferáza, orotidin monofosfátdekarboxyláza nebo purin nukleosidfosforyláza.
Klinická účinnost a bezpečnost
Účinnost přípravku febuxostatu byla prokázána ve třech pivotních studiích fáze 3 (dvě pivotní studie APEX a FACT a další studie CONFIRMS popsané níže), které byly provedeny u 4101 pacientů s hyperurikémií a dnou. V každé pivotní studii fáze 3 prokázal febuxostat lepší schopnost snižovat a udržovat sérové hladiny kyseliny močové ve srovnání s alopurinolem. Primárním cílovým parametrem účinnosti ve studiích APEX a FACT byl podíl pacientů, jejichž hladiny kyseliny močové za poslední tři měsíce byly nižší než 6,0 mg/dl (357 mikromolů/l). V další studii fáze 3 – CONFIRMS, jejíž výsledky byly k dispozici po prvním vydání rozhodnutí o registraci febuxostatu, byl primárním cílovým parametrem z hlediska účinnosti podíl pacientů, kteří měli při závěrečné návštěvě sérové hladiny urátů <6,0 mg/dl. Do těchto studií nebyli zařazeni pacienti s orgánovou transplantací (viz bod 4.2).
Studie APEX: Alopurinolem a placebem kontrolovaná studie účinnosti febuxostatu (APEX) byla randomizovaná, dvojitě zaslepená, multicentrická, 28týdenní studie fáze 3. Bylo do ní randomizováno 1 072 pacientů: placebo (n=134), febuxostat 80 mg jednou denně (n=267), febuxostat 120 mg jednou denně (n=269), febuxostat 240 mg jednou denně (n=134) nebo alopurinol (300 mg jednou denně [n=258] u pacientů s výchozí hladinou kreatininu v séru >1,5 mg/dl nebo 100 mg jednou denně [n=10] u pacientů s výchozí hladinou kreatininu v séru >1,5 mg/dl a <2,0 mg/dl). Jako bezpečnostní hodnocená dávka bylo použito 240 mg febuxostatu (2krát vyšší, než je doporučená nejvyšší dávka).
Studie APEX ukázala statisticky významnou superioritu obou léčebných ramen febuxostatu 80 mg jednou denně a 120 mg jednou denně versus léčebné rameno s konvenčně používanými dávkami alopurinolu 300 mg (n=258)/100 mg (n=10) ve snížení hladiny kyseliny močové v séru pod 6 mg/dl (357 mikromolů/l) (viz tabulka 2 a obrázek 1).
Studie FACT: Alopurinolem kontrolovaná studie s febuxostatem (FACT) byla randomizovaná, dvojitě zaslepená, multicentrická, 52týdenní studie fáze 3. Bylo do ní randomizováno 760 pacientů: febuxostat 80 mg jednou denně (n=256), febuxostat 120 mg jednou denně (n=251) nebo alopurinol 300 mg jednou denně (n=253).
Studie FACT prokázala statisticky významnou superioritu obou léčebných ramen febuxostatu80 mg a 120 mg jednou denně versus léčebné rameno s konvenčně používanou dávkou alopurinolu 300 mg ve snížení a udržení hladiny kyseliny močové v séru pod 6 mg/dl (357 mikromolů/l).
Tabulka 2 shrnuje výsledky primárních cílových parametrů účinnosti.
Tabulka 2: Podíl pacientů s hladinami kyseliny močové v séru <6,0 mg/dl (357 mikromolů/l) Poslední tři měsíční návštěvy
| Studie | Febuxostat 80 mg jednou denně | Febuxostat 120 mg jednou denně | Alopurinol 300/100 mg jednou denně1 |
| APEX | 48 % | 65 % *, # | 22 % |
| (28 týdnů) | (n=262) | (n=269) | (n=268) |
| FACT | 53 % * | 62 % | 21 % |
| (52 týdnů) | (n=255) | (n=250) | (n=251) |
| Kombinované | 51 % * | 63 % *, # | 22 % |
| výsledky | (n=517) | (n=519) | (n=519) |
1 výsledky získané od subjektů užívajících buď 100 mg jednou denně (n=10: pacienti s hladinou kreatininu v séru >1,5 a <=2,0 mg/dl) nebo 300 mg jednou denně (n=509) byli seskupeni pro analýzy. * p<0,001 vs. alopurinol
# p < 0,001 vs. 80 mg
Schopnost febuxostatu snižovat hladiny kyseliny močové v séru byla rychlá a trvalá. Snížení hladiny kyseliny močové v séru pod 6,0 mg/dl (357 mikromol/l) byly zaznamenány při návštěvě ve 2. týdnu a udržely se během léčby. Průměrné hladiny kyseliny močové v séru v průběhu času pro každou léčebnou skupinu ze dvou pivotních studií fáze 3 jsou uvedeny na obrázku 1.
Obrázek 1: Průměrné hladiny kyseliny močové v séru v kombinovaných pivotních studiích fáze 3
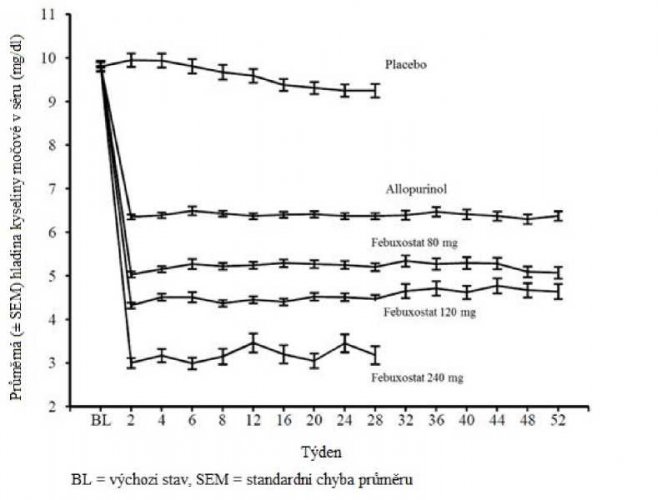
Allopurinol
Ecbuxoslat 80 mg
BL 2 4 6 8 12 16 20 24 28 32 36 40 44 48 52
Týden
BL = výchozí stav, SEM = standardní chyba průměru
í
- E---í---E-
i
Placebo
FebuxoMal 120 mg
Febuxostat 240 mg
Pozn.: 509 pacientů užívalo alopurinol v dávce 300 mg jednou denně; 10 pacientů s hladinou kreatininu v séru >1,5 a <2,0 mg/dl dostávalo dávku 100 mg jednou denně (10 pacientů z 268 ve studii APEX). 240 mg febuxostatu bylo použito pro hodnocení bezpečnosti febuxostatu ve dvojnásobné dávce, než je doporučená nejvyšší dávka.
Studie CONFIRMS: Studie CONFIRMS byla randomizovaná kontrolovaná 26týdenní studie fáze 3, která byla provedena za účelem zhodnocení bezpečnosti a účinnosti 40 mg a 80 mg febuxostatu v porovnání s 300 mg nebo 200 mg alopurinolem u pacientů s dnou a hyperurikémií. Dva tisíce dvě stě šedesát devět (2 269) pacientů bylo randomizováno mezi febuxostat 40 mg podávaný jednou denně (n = 757), febuxostat 80 mg podávaný jednou denně (n = 756) nebo alopurinol 300/200 mg podávaný jednou denně (n = 756). Nejméně 65 % pacientů mělo mírné až středně těžké poškození ledvin (s clearance kreatininu 30–89 ml/min. Po dobu 26 týdnů byla povinná profylaxe proti dnavým záchvatům.
Podíl pacientů, kteří při závěrečné návštěvě měli sérové hladiny urátů <6,0 mg/dl (357 ^mol/l), činil 45 % u 40 mg febuxostatu, 67 % u 80 mg febuxostatu a 42 % u 300/200 mg alopurinolu.
Primární cílový parametr u podskupiny pacientů s poruchou funkce ledvin
Studie APEX hodnotila účinnost u 40 pacientů s poruchou funkce ledvin (tj. výchozí hladina kreatininu v séru vyšší než 1,5 mg/dl a < 2,0 mg/dl). U subjektů s poruchou funkce ledvin, které byly randomizovány do alopurinolu, byla dávka ukončena na 100 mg jednou denně. Febuxostat dosáhl primárního cílového parametru účinnosti u 44 % (80 mg jednou denně), 45 % (120 mg jednou denně) a 60 % (240 mg jednou denně) pacientů ve srovnání s 0 % ve skupině alopurinolu v dávce 100 mg jednou denně a ve skupině placeba.
Nevyskytly se žádné klinicky významné rozdíly v procentu snížení koncentrace kyseliny močové v séru u zdravých subjektů bez ohledu na jejich renální funkci (58 % ve skupině s normální renální funkcí a 55 % ve skupině se závažnou renální dysfunkcí).
Ve studii CONFIRMS byla prospektivně definována analýza pacientů s dnou a poruchou funkce ledvin, která ukázala, že u pacientů s dnou a mírnou až středně těžkou poruchou funkce ledvin (65 % studovaných pacientů) byl pro snížení sérových hladin urátů pod 6 mg/dl významně účinnější febuxostat než alopurinol 300/200 mg.
Primární cílový parametr u podskupiny pacientů s hladinou kyseliny močové v séru > 10 mg/dl Asi 40 % pacientů (kombinace studie APEX a FACT) mělo výchozí hladinu kyseliny močové v séru > 10 mg/dl. V této podskupině dosáhl febuxostat primárního cílového parametru účinnosti (hladina kyseliny močové v séru < 6,0 mg/dl po poslední 3. návštěvě) u 41 % (80 mg jednou denně), 48 % (120 mg jednou denně) a 66 % (240 mg jednou denně) pacientů ve srovnání s 9 % ve skupině alopurinolu v dávce 300 mg/100 mg jednou denně a 0 % ve skupině placeba.
Ve studii CONFIRMS byl podíl pacientů s výchozí sérovou hladinou urátů >10 mg/dl, kteří dosáhli primárního cílového parametru z hlediska účinnosti (sérové hladiny urátů <6,0 mg/dl při závěrečné návštěvě), 27 % (66/249) u pacientů léčených febuxostatem 40 mg podávaným jednou denně, 49 % (125/254) v případě febuxostatu 80 mg podávaného jednou denně a 31 % (72/230) u alopurinolu 300/200 mg podávaného jednou denně.
Klinické výsledky: podíl pacientů vyžadujících léčbu dnavého záchvatu
Studie APEX: Během 8týdenního období profylaxe vyžadoval léčbu dnavých záchvatů vyšší podíl subjektů (36 %) ve skupině léčené febuxostatem 120 mg než ve skupině s febuxostatem 80 mg (28 %), alopurinolem 300 mg (23 %) nebo placebem (20 %). Výskyt záchvatů se po období profylaxe zvýšil a postupně s časem klesal. Mezi 8. a 28. týdnem dostávalo léčbu dnavých záchvatů 46 až 55 % subjektů. Během posledních 4 týdnů studie (ve 24.-28. týdnu) byly dnavé záchvaty pozorovány u 15 % (febuxostat 80 mg, 120 mg), 14 % (alopurinol 300 mg) a 20 % (placebo) subjektů.
Studie FACT: Během 8týdenního období profylaxe vyžadoval léčbu dnavých záchvatů vyšší podíl subjektů (36 %) ve skupině léčené febuxostatem 120 mg než ve skupině léčené febuxostatem 80 mg (22 %) nebo ve skupině léčené alopurinolem 300 mg (21 %). Po 8týdenním období profylaxe se výskyt záchvatů zvýšil a poté postupně s časem klesal (v 8. až 52. týdnu dostávalo léčbu dnavých záchvatů 64% a 70 % subjektů). Během posledních 4 týdnů studie (ve 49.-52. týdnu) byly dnavé záchvaty pozorovány u 6–8 % (febuxostat 80 mg, 120 mg) a u 11 % (alopurinol 300 mg) subjektů.
Podíl subjektů vyžadujících léčbu dnavého záchvatu (studie APEX a FACT) byl početně nižší ve skupinách, které dosáhly průměrné hladiny kyseliny močové v séru po výchozím stavu nižší než 6,0 mg/dl, 5,0 mg/dl nebo 4,0 mg/dl ve srovnání se skupinou, která dosáhla průměrné hladiny kyseliny močové v séru po výchozím stavu >6,0 mg/dl během posledních 32 týdnů léčebné fáze (intervaly 20. týden – 24. týden až 49. týden – 52. týden).
V průběhu studie CONFIRMS činil procentuální podíl pacientů vyžadujících léčbu dnavých záchvatů (1. den až 6. měsíc) 31 % ve skupině febuxostatu 80 mg a 25 % ve skupině alopurinolu. Mezi skupinami léčenými febuxostatem 80 mg a 40 mg nebyl v podílu pacientů, kteří vyžadovali léčbu dnavých záchvatů, pozorován žádný rozdíl.
Dlouhodobé otevřené rozšířené studie
Studie EXCEL (C02–021): Studie Excel byla tříletá otevřená multicentrická randomizovaná rozšířená bezpečnostní studie fáze 3, kontrolovaná alopurinolem u pacientů, kteří dokončili pivotní studie fáze 3 (APEX nebo FACT). Do studie bylo zařazeno celkem 1 086 pacientů: febuxostat 80 mg podávaný jednou denně (n = 649), febuxostat 120 mg podávaný jednou denně (n = 292) a alopurinol 300/100 mg podávaný jednou denně (n = 145). Přibližně 69 % pacientů nevyžadovalo pro dosažení konečné stabilní léčby žádnou změnu v léčbě. Pacienti, kteří měli 3krát po sobě sérovou hladinu kyseliny močové >6,0 mg/dl, byli vyřazeni.
Sérové hladiny urátů byly v čase zachovány (tj. 91 % pacientů původně léčených febuxostatem 80 mg a 93 % pacientů původně léčených febuxostatem 120 mg mělo v 36. měsíci sérové hladiny kyseliny močové <6 mg/dl).
Tříleté údaje ukázaly snížení výskytu dnavých záchvatů s méně než 4 % subjektů, kteří vyžadovali léčbu záchvatu (tj. více než 96 % pacientů nevyžadovalo léčbu záchvatu) od 16. do 24. měsíce a od 30. do 36. měsíce.
U 46 % pacientů na konečné stabilní léčbě 80 mg febuxostatu podávaného jednou denně a u 38 % pacientů léčených 120 mg febuxostatu podávaného jednou denně se od základní hladiny do závěrečné návštěvy zcela vyřešil primární hmatný tofus.
Studie FOCUS (TMX-01–005) byla 5letá otevřená multicentrická prodloužená studie bezpečnosti fáze 2 u pacientů, kteří dokončili 4 týdny s dvojitě zaslepeným dávkováním febuxostatu ve studii TMX-00–004. Do studie bylo zahrnuto 116 pacientů, kteří zpočátku dostávali febuxostat v dávce 80 mg jednou denně. Šedesát dva procent pacientů nevyžadovalo pro udržení sérové hladiny kyseliny močové <6 mg/dl žádnou úpravu dávky a 38 % pacientů vyžadovalo úpravu až do dosažení konečné stabilní dávky.
Podíl pacientů se sérovými hladinami urátů <6,0 mg/dl (357 ^mol/l) při závěrečné návštěvě činil u všech dávek febuxostatu více než 80 % (81–100 %).
Během klinických studií fáze 3 byly pozorovány mírné abnormality jaterních testů u pacientů léčených febuxostatem (5,0 %). Tento výskyt byl podobný jako u alopurinolu (4,2 %) (viz bod 4.4). Zvýšené hodnoty TSH (>5,5 ^IU/ml) byly pozorovány u pacientů užívajících febuxostat dlouhodobě (5,5 %) a u pacientů užívajících alopurinol (5,8 %) v dlouhodobých otevřených prodlouženích studií (viz bod 4.4).
5.2 Farmakokinetické vlastnosti
U zdravých subjektů se maximální plazmatické koncentrace (Cmax) a křivka plochy pod křivkou koncentrace a času (AUC) febuxostatu zvýšily úměrně s dávkou po jednorázových a opakovaných dávkách 10 mg až 120 mg. U dávek mezi 120 mg a 300 mg bylo pozorováno vyšší než dávce úměrné zvýšení AUC u febuxostatu. Nedochází k žádné výrazné akumulaci, pokud jsou dávky 10 mg až 240 mg podávány každých 24 hodin. Febuxostat má zdánlivý terminální eliminační poločas (t1/2) přibližně 5 až 8 hodin.
Populační farmakokinetické/farmakodynamické analýzy byly provedeny u 211 pacientů s hyperurikémií a dnou léčených febuxostatem v dávce 40 mg až 240 mg jednou denně. Farmakokinetické parametry febuxostatu jsou podle odhadů z těchto analýz obecně shodné s parametry získanými u zdravých subjektů, což ukazuje na to, že zdravé subjekty jsou reprezentativní pro farmakokinetické/farmakodynamické hodnocení u populace pacientů s dnou.
Absorpce
Febuxostat se rychle (tmax 1,0 až 1,5 h) a dobře vstřebává (minimálně 84 %). Po jednorázové nebo opakované perorální dávce 80 a 120 mg jednou denně je Cmax asi 2,8 až 3,2 mikrogramů/ml nebo 5,0 až 5,3 mikrogramů/ml. Absolutní biologická dostupnost tablet febuxostatu nebyla hodnocena.
Po opakovaných perorálních dávkách 80 mg jednou denně nebo jednorázové dávce 120 mg s jídlem s vysokým obsahem tuků došlo ke 49% a 38% snížení Cmax a 18% a 16% snížení AUC. U testovaných případů však nebyla pozorována žádná klinicky významná změna v procentu snížení koncentrace kyseliny močové v séru (80 mg opakovaná dávka). Febuxostat může být tudíž užíván nezávisle na jídle.
Distribuce
Zdánlivý ustálený distribuční objem (Vss/F) febuxostatu se pohybuje od 29 do 75 l po perorálních dávkách 10 až 300 mg. Vazba na plasmatické proteiny u febuxostatu je asi 99,2 % (primárně na albumin) a je konstantní v koncentračním rozmezí dosaženém u dávek 80 a 120 mg. Vazba na plazmatické proteiny u účinných metabolitů se pohybuje od 82 % do 91 %.
Biotransformace
Febuxostat se rozsáhle metabolizuje konjugací v enzymatickém systému uridindifosfát-glukuronosyltransferázy (UDPGT) a oxidací v systému cytochromu P450 (CYP). Byly identifikovány čtyři farmakologicky aktivní hydroxylové metabolity, z nichž tři se vyskytují v plasmě u člověka. In vitro studie s humánními jaterními mikrosomy ukázaly, že tyto oxidativní metabolity se tvořily primárně v CYP1A1, CP1A2, CYP2C8 nebo CYP2C9 systémech a febuxostat glukuronid se tvořil primárně v systémech UGT 1A1, 1A8 a 1A9.
Eliminace
Febuxostat se vylučuje jak játry, tak ledvinami. Po perorálním podání 14C značeného febuxostatu v dávce 80 mg se asi 49 % dávky objevilo v moči jako nezměněný febuxostat (3 %), acylglukuronid účinné látky (30 %), jeho známé oxidativní metabolity a jejich konjugáty (13 %) a další neznámé metabolity (3 %).
Kromě vylučování do moči se asi 45 % dávky objevilo ve stolici jako nezměněný febuxostat (12 %), acyl glukuronid účinné látky (1 %), jeho známé oxidativní metabolity a jejich konjugáty (25 %) a další neznámé metabolity (7 %).
Porucha funkce ledvin
Po opakovaných dávkách 80 mg febuxostatu u pacientů s mírnou, středně těžkou nebo těžkou poruchou funkce ledvin se Cmax febuxostatu nezměnila v porovnání se subjekty s normální funkcí ledvin. Průměrná celková AUC febuxostatu se zvýšila asi 1,8krát ze 7,5 mikrogramů/h/ml ve skupině s normální funkcí ledvin na 13,2 mikrogramů/h/ml ve skupině se závažnou renální dysfunkcí. Cmax a AUC účinných metabolitů se zvýšily až dvoj- a čtyřnásobně. U pacientů s mírnou až středně těžkou poruchou funkce ledvin však není nutná žádná úprava dávky.
Porucha funkce jater
Po opakovaných dávkách 80 mg febuxostatu pacientů s mírnou (Child-Pugh skóre A) nebo středně těžkou (Child-Pugh skóre B) poruchou funkce jater se Cmax a AUC febuxostatu a jeho metabolitů významně nezměnily ve srovnání se subjekty s normální funkcí jater. Nebyly provedeny žádné studie u pacientů s těžkou poruchou funkce jater (Child-Pugh skóre C).
Věk
Nevyskytly se žádné významné změny u AUC febuxostatu nebo jeho metabolitů po opakovaných perorálních dávkách febuxostatu u starších pacientů ve srovnání s mladšími zdravými subjekty.
Pohlaví
Po opakovaných perorálních dávkách febuxostatu byly Cmax a AUC o 24 % a 12 % vyšší u žen než u mužů. Váhově upravené Cmax a AUC však byly podobné mezi oběma pohlavími. Není nutná žádná úprava dávkování podle pohlaví.
5.3 Předklinické údaje vztahující se k bezpečnosti
Účinky v neklinických studiích byly obecně pozorovány po expozicích dostatečně převyšujících maximální expozici u člověka.
Kancerogenní, mutagenní a reprodukční potenciál
U dospělých potkanů bylo zjištěno statisticky významné zvýšení výskytu nádorů močového měchýře (papilom z přechodných buněk a karcinom) pouze v souvislosti s xanthinovými konkrementy ve skupině s vysokým dávkováním při asi 11násobné expozici u člověka. Nedošlo k žádnému významnému zvýšení u žádného dalšího typu nádoru u samců nebo samic myší nebo potkanů. Tyto nálezy jsou považovány za důsledek druhově specifického metabolismu purinů a složení moči a nemá význam s ohledem na klinické použití.
Standardní série testů genotoxicity neodhalila žádné biologicky významné genotoxické účinky febuxostatu.
Bylo zjištěno, že perorální dávky febuxostatu až 48 mg/kg/den nemají žádný účinek na fertilitu a reprodukční schopnosti samců a samic potkanů.
Neobjevily se žádné důkazy o poruše fertility, teratogenních účincích nebo nežádoucích účincích na plod v důsledku užívání febuxostatu. Při vysokých dávkách se objevila maternální toxicita související se snížením indexu odstavení a snížením vývoje potomstva u potkanů asi při 4,3násobné expozici u člověka. Studie teratogenity provedené u březích potkanů asi při 4,3násobné a u březích králíků asi při 13násobné expozici u člověka neodhalily žádné teratogenní účinky.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Jádro tablety
Magnesium aluminometasilikát
Laktosa
Mikrokrystalická celulosa
Kopovidon
Krospovidon
Magnesium-stearát
Koloidní bezvodý oxid křemičitý
Potahová vrstva tablety
Potahová soustava Opadry II žlutá obsahující:
Polyvinylalkohol
Oxid titaničitý (E 171)
Makrogol
Mastek
Žlutý oxid železitý (E 172)
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
Pro blistry:
2 roky
Pro lahvičky:
2 roky
Po prvním otevření: 28 dní
6.4 Zvláštní opatření pro uchovávání
Tento přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.5 Druh obalu a obsah balení
Urikostad 80 mg se dodává v Al/Al blistrech s vysoušedlem, které obsahují 14, 28, 84 a 98 potahovaných tablet, nebo v HDPE lahvičkách obsahujících 100 a 500 potahovaných tablet.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
STADA Arzneimittel AG
Stadastrasse 2 – 18
61118 Bad Vilbel
Německo
8. REGISTRAČNÍ ČÍSLO(A)
29/079/17-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 25. 4. 2018
Další informace o léčivu URIKOSTAD
Jak
se URIKOSTAD
podává: perorální podání - potahovaná tableta
Výdej
léku: na lékařský předpis
Balení: Obal na tablety
Velikost
balení: 100
Držitel rozhodnutí o registraci daného léku v České republice:
STADA Arzneimittel AG, Bad Vilbel
E-mail: info@stada-pharma.cz
Telefon: +420 257 888 111
