Souhrnné informace o léku - TISSEEL
1. NÁZEV PŘÍPRAVKU
TISSEEL
Roztoky pro tkáňové lepidlo
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
| Složka 1: Roztok lepicího proteinu Fibrinogenum humanum (jako srážlivý protein) Aprotininum (syntetické) Pomocné látky se známým účinkem Polysorbát 80 | 91 mg/ml 3000 KIU/ml 0,6 – 1,9 mg/ml |
| Složka 2: Roztok thrombinu Thrombinum humanum Calcii chloridum dihydricum | 500 IU/ml 40 Limoi/ini |
1, 2 nebo 5 ml roztoku lepicího proteinu (se syntetickým aprotininem) a 1, 2 nebo 5 ml roztoku thrombinu (s chloridem vápenatým) vytvoří celkový objem 2, 4 nebo 10 ml roztoku fibrinového lepidla připraveného k použití.
| Po smíchání | 1 ml | 2 ml | 4 ml | 10 ml |
| Složka 1: Roztok lepicího proteinu | ||||
| Fibrinogenum humanum | 45,5 mg | 91 mg | 182 mg | 455 mg |
| (jako srážlivý protein) | ||||
| Aprotininum (syntetické) | 1 500 KIU | 3 000 KIU | 6 000 KIU | 15 000 KIU |
| Složka 2: Roztok thrombinu | ||||
| Thrombinum humanum | 250 IU | 500 IU | 1000 IU | 2500 IU |
| Calcii chloridům | 20 Limo! | 40 Limo! | 80 Limo! | 200 Limo! |
Přípravek TISSEEL obsahuje koagulační faktor XIII ko-purifikovaný s lidským fibrinogenem v množství 0,6 – 5 IU/ml.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Roztoky pro tkáňové lepidlo
Zmrazené roztoky jsou bezbarvé až bledě žluté, opalescentní. Po rozmrazení jsou bezbarvé až bledě žluté.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Podpůrná léčba tam, kde jsou standardní chirurgické techniky nedostatečné (viz bod 5.1)
- k podpoře hemostázy
- jako tkáňové lepidlo ke zlepšení hojení ran nebo podpoře sutur v cévní chirurgii, u gastrointestinálních anastomóz
- k lepení tkání, ke zlepšení adheze oddělených tkání (např. neštěpených transplantátů, tkáňových štěpů a transplantátů)
Byla prokázána účinnost u plně heparinizovaných pacientů.
4.2 Dávkování a způsob podání
Přípravek TISSEEL smějí používat pouze zkušení chirurgové, kteří byli k jeho použití vyškoleni.
Množství přípravku TISSEEL, které je třeba aplikovat, a četnost aplikace by měly být vždy přizpůsobeny zjištěným klinickým potřebám pacienta.
Dávka, kterou je třeba aplikovat, se řídí proměnnými faktory, které mimo jiné zahrnují typ chirurgického výkonu, velikost plochy, zamýšlený způsob aplikace a počet aplikací.
Podání přípravku musí být individualizováno ošetřujícím lékařem. V klinických studiích bylo individuální dávkování typicky v rozsahu 4 – 20 ml. Při některých procedurách (např. úrazy jater nebo uzavírání rozsáhlých popálených povrchů) mohou být potřebné větší objemy.
Počáteční množství přípravku k aplikaci na zvolenou anatomickou oblast nebo cílový povrch má být dostatečné pro úplné pokrytí místa zamýšlené aplikace. Aplikaci lze v případě potřeby opakovat.
Neaplikujte však opakovaně přípravek TISSEEL na předchozí polymerizovanou vrstvu přípravku TISSEEL, protože přípravek TISSEEL nepřilne k polymerizované vrstvě.
Při aplikaci lepidla na povrchy je 1 balení přípravku TISSEEL 2 ml (tj. 1 ml roztoku TISSEEL plus 1 ml roztoku thrombinu) dostatečné pro pokrytí oblasti minimálně 10 cm .
Je-li přípravek TISSEEL nanášen rozprašováním, bude stejný objem postačující k pokrytí značně větších ploch, v závislosti na konkrétní indikaci a individuálním případu.
Pro prevenci nadměrné tvorby granulační tkáně a pro zajištění postupné absorpce ztuhlého fibrinového lepidla se doporučuje aplikovat pouze tenkou vrstvu přípravku TISSEEL.
Pediatrická populace
Bezpečnost a účinnost přípravku TISSEEL u pediatrických pacientů nebyla stanovena.
Epilezionální podání.
Aby bylo zajištěno optimální bezpečné použití přípravku TISSEEL ve formě spreje, dodržujte následující doporučení:
Při chirurgických zákrocích na otevřených ranách používejte regulátor tlaku, který dodává tlak maximálně 2,0 baru (28,5 psi).
Při minimálně invazivních/laparoskopických zákrocích používejte pouze regulátor tlaku dodávající tlak maximálně 1,5 baru (22 psi). Používejte pouze plynný oxid uhličitý.
Před aplikací přípravku TISSEEL je třeba standardním způsobem osušit povrch rány (např. aplikací intermitentní komprese, tampóny či použitím sacích zařízení). K vysoušení rány nepoužívejte stlačený vzduch nebo plyn.
Přípravek TISSEEL se smí sprejovat pouze na viditelná aplikační místa.
Přípravek TISSEEL má být rekonstituován a aplikován v souladu s příslušnými pokyny. Používejte jej pouze se zařízeními doporučenými pro tento produkt (viz bod 6.6).
Specifická doporučení pro sprejovou aplikaci stran požadovaného tlaku a vzdálenosti od tkáně v závislosti na chirurgické proceduře a délce hrotů aplikátorů jsou uvedena v bodech 4.4 a 6.6.
Při chirurgických výkonech, u nichž se používá minimální objem fibrinového lepidla, se doporučuje vytlačit a zlikvidovat prvních několik kapek přípravku.
4.3 Kontraindikace
Přípravek TISSEEL samotný není určen k léčbě masivního a tryskajícího arteriálního nebo venózního krvácení.
Přípravek TISSEEL není indikován k náhradě kožních stehů k uzavření chirurgické rány.
Přípravek TISSEEL se nikdy nesmí aplikovat intravaskulárně. Intravaskulární aplikace může vyvolat život ohrožující tromboembolické příhody.
Přípravek TISSEEL se nesmí aplikovat v případě hypersenzitivity na léčivé látky nebo na kteroukoli pomocnou látku přípravku.
4.4 Zvláštní upozornění a opatření pro použití
Pouze epilezionální podání. Neaplikujte intravaskulárně.
V případě neúmyslné intravaskulární aplikace přípravku mohou nastat život ohrožující trombembolické komplikace.
Opatrnost je třeba při aplikaci fibrinového lepidla pomocí stlačeného plynu.
Aplikace natlakovaným plynem je spojena s potenciálním rizikem vzduchové nebo plynové embolie, protržení tkáně nebo zachycení plynu s kompresí, což může být život ohrožující.
Přípravek TISSEEL aplikujte v tenké vrstvě. Nadměrná tloušťka sraženiny může negativně ovlivnit účinnost přípravku i průběh léčebného procesu.
Při použití sprejovacích zařízení, která k podávání fibrinových tkáňových lepidel využívají regulátor tlaku, se objevily život ohrožující/fatální případy vzduchové nebo plynové embolie. Zdá se, že je tato událost spojena s použitím sprejovacího zařízení při vyšším než doporučeném tlaku a/nebo v přílišné blízkosti k povrchu tkáně. Ve srovnání s použitím s CO2se riziko při sprejování fibrinových tkáňových lepidel za použití vzduchu zdá být vyšší a z tohoto důvodu jej nelze při sprejování přípravku TISSEEL při chirurgickém zákroku na otevřené ráně vyloučit.
Při aplikaci přípravku TISSEEL pomocí sprejovacího zařízení se ujistěte, že používáte tlak v rozmezí doporučeném výrobcem tohoto zařízení (tlaky a vzdálenosti viz tabulka v bodě 6.6).
Aplikace přípravku TISSEEL sprejem by se měla používat pouze v situacích, kdy lze přesně změřit sprejovací vzdálenost; ta musí být v souladu s doporučeními výrobce. Nesprejujte blíže než z doporučované vzdálenosti.
Kvůli riziku výskytu vzduchové nebo plynové embolie je třeba během sprejování přípravku TISSEEL hlídat, zda u pacienta nedochází ke změnám krevního tlaku, pulzu, saturace kyslíkem nebo obsahu CO2_ ve vzduchu na konci výdechu (viz také bod 4.2).
Zdravotnický prostředek EasySpray / sprejovací zařízení se nesmí použít k aplikaci přípravku TISSEEL v místech organismu, která jsou špatně přístupná.
Před podáním přípravku TISSEEL je třeba zajistit dostatečnou ochranu/pokrytí části těla mimo místo aplikace, aby se předešlo tkáňové adhezi na nežádoucích místech.
Jestliže jsou fibrinová lepidla aplikovaná na stísněných místech, např. mozek nebo mícha, je třeba vzít v úvahu riziko kompresivních komplikací.
Pro zajištění odpovídajícího promíchání složky lepicího proteinu a složky thrombinu se doporučuje vytlačit prvních několik kapek přípravku z aplikační kanyly a před použitím je zlikvidovat.
Podobně jako u jiných přípravků obsahujících proteiny se mohou objevit hypersenzitivní reakce alergického typu.
Intravaskulární aplikace může u vnímavých pacientů zvýšit pravděpodobnost a závažnost akutních hypersenzitivních reakcí.
U přípravku TISSEEL byly zaznamenány hypersenzitivita a anafylaktické reakce (také fatální, zahrnující anafylaktický šok). Příznaky hypersenzitivity mohou zahrnovat vyrážku, generalizovanou kopřivku, tlak na hrudi, sípání, hypotenzi. Pokud se vyskytnou tyto příznaky, podávání přípravku musí být okamžitě přerušeno a zahájena v současnosti platná standardní protišoková léčba. Zbylý přípravek musí být odstraněn z místa aplikace.
Přípravek TISSEEL obsahuje syntetický protein (aprotinin). I v případě přísně lokální aplikace existuje riziko anafylaktické reakce spojené s přítomností aprotininu. Riziko se zdá výt vyšší v případech, kdy došlo k předchozí expozici, i pokud byla dobře tolerována. Proto je nutné zaznamenat jakékoli použití aprotininu nebo přípravků obsahujících aprotinin do dokumentace pacienta.
Syntetický aprotinin je strukturálně identický s aprotininem hovězím, a proto by použití přípravku TISSEEL u pacientů alergických na hovězí proteiny mělo být pečlivě zváženo.
Ve dvou retrospektivních nerandomizovaných studiích u aortokoronárního bypassu bylo u pacientů, jimž bylo aplikováno tkáňové lepidlo, zjištěno statisticky signifikantní zvýšení rizika mortality. Přestože tyto studie neprokázaly příčinnou souvislost, nemůže být u těchto pacientů zvýšené riziko při použití přípravku TISSEEL vyloučeno. Proto je třeba dbát na to, aby se přípravek náhodně nedostal do cévy.
Je třeba vyhnout se injekci do nosní sliznice, protože by mohlo dojít k tromboembolickým komplikacím v povodí arteria ophthalmica.
Injekce přípravku TISSEEL do tkáně s sebou nese riziko místního poškození tkáně.
Přípravek TISSEEL má být aplikován pouze v tenké vrstvě. Nadměrná tloušťka sraženiny může negativně ovlivnit účinnost přípravku a proces hojení rány.
Polysorbát 80 může způsobit místní iritaci kůže, jako je kontaktní dermatitida.
Standardní opatření zabraňující přenosu infekce v souvislosti s používáním léčivých přípravků vyrobených z lidské krve nebo plazmy zahrnují pečlivý výběr dárců, testování jednotlivých odběrů krve a plazmatických poolů na specifické ukazatele infekce a zařazení účinných výrobních postupů deaktivace/odstranění virů. Přesto nemůže být možnost přenosu infekce při podávání léčivých přípravků vyráběných z lidské krve nebo plazmy zcela vyloučena. To platí i pro jakékoli neznámé nebo vznikající viry a jiné patogeny.
Přijatá opatření jsou považována za účinná proti obaleným virům, jako je virus lidské imunodeficience (HIV), virus hepatitidy B (HBV) a virus hepatitidy C (HCV) a proti neobalenému viru hepatitidy A (HAV).
Omezený účinek mohou mít tato opatření u neobalených virů, jako je parvovirus B19. Infekce parvovirem B19 může být závažná pro těhotné ženy (infekce plodu) a pro jedince s imunodeficitem nebo se zvýšenou erytropoézou (např. hemolytická anémie).
U pacientů s pravidelným/opakovaným podáváním tkáňových lepidel pocházejících z lidské plazmy se má zvážit vhodná vakcinace (hepatitida A a B).
Při každém podání přípravku TISSEEL důrazně doporučujeme zaznamenat název a číslo šarže přípravku, aby bylo možné zpětně dohledat údaje o použité šarži u daného pacienta.
Přípravky obsahující oxidovanou celulózu by neměly být používány s přípravkem TISSEEL (viz. bod 6.2 Inkompatibility).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie interakcí. Podobně jako srovnatelné přípravky nebo roztoky thrombinu může být přípravek denaturován kontaktem s roztoky obsahujícími alkohol, jód nebo těžké kovy (např. antiseptické roztoky). Před aplikací přípravku je třeba tyto látky odstranit v maximální možné míře. Viz také bod 6.2
4.6 Fertilita, těhotenství a kojení
Bezpečnost použití tkáňových lepidel/hemostatik během těhotenství a kojení nebyla ověřena v kontrolovaných klinických studiích. Experimentální studie u zvířat nejsou dostatečné pro stanovení bezpečnosti přípravku v souvislosti s oplozením, vývojem embrya či plodu, průběhem těhotenství a perinatálním a postnatálním vývojem.
Proto by měl být přípravek podáván těhotným a kojícím ženám, jen pokud je to jednoznačně potřebné.
Viz bod 4.4, kde naleznete informaci o infekci parvovirem B19.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Není relevantní.
4.8 Nežádoucí účinky
U pacientů, kterým byla aplikována tkáňová lepidla/hemostatika, může vzácně dojít ke vzniku hypersenzitivních nebo alergických reakcí (které mohou zahrnovat, ale neomezují se na angioedém, pálení a podráždění v místě aplikace, bradykardii, bronchospasmus, třesavku, dušnost, návaly horka, generalizovanou kopřivku, bolest hlavy, vyrážku, hypotenzi, letargii, nauzeu, svědění, neklid, parestézii, tachykardii, tlak na hrudi, třes, zvracení, sípání), anafylaktické reakce a anafylaktický šok mohou mít i fatální následky.
V ojedinělých případech progredovaly tyto reakce až v těžkou anafylaxi. Takové reakce se mohou objevit, zvláště pokud je přípravek použit opakovaně nebo pokud je podán pacientům se známou přecitlivělostí na aprotinin (viz bod 4.4) nebo na jakoukoli další složku přípravku.
I když byla první léčba přípravkem TISSEEL dobře tolerována, následné podání přípravku TISSEEL nebo systémové podání aprotininu může vyústit v závažné anafylaktické reakce.
Vzácně se mohou vytvořit protilátky proti složkám tkáňového lepidla.
Neúmyslné intravaskulární podání může vyvolat tromboembolické příhody a diseminovanou intravaskulární koagulopatii (DIC). Navíc existuje také riziko anafylaktické reakce (viz bod 4.4).
Pro údaje o bezpečnosti s ohledem na přenosná agens viz bod 4.4.
Nežádoucí účinky uvedené v tomto bodě byly hlášeny z klinických studií zaměřených na bezpečnost a účinnost přípravku TISSEEL a z postmarketingové zkušenosti (označené „p“ v tabulce nežádoucích účinků níže) s tkáňovými lepidly společnosti Baxter. V klinických studiích byl přípravek TISSEEL aplikován k doplňkové hemostázi v kardiochirurgii, cévní chirurgii, u totálních endoprotéz kyčelního kloubu a u operací jater a sleziny. Jiné klinické studie zahrnovaly lepení lymfatických cév u pacientů podstupujících axilární lymfadenektomii, lepení anastomóz tlustého střeva a lepení dura mater ve fossa posterior. Protože nelze vypočítat frekvenci pozorovaných postmarketingových nežádoucích účinků, kdykoli je to možné, byla vypočtena horní hranice 95% intervalu spolehlivosti za použití trojčlenky následujícím způsobem: 3/1146 = 0,0026 nebo 0,26%, což je „Méně časté“ (kde „1146“ je celkový počet subjektů, kterým byl v klinických studiích, uvedených v SPC, podán přípravek TISSEEL),
Velmi časté (>1/10)
Časté (>1/100 až <1/10)
Méně časté (>1/1 000 až <1/100)
Vzácné (>1/10 000 až <1/1 000)
Velmi vzácné (<1/10 000)
Není známo (z dostupných údajů nelze určit)
| Třídy orgánových systémů | Preferovaný termín dle MedDRA | Četnost |
| Infekce a infestace | Pooperační infekce rány | Časté |
| Poruchy krve a lymfatického systému | Zvýšení degradačních produktů fibrinu | Méně časté |
| Poruchy imunitního systému | Hypersenzitivní reakce * p Anafylaktické reakce*p Anafylaktický šok*p | Méně časté Méně časté Méně časté |
| Parestézie p Bronchospasmus p Sípání p Svědění p Erytém p | Méně časté Méně časté Méně časté Méně časté Méně časté | |
| Poruchy nervového systému | Poruchy smyslového vnímání | Časté |
| Srdeční poruchy | Bradykardie p Tachykardie p | Méně časté Méně časté |
| Cévní poruchy | Trombóza axilární žíly** Hypotenze Hematom (NOS) p Arteriální embolie p Vzduchová embolie*** p Embolie cerebrální artérie p Cerebrální infarkt** p | Časté Vzácné Méně časté Méně časté Není známo Méně časté Méně časté |
| Respirační, hrudní a mediastinální poruchy | Dušnost p | Méně časté |
| Gastrointestinální poruchy | Nauzea Intestinální obstrukce p | Méně časté Méně časté |
| Poruchy kůže a podkožní tkáně | Vyrážka Kopřivka p Porucha hojení p | Časté Méně časté Méně časté |
| Poruchy svalové a kosterní soustavy a pojivové tkáně | Bolest v končetině | Časté |
| Celkové poruchy a reakce v místě aplikace | Bolest Zvýšená tělesná teplota Přechodné zarudnutí kůže p Edém p | Časté Časté Méně časté Méně časté |
| Poranění, otravy a procedurální komplikace | Bolest spojená se zákrokem Serom Angioedém p | Méně časté Velmi časté Méně časté |
* anafylaktická reakce a anafylaktický šok zahrnují i případy s fatálním následkem
** jako následek intravaskulární aplikace do sinus petrosus superior.
*** stejně jako u jiných fibrinových lepidel došlo při použití zdravotnického prostředku se stlačeným vzduchem nebo plynem k život ohrožující/fatální vzduchové nebo plynové embolii; zdá se, že tato příhoda zřejmě souvisí s nevhodným používáním sprejovacího zařízení (např. vyšší než doporučený tlak a těsná blízkost od povrchu tkáně).
p Nežádoucí účinky pozorované v postmarketingovém použití.
Reakce Třídy
Další nežádoucí účinky spojené s použitím přípravků zařazených do třídy fibrinové lepidlo/hemostatikum zahrnují:projevy hypersenzitivity zahrnující podráždění v místě aplikace, obtížné dýchání, třesavka, bolest hlavy, letargie, neklid a zvracení.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu: Státní ústav pro kontrolu léčiv, Šrobárova 48, 100 41 Praha 10. Webové stránky:
4.9 Předávkování
Nebyl hlášen žádný případ předávkování.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: lokální hemostatika, ATC kód: B02BC; tkáňová lepidla, ATC kód: V03AK
Systém adheze fibrinu napodobuje poslední fázi fyziologického srážení krve. K přeměně fibrinogenu na fibrin dochází rozštěpením fibrinogenu na fibrinové monomery a fibrinopeptidy. Fibrinové monomery agregují a vytvářejí fibrinovou sraženinu. Faktor XIIIa, který vzniká aktivací faktoru XIII thrombinem, zesíťovává fibrin. K přeměně fibrinogenu a k zesíťovatění fibrinu jsou zapotřebí kalciové ionty.
V dalším průběhu hojení rány zvyšuje plazmin fibrinolytickou aktivitu a je zahájen rozklad fibrinu na fibrinové degradační produkty. Proteolytická degradace fibrinu je inhibována antifibrinolytiky. Aprotinin je přítomen v přípravku TISSEEL jako antifibrinolytikum k prevenci předčasné degradace sraženiny.
K průkazu účinnosti byly provedeny studie in vivo u 4 zvířecích modelů úzce imitujících situaci u pacientů. Přípravek TISSEEL prokázal účinnost při primární a sekundární hemostáze a při hojení rány.
Klinické studie prokazující hemostázu a srůstání švů byly provedeny u celkem 213 pacientů (120 s přípravkem TISSEEL, 93 s kontrolním přípravkem), kteří podstoupili zákrok na cévách s ePTFE, u celkem 70 pacientů (35 s přípravkem TISSEEL, 35 s kontrolním přípravkem), kteří podstoupili parciální resekci jater a u celkem 317 pacientů (157 s přípravkem TISSEEL, 160 s předchozí formulí fibrinového lepidla s jednostupňovou inaktivací virů, jako kontrolním přípravkem), kteří podstoupili operaci srdce s mimotělním oběhem (kardiopulmonální bypass) a mediální sternotomii.
Účinnost přípravku TISSEEL, který doplňuje konvenční chirurgické metody lepení anastomóz střev u pacientů s traumatem podstupujících uzavření dočasné kolostomie, byla prokázána v randomizované kontrolované prospektivní studii v jednom centru provedené v roce 1986 s celkovým počtem 120 pacientů (61 s přípravkem TISSEEL, 59 s kontrolním přípravkem).
5.2 Farmakokinetické vlastnosti
Přípravek TISSEEL se podává výhradně epilezionálně. Intravaskulární podání je kontraindikováno. Intravaskulární farmakokinetické studie nebyly proto u lidí prováděny.
Farmakokinetické studie u různých druhů laboratorních zvířat nebyly prováděny.
Fibrinová lepidla/hemostatika jsou metabolizována stejným způsobem jako endogenní fibrin, tedy fibrinolýzou a fagocytózou.
5.3 Předklinické údaje vztahující se k bezpečnosti
Vzhledem k povaze a způsobu aplikace přípravku (obvykle jednorázově, pouze ve výjimečných případech opakovaná aplikace několika ml) a mechanismu účinku (lokální účinnost bez systémového efektu nebo distribuce do jiných orgánů a tkání) nejsou dostupné předklinické údaje vztahující se k bezpečnosti přípravku TISSEEL, jako je chronická toxicita, kancerogenita, reprodukční a vývojová toxicita nebo stimulace imunity.
Studie toxicity jedné dávky u potkanů a králíků neprokázaly akutní toxicitu přípravku TISSEEL. In vitro testy navíc nepotvrdily mutagenitu. Roztoky lepicího proteinu byly rovněž dobře tolerovány kulturami buněk lidských fibroblastů in vitro, čímž byla prokázána výborná buněčná kompatibilita a nebyla potvrzena cytotoxicita.
Na základě podrobného průzkumu literatury může být vyloučen jakýkoli negativní účinek nebo toxicita zbytků organických rozpouštědel v přípravku TISSEEL.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Složka 1: Roztok lepicího proteinu
Roztok lidského albuminu
Histidin
Nikotinamid
Dihydrát natrium-citrát
Polysorbát 80
Voda na injekci
Složka 2: Roztok thrombinu
Roztok lidského albuminu
Chlorid sodný
Voda na injekci
6.2 Inkompatibility
Přípravky obsahující oxidovanou celulózu nemají být používány s přípravkem TISSEEL, protože nízké pH interferuje s aktivitou thrombinu.
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě 6.6.
6.3 Doba použitelnosti
2 roky.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte a převážejte zmrazené (při < –20 °C) bez přerušení až do aplikace.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
Neotevřená balení rozmrazená při teplotě do 25 °C, je možné uchovávat až po dobu 72 hodin při teplotě do 25 °C. Není-li roztok použit do 72 hodin po rozmrazení, přípravek TISSEEL zlikvidujte.
V žádném případě po rozmrazení znovu nezmrazujte a nevracejte do chladničky.
6.5 Druh obalu a obsah balení
1 ml, 2 ml nebo 5 ml roztoku lepicího proteinu a 1 ml, 2 ml nebo 5 ml roztoku thrombinu předplněných ve dvoukomorové injekční stříkačce (polypropylen), uzavřené krytem, balené do dvou sáčků a s prostředkem sestávajícím se ze 2 spojovacích částí a 4 aplikačních kanyl.
nebo
1 ml, 2 ml nebo 5 ml roztoku lepicího proteinu a 1 ml, 2 ml nebo 5 ml roztoku thrombinu předplněných ve dvoukomorové injekční stříkačce (polypropylen), uzavřené krytem, balené do dvou sáčků a s prostředkem sestávajícím se ze 2 spojovacích částí, 4 aplikačních kanyl a jednoho dvojitého pístu.
nebo
1 ml, 2 ml nebo 5 ml roztoku lepicího proteinu a 1 ml, 2 ml nebo 5 ml roztoku thrombinu předplněných ve dvou injekčních stříkačkách (polypropylen), uzavřených krytem, balených do dvou sáčků a s prostředkem sestávajícím se ze 2 spojovacích částí a 4 aplikačních kanyl.
Přípravek TISSEEL je k dispozici v následujících velikostech balení: 1 × 2 ml (1 ml + 1 ml), 1 × 4 ml (2 ml + 2 ml) a 1 × 10 ml (5 ml + 5 ml).
Na trhu nemusí být všechny velikosti balení.
Další příslušenství pro aplikaci přípravku je možné získat od společnosti BAXTER.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
- Před podáním přípravku TISSEEL zakryjte všechny části těla, které se nenacházejí v požadované oblasti aplikace, aby nedošlo k přilnutí ke tkáni na nežádoucích místech.
- K prevenci přilnutí přípravku TISSEEL na rukavice a nástroj tyto před kontaktem navlhčete roztokem chloridu sodného.
- Návod pro aplikaci tkáňového lepidla na povrchy: 1 balení přípravku TISSEEL 2 ml (tj. 1 ml roztoku lepicího proteinu plus 1 ml roztoku thrombinu) je dostatečné pro pokrytí oblasti minimálně 10 cm2.
- Potřebná dávka přípravku TISSEEL závisí na velikosti povrchu, který je třeba pokrýt.
- Jednotlivé komponenty přípravku TISSEEL NEAPLIKUJTE odděleně. Obě komponenty se musí aplikovat společně.
- NEVYSTAVUJTE přípravek TISSEEL teplotám nad 37 °C. NEVKLÁDEJTE přípravek do mikrovlnné trouby.
- NEROZMRAZUJTE přípravek držením v rukou. Přípravek TISSEEL použijte až po úplném rozmrazení a zahřátí na 33 °C – 37 °C.
- Ochranný kryt stříkačky sejměte až po úplném dokončení rozmrazování a zahřívání. PRIMA systém: Kryt z injekční stříkačky snáze sejmete, když jím budete střídavě pohybovat vpřed a vzad a poté ochranný kryt z injekční stříkačky stáhnete.
- Vytlačte z injekční stříkačky veškerý vzduch, poté na spojovací část nasaďte aplikační kanylu.
Roztok lepicí bílkoviny i roztok thrombinu jsou naplněny do jednorázové předplněné stříkačky. Přípravek je balen do dvou sterilních sáčků za aseptických podmínek. Vnitřní sáček a jeho obsah jsou sterilní, pokud nedošlo k porušení integrity vnějšího sáčku. Sterilní metodou přeneste sterilní vnitřní sáček a obsah do sterilního pole.
Jednorázová injekční stříkačka může být rozmražena a zahřáta jedním z následujících způsobů:
1. Rychlé rozmrazování/zahřívání (sterilní vodní lázeň) - doporučená metoda
-
2. Rozmrazování/zahřívání v nesterilní vodní lázni
-
3. Rozmrazování/zahřívání v inkubátoru
-
4. Jednorázová injekční stříkačka může být také rozmražena a uchovávána při pokojové teplotě (nepřesahující 25 °C) až po dobu 72 hodin. Před použitím je nutné přípravek zahřát.
1) Rychlé rozmrazování/zahřívání (sterilní vodní lázeň) - doporučená metoda
Doporučuje se rozmrazit a zahřát obě složky fibrinového lepidla ve vodní lázni při teplotě 33 °C – 37 °C.
- Teplota vodní lázně nesmí přesáhnout 37 °C. Ke kontrole rozmezí teplot vodní lázně použijte teploměr a v případě potřeby vodu vyměňte.
- Pokud používáte k rozmrazení a zahřátí sterilní vodní lázeň, má být předplněná stříkačka vyňata ze sáčků ještě předtím, než ji vložíte do sterilní vodní lázně.
Přeneste píst injekční stříkačky a vnitřní obal do sterilního pole, vyjměte předplněnou injekční stříkačku z vnitřního obalu a umístěte ji přímo do sterilní vodní lázně. Ujistěte se, že obsah předplněné injekční stříkačky je zcela ponořen pod vodou.
Tabulka 1: Minimální časy rozmrazování a zahřívání pomocí sterilní vodní lázně
Velikost balení
Minimální časy rozmrazování
a zahřívání 33 °C – 37 °C, sterilní vodní lázeň
Přípravek vyjmutý ze sáčků
| PRIMA | AST | DSS | |
| 2 ml | 5 minut | 5 minut | 8 minut |
| 4 ml | 5 minut | 5 minut | 9 minut |
| 10 ml | 10 minut | 12 minut | 13 minut |
-
2) Rozmrazování/zahřívání v nesterilní vodní lázni
Ponechte předplněnou injekční stříkačku v obou obalech a umístěte ji na příslušnou dobu do vodní lázně mimo sterilní pole (viz tabulka 2). Zajistěte, aby obaly zůstaly po celou dobu rozmrazování ponořené. Po rozmrazení vyjměte z vodní lázně, osušte vnější obal a přeneste vnitřní obal s předplněnou injekční stříkačkou do sterilního pole.
Tabulka 2: Minimální časy rozmrazování a zahřívání pomocí nesterilní vodní lázně
| Velikost balení | Minimální časy rozmrazování a zahřívání 33 °C – 37 °C, nesterilní vodní lázeň | ||
| Přípravek v sáčcích | |||
| PRIMA | AST | DSS | |
| 2 ml | 15 minut | 30 minut | 31 minut |
| 4 ml | 20 minut | 40 minut | 46 minut |
| 10 ml | 35 minut | 80 minut | 64 minut |
-
3) Rozmrazování/zahřívání v inkubátoru:
Ponechte předplněnou injekční stříkačku v obou obalech a umístěte ji na příslušnou dobu do inkubátoru mimo sterilní pole (viz tabulka 3). Po rozmrazení/zahřátí vyjměte z inkubátoru, sejměte vnější obal a přeneste vnitřní obal s předplněnou injekční stříkačkou do sterilního pole.
Tabulka 3: Minimální časy rozmrazování a zahřívání v inkubátoru
| Velikost balení | Minimální časy rozmrazování a zahřívání 33 °C – 37 °C, inkubátor | ||
| Přípravek v sáčcích | |||
| PRIMA | AST | DSS | |
| 2 ml | 40 minut | 40 minut | 62 minut |
| 4 ml | 50 minut | 85 minut | 77 minut |
| 10 ml | 90 minut | 105 minut | 114 minut |
-
4) Rozmrazování při pokojové teplotě (nepřesahující 25 °C) PŘED zahříváním:
Ponechte předplněnou injekční stříkačku v obou obalech a rozmrazujte ji při pokojové teplotě po příslušnou dobu mimo sterilní pole (viz tabulka 4). Po rozmrazení ji ve vnějším obalu zahřejte v inkubátoru, aby byl přípravek připraven k použití.
Tabulka 4: Minimální časy rozmrazování při pokojové teplotě mimo sterilní pole a časy následného zahřívání v inkubátoru na teplotu 33 °C až 37 °C
| Velikos t balení | Minimální časy rozmrazování přípravku při pokojové teplotě (do 25 °C) následované dodatečným zahříváním před použitím v inkubátoru při teplotě 33 °C- 37 °C Přípravek v sáčcích | ||||||
| PRIMA | AST | DSS | |||||
| Časy rozmrazová ní při pokojové teplotě (do 25 °C) | Zahřívání v inkubátor u při teplotě (33 °C- 37 °C) | Časy rozmrazová ní při pokojové teplotě (do 25 °C) | Zahřívání v inkubátor u při teplotě (33 °C- 37 °C) | Časy rozmrazován í při pokojové teplotě (do 25 °C) | Zahřívání v inkubáto ru při teplotě (33 °C –37 °C) | ||
| 2 ml | 80 minut | +11 minut | 60 minut | +15 minut | 82 minut | +28 minut | |
| 4 ml | 90 minut | +13 minut | 110 minut | +25 minut | 117 minut | +30 minut | |
| 10 ml | 160 minut | +25 minut | 160 minut | +35 minut | 167 minut | +44 minut | |
Po rozmrazení při pokojové teplotě musí být přípravek do 72 hodin použit.
Po rozmrazení a zahřátí (rozmrazování při teplotě 33 °C až 37 °C, metody 1, 2 a 3) byla chemická a fyzikální stabilita přípravku prokázána na 12 hodin při 33 °C až 37°C.
Pro přípravek rozmrazený při pokojové teplotě v neporušeném obalu (metoda 4) byla chemická a fyzikální stabilita přípravku prokázána na 72 hodin při teplotě do 25 °C. Těsně před použitím zahřejte na teplotu 33 °C až 37 °C.
Z mikrobiologického hlediska, pokud způsob otevření/rozmrazení vylučuje riziko mikrobiální kontaminace, má být přípravek použit okamžitě po zahřátí na teplotu 33 °C až 37 °C.
Není-li použit okamžitě, použití a podmínky uchovávání jsou v odpovědnosti uživatele.
Po zahájení rozmrazování znovu nezmrazujte ani nevracejte do chladničky.
Pro usnadnění optimálního smísení obou roztoků a tuhnutí tkáňového lepidla je nutné obě složky tkáňového lepidla udržovat při teplotě 33 °C – 37 °C až do jejich použití.
Roztoky lepicího proteinu a thrombinu mají být čiré nebo lehce opalescentní. Nepoužívejte roztoky, které jsou zakalené nebo obsahují usazeniny. Rozmrazené přípravky je třeba před podáním vizuálně zkontrolovat s ohledem na obsah částic a změnu barvy. V případě jakýchkoli změn roztok zlikvidujte.
Rozmrazený roztok lepicího proteinu má být mírně viskózní tekutina. Má-li roztok konzistenci ztuhlého gelu, je nutné předpokládat, že byl denaturován (např. kvůli přerušení chladového řetězce nebo kvůli přehřátí během zahřívání). V takovém případě přípravek TISSEEL NEPOUŽÍVEJTE.
- Vyjměte jednorázovou předplněnou injekční stříkačku z obalu těsně před použitím.
- Přípravek TISSEEL nepoužívejte, dokud není zcela rozmražený a zahřátý (kapalná konzistence).
- Ochranný kryt injekční stříkačky sejměte těsně před podáním.
PRIMA systém: Kryt z injekční stříkačky snáze sejmete, když jím budete střídavě pohybovat vpřed a vzad a poté ochranný kryt z injekční stříkačky stáhnete.
Pro aplikaci připojte dvoukomorovou předplněnou injekční stříkačku s roztokem lepicího proteinu a roztokem thrombinu ke spojovací části a k aplikační kanyle – obojí je součástí dodávaného příslušenství. Společný píst dvoukomorové injekční stříkačky zajišťuje, že je spojovací část plněna stejnými objemy obou složek lepidla před vstupem do aplikační kanyly, kde se míchají a následně aplikují.
Návod k použití pro PRIMA systém:
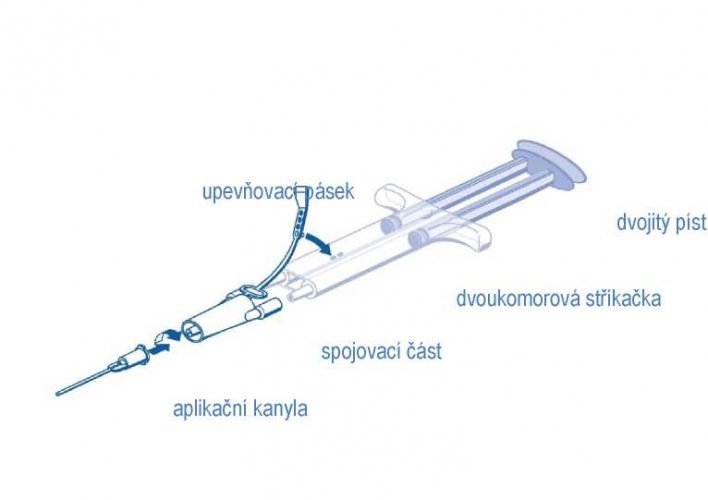
upevňovací-pásek
spojovací část
aplikační kanyla
dvoukomorová stříkačka
dvojitý píst
- Před nasazením jakékoli aplikační pomůcky vytlačte z injekční stříkačky veškerý vzduch.
- Vyrovnejte spojovací část s upevňovacím páskem na té straně injekční stříkačky, kde se nachází otvor pro upevňovací pásek.
- Připojte ústí dvoukomorové injekční stříkačky ke spojovací části a zajistěte jejich pevné připojení.
- Na spojovací část nasaďte aplikační kanylu.
Před aplikací přípravku TISSEEL je třeba standardním způsobem osušit povrch rány (např. aplikací intermitentní komprese, tampóny či použitím sacích zařízení). K vysoušení rány nepoužívejte stlačený vzduch nebo plyn.
- Aplikujte směs roztoku lepicího proteinu a thrombinu na povrch příjemce nebo na povrchy, které chcete spojit, pomalým tlakem na zadní část společného pístu.
- Při chirurgických výkonech, u nichž se používá minimální objem fibrinového lepidla, se doporučuje vytlačit a zlikvidovat prvních několik kapek přípravku.
- Po aplikaci přípravku TISSEEL ponechejte alespoň 2 minuty, aby se dosáhla dostatečná polymerizace.
nebo
Pro aplikaci připojte dvoukomorovou předplněnou injekční stříkačku s roztokem lepicího proteinu a roztokem thrombinu ke spojovací části a k aplikační kanyle – obojí je součástí dodávaného příslušenství. Společný píst dvoukomorové injekční stříkačky, který je rovněž součástí dodávaného příslušenství, zajišťuje, že je spojovací část plněna stejnými objemy obou složek lepidla před vstupem do aplikační kanyly, kde se míchají a následně aplikují.
Návod k použití pro AST systém:
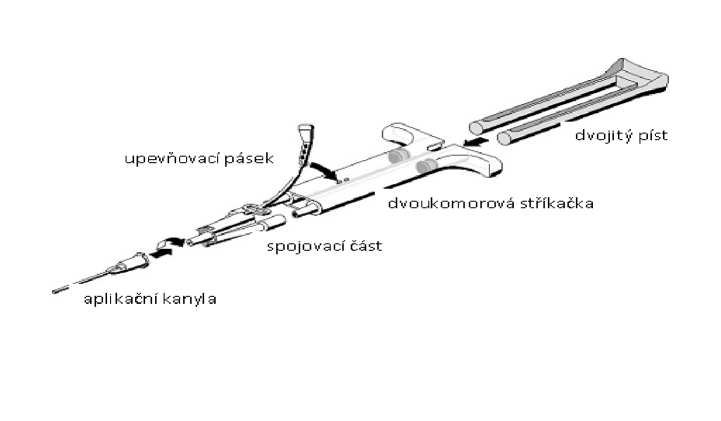
- Před nasazením jakékoli aplikační pomůcky vytlačte z injekční stříkačky veškerý vzduch.
- Vyrovnejte spojovací část s upevňovacím páskem na té straně injekční stříkačky, kde se nachází otvor pro upevňovací pásek.
- Připojte ústí dvoukomorové injekční stříkačky ke spojovací části a zajistěte jejich pevné připojení.
- Na spojovací část nasaďte aplikační kanylu.
Před aplikací přípravku TISSEEL je třeba standardním způsobem osušit povrch rány (např. aplikací intermitentní komprese, tampóny či použitím sacích zařízení). K vysoušení rány nepoužívejte stlačený vzduch nebo plyn.
- Aplikujte směs roztoku lepicího proteinu a thrombinu na povrch příjemce nebo na povrchy, které chcete spojit, pomalým tlakem na zadní část společného pístu.
- Při chirurgických výkonech, u nichž se používá minimální objem fibrinového lepidla, se doporučuje vytlačit a zlikvidovat prvních několik kapek přípravku.
- Po aplikaci přípravku TISSEEL ponechejte alespoň 2 minuty, aby se dosáhla dostatečná polymerizace.
nebo
Pro aplikaci připojte dvě injekční stříkačky s roztokem lepicího proteinu a thrombinu ke spojovací části a kanyle, jak uvedeno v návodu přiloženého zdravotnického prostředku (DUPLOJECT COMBI).
Společný píst držáku pro dvě injekční stříkačky DUPLOJECT zajišťuje, že dojde k naplnění stejných objemů do spojovací části před jejich smísením v aplikační kanyle, kde se míchají a dále aplikují.
Návod k použití pro DSS systém:
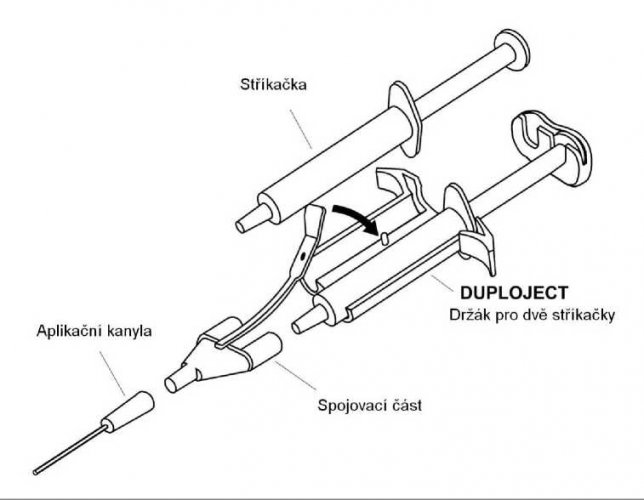
- Před nasazením jakékoli aplikační pomůcky vytlačte z injekční stříkačky veškerý vzduch.
- Vyrovnejte spojovací část s upevňovacím páskem na té straně injekční stříkačky, kde se nachází místo pro připojení upevňovacího pásku.
- Připojte ústí DSS systému ke spojovací části a zajistěte jejich pevné připojení.
- Nasaďte aplikační kanylu na spojovací část.
Před aplikací přípravku TISSEEL je třeba standardním způsobem osušit povrch rány (např. aplikací intermitentní komprese, tampóny či použitím sacích zařízení). K vysoušení rány nepoužívejte stlačený vzduch nebo plyn.
Aplikujte směs roztoku lepicího proteinu a thrombinu na povrch příjemce nebo na povrchy, které chcete spojit, pomalým tlakem na zadní část společného pístu.- Při chirurgických výkonech, u nichž se používá minimální objem fibrinového lepidla, se doporučuje vytlačit a zlikvidovat prvních několik kapek přípravku.
- Po aplikaci přípravku TISSEEL ponechejte alespoň 2 minuty, aby se dosáhla dostatečná polymerizace.
| Poznámka: | Je-li aplikace složek tkáňového lepidla přerušena, může dojít k ucpání kanyly. V takovém případě vyměňte aplikační kanylu za novou těsně před obnovením aplikace. Dojde-li k ucpání otvorů spojovací části, použijte náhradní spojovací část, která je součástí balení. Po smíchání složek lepidla dochází k tuhnutí během sekund v důsledku vysoké koncentrace thrombinu (500 IU/ml). Aplikace je rovněž možná pomocí dalšího příslušenství, které dodává společnost BAXTER a které je zvlášť vhodné např. k endoskopickému použití, při miniinvazivní chirurgii nebo pro aplikaci na rozsáhlé nebo obtížně přístupné oblasti. Při použití těchto aplikačních pomůcek pečlivě dodržujte pokyny pro jejich použití. Při určitých aplikacích se jako nosná substance nebo k posílení účinku používá biokompatibilní materiál, jako např. kolagenová houba. |
Aplikace spreje
Při aplikaci přípravku TISSEEL pomocí sprejovacího zařízení se ujistěte, že používáte tlak a vzdálenost od tkáně v rozmezí doporučovaném výrobcem:
| Doporučovaný | lak, vzdálenost a zařízení k aplikaci spreje přípravku TISSE | EL | |||
| Operace | Vhodná sprejovací souprava | Vhodné hroty aplikátorů | Vhodný regulátor tlaku | Doporučená vzdálenost od cílové tkáně | Doporučený tlak spreje |
| Otevřená rána | Sprejovací souprava Tisseel/Artiss | – | EasySpray | 10–15 cm | 1,5–2,0 bary (21,528,5 psi) |
| Sprejovací souprava Tisseel/Artiss, balení po 10 kusech | – | EasySpray | |||
| Laparoskopické /minimálně invazivní postupy | – | Aplikátor Duplospray MIS 20 cm | Regulátor Duplospray MIS Regulátor Duplospray MIS NIST B11 | 2–5 cm | 1,2–1,5 bar (18–22 psi) |
| Aplikátor Duplospray MIS 30 cm | Regulátor Duplospray MIS | ||||
| Regulátor Duplospray MIS NIST B11 | |||||
| Aplikátor Duplospray MIS 40 cm | Regulátor Duplospray MIS | ||||
| Regulátor Duplospray MIS NIST B11 | |||||
| Vyměnitelný hrot | Regulátor Duplospray MIS | ||||
| Regulátor Duplospray MIS NIST B11 |
Pro aplikaci přípravku TISSEEL do těsného hrudního a břišního prostoru je doporučen DuploSpray MIS aplikátor a regulátor. Prosím postupujte podle instrukcí návodu pro zdravotnický prostředek DuploSpray MIS.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
BAXTER CZECH spol. s r.o., Karla Engliše 3201/6, 150 00 Praha 5, Česká republika
8. REGISTRAČNÍ ČÍSLO
87/791/09-C
Další informace o léčivu TISSEEL
Jak
se TISSEEL
podává: epilezionální podání - roztok pro tkáňové lepidlo
Výdej
léku: na lékařský předpis
Balení: Předplněná injekční stříkačka
Velikost
balení: 1X10ML
Držitel rozhodnutí o registraci daného léku v České republice:
BAXTER CZECH spol. s r.o., Praha
E-mail: magdalena_brunova@baxter.com; dana_sladeckova@baxter.com
Telefon: 225774141, 225774143
