Souhrnné informace o léku - SPASMED 30 MG
1. NÁZEV PŘÍPRAVKU
SPASMED 30 mg
potahované tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna potahovaná tableta obsahuje trospii chloridum 30 mg.
Pomocné látky se známým účinkem: Jedna potahovaná tableta obsahuje 100 mg monohydrátu laktosy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
potahovaná tableta
Bílé nebo téměř bílé, kulaté, bikonvexní, potahované tablety se „SNAP-TAB“ půlicí drážkou na jedné straně usnadňující dělení na dvě poloviny. Tabletu lze rozdělit na stejné dávky.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Symptomatická léčba zvýšené frekvence močení a/nebo urgence močení a/nebo urgentní inkontinence u pacientů se syndromem hyperaktivního močového měchýře nebo s urodynamicky ověřenou idiopatickou nebo neurogenní hyperaktivitou detruzoru.
4.2 Dávkování a způsob podání
Dávkování
Doporučená denní dávka je 45 mg trospium chloridu.
Po zvážení individuální účinnosti a snášenlivosti může být denní dávka snížena na 30 mg nebo zvýšena na 90 mg po 4 týdnech léčby.
V následující tabulce je uvedeno doporučené denní dávkování:
| Celková denní dávka | Dávkování během dne | Jednotlivá dávka |
| 45 mg | 3× denně 4 potahované tablety Spasmed 30 mg nebo 1 potahovaná tableta Spasmed 30 mg ráno a 4 potahované tablety Spasmed 30 mg večer | 15 mg trospium chloridu 30 mg trospium chloridu 15 mg trospium chloridu |
| 90 mg | 3× denně 1 potahovaná tableta Spasmed 30 mg | 30 mg trospium chloridu |
| 30 mg | 2× denně 4 potahované tablety Spasmed 30 mg | 15 mg trospium chloridu |
U pacientů s těžkým poškozením ledvin (clearance kreatininu 10–30 ml/min/1,73 m2) je doporučená dávka 15 mg trospium chloridu 1–2× denně nebo 1–2× každý druhý den. Jednotlivé dávky by měly být stanoveny po zvážení individuální účinnosti a snášenlivosti.
Pediatrická populace
Spasmed 30 mg není určen k léčbě dětí do 12 let. Po pečlivém zvážení účinnosti a snášenlivosti může být v zásadě stanoveno individuální dávkování. V závislosti na věku a tělesné hmotnosti lze považovat za vhodnou počáteční denní dávku 15 mg (2×7,5 mg) nebo 30 mg (2×15 mg) trospium chloridu. V případě denní dávky 15 mg (2×7,5 mg) se doporučuje předepsat přípravek Spasmed 15.
Způsob podání
Jak je znázorněno na obrázku, tablety mohou být rozděleny na dvě části. Chcete-li to provést, umístěte tabletu na tvrdý povrch a palcem zatlačte na půlicí drážku (působením krátkého, silného tlaku), aby se tableta rozdělila na dvě stejně velké části.
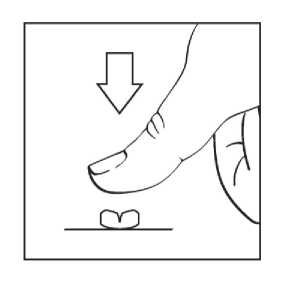
Tablety se polykají celé spolu s jídlem a zapíjejí se sklenicí vody. Nutnost pokračování léčby by měla být přehodnocována v pravidelných intervalech každých 3–6 měsíců.
4.3 Kontraindikace
Spasmed nesmí užívat pacienti s
-
– hypersenzitivitou na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1,
-
– retencí moče,
-
– glaukomem s úzkým úhlem,
-
– tachyarytmií,
-
– myastenií gravis,
-
– závažným chronickým zánětlivým onemocněním střev (ulcerózní kolitida nebo Crohnova nemoc),
-
– toxickým megakolon,
-
– poškozením ledvin vyžadujícím dialýzu (clearance kreatininu < 10 ml/min/1,73 m2).
4.4 Zvláštní upozornění a opatření pro použití
Zvláštní opatrnosti při léčbě trospium chloridem je třeba u pacientů s
-
– obstrukcí gastrointestinálního traktu (např. pylorostenóza),
-
– obstrukcí močového průtoku s rizikem vzniku retence moče,
-
– autonomní neuropatií,
-
– hiátovou hernií a refluxní ezofagitidou,
-
– a u pacientů, kde rychlá srdeční frekvence není žádoucí (např. hypertyreóza, ischemická choroba srdeční, srdeční nedostatečnost).
Použití trospium chloridu se nedoporučuje u pacientů s těžkou poruchou funkce jater, protože nejsou k dispozici data.
Trospium chlorid je vylučován převážně ledvinami. U pacientů s těžkou poruchou funkce ledvin bylo pozorováno signifikantní zvýšení plazmatické hladiny. Proto by léčba u těchto skupin pacientů, i když je funkce ledvin poškozena jen mírně až středně, měla být zahajována s opatrností.
Před zahájením léčby je nutné vyloučit organické příčiny pollakisurie a urgence, jako jsou například choroby srdce nebo ledvin, polydipsie, nebo záněty a nádory močových cest.
Pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, vrozeným nedostatkem laktázy nebo malabsorpcí glukózy a galaktózy by tento přípravek neměli užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Mohou se objevit tyto interakce:
-
– zesílení anticholinergního účinku amantadinu, tricyklických antidepresiv, chinidinu, antihistaminik a disopyramidu,
-
– zesílení tachykardizujícího účinku betasympatomimetik,
-
– snížení účinku prokinetik (např. metoklopramid a cisaprid).
Při současném užívání přípravku s léčivy, jako guar, cholestyramin a cholestipol, nelze vyloučit snížení absorpce trospium chloridu. Proto se současné podávání s těmito léčivy nedoporučuje.
Metabolické interakce trospium chloridu s enzymy cytochromu P450, které se podílejí na metabolismu léčivé látky (P450 1A2, 2A6, 2C9, 2C19, 2D6, 2E1, 3A4), byly zkoumány in vitro. Vliv trospium chloridu na metabolismus nebyl zaznamenán. Vzhledem k tomu, že trospium chlorid je metabolizován pouze v malé míře a relevantní je pouze esterová hydrolýza, žádné metabolické interakce se neočekávají. Navíc ani klinické studie, ani farmakovigilance nepřinesly údaje, které by prokázaly klinicky významné interakce.
4.6 Fertilita, těhotenství a kojení
Těhotenství
Nejsou k dispozici žádné studie týkající se použití Spasmedu u těhotných žen. Studie na zvířatech neukazují na reprodukční toxicitu (viz bod 5.3). Nicméně jsou doporučena preventivní opatření před použitím Spasmedu v průběhu těhotenství.
Kojení
Nejsou k dispozici žádné studie, pokud jde o vylučování trospium chloridu do mateřského mléka. U potkanů bylo zjištěno, že je v omezeném množství vylučován do mateřského mléka. Při rozhodování, zda pokračovat/ukončit kojení nebo pokračovat/ukončit léčbu Spasmedem, musí být zváženy výhody kojení, stejně jako potenciální přínos Spasmedu.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Vzhledem k poruchám akomodace může být narušena schopnost řídit a obsluhovat stroje.
4.8 Nežádoucí účinky
Nežádoucí účinky byly rozděleny podle četnosti výskytu za použití následující konvence:
Velmi časté (> 1/10); časté (> 1/100 až < 1/10); méně časté (> 1/1000 až < 1/100); vzácné (> 1/10 000 až < 1/1000); velmi vzácné (< 1/10 000), není známo (z dostupných údajů nelze určit).
Během léčby přípravkem Spasmed se mohou objevit anticholinergní účinky jako sucho v ústech, dyspepsie nebo zácpa.
Poruchy imunitního systému
Vzácné: anafylaxe
Není známo: Stevens-Johnsonův syndrom (SJS), toxická epidermální nekrolýza (TEN)
Poruchy oka
Méně časté: poruchy akomodace (zvláště u dalekozrakých a nedostatečně korigovaných pacientů)
Srdeční poruchy
Méně časté: tachykardie
Vzácné: tachyarytmie
Respirační, hrudní a mediastinální poruchy
Méně časté: dyspnoe
Gastrointestinální poruchy
Časté: sucho v ústech, dyspepsie, zácpa, bolest žaludku a nauzea
Méně časté: diarea, flatulence
Poruchy kůže a podkožní tkáně
Méně časté: kožní vyrážka
Vzácné: angioedém
Poruchy ledvin a močových cest
Méně časté: poruchy močení (např. reziduální moč)
Vzácné: retence moče
Celkové poruchy a reakce v místě aplikace
Méně časté: slabost nebo bolest na hrudi.
Vyšetření
Vzácné: mírné až střední zvýšení transamináz
Komplikace spojené s léčbou
Velmi vzácné: bolest hlavy, závrať
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10;
webové stránky:
4.9 Předávkování
Maximální jednotlivá dávka trospium chloridu podaná perorálně lidem byla 360 mg. Byly pozorovány sucho v ústech, tachykardie a poruchy mikce. Až dosud nebyly popsány žádné příznaky závažného předávkování nebo intoxikace.
Jako projev předávkování lze očekávat zesílené anticholinergní účinky, jako jsou poruchy zraku, tachykardie, sucho v ústech a zčervenání kůže.
V případě intoxikace by měla být přijata následující opatření:
-
– výplach žaludku a snížení vstřebávání (např. aktivní uhlí)
-
– lokální aplikace pilokarpinu u pacientů s glaukomem
-
– katetrizace močového měchýře v případě retence moče
-
– u závažných příznaků je doporučeno použít parasympatomimetikum (např. neostigmin)
-
– podání betablokátorů při nedostatečné odpovědi, manifestní tachykardii a/nebo oběhovém selhání (např. 1 mg propranololu i.v. za monitorování EKG a krevního tlaku).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: spasmolytikum, urologikum
ATC kód: G04BD09
Trospium chlorid je kvarterní amoniový derivát nortropanu a patří do skupiny parasympatolytik resp. anticholinergik. V závislosti na koncentraci kompetuje o postsynaptická vazebná místa s acetylcholinem, postsynaptickým endogenním transmiterem. Má vysokou afinitu k M1– a M3-receptorům, nízkou afinitu k M2-receptorům a nepatrnou afinitu k nikotinovým receptorům.
Antimuskarinové vlastnosti trospium chloridu se projevují relaxací hladké svaloviny a funkcí orgánů zprostředkovanou muskarinovými receptory.
Trospium chlorid tlumí kontraktilitu hladkého svalstva gastrointestinálního a urogenitálního traktu. Snižuje sekreci bronchiálního sekretu, slin, potu a inhibuje akomodaci. Ovlivnění centrálního nervstva nebylo dosud zaznamenáno.
5.2 Farmakokinetické vlastnosti
Maximální plazmatické hladiny je dosaženo za 4–6 hodin po perorálním podání. Poločas eliminace je velmi variabilní a pohybuje se v rozpětí 5–18 hodin po perorálním podání. K akumulaci nedochází. Vazba na plasmatické bílkoviny činí 50–80 %. Po podání jednotlivé dávky v rozmezí 20–60 mg je plazmatická hladina přímo úměrná podané dávce. Většina systémově dostupného trospium chloridu je vylučována v nezměněné formě renální exkrecí. Malá část (asi 10 %) se vylučuje jako spiroalkohol, metabolit vznikající esterhydrolýzou.
Farmakokinetická data neodhalila žádné významné rozdíly u starších pacientů nebo mezi pohlavími.
Současný příjem potravy vede ke snížení biologické dostupnosti, ale také k více homogenním plazmatickým hladinám. S vědomím, že byla prokázána ekvivalence účinnosti trospium chloridu s prodlouženým uvolňováním v porovnání s oxybutyninem, aniž by bylo předepsáno podání nalačno, není třeba užívat Spasmed potahované tablety nalačno.
Trospium chlorid vykazuje diurnální variabilitu se snížením hodnot Cmax a AUC v době oběda a večer v závislosti na ranní dávce.
Ve studii zahrnující pacienty s těžkým poškozením ledvin (clearance kreatininu 8–32 ml/min) byla průměrná hodnota AUC 4krát a Cmax 2krát vyšší. Průměrný poločas byl dvojnásobný ve srovnání se zdravými osobami. Studie zahrnující pacienty s mírným poškozením ledvin nejsou známy.
5.3 Předklinické údaje vztahující se k bezpečnosti
Toxikologické vlastnosti
-
a) Mutagenní a karcinogenní potenciál
Trospium chlorid nevykazoval mutagenní aktivitu v in vitro a in vivo testech. Dlouhodobé studie na potkanech a myších neprokázaly karcinogenní potenciál.
-
b) Reprodukční toxicita
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Jádro tablety:
Monohydrát laktosy
Mikrokrystalická celulosa
Kukuřičný škrob
Sodná sůl karboxymethylškrobu (typ A)
Kyselina stearová
Povidon 25
Koloidní bezvodý oxid křemičitý
Potahová vrstva tablety (potahová soustava Sepifilm LP 770 bílá):
Hypromelosa
Oxid titaničitý (E171)
Mikrokrystalická celulosa
Kyselina stearová
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
5 let
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.5 Druh obalu a velikost balení
PVC/Al blistr, krabička.
Velikost balení: 30 nebo 50 potahovaných tablet.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
PRO.MED.CS Praha a.s., Telčská 377/1, Michle, 140 00 Praha 4, Česká republika
8. REGISTRAČNÍ ČÍSLO(A)
73/666/09-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 30.9.2009
Datum posledního prodloužení registrace: 30.4.2014
Další informace o léčivu SPASMED 30 MG
Jak
se SPASMED 30 MG
podává: perorální podání - potahovaná tableta
Výdej
léku: na lékařský předpis
Balení: Blistr
Velikost
balení: 50
Držitel rozhodnutí o registraci daného léku v České republice:
PRO.MED.CS Praha a.s., Praha
E-mail: vpois@promedcs.com
Telefon: +420 497 771 704, +420 241 013 111
