Souhrnné informace o léku - PEMETREXED MYLAN PHARMA
1. NÁZEV PŘÍPRAVKU
Pemetrexed Mylan Pharma 500 mg prášek pro koncentrát pro infuzní roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna injekční lahvička obsahuje pemetrexedum 500 mg (jako pemetrexedum dinatricum dihemihydricum).
Po rekonstituci (viz bod 6.6) obsahuje jedna lahvička pemetrexedum 25mg/ml.
Pomocné látky se známým účinkem:
Jedna lahvička obsahuje přibližně 54 mg sodíku (2,35 mmol).
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek pro koncentrát pro infuzní roztok.
Bílý až lehce nažloutlý nebo zelenožlutý lyofilizovaný prášek.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Maligní mezoteliom pleury
Přípravek Pemetrexed Mylan Pharma je v kombinaci s cisplatinou indikován k léčbě pacientů bez předchozí chemoterapie s neresekovatelným maligním mezoteliomem pleury.
Nemalobuněčný karcinom plic
Přípravek Pemetrexed Mylan Pharma je v kombinaci s cisplatinou indikován v první linii k léčbě pacientů s lokálně pokročilým nebo metastazujícím nemalobuněčným karcinomem plic jiného histologického typu, než predominantně z dlaždicových buněk (viz bod 5.1).
Přípravek Pemetrexed Mylan Pharma je indikován jako monoterapie k udržovací léčbě lokálně pokročilého nebo metastazujícího nemalobuněčného karcinomu plic jiného histologického typu, než predominantně z dlaždicových buněk u pacientů, u kterých po chemoterapii založené na platině nedošlo k bezprostřední progresi onemocnění. (viz bod 5.1).
Přípravek Pemetrexed Mylan Pharma je indikován ve druhé linii jako monoterapie k léčbě pacientů s lokálně pokročilým nebo metastazujícím nemalobuněčným karcinomem plic jiného histologického typu, než predominantně z dlaždicových buněk (viz bod 5.1).
4.2 Dávkování a způsob podání
Dávkování:
Pemetrexed Mylan Pharma se smí podávat pouze pod dohledem lékaře s kvalifikací pro používání protinádorové chemoterapie.
Pemetrexed Mylan Pharma v kombinaci s cisplatinou
Doporučená dávka přípravku Pemetrexed Mylan Pharma je 500 mg/m2 tělesného povrchu (body surface area – BSA) podávaná jako intravenózní infuze po dobu 10 minut první den každého 21denního cyklu. Doporučená dávka cisplatiny je 75 mg/m2 BSA, podaná infuzí během dvou hodin přibližně 30 minut po ukončení infuze pemetrexedu v první den každého 21denního cyklu. Pacienti musejí dostávat přiměřenou antiemetickou terapii a hydrataci před podáním cisplatiny, případně i po jejím podání, (informace o dávkování cisplatiny – viz rovněž souhrn údajů o přípravku pro přípravky s obsahem cisplatiny).
Pemetrexed Mylan Pharma v monoterapii
U pacientů léčených pro nemalobuněčný karcinom plic po předchozí chemoterapii je doporučená dávka přípravku Pemetrexed Mylan Pharma 500 mg/m2 BSA podávaná jako intravenózní infuze po dobu 10 minut v první den každého 21denního cyklu.
Režim premedikace
Ke snížení výskytu a závažnosti kožních reakcí se podá kortikosteroid den před podáním pemetrexedu, v den jeho podání a v den po jeho podání. Kortikoid má být ekvivalentní 4 mg dexamethasonu podávanému perorálně 2× denně (viz bod 4.4).
Ke snížení toxicity musí pacienti léčení pemetrexedem dostávat rovněž vitaminovou suplementaci (viz bod 4.4). Pacienti musí denně užívat kyselinu listovou perorálně nebo multivitaminy s obsahem kyseliny listové (350 – 1 000 mikrogramů). Během sedmi dnů před první dávkou pemetrexedu se musí podat nejméně pět dávek kyseliny listové a její podávání musí pokračovat po celý průběh léčby a po dobu 21 dní po poslední dávce pemetrexedu. Pacienti musejí rovněž dostat intramuskulární injekci vitaminu B12 (1000 mikrogramů) v týdnu před první dávkou pemetrexedu a poté jednou za každé tři cykly poté. Další injekce vitaminu B12 se mohou podávat ve stejný den jako pemetrexed.
Monitorování
Pacienti používající pemetrexed musejí mít před každou dávkou monitorovaný celý krevní obraz, včetně diferenciálního počtu leukocytů a počtu trombocytů. Před každým podáním chemoterapie musí být provedeno biochemické vyšetření krve za účelem vyhodnocení funkce ledvin a jater. Před zahájením každého cyklu chemoterapie je nutné, aby pacienti měli následující výsledky vyšetření: absolutní počet neutrofilů musí být > 1500 buněk/mm3 a počet trombocytů musí být > 100 000 buněk/mm3. Clearance kreatininu musí být > 45 ml/min. Celkový bilirubin musí být < 1,5násobek horní hranice normálních hodnot. Alkalická fosfatáza (ALP), aspartátaminotransferáza (AST neboli SGOT) a alaninaminotransferáza (ALT neboli SGPT) musejí být < 3násobek horní hranice normálních hodnot. V případě postižení jater tumorem jsou akceptovatelné hodnoty alkalické fosfatázy, AST a ALT < 5násobek horní hranice normálních hodnot.
Úprava dávek
Úprava dávky při zahájení následného cyklu se provede na základě krevního obrazu v době nejhlubšího poklesu nebo na základě maximální nehematologické toxicity zjištěné v předchozím cyklu terapie. Léčbu lze odložit, aby byl dostatek času k úpravě. Po úpravě se pacienti léčí podle pokynů uvedených v tabulce 1, 2 a 3, které se použijí v případě podávání přípravku Pemetrexed Mylan Pharma v monoterapii nebo v kombinaci s cisplatinou.
| Tabulka 1 – Úpravy dávek pro přípravek Pemetrexed Mylan Pharma (v monoterapii nebo v kombinaci) a cisplatinu – hematologické toxicity | |
| Absolutní počet neutrofilů v době nejhlubšího | 75 % předchozí dávky (přípravku Pemetrexed |
| poklesu < 500 /mm3 a trombocytů v době nejhlubšího poklesu >50 000 /mm3. | Mylan Pharma i cisplatiny) |
| Počet trombocytů v době nejhlubšího poklesu < 50 000 /mm3 bez ohledu na absolutní počet neutrofilů v době nejhlubšího poklesu. | 75 % předchozí dávky (přípravku Pemetrexed Mylan Pharma i cisplatiny) |
| Počet trombocytů v době nejhlubšího poklesu < 50 000 /mm3 s krváceníma bez ohledu na absolutní počet neutrofilů v době nejhlubšího poklesu. | 50 % předchozí dávky (přípravku Pemetrexed Mylan Pharma i cisplatiny) |
Pokud u pacientů dojde k rozvoji nehematologické toxicity > 3. stupně (s výjimkou neurotoxicity), musí se Pemetrexed Mylan Pharma vysadit až do úpravy na hodnoty nižší nebo stejné, jako byly hodnoty před léčbou. Léčba se zahájí podle směrnic uvedených v tabulce 2.
| Tabulka 2 – Úprava dávek pro přípravek Pemetrexed Mylan Pharma (v monoterapii nebo v kombinaci) a cisplatinu – nehematologické toxicitya,b | ||
| Dávka přípravku Pemetrexed Mylan Pharma (mg/m2) | Dávka cisplatiny (mg/m2) | |
| Jakákoliv txicita stupně 3 nebo 4 s výjimkou mukozitidy | 75 % předchozí dávky | 75 % předchozí dávky |
| Jakýkoli průjem s nutností hospitalizace (bez ohledu na stupeň) nebo průjem stupně 3 nebo 4 | 75 % předchozí dávky | 75 % předchozí dávky |
| Mukozitida stupně 3 nebo 4 | 50 % předchozí dávky | 100 % předchozí dávky |
| a Obecná kritéria toxicity podle National Cancer Institute (CTC v2.0; N C | 1998) | |
b S výjimkou neurotoxicity
V případě neurotoxicity je doporučená úprava dávky pro přípravek Pemetrexed Mylan Pharma a cisplatinu uvedena v tabulce 3. Pokud se vyskytnou projevy neurotoxicity stupně 3 nebo 4, musejí pacienti léčbu přerušit.
| Tabulka 3 – Tabulka úpravy dávek pro přípravek Pemetrexed Mylan Pharma (v monoterapii nebo v kombinaci) a cisplatinu – neurotoxicita | ||
| Stupeň toxicity a | Dávka přípravku Pemetrexed Mylan Pharma (mg/ m2) | Dávka cisplatiny (mg/m2) |
| 0 – 1 | 100 % předchozí dávky | 100 % předchozí dávky |
| 2 | 100 % předchozí dávky | 50 % předchozí dávky |
a Obecná kritéria toxicity podle National Cancer Institute (CTC v2.0, NCI 1998)
Léčba přípravkem Pemetrexed Mylan Pharma musí být přerušena, pokud se u pacienta vyskytnou jakékoli projevy hematologické nebo nehematologické toxicity stupně 3 nebo 4 po 2 sníženích dávky nebo ihned, pokud se vyskytnou projevy neurotoxicity stupně 3 nebo 4.
Starší pacienti: V klinických studiích nebyly žádné známky, že by pacienti ve věku 65 let nebo starší měli zvýšené riziko nežádoucích účinků v porovnání s pacienty mladšími 65 let. Není nutné žádné snížení dávky, kromě případů, kdy je toto snížení nezbytné pro všechny pacienty.
Pediatrická populace
Použití přípravku Pemetrexed Mylan Pharma u maligního mezoteliomu pleury a nemalobuněčného karcinomu plic není u pediatrické populace relevantní.
Porucha funkce ledvin: (standardní Cockroftův a Gaultův vzorec nebo rychlost glomerulární filtrace měřená metodou clearance Tc99m-DPTA v séru): pemetrexed se primárně vylučuje v nezměněné formě ledvinami. V klinických studiích nebyla u pacientů s clearance kreatininu > 45 ml/min zapotřebí žádná úprava dávky, kromě úprav doporučovaných pro všechny pacienty. Údaje o použití pemetrexedu u pacientů s clearance kreatininu pod 45 ml/min jsou nedostatečné, a proto se u těchto pacientů používání pemetrexedu nedoporučuje (viz bod 4.4).
Porucha funkce jater: Nebyl zjištěn žádný vztah mezi AST (SGOT), ALT (SGPT) nebo celkovým bilirubinem a farmakokinetikou pemetrexedu. Nicméně, pacienti s poruchou funkce jater a bilirubinem > 1,5 x vyšším, než je horní hranice normální hodnoty a/nebo aminotransferázami> 3,0 x vyššími, než je horní hranice normálních hodnot (při chybění metastáz do jater) nebo > 5,0 x vyššími, než je horní hranice normálních hodnot (při přítomnosti metastáz do jater), nebyli specificky studováni.
Způsob podání:
Opatření, která je nutno učinit před zacházením s léčivým přípravkem Pemetrexed Mylan Pharma nebo před jeho podáním naleznete v bodě 6.6.
Pemetrexed Mylan Pharma má být podávána jako intravenózní infuze po dobu 10 minut první den každého 21denního cyklu. Pokyny pro rekonstituci a naředění přípravku Pemetrexed Mylan Pharma před podáním naleznete v bodě 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Kojení (viz bod 4.6).
Současné podávání vakcíny proti žluté zimnici (viz bod 4.5).
4.4 Zvláštní upozornění a opatření pro použití
Pemetrexed může potlačit funkci kostní dřeně, která se manifestuje jako neutropenie, trombocytopenie a anémie (nebo pancytopenie) (viz bod 4.8). Útlum kostní dřeně představuje obvykle toxicitu, která limituje velikost použité dávky. Pacienti musejí být během léčby sledováni z hlediska myelosuprese a pemetrexed se nesmí podat do doby, než se absolutní počet neutrofilů nevrátí na hodnoty > 1500 buněk/mm3 a počet trombocytů se nevrátí na hodnoty > 100 000 buněk/mm3. Úprava dávek v následujících cyklech je dána hodnotami absolutního počtu neutrofilů v době nejhlubšího poklesu, počtu trombocytů a maximální nehematologickou toxicitu pozorovanou v předchozím cyklu (viz bod 4.2).
Pokud byla před léčbou podávána kyselina listová a vitamin B12, byla hlášena menší toxicita a snížení hematologické a nehematologické toxicity stupně 3 nebo 4, jako je neutropenie, febrilní neutropenie a infekce s neutropenií stupně 3 nebo 4. Proto musejí být všichni pacienti léčení pemetrexedem poučeni, aby užívali kyselinu listovou a vitamin B12 jako profylaktické opatření ke snížení toxicity související s léčbou (viz bod 4.2).
U pacientů, kteří nedostávali před léčbou kortikosteroid, byly popsány kožní reakce. Podávání dexamethasonu (nebo ekvivalentního kortikosteroidu) před léčbou pemetrexedem může snížit výskyt a závažnost kožních reakcí (viz bod 4.2).
Nebyl studován dostatečný počet pacientů s clearance kreatininu pod 45 ml/min. Proto se nedoporučuje používání pemetrexedu u pacientů s clearance kreatininu < 45 ml/min. (viz bod 4.2).
Pacienti s lehkou až středně těžkou renální insuficiencí (clearence kreatininu 45–79 ml/min) by se měli vyvarovat užívání nesteroidních protizánětlivých léků (NSAID) jako je ibuprofen a kyselina acetylsalicylová (> 1,3 g denně) dva dny před podáním pemetrexedu, v den jeho podání a dva dny po podání pemetrexedu (viz bod 4.5). U pacientů s lehkou až středně těžkou renální insuficiencí, u kterých je terapie pemetrexedem vhodná, má být prerušeno užívání NSAID s dlouhým eliminačním poločasem nejméně pět dnů před podáním pemetrexedu, v den jeho podání a nejméně dva dny po podání pemetrexedu (viz bod 4.5).
-
V souvislosti s podáváním pemetrexedu samotného nebo v kombinaci s jinými chemoterapeutiky byly hlášeny závažné renální příhody, včetně akutního selhání ledvin. U mnoha pacientů, u kterých k renálním příhodám došlo, existovaly rizikové faktory pro rozvoj těchto příhod, včetně dehydratace, preexistující hypertenze nebo diabetu. Po uvedení přípravku na trh byly při podávání pemetrexedu samostatně nebo společně s jinými chemoterapeutickými přípravky hlášeny také nefrogenní diabetes insipidus a renální tubulární nekróza. Většina těchto příhod odezněla po vysazení pemetrexedu. Pacienty je třeba pravidelně kontrolovat s ohledem na možnou tubulární nekrózu, pokles renálních funkcí a známky a příznaky nefrogenního diabetu insipidu (např. hypernatremii).
-
V důsledku gastrointestinální toxicity pemetrexedu podávaného v kombinaci s cisplatinou byly popsány případy vážné dehydratace. Proto mají pacienti dostávat přiměřenou antiemetickou terapii a odpovídající hydrataci před podáním a případně i po podání medikace.
-
V průběhu klinických studií s pemetrexedem byly méně často hlášeny závažné kardiovaskulární příhody, zahrnující infarkt myokardu a cerebrovaskulární příhody obvykle, když byl pemetrexed podáván v kombinaci s dalšími cytostatiky. Většina pacientů, u kterých byly tyto příhody pozorovány, měla preexistující kardiovaskulární rizikové faktory (viz bod 4.8).
Pokles imunity je častým jevem u pacientů s onkologickým onemocněním. Proto současné používání živých oslabených vakcín není doporučeno (viz bod 4.3 a 4.5).
Pemetrexed může mít geneticky škodlivé účinky. Pohlavně zralým mužům se doporučuje, aby během léčby a až 6 měsíců po jejím ukončení nepočali dítě. Doporučuje se používání antikoncepčních metod nebo abstinence. Vzhledem k možnosti, že by pemetrexed způsobil ireverzibilní neplodnost, se mužům doporučuje, aby před zahájením léčby vyhledali konzultaci o možnosti uchování spermií.
Ženy v plodném věku musejí během léčby pemetrexedem používat účinnou antikoncepční metodu (viz bod 4.6).
U pacientů léčených ozařováním před léčbou, v průběhu nebo následovně po léčbě pemetrexedem byly hlášeny případy postradiační pneumonitidy. Těmto pacientům má být věnována zvýšená pozornost a opatrnost je také zapotřebí při použití dalších radiosenzibilizujících látek.
Byly hlášeny případy kožní reakce v místě předchozího ozařování (radiation recall) u pacientů ozařovaných před delší dobou – před týdny až roky.
Tento přípravek obsahuje přibližně 2,3 mmol sodíku (přibližně 54 mg) v jedné injekční lahvičce. Nutno vzít v úvahu u pacientů na dietě s nízkým obsahem sodíku.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Pemetrexed se vylučuje hlavně ledvinami v nezměněné formě, a to tubulární sekrecí a v menším rozsahu glomerulární filtrací. Souběžné podávání nefrotoxických léků (např. aminoglykosidy, kličková diuretika, sloučeniny platiny, cyklosporin) může vést k opožděné clearance pemetrexedu. Tato kombinace se musí používat s opatrností. Pokud je to nutné, má být pečlivě monitorována clearance kreatininu.
Souběžné podávání látek, které se rovněž vylučují tubulární sekrecí (např. probenecid, penicilin), může vést k opožděné clearance pemetrexedu. Při kombinaci těchto látek je zapotřebí zvýšené opatrnosti. Pokud je to nutné, má být pečlivě monitorována clearance kreatininu.
U pacientů s normální renální funkcí (clearance kreatininu > 80 ml/min) mohou vysoké dávky nesteroidních protizánětlivých léků (NSAID, jako je ibuprofen > 1600 mg denně) a vysoké dávky kyseliny acetylsalicylové (>1,3 g denně) snížit eliminaci pemetrexedu a tím zvýšit výskyt nežádoucích účinků. Proto je zapotřebí při současném podávání vyšších dávek NSAID nebo kyseliny acetylsalicylové společně s pemetrexedem u pacientů s normální renální funkcí (clearence kreatininu > 80 ml/min) zvýšené opatrnosti.
Pacienti s lehkou až středně těžkou renální insuficiencí (clearence kreatininu od 45 do 79 ml/min) se mají vyvarovat současného používání pemetrexedu s NSAID (např. ibuprofen) nebo s vyššími dávkami kyseliny acetylsalicylové 2 dny před podáním pemetrexedu, v den jeho podání a nejméně 2 dny po podání pemetrexedu (viz bod 4.4).
Jelikož nejsou k dispozici údaje o potenciální interakci mezi pemetrexedem a NSAID s delším poločasem, jako je piroxikam a rofekoxib, je potřebné jejich podávání u pacientů s lehkou až středně těžkou renální insuficiencí přerušit nejméně 5 dní před podáním pemetrexedu, v den jeho podání a nejméně 2 dny po podání pemetrexedu (viz bod 4.4). Pokud je současné podávání NSAID nezbytné, mají být pacienti důkladně monitorováni z hlediska toxicity, zejména myelosuprese a gastrointestinální toxicity.
Pemetrexed prochází omezeným jaterním metabolismem. Výsledky studií in vitro s lidskými jaterními mikrozomy ukázaly, že nelze předpovědět, zda pemetrexed způsobí klinicky významnou inhibici metabolické clearance léků metabolizovaných CYP3A, CYP2D6, CYP2C9 a CYP1A2.
Interakce běžné u všech cytotoxických látek:
Vzhledem ke zvýšenému riziku trombózy u pacientů s maligním onemocněním je časté používání antikoagulační léčby. Vysoká intraindividuální variabilita koagulačního stavu při těchto chorobách a možnost interakce mezi perorálními antikoagulancii a protinádorovou chemoterapií vyžaduje zvýšenou frekvenci monitorování INR (International Normalised Ratio), pokud bylo rozhodnuto léčit pacienta perorálními antikoagulancii.
Kontraindikované souběžné používání: vakcína proti žluté zimnici: riziko fatálního generalizovaného vakcinačního onemocnění (viz bod 4.3).
Nedoporučené současné používání: živé oslabené vakcíny (vyjma žluté zimnice, kdy je současné používání kontraindikováno): riziko systémové reakce s možným fatálním vyústěním. Toto riziko je zvýšeno u osob s již existujícím poklesem imunity způsobeným základním onemocněním. Kde je to možné použijte inaktivované vakcíny (poliomyelitis) (viz bod 4.4).
4.6 Fertilita, těhotenství a kojení
Antikoncepce u mužů a u žen
Ženy v produktivním věku musí v průběhu léčby pemetrexedem používat účinnou antikoncepci.
Pemetrexed může mít geneticky škodlivé účinky. Pohlavně zralým mužům se doporučuje, aby během léčby a až 6 měsíců po jejím ukončení nepočali dítě. Doporučuje se používání antikoncepčních metod nebo abstinence.
Těhotenství
Neexistují údaje o použití pemetrexedu u těhotných žen, avšak je podezření, že pemetrexed tak jako ostatní antimetabolity způsobuje vážné vrozené vady, pokud je podáván v těhotenství. Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3). Pemetrexed se nemá používat v těhotenství, pokud to není jednoznačně nezbytné a po pečlivém zvážení potřeby léčby u matky a rizika pro plod (viz bod 4.4).
Kojení
Není známo, zda se pemetrexed vylučuje do lidského mateřského mléka a nežádoucí účinky u kojeného dítěte nelze vyloučit. Při léčbě pemetrexedem musí být kojení přerušeno (viz bod 4.3).
Fertilita
Vzhledem k možnosti způsobit léčbou pemetrexedem ireverzibilní neplodnost, se mužům doporučuje, aby před zahájením léčby vyhledali konzultaci o možnosti uchování spermií.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit a obsluhovat stroje nebyly provedeny. Bylo však popsáno, že pemetrexed může způsobovat únavu. Pacienti proto mají být upozorněni, aby neřídili nebo neobsluhovali stroje v případě, že se tyto nežádoucí účinky objeví.
4.8 Nežádoucí účinky
Nejčastěji hlášenými nežádoucími účinky v souvislosti s pemetrexedem používaným ať už v monoterapii nebo v kombinaci, jsou útlum kostní dřeně, manifestující se jako anémie, neutropenie, leukopenie, trombocytopenie; a gastrointestinální toxicita, manifestující se jako anorexie, nauzea, zvracení, průjem, zácpa, faryngitida, mukozitida a stomatitida. Další nežádoucí účinky zahrnují renální toxicitu, zvýšení hladin aminotransferáz, alopecii, únavu, dehydrataci, vyrážku, infekci/sepsi a neuropatii. Mezi vzácné nežádoucí účinky patří Stevens-Johnsonův syndrom a toxická epidermální nekrolýza.
-
V tabulce je uvedena frekvence a závažnost nežádoucích účinků, které byly hlášeny u více než 5 % ze 168 pacientů s mezoteliomem, kteří byli randomizováni k léčbě cisplatinou a pemetrexedem a u 163 pacientů s mezoteliomem, kteří byli randomizováni k léčbě cisplatinou v monoterapii. V obou léčebných ramenech byla pacientům, u kterých dosud nebyla prováděna chemoterapie, přidána kyselina listová a vitamin B12.
Nežádoucí účinky
Frekvence nežádoucích účinků je definována následovně: velmi časté ( >1/10); časté ( >1/100 až <1/10); méně časté (>1/1000 až <1/100); vzácné (>1/10000 až <1/1000); velmi vzácné < 1/10000, není známo (z dostupných údajů nelze určit – spontánních hlášení).
Viz obecná kritéria toxicity podle National Cancer Institute, verze 2 pro každý stupeň toxicity s výjimkou termínu „snížení clearance kreatininu“
, který je odvozen z termínu „renální/urogenitální, jiné“.
V souladu s National Cancer Institute CTC (v2.0, NCI 1998), by případy poruchy chuti a alopecie měly být hlášeny pouze jako stupeň 1 nebo 2.
Pro účely této tabulky byla použita hraniční hodnota 5 % pro zařazení všech příhod, kdy hlásící osoba považovala příhodu za možnou souvislost s léčbou pemetrexedem a cisplatinou.
Klinicky relevantní projevy toxicity (dle CTC), které byly hlášeny u > 1 % a < 5 % u pacientů náhodným výběrem přidělených k léčbě cisplatinou a pemetrexedem, jsou: renální selhání, infekce, horečka, febrilní neutropenie, zvýšení AST, ALT a GGT, kopřivka a bolest na hrudi.
Klinicky relevantní projevy toxicity (dle CTC), které byly hlášeny u < 1 % pacientů náhodným výběrem přidělených k léčbě cisplatinou a pemetrexedem, jsou: arytmie a motorická neuropatie.
V tabulce níže je uvedena frekvence a závažnost nežádoucích účinků, které byly hlášeny u více než 5 % z 265 pacientů, kteří byli randomizováni k léčbě pemetrexedem v monoterapii se suplementací kyselinou listovou a vitaminem B12 a u 276 pacientů, kteří byli randomizováni k léčbě docetaxelem v monoterapii. U všech pacientů byla stanovena diagnóza lokálně pokročilého nebo metastazujícího nemalobuněčného karcinomu plic a již byli léčeni chemoterapií.
| Třída orgánových systémů | Frekvence | Nežádoucí účinek | pemetrexed n = 265 | docetaxel n = 276 | ||
| Všechny stupně toxicity (%) | Toxicita stupně 3–4 (%) | Všechny stupně toxicity (%) | Toxicita stupně 3–4 (%) | |||
| Poruchy krve a lymfatického systému | Velmi časté | Neutrofily/ granulocyty – snížení | 10,9 | 5,3 | 45,3 | 40,2 |
| Leukocyty – snížení | 12,1 | 4,2 | 34,1 | 27,2 | ||
| Hemoglobin snížení h | 19,2 | 4,2 | 22,1 | 4,3 | ||
| Časté | Trombocyty – snížení | 8,3 | 1,9 | 1,1 | 0,4 | |
| Gastrointestinální poruchy | Velmi časté | Průjem | 12,8 | 0,4 | 24,3 | 2,5 |
| Zvracení | 16,2 | 1,5 | 12,0 | 1,1 | ||
| Stomatitida/ farvnsitida | 14,7 | 1,1 | 17,4 | 1,1 | ||
| Nauzea | 30,9 | 2,6 | 16,7 | 1,8 | ||
| Anorexie | 21,9 | 1,9 | 23,9 | 2,5 | ||
| Časté | Zácpa | 5,7 | 0,0 | 4,0 | 0,0 | |
| Poruchy jater a žlučových cest | Časté | SGPT (ALT) – zvýšení | 7,9 | 1,9 | 1,4 | 0,0 |
| SGOT (AST) – zvýšení | 6,8 | 1,1 | 0,7 | 0,0 | ||
| Poruchy kůže a podkožní tkáně | Velmi časté | Vyrážka/ deskvamace | 14,0 | 0,0 | 6,2 | 0,0 |
| Časté | Pruritus | 6,8 | 0,4 | 1,8 | 0,0 | |
| Alopecie | 6,4 | 0,4 | 37,7 | 2,2 | ||
| Celkové poruchy a reakce v místě aplikace | Velmi časté | Únava | 34,0 | 5,3 | 35,9 | 5,4 |
| Časté | Horečka | 8,3 | 0,0 | 7,6 | 0,0 | |
* Viz obecná kritéria toxicity podle National Cancer Institute, verze 2 pro každý stupeň toxicity.
V souladu s National Cancer Institute CTC (v2.0, NCI 1998), by případy alopecie měly být hlášeny pouze jako stupeň 1 nebo 2.
Pro účely této tabulky byla použita hraniční hodnota 5 % pro zařazení všech příhod, kdy hlásící osoba považovala příhodu za možnou souvislost s léčbou pemetrexedem).
Klinicky relevantní projevy toxicity (dle CTC), které byly hlášeny u > 1 % a < 5 % u pacientů náhodným výběrem přidělených k léčbě pemetrexedem, jsou: infekce bez neutropenie, febrilní neutropenie, alergická reakce/hypersenzitivita, zvýšení kreatininu, motorická neuropatie, senzorická neuropatie, erythema multiforme a bolest břicha.
Klinicky relevantní projevy toxicity (dle CTC), které byly hlášeny u < 1 % pacientů náhodným výběrem přidělených k léčbě pemetrexedem, jsou: supraventrikulární arytmie.
Klinicky relevantní laboratorní projevy toxicity stupně 3 a 4 byly obdobné při hodnocení integrovaných výsledků studií fáze 2 sledujících monoterapii pemetrexedem (n = 164) a studie fáze 3 sledující monoterapii pemetrexedem (popsána výše), s výjimkou neutropenie (12,8 % oproti 5,3 %) a zvýšení alaninaminotransferázy (15,2 % oproti 1,9 %). Tyto rozdíly byly pravděpodobně dány rozdíly v populaci pacientů, protože do studií fáze 2 byli zařazeni pacienti dosud neléčení chemoterapií a pacientky s karcinomem prsu, předem intenzivně léčené s již existujícími metastázami do jater a/nebo s patologickými výchozími funkčními jaterními testy.
V tabulce níže je uvedena frekvence a závažnost nežádoucích účinků pravděpodobně souvisejících se studovanou medikací, které byly hlášeny u více než 5 % z 839 pacientů s NSCLC, kteří byli randomizováni k léčbě cisplatinou v kombinaci s pemetrexedem a z 830 pacientů s NSCLC, kteří byli randomizováni k léčbě cisplatinou v kombinaci s gemcitabinem. Všichni pacienti dostali studovanou léčbu jako zahajovací léčbu lokálně pokročilého nebo metastazujícího nemalobuněčného karcinomu plic a pacienti v obou skupinách byli plně suplementováni kyselinou listovou a vitamínem B12.
| Třída orgánových systémů | Frekvence | Nežádoucí účinek* | pemetrexed/cisplatina (N = 839) | gemcitabin/cisplatin a N = 830) | ||
| Všechny stupně toxicity (%) | Toxicita stupně 3–4 (%) | Všechny stupně toxicity (%) | Toxicita stupně 3–4 (%) | |||
| Poruchy krve a lymfatického systému | Velmi časté | Hemoglobin – snížení | 33,0* | 5,6* | 45,7* | 9,9* |
| Neutrofily/ granulocyty – snížení | 29,0* | 15,1* | 38,4* | 26,7* | ||
| Leukocyty – snížení | 17,8 | 4,8* | 20,6 | 7,6* | ||
| Trombocyty – snížení | 10,1* | 4,1* | 26,6* | 12,7* | ||
| Poruchy nervového systému | Časté | Neuropatie-senzorická | 8,5* | 0,0* | 12,4* | 0,6* |
| Porucha chuti | 8,1 | 0,0 | 8,9 | 0,0 | ||
| Gastrointestinální poruchy | Velmi časté | Nauzea | 56,1 | 7,2* | 53,4 | 3,9* |
| Zvracení | 39,7 | 6,1 | 35,5 | 6,1 | ||
| Anorexie | 26,6 | 2,4* | 24,2 | 0,7* | ||
| Zácpa | 21,0 | 0,8 | 19,5 | 0,4 | ||
| Stomatitida/ faryngitida | 13,5 | 0,8 | 12,4 | 0,1 | ||
| Průjem bez kolostomie | 12,4 | 1,3 | 12,8 | 1,6 | ||
| Časté | Dyspepsie/ pálení žáhy | 5,2 | 0,1 | 5,9 | 0,0 | |
| Poruchy kůže a podkožní tkáně | Velmi časté | Alopecie | 11,9* | 0 | 21,4* | 0,5 |
| Časté | Vyrážka/ deskvamace | 6,6 | 0,1 | 8,0 | 0,5 | |
| Poruchy ledvin a močových cest | Velmi časté | Kreatinin – zvýšení | 10,1* | 0,8 | 6,9* | 0,5 |
| Celkové poruchy a reakce v místě aplikace | Velmi časté | Únava | 42,7 | 6,7 | 44,9 | 4,9 |
* hodnota p <0,05 při srovnání kombinace pemetrexed/cisplatina a gemcitabin/cisplatina při použití Fisherova exaktního testu.
** Viz obecná kritéria toxicity podle National Cancer Institute, verze 2 pro každý stupeň toxicity.
V souladu s National Cancer Institute CTC (v2.0, NCI 1998), by případy poruchy chuti a alopecie měly být hlášeny pouze jako stupeň 1 nebo 2.
Pro účely této tabulky byla použita hraniční hodnota 5 % pro zařazení všech příhod, kdy hlásící osoba považovala příhodu za eventuálně související s léčbou pemetrexedem a cisplatinou.
Klinicky relevantní toxicita, která byla hlášena u > 1 % a < 5 % pacientů náhodným výběrem přidělených k léčbě pemetrexedem a cisplatinou, zahrnovala: zvýšení hodnot AST, zvýšení hodnot ALT, infekci, febrilní neutropenii, renální selhání, pyrexii, dehydrataci, konjunktivitidu a snížení clearance kreatininu. Klinicky relevantní toxicita, která byla hlášena u < 1 % pacientů náhodným výběrem přidělených k léčbě pemetrexedem a cisplatinou, zahrnovala: zvýšení hodnot GGT, bolest na hrudi, arytmie a motorickou neuropatii.
Klinicky relevantní toxicita byla v celkové populaci u pacientů používajících pemetrexed v kombinaci s cisplatinou podobná bez ohledu na pohlaví.
V tabulce níže je uvedena frekvence a závažnost nežádoucích účinků pravděpodobně souvisejících se studijní medikací, které byly v klinických hodnoceních udržovací léčby pemetrexedem v monoterapii (JMEN: N=663) a pokračující udržovací léčby pemetrexedem (PARAMOUNT: N=539) hlášeny u více než 5 % z 800 pacientů, kteří byli randomizováni k léčbě samotným pemetrexedem a 402 pacientů, kteří byli randomizováni k léčbě placebem. U všech pacientů byl diagnostikován NSCLC stadia IIIB nebo IV a všichni podstoupili předchozí terapii založenou na platině. Pacienti v obou ramenech studie byli plně suplementováni kyselinou listovou a vitaminem B12.
| Třída orgánových systémů | Frekvence* | Nežádoucí účinek | Pemetrexed (N = 800) | Placebo (N = 402) | ||
| Všechny stupně toxicity (%) | Toxicita stupně 3–4 (%) | Všechny stupně toxicity (%) | Toxicita stupně 3–4 (%) | |||
| Poruchy krve a lymfatického systému | Velmi časté | Hemoglobin snížení | 18,0 | 4,5 | 5,2 | 0,5 |
| Časté | Leukocyty snížení | 5,8 | 1,9 | 0,7 | 0,2 | |
| Neutrofily snížení | 8,4 | 4,4 | 0,2 | 0,0 | ||
| Poruchy nervového systému | Časté | Neuropatie-senzorická | 7,4 | 0,6 | 5,5 | 0,2 |
| Gastrointestinální poruchy | Velmi časté | Nauzea | 17,3 | 0,8 | 4,0 | 0,2 |
| Anorexie | 12,8 | 1,1 | 3,2 | 0,0 | ||
| Časté | Zvracení | 8,4 | 0,3 | 1,5 | 0,0 | |
| Mukozitida/ stomatitida | 6,8 | 0,8 | 1,7 | 0,0 | ||
| Poruchy jater a žlučových cest | Časté | ALT (SGPT) vzestup | 6,5 | 0,1 | 2,2 | 0,0 |
| AST (SGOT) vzestup | 5,9 | 0,0 | 1,7 | 0,0 | ||
| Poruchy kůže a podkožní tkáně | Časté | Vyrážka/ deskvamace | 8,1 | 0,1 | 3,7 | 0,0 |
| Celkové poruchy a reakce v místě aplikace | Velmi časté | Únava | 24,1 | 5,3 | 10,9 | 0,7 |
| Časté | Bolest | 6,6 | 0,6 | 4,2 | 0,0 | |
| Edém | 5,6 | 0,0 | 1,5 | 0,0 | ||
| Renální poruchy | Časté | Renální poruchy**** | 7,6 | 0,9 | 1,7 | 0,0 |
Zkratky: ALT (SGPT) = alaninaminotransferáza; AST (SGOT) = aspartátraminotransferáza; CTCAE = obecná terminologická kritéria nežádoucích účinků (Common Terminology Criteria for Adverse Event); NCI = National Cancer Institute.
* Definice frekvence nežádoucích účinků: velmi časté – > 10 %; časté > 5% až < 10 %. Pro účely této tabulky byla použita hraniční hodnota 5 % pro zařazení všech příhod, kdy hlásící osoba považovala příhodu za možnou souvislost s léčbou pemetrexedem.
Viz NCI CTCAE kritéria (verze 3.0; NCI 2003) pro každý stupeň toxicity. Výskyt toxicit uveden podle CTCAE verze 3.0.
*** v integrované tabulce nežádoucích účinků jsou kombinovány výsledky klinických hodnocení udržovací léčby pemetrexedem JMEN (N=663) a pokračující udržovací léčby pemetrexedem PARAMOUNT (N=539).
****Souhrnné označení zahrnuje zvýšení kreatininu v séru/krvi, pokles glomerulární filtrace, renální selhání a renální/urogenitální – jiné.
Klinicky relevantní projevy toxicity (dle CTC) jakéhokoli stupně, které byly hlášeny u > 1 % a <5 % pacientů náhodným výběrem přidělených k léčbě pemetrexedem zahrnují: febrilní neutropenii, infekci, snížení počtu trombocytů, průjem, zácpu, alopecii, pruritus/svědění, horečku (bez neutropenie), onemocnění očního povrchu (včetně konjunktivitidy), zvýšené slzení, závrať a motorickou neuropatii.
Klinicky relevantní projevy toxicity (dle CTC), které byly hlášeny u < 1 % pacientů náhodným výběrem přidělených k léčbě pemetrexedem, jsou: alergická reakce/hypersenzitivita, multiformní erytém, supraventrikulární arytmie a plicní embolie.
Bezpečnost byla hodnocena u pacientů, kteří byli randomizováni k léčbě pemetrexedem (N=800. Výskyt nežádoucích účinků byl hodnocen u pacientů, kteří dostali < 6 cyklů udržovací léčby pemetrexedem (N=519) a srovnán s výskytem u pacientů, kteří dostali > 6 cyklů léčby pemetrexedem (N=281). S déle trvající expozicí bylo pozorováno zvýšení výskytu nežádoucích účinků (všech stupňů). Významné zvýšení výskytu neutropenie stupně 3/4 potenciálně související s hodnoceným lékem, bylo pozorováno při delší expozici pemetrexedu (< 6 cyklů: 3,3%, > 6cyklů: 6,4%: p=0,046). U jednotlivých stupňů 3/4/5 dalších nežádoucích účinků nebyly při delší expozici pozorovány statisticky významné rozdíly.
-
V průběhu klinických studií s pemetrexedem byly méně často hlášeny závažné kardiovaskulární a cerebrovaskulární příhody, zahrnující infarkt myokardu, anginu pectoris a tranzitorní ischemické ataky obvykle, když byl pemetrexed podáván v kombinaci s dalšími cytostatiky. Většina pacientů, u kterých byly tyto příhody pozorovány, měla preexistující kardiovaskulární rizikové faktory.
-
V průběhu klinických studií s pemetrexedem byly vzácně hlášeny potenciálně závažné mimořádné případy hepatitidy.
-
V průběhu klinických studií s pemetrexedem byly často hlášeny sepse, někdy s fatálním průběhem.
-
V průběhu postmarketingového sledování byly hlášeny u pacientů léčených pemetrexedem následující nežádoucí účinky:
-
V souvislosti s podáváním pemetrexedu samotného nebo v kombinaci s jinými chemoterapeutiky byly méně často hlášeny případy akutního selhání ledvin (viz bod 4.4). Po uvedení přípravku na trh byly hlášeny nefrogenní diabetes insipidus a renální tubulární nekróza s neznámou frekvencí.
U pacientů léčených ozařováním před léčbou, v průběhu nebo následně po léčbě pemetrexedem byly méně často hlášeny případy postradiační pneumonitidy (viz bod 4.4).
U pacientů, kteří podstoupili léčbu ozařováním, byly vzácně hlášeny případy kožní reakce v místě předchozího ozařování (radiation recall) (viz bod 4.4).
Méně často byly hlášeny případy periferní ischémie, které někdy vedly k nekróze končetiny.
Vzácně byly hlášeny případy tvorby puchýřů včetně Stevens-Johnsonova syndromu a toxické epidermální nekrolýzy, které byly v některých případech fatální.
Vzácně byla u pacientů léčených pemetrexedem hlášena hemolytická anémie.
Vzácně byly hlášeny případy anafylaktického šoku.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky:
4.9 Předávkování
Symptomy
K popsaným symptomům předávkování patří neutropenie, anémie, trombocytopenie, mukozitida, senzorická polyneuropatie a vyrážka. K předpokládaným komplikacím předávkování patří útlum kostní dřeně, který se manifestuje neutropenií, trombocytopenií a anémií. Kromě toho lze pozorovat infekce s horečkou nebo bez ní, průjem, případně mukozitidu.
Léčba
V případě podezření na předávkování, musí být u pacientů sledován krevní obraz a mají dostávat podle potřeby podpůrnou léčbu. V léčbě předávkování pemetrexedem se má zvážit podávání kalcium-folinátu nebo kyseliny folinové.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: analogy kyseliny listové, ATC kód: L01BA04
Mechanismus účinku
Pemetrexed Mylan Pharma (pemetrexed) je tzv. „multi-targeted“ antifolikum, protinádorová látka působící narušení několika klíčových metabolických procesů závislých na kyselině listové, které jsou nezbytné pro replikaci buněk.
Farmakodynamické vlastnosti
Studie in vitro prokázaly, že pemetrexed se chová jako tzv. „multi-targeted“ antifolikum tím, že inhibuje thymidylátsyntázu (TS), dihydrofolátreduktázu (DHFR) a glycinamid ribonukleotid formyltransferázu (GARFT), které jsou klíčové enzymy závislé na folátu pro biosyntézu thymidinu a purinových nukleotidů de novo. Pemetrexed je transportován do buněk redukovaným nosičem folátu a membránovým folátovým vazebným proteinovým transportním systémem. Jakmile je pemetrexed v buňce, přeměňuje se rychle a efektivně na polyglutamátové formy pomocí enzymu folylpolyglutamátsyntetáza. Polyglutamátové formy se zadržují v buňkách a jsou ještě silnějšími inhibitory TS a GARFT. Polyglutamace je proces závislý na čase a koncentraci, ke kterému dochází v nádorových buňkách a v menší míře i v normálních tkáních. Polyglutamátové metabolity mají zvýšený intracelulární poločas, což vede k protrahovanému účinku léku v maligních buňkách.
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s pemetrexedem u všech podskupin pediatrické populace ve schválených indikací ch (viz bod 4.2).
Klinická účinnost
Mezoteliom:
Studie EMPHACIS byla multicentrická, randomizovaná, jednoduše zaslepená studie fáze 3 s pemetrexedem a cisplatinou oproti cisplatině u pacientů s maligním mezoteliomem pleury, kteří dosud nepodstoupili chemoterapii. V této studii bylo prokázáno, že pacienti léčení pemetrexedem a cisplatinou měli klinicky významnou výhodu mediánu přežívání, trvající 2,8 měsíce v porovnání s pacienty léčenými cisplatinou v monoterapii.
Během studie byla k léčbě zavedena dlouhodobá suplementace nízkými dávkami kyseliny listové a vitaminu B12 s cílem snížit toxicitu. Primární analýza této studie byla provedena na populaci všech pacientů randomizovaně přidělených do léčebné skupiny, kteří dostávali hodnocený lék (randomizovaní a léčení). Byla provedena analýza podskupin u pacientů, kteří dostávali suplementaci kyselinou listovou a vitaminem B12 v průběhu celé léčebné kúry hodnoceným lékem (úplná suplementace). Výsledky těchto analýz účinnosti jsou shrnuty v následující tabulce:
Účinnost pemetrexedu v kombinaci s cisplatinou oproti cisplatině u pacientů s maligním mezoteliomem pleury
| Randomizováni a léčeni pacienti | Plně suplementováni pacienti | |||
| Parametr účinnosti | pemetrexed/ | cisplatina | pemetrexed/ | cisplatina |
| cisplatina | cisplatina | |||
| (n = 226) | (n = 222) | (n = 168) | (n = 163) | |
| Medián celkového přežívání (měsíce) | 12,1 | 9,3 | 13,3 | 10,0 |
| (95 % CI) | (10,0 – 14,4) | (7,8 – 10,7) | (11,4 – 14,9) | (8,4 – 11,9) |
| Log Rank hodnota p* | 0,020 | 0,051 | ||
| Medián doby do progrese tumoru | 5,7 | 3,9 | 6,1 | 3,9 |
| (měsíce) | ||||
| (95 % CI) | (4,9 – 6,5) | (2,8 – 4,4) | (5,3 – 7,0) | (2,8 – 4,5) |
| Log Rank hodnota p* | 0,001 | 0,008 | ||
| Doba do selhání léčby (měsíce) | 4,5 | 2,7 | 4,7 | 2,7 |
| (95 % CI) | (3,9 – 4,9) | (2,1 – 2,9) | (4,3 – 5,6) | (2,2 – 3,1) |
| Log Rank hodnota p* | 0,001 | 0,001 | ||
| Výskyt celkové odpovědi | 41,3 % | 16,7 % | 45,5 % | 19,6 % |
| (95 % CI) | (34,8 – 48,1) | (12,0 – 22,2) | (37,8 – 53,4) | (13,8 – 26,6) |
| Fisherova přesná hodnota p* | < 0,001 | < 0,001 | ||
Zkratky: CI = interval spolehlivosti *hodnota p se týká srovnání mezi rameny
V rameni Pemetrexed Mylan Pharma/cisplatina, randomizovaní a léčení (n = 225) a plně suplementovaní (n = 167) pacienti
Statisticky významné zlepšení klinicky významných symptomů (bolest a dušnost) vyskytujících se při maligním mezoteliomu pleury v rameni s pemetrexedem /cisplatinou (212 pacientů) oproti rameni s léčbou pouze cisplatinou (218 pacientů) bylo prokázáno pomocí škály symptomů karcinomu plic. Byly rovněž pozorovány statisticky významné rozdíly v plicních funkčních testech. Oddělení mezi léčebnými rameny bylo dosaženo zlepšením plicní funkce v rameni pemetrexed/cisplatina a zhoršením plicní funkce v čase u kontrolního ramene.
Existují omezené údaje u pacientů s maligním mezoteliomem pleury, léčených pemetrexedem v monoterapii. Pemetrexed v dávce 500 mg/m2 byl studován jako lék podávaný v monoterapii u 64 pacientů s maligním mezoteliomem pleury dosud neléčených chemoterapií. Celkový výskyt odpovědi na léčbu byl 14,1 %.
NSCLC, léčba v druhé linii:
V multicentrické, randomizované, otevřené studii fáze 3 s pemetrexedem a docetaxelem u pacientů s lokálně pokročilým nebo metastatickým nemalobuněčným karcinomem plic po předchozí chemoterapii byl prokázán medián doby přežívání 8,3 měsíce u pacientů léčených pemetrexedem (ITT populace se záměrem léčit, n = 283) a 7,9 měsíců u pacientů léčených docetaxelem (populace se záměrem léčit, n = 288). Předchozí chemoterapie nezahrnovala pemetrexed. Výsledky analýzy vlivu histologie NSCLC na celkové přežití svědčí ve prospěch pemetrexedu oproti docetaxelu u pacientů s NSCLC jiného histologického typu, než predominantně z dlaždicových buněk (n=399; 9,3 oproti 8,0 měsícům, adjustovaný HR=0,78; 95 CI=0,61–1,00; p=0,047) a ve prospěch docetaxelu u karcinomu s histologickou strukturou z dlaždicových buněk (n=172; 6,2 oproti 7,4 měsícům, adjustovaný HR=1,56; 95% CI =1,08– 2,26; p = 0,018). V histologických podskupinách nebyly pozorovány žádné klinicky důležité rozdíly v bezpečnostním profilu pemetrexedu.
Omezené klinické údaje z jiného randomizovaného kontrolovaného klinického hodnocení fáze 3 naznačují, že údaje o účinnosti pemetrexedu (Overall survival OS – celková doba přežití, Progression free survival PFS – doba přežívání bez progrese) jsou podobné pro skupinu pacientů s předchozí léčbou docetaxelem (n=41) a pacientů bez předchozí léčby docetaxelem (n=540).
Účinnost pemetrexedu oproti docetaxelu u pacientů s nemalobuněčným karcinomem plic – ITT populace
| pemetrexed | docetaxel | |
| Doba přežívání (měsíce)
| (n = 283) (7,0 – 9,4“ | (n = 288) 7,9 (6,3 – 9,2) |
| 0,99 (0,82 – 1,20) 0,226 | ||
| Doba přežívání bez progrese (měsíce)
| (n = 283) (n = 288) 2,9 2,9 0,97 (0,82 – 1,16) | |
| Doba do selhání léčby (TTTF – měsíce)
| (n = 283) (n = 288) 2,3 2,1 0,84 (0,71 – 0,997) | |
| Odpověď (n: kvalifikovaní pro odpověď)
| (n = 264) 9,1 (5,9 – 13,2) 45,8 | (n = 274) 8,8 (5,7 – 12,8) 46,4 |
Zkratky: CI = interval spolehlivosti; HR = poměr rizik; ITT = záměr léčit; n = celková velikost populace
NSCLC, léčba v první linii:
Multicentrická, randomizovaná, otevřená studie fáze 3 s pemetrexedem a cisplatinou oproti gemcitabinu s cisplatinou u pacientů bez předchozí chemoterapie s lokálně pokročilým nebo metastazujícím (stadium IIIb nebo IV) nemalobuněčným karcinomem plic (NSCLC) prokázala, že pemetrexed v kombinaci s cisplatinou (populace ITT Intent-to-treat, hodnocení všech randomizovaných pacientů, n =862) dosáhl primárního cílového parametru a prokázal podobný klinický účinek jako gemcitabin v kombinaci s cisplatinou (ITT n =863) na celkové přežití (adjustovaný poměr rizik 0,94; 95% CI 0,84–1,05). Všichni pacienti účastnící se této studie měli ECOG výkonnostní stav 0 nebo 1.
Primární analýza účinnosti byla založena na ITT populaci. Analýzy citlivosti pro hlavní cílové parametry studie byly také vyhodnoceny u populace pacientů splňujících vstupní kritéria protokolu (Protocol Qualified -PQ). Výsledky analýz účinnosti u populace PQ jsou v souladu s analýzami populace ITT a podporují noninferioritu kombinace AC oproti GC.
Doba přežívání bez progrese (Progression free survival – PFS) a výskyt celkové odpovědi byly podobné v obou ramenech léčby: medián PFS byl 4,8 měsíců pro pemetrexed v kombinaci s cisplatinou oproti
-
5,1 měsícům pro gemcitabin v kombinaci s cisplatinou (adjustovaný poměr rizik 1,04; 95% CI= 0,94 –1,15) a četnost celkové odpovědi byla 30,6% (95% CI =27,3– 33,9) pro pemetrexed s cisplatinou oproti 28,2% (95% CI =25,0–31,4) pro gemcitabin s cisplatinou. Údaje o PFS byly částečně potvrzeny nezávislým přezkoumáním (pro přezkoumání bylo náhodně vybráno 400/1725 pacientů).
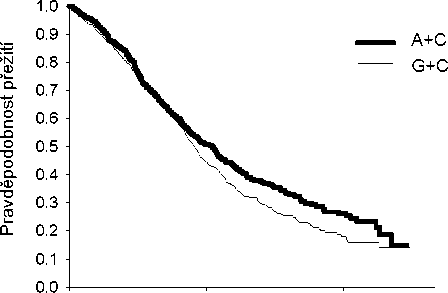
Analýza vlivu histologického původu NSCLC na celkovou dobu přežití prokázala klinicky významné rozdíly mezi jednotlivými histologickými typy, viz níže uvedená tabulka.
Účinnost kombinace pemetrexed + cisplatina oproti kombinaci gemcitabin + cisplatina v první linii nemalobuněčného karcinomu plic – ITT populace a histologické podskupiny.
| ITT populace a histologické podskupiny | Medián celkové doby přežití v měsících (95% CI) | Adjustovaný poměr rizik (HR) (95% CI) | Superiorita hodnota p | |||
| pemetrexed + cisplatina | gemcitabin + cisplatina | |||||
| ITT populace (N = 1725) | 10,3 (9,8 – 11,2) | N=862 | 10,3 (9,6 – 10,9) | N=863 | 0,94a (0,84 – 1,05) | 0,259 |
| Adenokarcinom (N=847) | 12,6 (10,7 – 13,6) | N=436 | 10,9 (10,2 – 11,9) | N=411 | 0,84 (0,71–0,99) | 0,033 |
| Velkobuněčný (N=153) | 10,4 (8,6 – 14,1) | N=76 | 6,7 (5,5 – 9,0) | N=77 | 0,67 (0,48–0,96) | 0,027 |
| Jiný (N=252) | 8,6 (6,8 – 10,2) | N=106 | 9,2 (8,1 – 10,6) | N=146 | 1,08 (0,81–1,45) | 0,586 |
| Dlaždicobuněčný (N=473) | 9,4 (8,4 – 10,2) | N=244 | 10,8 (9,5 – 12,1) | N=229 | 1,23 (1,00–1,51) | 0,050 |
Zkratky: CI = interval spolehlivosti; ITT = záměr léčit; N = celková velikost souboru.
a Statisticky významné pro noninferioritu, s celkovým intervalem spolehlivosti pro HR dostatečně pod hranicí noninferiority 1,17645 (p <0,001)
Kaplan – Meierova křivka celkové doby přežití podle histologického typu
Adenokarcinom
O 6 12
Doba přežití (měsíce)
18 24 30
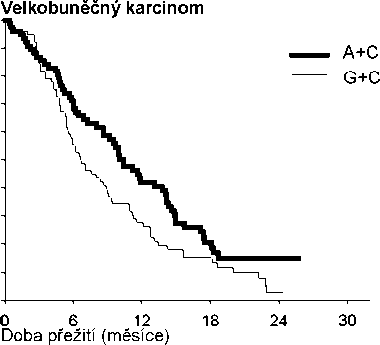
V histologických podskupinách nebyly pozorovány žádné klinicky významné rozdíly v bezpečnostním profilu pemetrexedu v kombinaci s cisplatinou.
U pacientů léčených pemetrexedem v kombinaci s cisplatinou byl zapotřebí menší počet transfúzí (16,4% oproti 28,9%, p<0,001), transfuzí erytrocytů (16,1% oproti 27,3%, p<0,001) a transfuzí trombocytů (1,8% oproti 4,5%, p=0,002). Rovněž byl zapotřebí menší počet podání erytropoetinu/darbopoetinu (10,4% oproti 18,1%, p<0,001), G-CSF/GM-CSF (3,1% oproti 6,1%, p=0,004) a přípravků obsahujících železo (4,3% oproti 7,0%, p=0,021).
NSCLC, udržovací léčba:
JMEN:
Multicentrická, randomizovaná, dvojitě zaslepená studie fáze 3 kontrolovaná placebem (JMEN), srovnávala účinnost a bezpečnost udržovací léčby pemetrexedem spolu s nejlepší možnou podpůrnou léčbou (BSC) (n = 441) a podávání placeba spolu s BSC (n=222) u pacientů s lokálně pokročilým (stadium IIIB) nebo metastazujícím (stadium IV) nemalobuněčným karcinomem plic (NSCLC), u kterých nedošlo k progresi po 4 cyklech terapie první linie dvojkombinací obsahující cisplatinu nebo karboplatinu v kombinaci s gemcitabinem, paklitaxelem nebo docetaxelem. Kombinovaná léčba obsahující v první linii v dvojkombinaci pemetrexedeu nebyla zahrnuta. Všichni pacienti účastnící se této studie měli ECOG výkonnostní stav 0 nebo 1. Udržovací léčba byla pacientům podávána do doby progrese nemoci. Účinnost a bezpečnost byly měřeny od doby randomizace po dokončení (indukční) terapie první linie. Střední hodnota počtu cyklů podaných pacientům byla 5 cyklů udržovací léčby s pemetrexedem a 3,5 cyklů podávání placeba. Celkem 213 pacientů (48,3%) dokončilo > 6 cyklů 103 pacientů (23,4%) > 10 cyklů léčby pemetrexedem.
Studie dosáhla primárního cílového parametru a prokázala statisticky významné zlepšení PFS ve skupině s pemetrexedem oproti skupině s placebem (n = 581, nezávisle hodnocená populace, medián 4,0 měsíce, resp. 2,0 měsíce) (poměr rizika = 0,60, 95% CI: 0.49 – 0,73; p < 0.00001). Nezávislé hodnocení pacientských skenů potvrdilo závěry hodnocení PFS ze strany zkoušejících. Střední hodnota celkové doby přežití (OS) pro celkovou populaci (n=663) byla 13,4 měsíců ve skupině s pemetrexedem a 10,6 měsíců ve skupině s placebem, poměr rizik = 0,79 (95% CI: 0,65 až 0,95; p = 0,01192).
V souladu s dalšími studiemi pemetrexedu byl ve studii JMEN pozorován rozdíl v účinnosti
s ohledem na histologii NSCLC. U pacientů s NSCLC jiného histologického typu, než predominantně z dlaždicových buněk (n=430, nezávisle hodnocená populace) byla střední doba přežívání bez progrese (PFS) 4,4 měsíce u pemetrexedu a 1,8 měsíců u skupiny placeba, poměr rizik = 0,47, 95% CI: 0,37 –0,60, p= 0,00001. Střední hodnota celkové doby přežití (OS) u pacientů s NSCLC jiného histologického typu, než predominantně z dlaždicových buněk (n=481) byla 15,5 měsíců ve skupině s pemetrexedem a 10,3 měsíce ve skupině placeba (poměr rizik = 0,70, 95% CI: 0,56–0,88; p=0,002). Střední doba OS včetně indukční fáze byla u pacientů s NSCLC jiného histologického typu, než predominantně z dlaždicových buněk 18,6 měsíců ve skupině s pemetrexedem a 13,6 měsíců ve skupině s placebem (poměr rizik =0,71, 95% CI: 0,56–0,88; p=0,002).
U pacientů s karcinomem histologického typu z dlaždicových buněk nenaznačují výsledky PFS a OS výhodu léčby pemetrexedem oproti placebu.
V histologických podskupinách nebyly pozorovány žádné klinicky důležité rozdíly v bezpečnostním profilu pemetrexedu.
užívajících pemetrexed nebo placebo
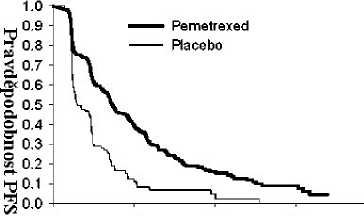
O 6 12 18
Doba přežívání bez progrese (v měsících)
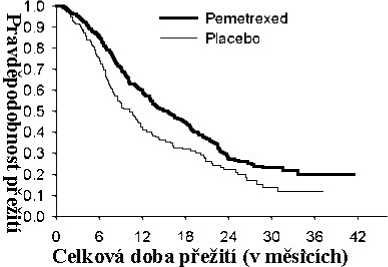
Pemetrexed
Placebo
0 6 12 18 24 30 36 42
Celková doba přežití (v městcích)
PARAMOUNT
Multicentrická, randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie fáze 3 (PARAMOUNT) porovnávala účinnost a bezpečnost pokračující udržovací léčby pemetrexedem plus BSC (n = 359) s léčbou placebem plus BSC (n = 180) u pacientů s lokálně pokročilým (stadium IIIB) nebo metastazujícím (stadium IV) NSCLC jiného histologického typu, než predominantně z dlaždicových buněk, u kterých nedošlo k progresi onemocnění po 4 cyklech první linie léčby dvojkombinací pemetrexedu a cisplatiny. Z celkového počtu 939 pacientů léčených indukcí pemetrexedem s cisplatinou, bylo 539 pacientů randomizováno na udržovací léčbu pemetrexedem nebo placebem.
Z randomizovaných pacientů mělo 44,9% úplnou/částečnou odpověď a u 51,9 % došlo ke stabilizaci onemocnění po indukci pemetrexedem s cisplatinou. Pacienti, kteří byli randomizováni k udržovací léčbě, museli mít výkonnostní stav ECOG 0 nebo 1. Medián doby od začátku indukční léčby pemetrexedem s cisplatinou do začátku udržovací léčby byl 2,96 měsíce jak v rameni s pemetrexedem, tak v rameni s placebem. Randomizovaní pacienti dostávali udržovací léčbu do doby progrese onemocnění. Účinnost a bezpečnost byly měřeny od doby randomizace po ukončení prvoliniové (indukční) léčby. Střední hodnoty počtu cyklů podaných pacientům byly 4 cykly léčby pemetrexedem a 4 cykly placeba. Celkem dokončilo > 6 cyklů udržovací léčby pemetrexedem 169 pacientů (47,1%), což představovalo nejméně 10 cyklů pemetrexedem celkem.
Studie splnila svůj primární cílový parametr a ukázala statisticky významné zlepšení PFS v rameni s pemetrexedem ve srovnání s placebovým ramenem (n = 472, nezávisle hodnocená populace, medián
-
3,9 měsíců a 2,6 měsíců v tomto pořadí) (poměr rizik = 0,64, 95% CI = 0,51–0,81; p = 0,0002). Nezávislé posouzení skenů pacientů potvrdilo nálezy z hodnocení PFS zkoušejícími. Pro randomizované pacienty byl, měřeno od zahájení první linie indukční léčby pemetrexedem s cisplatinou, medián PFS stanovený zkoušejícím 6,9 měsíců v rameni s pemetrexedem a 5,6 měsíce v rameni s placebem (poměr rizik = 0,59 95% CI = 0,47–0,74).
Po indukci pemetrexedem s cisplatinou (4 cykly), byla léčba pemetrexedem statisticky lepší než placebo z hlediska celkového přežívání (medián 13,9 měsíce versus 11,0 měsíců, poměr rizik = 0,78, 95% CI = 0,64–0,96, p = 0,0195). V době, kdy byla tato finální analýza doby přežívání provedena, bylo v rameni s pemetrexedem 28,7% pacientů naživu nebo byl kontakt s nimi ztracen oproti 21,7% pacientům v rameni s placebem. Relativní léčebný účinek pemetrexedu byl napříč podskupinami (včetně stadia nemoci, odpovědi na indukci, ECOG PS, kuřáckého statusu, pohlaví, histologie a věku) vnitřně konzistentní a podobný tomu, který byl pozorován v neadjustovaných analýzách OS a PFS. Jednoletá a 2letá četnost přežívání pacientů s pemetrexedem byla 58% a 32% dle uvedeného pořadí, ve srovnání s 45% a 21% u pacientů s placebem. Od začátku indukční léčby pemetrexedem s cisplatinou v první linii byl medián OS pacientů 16,9 měsíce u ramene s pemetrexedem a 14,0 měsíců u ramene s placebem (poměr rizik = 0,78, 95% CI= 0,64 – 0,96). Procento pacientů, kteří dostali postudijní léčbu bylo 64,3% u pemetrexedu a 71,7% u placeba.
PARAMOUNT: Kaplan – Meierova křivka doby přežívání bez progrese (PFS) a celkové doby přežívání (OS) u pacientů s NSCLC jiného histologického typu, než predominantně z dlaždicových buněk, pokračujících v udržovací léčbě pemetrexedem nebo placebem (nezávislé posouzení, měřeno od randomizace)
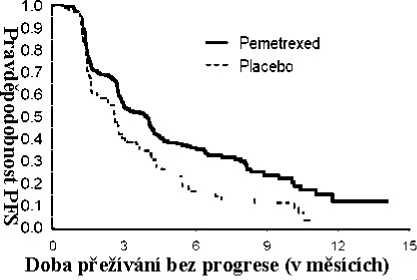
-
— Pemetrexed
-
— Placebo
1.0
5°-9
3 0.8
§,0.7
■3'0.6
0,0.5
8*0.4
O 0.3
oa
s02
3o.i
^0.0
0 3 6 9 12
Doba přežívání bez progrese (v měsících)
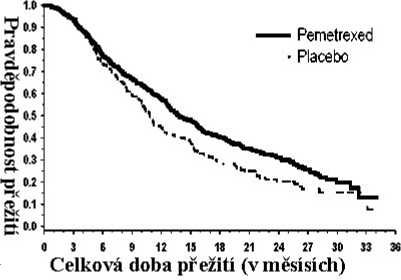
Pemetrexed Plače bo
3 6 9 12 15 18 21 24 27 30 33
Celková doba přežití (vměsísích)
Bezpečnostní profily udržovací léčby pemetrexedem z obou klinických hodnocení JMEN a PARAMOUNT byly podobné.
5.2 Farmakokinetické vlastnosti
Farmakokinetické vlastnosti pemetrexedu po jeho podání v monoterapii byly hodnoceny u 426 pacientů s různými maligními solidními tumory, kterým byl lék podáván v dávkách od 0,2 do 838 mg/m2 infuzí po dobu 10 minut. Distribuční objem pemetrexedu v ustáleném stavu činil 9 l/m2. Studie in vitro ukazují, že pemetrexed se přibližně z 81 % váže na plazmatické proteiny. Různý stupeň poruchy funkce ledvin nevede k významnému ovlivnění této vazby. Pemetrexed podstupuje v omezené míře metabolismus v játrech.
Pemetrexed se primárně vylučuje močí, přičemž 70 – 90 % podané dávky se odstraní močí v nezměněné formě během prvních 24 hodin po jeho podání. Studie in vitro naznačují, že pemetrexed je aktivně vylučován pomocí OAT3 (přenašeč organických aniontů). Celková systémová clearance pemetrexedu je 91,8 ml/min. a eliminační poločas plazmy je 3,5 hodin u pacientů s normální funkcí ledvin (clearance kreatininu 90 ml/min). Variabilita clearance mezi pacienty je střední, a to 19,3 %. Celková systémová expozice pemetrexedu (AUC) a maximální plazmatická koncentrace rostou proporcionálně s dávkou. Farmakokinetika pemetrexedu je stejná i při více léčebných cyklech.
Farmakokinetické vlastnosti pemetrexedu nejsou ovlivněny souběžně podanou cisplatinou. Suplementace kyselinou listovou perorálně a vitaminem B12 intramuskulárně neovlivňuje farmakokinetiku pemetrexedu.
5.3 Předklinické údaje vztahující se k bezpečnosti
Podání pemetrexedu březím myším vedlo ke snížení viability plodů, ke snížení hmotnosti plodů, neúplné osifikaci některých kosterních struktur a rozštěpu patra.
Podání pemetrexedu samcům myší vedlo k reprodukční toxicitě charakterizované snížením fertility a testikulární atrofií. V devítiměsíční studii provedené na bíglech s použitím intravenózní bolusové injekce byl pozorován nález na varlatech (degenerace/nekróza seminiferní výstelky). To naznačuje, že pemetrexed může poškodit mužskou fertilitu. Fertilita žen nebyla studována.
Pemetrexed nebyl mutagenní in vitro ani u testu chromozomální aberace na buňkách ovarií čínských křečků ani u Amesova testu. V mikronukleárním testu in vivo u myši bylo prokázáno, že pemetrexed je klastogenní.
Studie hodnotící kancerogenní potenciál pemetrexedu nebyly provedeny.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Mannitol
Kyselina chlorovodíková (k úpravě pH)
Hydroxid sodný (k úpravě pH)
6.2 Inkompatibility
Pemetrexed je fyzikálně inkompatibilní s diluenty obsahujícími kalcium, jako je laktátový Ringerův roztok a Ringerův roztok. Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě 6.6.
6.3 Doba použitelnosti
Neotevřená lahvička
3 roky.
Rekonstituované a infUzní roztoky
Pokud je přípravek Pemetrexed Mylan Pharma připraven podle návodu, neobsahují rekonstituované a infuzní roztoky žádné antimikrobiální konzervační látky. Chemická a fyzikální stabilita připraveného rekonstituovaného a infuzního roztoku byla prokázána na dobu 24 hodin při uchování při 25 °C a 2 °C –8 °C. Z mikrobiologického hlediska má být přípravek použit okamžitě. Není-li použit okamžitě, doba a podmínky uchovávání přípravku po otevření před použitím jsou v odpovědnosti uživatele a normálně by doba neměla být delší než 24 hodin při 2 °C –8 °C, pokud rekonstituce a ředění neproběhlo za kontrolovaných a validovaných aseptických podmínek.
6.4 Zvláštní opatření pro uchovávání
Neotevřená injekční lahvička
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky pro uchovávání.
Podmínky uchovávání tohoto léčivého přípravku po jeho rekonstituci jsou uvedeny v bodě 6.3.
6.5 Druh obalu a obsah balení
Injekční lahvička ze skla třídy I s brombutylovou gumovou zátkou a hliníkovým krytem s odtrhávacím víčkem obsahující 500 mg pemetrexedu.
Balení: 1 lahvička.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
-
1. Při rekonstituci a dalším ředění pemetrexedu k podání intravenózní infuze používejte aseptickou techniku.
-
2. Vypočtěte dávku a potřebný počet injekčních lahviček přípravku Pemetrexed Mylan Pharma. Každá lahvička obsahuje větší množství pemetrexedu zajišťující podání dané dávky.
-
3. Rekonstituujte obsah 500mg lahvičky s 20 ml injekčního roztoku chloridu sodného o koncentraci 9 mg/ml (0,9 %) bez konzervačních látek, čímž vznikne roztok s obsahem 25 mg/ml pemetrexedu. Pohybujte jemným krouživým pohybem každou injekční lahvičkou, dokud se prášek zcela nerozpustí. Výsledný roztok je čirý a jeho barva kolísá od bezbarvé po žlutou nebo žlutozelenou, aniž by byla narušena jeho kvalita. pH rekonstituovaného roztoku se pohybuje mezi 6,6 a 7,8. Potřebné je další ředění.
-
4. Příslušný objem rekonstituovaného roztoku pemetrexedu musí být dále naředěn na 100 ml injekčním roztokem chloridu sodného 9 mg/ml (0,9 %) bez konzervačních látek a podá se intravenózní infuzí po dobu 10 minut.
-
5. Infuzní roztoky pemetrexedu, připravené podle návodu výše, jsou kompatibilní s polyvinylchloridovými a polyolefinovými infuzními sety a infuzními vaky.
-
6. Léčivé přípravky pro parenterální použití se musí před podáním vizuálně zkontrolovat, zda neobsahují pevné částice a zda nedošlo ke změně barvy. Jestliže zpozorujete pevné částice, přípravek nepodávejte.
-
7. Roztok pemetrexedu je určen pouze na jedno použití. Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Bezpečnostní opatření při přípravě a podání přípravku Pemetrexed Mylan Pharma: Tak jako i u jiných potenciálně toxických protinádorových látek je nutné udržovat pozornost při zacházení s infuzním roztokem pemetrexedu a při jeho přípravě. Doporučuje se používat ochranné rukavice. Pokud dojde ke kontaktu roztoku pemetrexedu s kůží, umyjte ihned a důkladně kůži mýdlem a vodou. Pokud dojde ke kontaktu roztoku pemetrexedu se sliznicemi, opláchněte je důkladně vodou. Pemetrexed není zpuchýřující látka.
V případě podání mimo žílu neexistuje specifické antidotum. Bylo popsáno několik případů podání pemetrexedu mimo žílu, které hodnotící lékař nepovažoval za závažné. Únik pemetrexedu mimo žílu se léčí podle místních standardních postupů jako u jiných nezpuchýřujících látek.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Mylan S.A.S.
117 allée des Parcs
69 800 Saint Priest
Francie
8. REGISTRAČNÍ ČÍSLO
44/021/16-C
Další informace o léčivu PEMETREXED MYLAN PHARMA
Jak
se PEMETREXED MYLAN PHARMA
podává: intravenózní podání - prášek pro koncentrát pro infuzní roztok
Výdej
léku: na lékařský předpis
Balení: Injekční lahvička
Velikost
balení: 1
Držitel rozhodnutí o registraci daného léku v České republice:
Mylan S.A.S., Saint-Priest
E-mail: officecz@mylan.com
Telefon: +420 222 004 400
