Souhrnné informace o léku - MISODEL
1.
Misodel 200 mikrogramů vaginální inzert
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Misodel obsahuje 200 mikrogramů misoprostolum.
Misoprostolum se uvolňuje in vivo s průměrnou rychlostí přibližně 7 mikrogramů/hodinu po dobu 24 hodin. Uvolňování léku probíhá po celou dobu přítomnosti přípravku Misodel v pochvě.
Pomocné látky se známým účinkem: 0,13 mg butylhydroxyanisolu v jedné dávce (viz bod 4.4).
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Vaginální inzert.
Polymerová vložka je umístěna v systému pro vytažení, tvořeném inertním váčkem z tkaného polyesteru a tkanicí. Polymerová vložka je obdélníkového tvaru se zaoblenými rohy, je hnědožluté barvy, semitransparentní, nerozkládá se biologicky; její délka je přibližně 30 mm, šířka 10 mm a tloušťka 0,8 mm. Misodel ve vlhkém prostředí bobtná.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Misodel je od 36. týdne těhotenství indikován pro indukci porodu u žen s nepříznivými poměry v děložním hrdle, u nichž je klinicky indikována indukce.
4.2 Dávkování a způsob podávání
Dávkování
Misodel 200 mikrogramů je léková forma s řízeným uvolňováním, která uvolňuje misoprostol rychlostí přibližně 7 mikrogramů za hodinu po dobu 24 hodin.
Maximální doporučená dávka je jeden Misodel vaginální insert (200 mikrogramů).
Vyjměte Misodel
- Na začátku porodu
- Jestliže se objeví nadměrné děložní stahy:
-
– Tachysystolie: více než 5 kontrakcí za 10 minut ve dvou po sobě jdoucích 10minutových intervalech nebo v průměru během 30 minut
-
– Dlouhotrvající kontrakce: jednotlivé kontrakce trvající 2 minuty nebo více
-
– Hypertonické kontrakce: kontrakce jsou příliš časté a klidový tonus dělohy je vysoký
- Jestliže existují klinické obavy o matku a/nebo dítě
- Jestliže od zavedení uplynulo 24 hodin.
Pokud Misodel vypadne, nenahrazujte jej dalším.
V případě následného podání oxytocinu se doporučuje s tímto podáním vyčkat nejméně 30 minut od vyjmutí vaginálního inzertu (viz bod 4.5).
Nepříznivý poměr v děložním hrdle (modifikované Bishop skóre < 4) bylo kritérium pro zařazení do pilotní studie fáze III klinického hodnocení.
Pediatrická populace
Nebyla hodnocena bezpečnost a účinnost přípravku Misodel u těhotných žen mladších než 18 let věku. Nejsou dostupné žádné údaje.
Způsob podání
Misodel by měl být podáván pouze vyškolenými porodnickými pracovníky v prostředí nemocnice, kde jsou dostupné možnosti pro kontinuální monitorování plodu a dělohy. Před použitím přípravku Misodel je třeba pečlivě vyšetřit stav děložního hrdla. Po zavedení musí být pečlivě monitorována aktivita dělohy a stav plodu pracovníky proškolenými k interpretaci kardiotokografie. Misodel se může používat pouze v nemocnicích, kde je k dispozici zařízení pro urgentní vedení porodu císařským řezem.
Misodel je dodáván v jednotlivém sáčku z hliníkové folie a musí být uložen v mrazničce. Před použitím není nutné přípravek rozmrazovat.
Na straně foliového sáčku je „značka pro odtržení“. Otevřete sáček podél značky pro odtržení napříč horní částí sáčku. Nepoužívejte nůžky ani jiné ostré předměty, které by mohly porušit systém pro vytažení.
Zaveďte Misodel vysoko do zadní části klenby pochvy (obrázek a). K tomu, aby Misodel zůstal in situ, je třeba jej otočit o 90o tak, aby byl umístěn příčně v zadní klenbě pochvy (obrázek b). Jako pomůcku je v případě nutnosti možno použít ve vodě rozpustné lubrikanty.
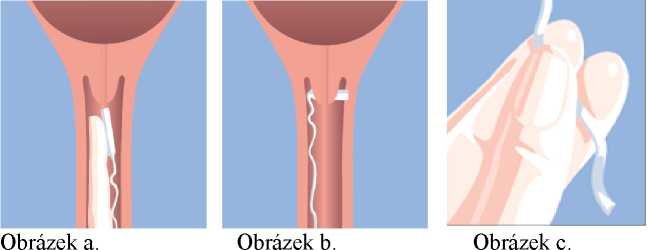
Po zavedení vaginálního inzertu je možno odstřihnout přesahující pásku pro vytažení nůžkami, vždy je však třeba dbát na to, aby byla pro vytažení k dispozici dostatečně dlouhá páska mimo pochvu.
Pacientka musí zůstat 30 minut po zavedení na lůžku, ale po uplynutí této doby může chodit. Je třeba dbát na to, aby nedošlo k nechtěnému vypadnutí nebo vytažení přípravku Misodel při návštěvě toalety nebo při vyšetřeních pochvy.
Vyjmutí
Misodel se vyjme jemným tahem za tkanici systému pro vytažení (obrázek c).
Vaginální inzert by NIKDY neměl být vyjmut ze systému pro vytažení.
Misodel je léková forma pro řízené uvolňování, která v přítomnosti vlhkosti bobtná, což je příčinou uvolňování léku. V průběhu zavádění zvětší Misodel svůj objem 2– 3× oproti původní velikosti a stane se poddajným. Po vyjmutí dbejte na to, aby byl z pochvy vyjmut celý produkt (systém pro zavádění i systém pro vytažení).
4.3 Kontraindikace
Misodel je kontraindikován:
- při hypersenzitivitě na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1
- po zahájení porodu (porodních stahů)
- při podezření nebo průkazu alterace plodu před indukcí (např. neúspěšný nezátěžový test nebo zátěžový test, zabarvení smolkou nebo diagnóza nebo anamnéza neuspokojivého stavu plodu)
- po podání oxytocinu a/nebo jiných léků indukujících porod (viz bod 4.4)
- při podezření nebo průkazu přítomnosti děložní jizvy v důsledku předchozí operace dělohy nebo děložního hrdla, např. porodu císařským řezem
- v přítomnosti abnormality dělohy (např. uterus bicornatus)
- v přítomnosti placenta praevia nebo po neobjasněném vaginálním krvácení po 24. gestačním týdnu těhotenství
- při nesprávné poloze plodu
- v přítomnosti známek nebo příznaků chorioamnionitis, s výjimkou případů, kdy již bylo zahájeno odpovídající léčení
- před 36. týdnem těhotenství.
4.4 Zvláštní upozornění a opatření pro použití
Misodel může způsobit excesivní děložní tachysystolii, která nemusí odpovídat na tokolytickou léčbu a nemusí odeznít před porodem. Misodel rovněž může způsobit nadměrnou stimulaci dělohy, pokud je ponechán na místě po zahájení porodu (viz bod 4.9).
Z tohoto důvodu je nutno vaginální inzert okamžité vyjmout (viz bod 4.2):
-
– Na začátku porodu: pravidelné, silné kontrakce příslušné kvality, které působí změnu děložního hrdla, a/nebo nejpozději tehdy, když rozšíření děložního hrdla je 4 cm, protože může dojít k nadměrným kontrakcím dělohy
-
– Jestliže jsou děložní stahy dlouhotrvající nebo nadměrné
-
– Existují-li klinické obavy o matku a/nebo dítě.
-
– Když od zavedení uplynulo 24 hodin.
Doporučuje se připravenost k použití tokolytické léčby, která v případě nutnosti má být poskytnuta neprodleně po vyjmutí Misodelu.
U žen s preeklampsií je třeba vyloučit známky alterace plodu nebo podezření na ni (viz bod 4.3). Těhotné ženy se závažnou preeklampsií, která se vyznačovala hemolytickou anémií, zvýšenými jaterními enzymy, nízkým počtem krevních destiček (HELLP syndrom) a postižením jiných orgánů nebo CNS (kromě mírné bolesti hlavy) nebyly zařazeny do pivotní studie fáze III (Miso-Obs-303; Studie EXPEDITE).
Misodel nebyl hodnocen u žen, u nichž došlo k ruptuře obalů více než 48 hodin před zavedením přípravku Misodel.
U žen s pozitivním nálezem streptokoka skupiny B vyžadujícím profylaktické podání antibiotik je třeba věnovat pozornost pečlivému načasování antibiotické léčby, aby se dosáhlo dostatečné ochrany novorozenců. V pilotní studii fáze III (Miso-Obs-303; studie EXPEDITE) činila nejkratší zaznamenaná doba do porodu 2,95 hodiny.
Misodel je třeba vyjmout před zahájením podávání oxytocinu, po vyjmutí přípravku Misodel do zahájení aplikace oxytocinu je nutno nejméně 30 minut vyčkat (viz body 4.2, 4.3 a 4.5).
Misodel byl zkoumán pouze u jednočetných těhotenství při prezentaci plodu hlavičkou. Nebyly provedeny studie u vícečetných těhotenství. Misodel nebyl hodnocen u žen s více než 3 předchozími vaginálními porody po 24 týdnech těhotenství.
Misodel by měl být použit pouze při klinické indikaci indukce porodu.
Misodel by měl být použit se zvýšenou opatrností u pacientek s modifikovaným Bishopovým skóre (mBS) > 4.
Druhá dávka přípravku Misodel se nedoporučuje, protože účinky druhé dávky nebyly zkoumány.
Obecně u pacientek, u nichž byl porod indukován jakoukoli fyziologickou nebo farmakologickou metodou, bylo popsáno zvýšené riziko poporodní diseminované intravaskulární koagulace.
Butylhydroxyanisol se používá jako antioxidant v zesítěném hydrogelovém polymeru. Ve finální lékové formě je přítomen pouze ve stopovém množství. Butylhydroxyanisol může způsobit kožní reakce (např. kontaktní dermatitis) nebo podráždění očí a sliznic.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie interakcí s přípravkem Misodel.
Současné použití oxytocinu nebo jiných látek indukujících porod je kontraindikováno vzhledem k tomu, že mohou vyvolat zvýšené uterotonické účinky (viz body 4.2, 4.3 a 4.4).
V klinických studiích byly pacientkám po vyjmutí přípravku Misodel v případě potřeby podány jiné přípravky obsahující prostaglandin bez patrného nepříznivého účinku. Před jejich podáním byl dodržen jednohodinový odstup od ukončení aplikace přípravku Misodel.
4.6 Fertilita, těhotenství a kojení
Fertilita
Studie fertility a časného embryonálního vývoje u potkanů zjistily známky možného nežádoucího účinku misoprostolu na implantaci, tato skutečnost však není pro indikované klinické použití přípravku Misodel relevantní (viz bod 5.3).
Těhotenství
Misodel byl hodnocen u těhotných žen, které byly v > 36 týdnu těhotenství.
Misodel by neměl být použit před 36. týdnem těhotenství (viz bod 4.3).
Kojení
Nebyly provedeny žádné studie, které zkoumaly množství kyseliny misoprostolové v kolostru nebo mateřském mléce po použití přípravku Misodel.
Kyselina misoprostolová byla detekována v mateřském mléce po perorálním podání misoprostolu v tabletové formě.
Po vyjmutí přípravku Misodel je medián poločasu kyseliny misoprostolové v plasmě přibližně 40 minut. Po pěti poločasech, tj. přibližně 3 hodinách, jsou koncentrace kyseliny misoprostolové v plasmě matky zanedbatelné. Kyselina misoprostolová může být vylučována do kolostra a mateřského mléka, předpokládá se však, že ve velmi nízkých koncentracích, které by neměly být důvodem pro omezení kojení. Při použití přípravku Misodel nebyly v rámci programu klinického vývoje pozorovány žádné účinky na kojené novorozence.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Není relevantní.
4.8 Nežádoucí účinky
Zkušenosti z klinických studií
Shrnutí profilu bezpečnosti
Profil nežádoucích reakcí v tabulce 1 je založen na pěti klinických studiích provedených s přípravkem Misodel u 874 těhotných žen v době porodu v normálním termínu. Nejčastější nežádoucí reakce jsou abnormální kontrakce dělohy, porucha srdeční frekvence plodu a abnormální porodní stahy vedoucí k postižení plodu.
Tabulka 1 Nežádoucí reakce pozorované v klinických studiích
| Vyjadřování frekvence podle | Velmi časté (>1/10) | Časté (>1/100 až <1/10) | Méně časté (>1/1,000 až <1/100) |
| Poruchy nervového systému | Hypoxicko-ischemická encefalopatie | ||
| Srdeční poruchy | Porucha srdeční frekvence plodu' | ||
| Respirační, hrudní a mediastinální poruchy | Dechový útlum * novorozence* | ||
| Přechodná tachypnoe novorozence | |||
| Gastrointestinální poruchy | Nauzea Zvracení | ||
| Poruchy kůže a podkožní tkáně | Vyrážka | ||
| Stavy spojené s těhotenstvím, šestinedělím a perinatálním obdobím | Mekonium v plodové vodě Abnormální děložní kontrakce | Acidóza plodu Poporodní krvácení | Předporodní krvácení Předčasná separace placenty |
| Abnormální porod ovlivňující plod | Děložní hypertonus | ||
| Poruchy reprodukčního systému a prsu | Pruritus genitálu | ||
| Vyšetření | Nízké Apgar skóre | Zvýšený krevní tlak | |
| Poranění, otravy a procedurální, komplikace | Ruptura dělohy |
'Termín porucha srdeční frekvence plodu zahrnuje různé typy neuspokojivé srdeční frekvence plodu
V pivotní studii přípravku Misodel (Miso-Obs-303: studie EXPEDITE) byli novorozenci sledováni první měsíc po porodu z hlediska přijetí do nemocnice nebo vyšetření na pohotovosti. Nebyly hlášeny žádné nežádoucí reakce po propuštění z nemocnice.
Hlášení podezření na nežádoucí reakce
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv Šrobárova 48
100 41 Praha 10
Webové stránky:
4.9 Předávkování
Nejsou k dispozici žádné jiné zkušenosti než zkušenosti s jednou aplikací přípravku Misodel. Riziko předávkování omezuje léková forma s řízeným uvolňováním a možnost vyjmout Misodel a tím zastavit podávání misoprostolu. Ponechání přípravku Misodel in situ z nedopatření po začátku porodní aktivity může vést k příznakům předávkování prostaglandinem (nadměrná stimulace dělohy). Pokud k tomu dojde, je nutno vyjmout Misodel a aplikovat léčbu v souladu s místními zvyklostmi.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Jiná gynekologika, uterotonika, prostaglandiny, ATC kód: G02AD06.
Mechanismus účinku
Misoprostol je syntetický analog prostaglandinu E1 (PGE1), což je přirozeně se vyskytující látka s oxytocinovým účinkem. Bylo prokázáno, že prostaglandiny řad E a F zvyšují in vitro aktivitu kolagenázy ve fibroblastech děložního hrdla králíků a způsobují dozrávání děložního hrdla a děložní stahy in vivo. Tyto farmakodynamické účinky jsou považovány za základ mechanismu účinku, který je relevantní pro klinický účinek přípravku Misodel.
Analoga PGE mají také řadu dalších účinků, např. relaxaci bronchiální a tracheální svaloviny, zvýšení sekrece hlenu a snížení sekrece kyseliny a pepsinu v žaludku, zvýšení průtoku krve ledvinami, zvýšení koncentrací cirkulujícího adrenokortikotropního hormonu a prolaktinu. Tyto farmakodynamické účinky nejsou při krátkodobé léčbě považovány za klinicky významné.
Klinická účinnost a bezpečnost
Pivotní studie fáze III (Miso-Obs-303: studie EXPEDITE) byla dvojitě zaslepená, randomizovaná, multicentrická studie provedená v USA u 1 358 těhotných žen. Studie porovnávala účinnost a bezpečnost přípravku Misodel a 10 mg dinoprostonu v systému pro vaginální podávání (PROPESS®). Nulipary a ženy, které již rodily, s nepříznivým stavem děložního hrdla (s modifikovaným Bishopovým skóre < 4) byly randomizovány do skupiny léčené přípravkem Misodel nebo do skupiny užívající přípravek PROPESS® po dobu až 24 hodin. Jedním z primárních cílů studie byla doba do vaginálního porodu a komprimárním výsledným ukazatelem bezpečnosti byla incidence porodů císařským řezem.
Tabulka 2 prezentuje klíčové výsledky primárních a sekundárních výsledných ukazatelů této studie.
Tabulka 2 Klíčové výsledné ukazatele Miso-Obs-303: studie EXPEDITE
| Misodel 200 mcg (N=678) | PROPESS® 10 mg (N=680) | Hodnota p | |
| Medián doby do vaginálního porodu novorozence (hodiny [h]) Nulipary Ženy, které již rodily | 21,5h 29,2 h (n=441) | 32,8h 43,1 h (n=451) | p < 0,001 p < 0,001 |
| 13,4 h (n=237) | 20,1 h (n=229) | p < 0,001 | |
| Incidence porodu císařským řezem n (%) | 176 (26,0%) | 184 (27,1%) | p = 0,646 |
| Nulipary | 152 (34,5%) | 168 (37,3%) | p = 0,386 |
| Ženy, které již rodily | 24 (10,1%) | 16 (7,0%) | p = 0,226 |
| Medián doby do všech porodů novorozence (vaginální a císařský řez) (h) | 18,3hf | 27,3hf | p < 0,001 |
| Celkový medián doby do začátku aktivně probíhajícího porodu (hodiny) | 12,1hff | 18,6hff | p < 0,001 |
| Celkový počet žen, které dostaly před | 324 (48,1%) | 497 (74,1%) | p < 0,001 |
| porodem oxytocin [n (%)] | (N=674) | (N=671) |
Ženy, které rodily císařským řezem, byly propuštěny před porodem, nebo které zrušily souhlas v průběhu první hospitalizace, byly cenzorovány za použití nejdelšího časového intervalu od podání zkoušeného léku do porodu císařským řezem nebo do porodu a propuštění (odhad metodou Kaplana-Meiera).
** Shrnutí mediánu doby do vaginálního porodu (pouze ženy, které rodily vaginálně): Misodel, 200 mcg: 16,6 h; PROPESS® 10 mg: 25,1 h
f Shrnutí mediánu doby do jakéhokoli porodu: Misodel, 200 mcg: 18,2 h; PROPESS® 10 mg: 27,2 h
ff Shrnutí mediánu doby do začátku aktivního porodu: Misodel, 200 mcg: 12,0 h; PROPESS® 10 mg: 18,0 h
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky klinických studií s přípravkem Misodel u jedné nebo více podskupin pediatrické populace při indukci porodu ve schválené indikaci (Viz bod 4.2 uvádějící informace o použití v pediatrické populaci).
5.2 Farmakokinetické vlastnosti
Misoprostol je chemicky ester a je rychle metabolizován na kyselinu misoprostolovou. V plasmě je možno prokázat pouze kyselinu misoprostolovou. Tato kyselina je dále metabolizována na inaktivní dinorové a tetranorové metabolity této kyseliny, které jsou eliminovány močí.
U netěhotných žen dochází k řízenému uvolňování ze systému pro vaginální podávání Misodel in vivo průměrnou rychlostí přibližně 7 mikrogramů za hodinu po dobu 24 hodin. V studii 24 těhotných žen v normálním termínu byly pozorovány medián Cmax 45,8 pg/ml při mediánu Tmax 4 hodiny. Medián terminálního poločasu (po vyjmutí inzertu) byl přibližně 40 minut.
Vazba kyseliny misoprostolové na sérové proteiny je méně než 90 % a koncentrace není závislá na terapeutických dávkách.
5.3 Předklinické údaje vztahující se k bezpečnosti
Konvenční studie farmakologie bezpečnosti, toxicity opakovaných dávek, genotoxicity a karcinogenity léčivé látky přípravku Misodel, misoprostolu, nezjistily žádná speciální rizika pro člověka.
U potkanů nebyly pozorovány žádné teratogenní účinky misoprostolu v dávkách až 10 mg/kg/den. U králíků bylo při dávkování 1 mg/kg/den pozorováno zvýšení počtu plodů s žebry navíc, což bylo pravděpodobně spojeno s toxicitou pro březí samice při této úrovni dávky. Při úrovních dávek blížící se letální dávce byly u myších plodů pozorovány různé fetální defekty. Jsou důkazy o možném nežádoucím účinku misoprostolu na implantaci, a v studiích fertility a embryonálního vývoje u potkanů byla zjištěna dávka bez pozorovaných nežádoucích účinků 0,4 mg/kg/den. Výše popsaná zjištění u myší a potkanů nejsou významná, protože Misodel je kontraindikován pro použití před 36. týdnem těhotenství.
Studie perinatální a postnatální toxicity u potkanů zjistily dávku perorálně podaného misoprostolu bez účinku na parametry reprodukce až do 1,0 mg/kg/den. Srovnáním expozice v studiích kinetiky u potkanů a lidí byl pro přípravek Misodel podaný v dávce 200 ve formě miniaturního systému pro vaginální podávání misoprostolu stanoven faktor bezpečnosti 20.
Nebyly zjištěny žádné důkazy lokálního dráždění v pochvě nebo v děložním hrdle po podání přípravku Misodel březím potkaním samicím.
Na základě výsledků konvenčních studií toxicity in vitro a in vivo nejsou známa žádná rizika pro člověka z hlediska systémové toxicity hydrogelového polymeru, polymerového systému pro vytažení a pomocných látek. Hydrogelové polymery a polyesterový systém pro vytažení obsahují inertní látky, které jsou lokálně dobře tolerovány.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Zesítěný hydrogelový polymer (obsahující makrogol, hexantriol a methylendicyklohexan-diisokyanát).
Butylhydroxyanisol
Polyesterový systém pro vytažení (příze tkaného polyesteru)
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
3 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v mrazničce (-10 až –25 °C). Před použitím není nutné rozmrazovat.
6.5 Druh obalu a obsah balení
1 × 200 mikrogramů vaginální inzert
5 × 200 mikrogramů vaginální inzert
5 × 200 mikrogramů vaginální inzert (multi-balení)
Každý vaginální inzert je uložen v individuálním sáčku z hliníkové fólie vyrobeném z vrstveného proužku hliníkové fólie obsahujícího pohlcovač vlhkosti a je balený v krabičce.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a zacházení s ním
Přípravek Misodel by měl být krátce před zavedením vyjmut z mrazničky a dále vyjmut ze sáčku z vrstvené hliníkové fólie.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
FERRING Pharmaceuticals CZ s.r.o.
K Rybníku 475
252 42 Jesenice u Prahy
Česká republika
8. REGISTRAČNÍ ČÍSLO (A)
54/123/14-C
Další informace o léčivu MISODEL
Jak
se MISODEL
podává: vaginální podání - vaginální inzert
Výdej
léku: výdej na lékařský předpis s omezením (omezení podle § 39 odst. 4 písm. a) ZoL)
Balení: Sáček
Velikost
balení: 5 MULTIPACK
Držitel rozhodnutí o registraci daného léku v České republice:
FERRING Pharmaceuticals CZ s.r.o., Jesenice u Prahy
E-mail: cz1-info@ferring.com
Telefon: +420 234 701 333
