Souhrnné informace o léku - MICTONORM 15 MG POTAHOVANÉ TABLETY
1. NÁZEV PŘÍPRAVKU
Mictonorm 15 mg potahované tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna potahovaná tableta obsahuje propiverini hydrochloridum 15 mg, ekvivalentní propiverinum 13,64 mg.
Pomocné látky se známým účinkem: jedna potahovaná tableta obsahuje 100,7 mg monohydrátu laktózy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
3. LÉKOVÁ FORMAPotahovaná tableta
Popis přípravku: bílé kulaté bikonvexní potahované tablety.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Symptomatická léčba močové inkontinence a/nebo zvýšené frekvence močení a nutkání k močení u pacientů se syndromem hyperaktivního močového měchýře nebo neurogenní hyperaktivitou detrusoru v důsledku poranění míchy.
4.2 Dávkování a způsob podání
Potahovaná tableta pro perorální podání.
Doporučené denní dávky jsou následující:
Dospělí:
Doporučená standardní dávka je 1 potahovaná tableta (= 15 mg propiverin-hydrochloridu) dvakrát denně; může se zvýšit na třikrát denně. Někteří pacienti mohou reagovat již na dávku 15 mg/ den. Při neurogenní hyperaktivitě detrusoru se doporučuje 1 potahovaná tableta třikrát denně. Maximální doporučená denní dávka propiverin-hydrochloridu je 45 mg.
Pediatrická populace:
Vzhledem k nedostatku údajů nemá být tento přípravek podáván dětem.
Starší pacienti:
Pro starší pacienty není určen speciální režim dávkování (viz bod 5.2).
Je třeba zvýšené opatrnosti a pečlivé lékařské kontroly pro nežádoucí účinky u pacientů s některým z následujících onemocnění (viz body 4.4, 4.5):
Použití u pacientů s poruchou funkce ledvin: u pacientů s lehkou a středně těžkou poruchou funkce ledvin není nutné dávkování upravovat (tito pacienti by však měli být léčeni se zvýšenou opatrností). Pro pacienty s těžkou poruchou funkce ledvin (clearance kreatininu < 30 ml/min) je stanovena maximální denní dávka 30 mg.
Použití u pacientů s poruchou funkce jater: u pacientů s lehkou poruchou funkce jater nemusí být dávkování měněno (tito pacienti by však měli být opět léčeni se zvýšenou opatrností). Studie u pacientů se středně těžkou nebo těžkou poruchou funkce jater nebyly prováděny – proto je u nich léčba propiverinem kontraindikována.
Tučné jídlo zvyšuje biologickou dostupnost propiverinu. Proto by měli pacienti užívat propiverin před jídlem. To je důležité především u pacientů s poruchou funkce ledvin či jater – viz bod 5.2.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoliv pomocnou látku tohoto přípravku.
Pacienti mající jedno z následujících onemocnění:
-
– obstrukci střeva
-
– významný stupeň obstrukce v odtoku moči z měchýře, kdy lze očekávat retenci moči
-
– myasthenia gravis
-
– intestinální atonii
-
– těžkou colitis ulcerosa
-
– toxické megakolon
-
– nekontrolovaný glaukom s uzavřeným úhlem
-
– střední nebo těžkou poruchu funkce jater
-
– tachyarytmii
4.4 Zvláštní upozornění a opatření pro použití
Lék se musí užívat s opatrností u pacientů trpících:
-
– autonomní neuropatií,
-
– poruchou funkce ledvin (viz bod 4.2),
-
– poruchou funkce jater (viz bod 4.2).
Po podání léku se mohou zhoršit symptomy těchto nemocí:
-
– těžké kongestivní srdeční selhání (NYHA IV)
-
– zbytnění prostaty
-
– hiátová hernie s refluxní chorobou jícnu
-
– srdeční arytmie
-
– tachykardie
Propiverin, stejně jako jiná anticholinergika, vyvolává mydriázu. Může proto u jedinců s predispozicí úzkých úhlů přední komory zvýšit riziko vyvolání akutního glaukomu s uzavřeným úhlem. Bylo hlášeno, že léky z této třídy, včetně propiverinu, mohou vyvolat nebo urychlit vznik glaukomu s uzavřeným úhlem.
Před zahájením léčby se musí vyloučit polakisurie a nykturie v důsledku renálního onemocnění nebo městnavého srdečního selhání i organické nemoci močového měchýře (např. infekce močových cest, maligní nádor).
Tento přípravek obsahuje monohydrát laktózy.
Pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, vrozeným nedostatkem laktázy nebo malabsorpcí glukózy a galaktózy by neměli tento přípravek užívat.
Kvůli vyššímu obsahu léčivé látky nemá být Mictonorm 15 mg potahované tablety podáván dětem mladším 12 let a dospělým s tělesnou hmotností nižší než 35 kg.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
-
– Zvýšení účinků při souběžném podávání tricyklických antidepresiv (např. imipramin), trankvilizérů (např. benzodiazepiny), anticholinergik (jsou-li podávána systémově), amantadinu, neuroleptik (např. fenothiazinů) a agonistů beta-adrenoceptoru (beta-sympatomimetik).
-
– Snížení účinků při souběžném podávání cholinergik.
-
– Pokles krevního tlaku u pacientů léčených isoniazidem.
-
– Účinek prokinetik jako metoclopramidu se může snížit.
-
– Jsou možné farmakokinetické interakce s jinými přípravky, metabolizovanými cytochromem P450 3A4 (CYP 3A4). Neočekává se však výrazný nárůst jejich plasmatické koncentrace, protože účinky propiverinu jsou ve srovnání s klasickými enzymovými inhibitory (např. ketokonazol nebo grapefruitový džus) malé. Propiverin lze považovat za slabý inhibitor CYP 3A4. Farmakokinetické studie u pacientů užívajících současně potentní inhibitory CYP 3A4 jako azolová antimykotika (např. ketokonazol, itrakonazol) nebo makrolidová antibiotika (např. erythromycin, clarithromycin) nebyly prováděny.
-
– Pacienti, kteří jsou současně léčeni silnými inhibitory enzymu CYP3A4 a methimazolem: Pacientům, kteří jsou současně s propiverinem léčeni silnými inhibitory monooxygenasy obsahující flavin (FMO), např. methimazol, a silnými inhibitory CYP 3A4/5 by měla být na začátku léčby podávána dávka 15 mg/den. Poté může být dávka na potřebnou hodnotu individuálně vytitrována. Nicméně je třeba postupovat opatrně a lékaři mají sledovat u těchto pacientů nežádoucí účinky (viz bod 5.2).
4.6 Fertilita, těhotenství a kojení
Fertilita
Nejsou k dispozici žádné klinické údaje o účincích propiverinu na plodnost. Studie na zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky na fertilitu.
Těhotenství
Nejsou k dispozici žádné údaje o podávání propiverinu těhotným ženám. Studie na zvířatech ukázaly na reprodukční toxicitu (viz bod 5.3). Mictonorm 15 mg potahované tablety se během těhotenství nedoporučuje.
Kojení
Není známo, zda se propiverin nebo jeho metabolity vylučují do lidského mateřského mléka. Dostupné farmakodynamické/toxikologické údaje u zvířat prokázaly vylučování propiverinu nebo metabolitů do mléka (viz bod 5.3). Riziko pro novorozence a kojence nelze vyloučit.
Je nutné rozhodnout, zda přerušit kojení nebo přerušit/zdržet se léčby propiverinem. V úvahu je třeba vzít přínos kojení pro dítě a přínos léčby pro ženu.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Nebyly provedeny žádné studie o účincích na schopnost řídit a obsluhovat stroje.
Propiverin může vyvolat malátnost a zamlžené vidění. To může zhoršit schopnost pacienta vykonávat činnosti, které vyžadují duševní bdělost, jako je řízení motorového vozidla a jiných strojů, resp. provádění jiných nebezpečných prací. Malátnost způsobenou propiverinem mohou zvýšit sedativa.
4.8 Nežádoucí účinky
V každé třídě orgánových systémů jsou nežádoucí účinky řazeny dle četnosti podle následující konvence:
Velmi časté (>1/10)
Časté (>1/100 až <1/10)
Méně časté (>1/1 000 až <1/100)
Vzácné (>1/10 000 až <1/1 000)
Velmi vzácné (<1/10 000)
Není známo (z dostupných údajů nelze určit)
Všechny nežádoucí účinky jsou přechodné a ustupují po snížení dávky nebo ukončení terapie nejdéle za 1 – 4 dny.
Poruchy imunitního systému
| vzácné: | hypersenzitivita |
Psychiatrické poruchy
| velmi vzácné: | neklid, zmatenost |
| není známo: | halucinace |
Poruchy nervového systému
| časté: | bolesti hlavy |
| méně časté: | tremor, závrať, poruchy chuti |
| není známo: | poruchy řeči |
| Poruchy oka časté: | poruchy akomodace, zhoršení zraku |
Srdeční poruchy
| vzácné: | tachykardie |
| velmi vzácné: | palpitace |
| Cévní poruchy méně časté: | snížený krevní tlak s ospalostí, zrudnutí |
Gastrointestinální poruchy
| velmi časté: | sucho v ústech |
| časté: | obstipace, bolest břicha, dyspepsie |
| méně časté: | nauzea/zvracení |
Poruchy kůže a podkožní tkáně
| méně časté: | svědění |
| vzácné: | vyrážka |
| Poruchy ledvin méně časté: | a močových cest retence moči, symptomy močového měchýře a močové trubice |
časté: únava
Při dlouhodobé terapii je nutné sledovat jaterní testy, protože vzácně může dojít k reverzibilním změnám jaterních enzymů.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
webové stránky:
4.9 Předávkování
4.9 PředávkováníSymptomy:
Předávkování propiverinem, antagonistou muskarinového receptoru, může potenciálně vést k závažným anticholinergním účinkům, charakterizovaným periferními symptomy a poruchami centrální nervové soustavy, např.
-
– závažné sucho v ústech
-
– bradykardie, což může vest k tachykardii
-
– mydriáza a poruchy akomodace
-
– retence moči
-
– inhibice intestinální motility
-
– neklid, zmatenost, halucinace, konfabulace
-
– závratě, nevolnost, poruchy řeči, svalová slabost
Léčba:
-
– V případě předávkování propiverin-hydrochloridem má být pacient léčen suspenzí aktivního uhlí a velkým množstvím vody.
-
– Výplach žaludku připadá v úvahu pouze s ochrannou intubací za použití naolejované sondy (kvůli suchosti sliznic) a je-li proveden do 1 hodiny po požití propiverinu. Zvracení nesmí být vyvoláno.
-
– Forsírovaná diuréza nebo hemodialýza nevedou ke zvýšení renální eliminace.
-
– V případě závažných centrálních anticholinergních účinků (halucinace, výrazná excitace) lze použít jako antidotum fysostigmin.
-
– Křeče či výrazná excitace: léčba benzodiazepiny.
-
– Dechová nedostatečnost: léčba umělou ventilací.
-
– Retence moči: léčba katetrizací.
-
– Mydriáza: léčba očními kapkami pilokarpinu a/nebo zatemněním pacientova pokoje.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
ATC kód: G04BD06
Farmakoterapeutická skupina: Urologika, léky pro časté nucení na močení a inkontinenci
Mechanismus působení
Inhibice vstupu vápníku a modulace nitrobuněčného vápníku v buňkách hladkého svalu močového měchýře způsobuje muskulotropní spasmolýzu.
Inhibice efferentního spojení nervus pelvicus vlivem anticholinergního působení.
Farmakodynamické účinky
V experimentech na zvířatech vyvolává propiverin-hydrochlorid na dávce závislé snížení intravezikálního tlaku a zvýšení kapacity močového měchýře.
Účinek je založen na farmakologických vlastnostech propiverinu a jeho tří urinárně aktivních metabolitů, jak bylo prokázalo na izolovaných stripech detrusoru močového měchýře lidského a zvířecího původu.
5.2 Farmakokinetické vlastnosti
Obecná charakteristika léčivé látky
Propiverin se téměř kompletně absorbuje z gastrointestinálního traktu. Podléhá vysokému first pass metabolismu. Účinky na buňky hladkého svalu močového měchýře jsou způsobeny vlastní léčivou látkou a třemi aktivními metabolity, které se rychle vylučují do moči.
Absorpce
Bioekvivalence Mictonormu 15 mg potahované tablety s referenčním léčivým přípravkem Mictonorm byla prokázána vhodnou studií biologické dostupnosti.
Po perorálním podání Mictonormu se propiverin rychle absorbuje z gastrointestinálního traktu a maximální koncentrace v plasmě dosahuje za 2,3 hodiny. Průměrná absolutní biologická dostupnost Mictonormu (propiverin-hydrochloridu 15 mg) je 40,5 % (aritmetická střední hodnota pro AUC'ii-V (p.o.) / AUC0-V (i.v.)).
Požití jídla zvyšuje biologickou dostupnost propiverinu (střední nárůst 1,3 krát), ale významně neovlivňuje maximální koncentraci propiverinu nebo jeho hlavního metabolitu, N-oxid propiverinu v plasmě. Tento rozdíl v biologické dostupnosti pravděpodobně není klinicky významný, ale úpravu dávky je nutné zvážit u pacientů s poruchou funkce jater a ledvin. Proto by měl být propiverin užíván pravidelně před jídlem.
Distribuce
Po opakovaném podávání Mictonormu třikrát denně se rovnovážného stavu koncentrací dosáhne po čtyřech až pěti dnech při vyšší koncentraci než po aplikaci jediné dávky (Cprům. = 61 ng/ml). Distribuční objem byl měřen u 21 zdravých dobrovolníků po intravenózní aplikaci propiverin-hydrochloridu a pohyboval se v rozpětí od 125 do 473 l (průměr 279 l), což ukazuje, že velké množství propiverinu se distribuje do periferních kompartmentů. Vazba na bílkoviny plasmy je 90 –95 % pro výchozí látku a asi 60 % pro hlavní metabolit.
Koncentrace propiverinu v plasmě u 16 zdravých dobrovolníků po jedné a opakovaných dávkách Mictonormu (třikrát denně po 6 dnů):
[ng/ml]
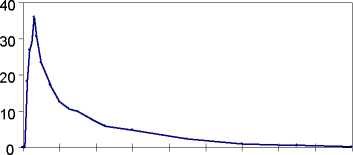
0 8 16 24 32 40 48 56 64 72 čas [h]
[ng/ml]
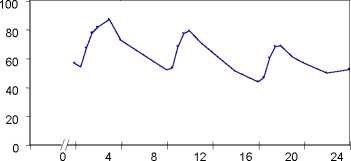
čas [h]
jediná dávka
vícenásobné dávky
Charakteristiky rovnovážného stavu propiverinu po vícenásobné aplikaci Mictonormu 16 zdravým dobrovolníkům (třikrát denně po 6 dnů):
| interval dávky [h] | AUC0-T [ng-h/m l] | CV [%] | PTF [%] | CV [%] | Cprům. [ng/ml] | CV [%] |
| 0 – 8 | 515 | 35 | 57 | 16 | 64 | 36 |
| 8 – 16 | 460 | 33 | 70 | 25 | 57 | 33 |
| 16 – 24 | 421 | 36 | 52 | 39 | 52 | 36 |
| CV: coefficient of variation (variační koeficient) PTF: peak-trough fluctuation (kolísání mezi vrcholovou a minimální hladinou) | ||||||
Biotransformace
Propiverin je extenzivně metabolizován střevními a jaterními enzymy. Primární metabolická cesta zahrnuje oxidaci piperidylu-N a je zprostředkována CYP 3A4 a flavinmonoxygenázou (FMO) 1 a 3. Dochází k tvorbě mnohem méně aktivního N-oxidu, jehož koncentrace v plasmě značně převyšuje koncentraci výchozí látky. V moči byly zjištěny čtyři metabolity; tři z nich jsou farmakologicky aktivní a mohou přispět k terapeutické účinnosti Mictonormu.
In vitro byla (při koncentracích převyšujících terapeutické koncentrace v plasmě 10 – 100 x – viz bod 4.5) zjištěna slabá inhibice CYP 3A4 a CYP 2D6.
Eliminace
Po perorálním podání dávky 30 mg 14C- propiverin-hydrochloridu zdravým dobrovolníkům bylo během 12 dnů vyloučeno do moči 60 % radioaktivity a 21 % se vyloučilo do stolice. Méně než 1 % perorální dávky se vylučuje do moči v nezměněném stavu. Průměrná celková clearance po podání jedné 30 mg dávky je 371 ml/min (191 – 870 ml/min).
Ve třech studiích, zahrnujících celkem 37 zdravých dobrovolníků, byl průměrný poločas eliminace
-
14,1 hodin, resp. 20,1 a 22,1 hodin.
Linearita / nelinearita
Farmakokinetické parametry propiverinu a N-oxidu propiverinu po perorálním podání 10 – 30 mg propiverin-hydrochloridu jsou lineárně závislé na dávce.
Při rovnovážném stavu nejsou ve srovnání s podáním jediné dávky žádné změny ve farmakokinetice.
Charakteristiky u pacientů
Porucha funkce ledvin:
Vážné poruchy ledvin nemění významně dispozici propiverinu a jeho hlavního metabolitu N-oxidu propiverinu, jak vyplývá ze studie s jednou dávkou u 12 pacientů s clearance kreatininu < 30 ml/min. Upravovat dávku není nutné, pokud celková denní dávka propiverin-hydrochloridu nepřekročí 30 mg (tj. Mictonorm 15 mg potahované tablety, podávaný dvakrát denně). V případě, že se má podávat vyšší dávka (tj. 45 mg), doporučuje se pečlivá titrace dávky a anticholinergního účinku jako ukazatele snášenlivosti.
Porucha funkce jater:
U 12 pacientů s mírnou až střední poruchou funkce jater (steatóza jater) byla ve srovnání s 12 zdravými kontrolními osobami podobná farmakokinetika rovnovážného stavu. Pro závažné poruchy jater nejsou údaje k dispozici.
Věk:
Porovnání minimálních koncentrací v plasmě při rovnovážném stavu (Mictonorm třikrát denně po 28 dní) nevykazuje žádný rozdíl mezi staršími pacienty (60 – 85 let; průměr 68) a mladými zdravými subjekty. Poměr výchozí látky k metabolitu zůstává u starších pacientů nezměněn, což svědčí o tom, že metabolická konverze propiverinu na jeho hlavní metabolit, N-oxid propiverinu, není závislá na věku a nelimituje celkovou exkreci.
Pacienti s glaukomem:
Nitrooční tlak u pacientů s glaukomem s otevřeným úhlem a u pacientů s léčeným (zvládnutým) glaukomem s uzavřeným úhlem se po podání Mictonormu třikrát denně po 7 dnů nezvyšuje, jak bylo prokázáno dvěma placebem kontrolovanými studiemi.
5.3 Předklinické údaje vztahující se k bezpečnosti
5.3 Předklinické údaje vztahující se k bezpečnosti-
V dlouhodobých studiích s perorálním dávkováním na dvou druzích savců byly hlavním účinkem spojeným s léčbou změny v játrech (včetně elevace hepatických enzymů). Tyto změny byly charakterizovány hypertrofií jater a tukovou degenerací jater – tato tuková degenerace byla po ukončení léčby reverzibilní.
-
V toxikologických studiích na potkanech nebyly pozorovány žádné účinky na samčí a samičí fertilitu a na reprodukční chování.
Ve studiích na zvířatech se objevila při perorálním podávání vysokých dávek březím samicím skeletální retardace plodu.
Látka se vylučovala do mléka kojících savců.
Nebyly nalezeny důkazy o mutagenitě. Studie na karcinogenitu, provedená na myších, ukázala při vysokých dávkách zvýšený výskyt hepatocelulárních adenomů a karcinomů u samců. Studie na karcinogenitu u potkanů odhalila při vysokých dávkách u samců hepatocelulární a ledvinové adenomy, jakož i papilomy močového měchýře, u samic polypy na slizniční vrstvě dělohy. Všechny uvedené tumory byly považovány za druhově specifické, a proto nejsou klinicky významné.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Jádro tablety:
-
– monohydrát laktózy
-
– celulozový prášek
-
– magnesium-stearát
Potahová vrstva:
-
– hypromelosa
-
– mikrokrystalická celulóza
-
– kyselina stearová
-
– mastek
-
– oxid titaničitý (E 171)
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
4 roky
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.5 Druh obalu a obsah balení
Potahované tablety jsou baleny v PVC/PVDC/hliníkových blistrech po 14, 20, 28, 30, 49, 50, 56, 60, 84, 98, 100, 112, 168, 252, 300 nebo 500 tabletách a vícečetném balení obsahujícím 280 (10 krabiček po 28 tabletách) potahovaných tablet.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
7. DRŽITEL ROZHODNUTÍ O REGISTRACIdo 30. 11. 2018
APOGEPHA Arzneimittel GmbH
KyffhauserstraBe 27
01309 Drážďany
Německo
od 1. 12. 2018
Herbacos Recordati s.r.o.
Štrossova 239
530 03 Pardubice
Česká republika
8. REGISTRAČNÍ ČÍSLO
73/420/16-C
Další informace o léčivu MICTONORM 15 MG POTAHOVANÉ TABLETY
Jak
se MICTONORM 15 MG POTAHOVANÉ TABLETY
podává: perorální podání - potahovaná tableta
Výdej
léku: na lékařský předpis
Balení: Blistr
Velikost
balení: 100
Držitel rozhodnutí o registraci daného léku v České republice:
Herbacos Recordati s.r.o., Pardubice
E-mail: petr.simerda@recordati.cz
Telefon: 721211559
