Souhrnné informace o léku - LUNALDIN
1. NÁZEV PŘÍPRAVKU
Lunaldin 100 mikrogramů sublingvální tablety
Lunaldin 200 mikrogramů sublingvální tablety
Lunaldin 300 mikrogramů sublingvální tablety
Lunaldin 400 mikrogramů sublingvální tablety
Lunaldin 600 mikrogramů sublingvální tablety
Lunaldin 800 mikrogramů sublingvální tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna sublingvální tableta obsahuje:
fentanylum 100 ^g (ve formě citrátu) fentanylum 200 ^g (ve formě citrátu) fentanylum 300 ^g (ve formě citrátu) fentanylum 400 ^g (ve formě citrátu) fentanylum 600 ^g (ve formě citrátu) fentanylum 800 ^g (ve formě citrátu)
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Sublingvální tableta.
sublingvální tableta o síle 100 mikrogramů je bílá, kulatá tableta
sublingvální tableta o síle 200 mikrogramů je bílá, oválná tableta sublingvální tableta o síle 300 mikrogramů je bílá, trojúhelníková tableta sublingvální tableta o síle 400 mikrogramů je bílá, kosočtvercová tableta sublingvální tableta o síle 600 mikrogramů je bílá tableta ve tvaru D sublingvální tableta o síle 800 mikrogramů je bílá tableta ve tvaru tobolky
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Zvládnutí průlomové bolesti u dospělých pacientů užívajících opioidy vzhledem ke chronickým bolestem vyvolaným nádorem. Průlomová bolest je přechodnou exacerbací jinak kontrolované chronické bolesti.
4.2 Dávkování a způsob podání
Lunaldin lze podávat pouze pacientům, kteří jsou považováni za tolerantní vůči své opioidní terapii chronické nádorové bolesti. Pacienty lze považovat za tolerantní, pokud užívají nejméně 60 mg perorálního morfinu denně, nejméně 25 ^g transdermálního fentanylu za hodinu, nejméně 30 mg oxykodonu denně, nejméně 8 mg hydromorfonu perorálně denně nebo analgeticky ekvivalentní dávku jiného opioidu po dobu jednoho týdne nebo déle.
Způsob podání:
Lunaldin sublingvální tablety podávejte přímo pod jazyk, a to co nejhlouběji. Tablety není vhodné polykat; je nutno je ponechat pod jazykem do úplného rozpuštění bez kousání nebo cucání. Pacienti mají být upozorněni, aby nejedli a nepili, dokud se sublingvální tableta zcela nerozpustí.
U pacientů, kteří mají sucho v ústech, lze sliznici před užitím přípravku Lunaldin zvlhčit vodou.
Titrace dávky:
Cílem titrace dávkování je zjistit optimální udržovací dávku pro dlouhodobou léčbu epizod průlomové bolesti. Tato optimální dávka má poskytnout adekvátní analgezii s přijatelnou hladinou nežádoucích reakcí.
Optimální dávku přípravku Lunaldin stanovte titrací směrem nahoru, dle individuálních potřeb pacienta. K dispozici je několik dávek k použití během titrační fáze. Jako počáteční dávku použijte 100 ^g, a titrujte nahoru podle potřeby a možností různých lékových sil.
Pacienti mají být pečlivě sledováni, dokud není dosaženo optimální dávky.
Přechod z jiných fentanylových přípravků na Lunaldin nelze provést v dávce 1:1, a to vzhledem k různým absorpčním profilům. Pokud pacienti přecházejí z jiných fentanylových přípravků, je nutná nová titrace dávky přípravku Lunaldin.
Při titraci doporučujeme následující dávkový režim, lékař však vždy musí vzít v potaz klinické potřeby pacienta, věk a přidružená onemocnění.
Všichni pacienti musí terapii zahájit jedinou 100 ^g sublingvální tabletou. Pokud se do 15–30 minut od podání jediné tablety nedostaví přiměřená analgezie, lze podat doplňkovou (druhou) 100 ^g tabletu. Pokud se do 15–30 minut od podání první dávky nedostaví přiměřená analgezie, je třeba zvážit při příští epizodě průlomové bolesti zvýšení dávky na následující vyšší lékovou sílu (viz následující schéma).
Zvyšování dávek musí pokračovat v krocích, dokud není zajištěna přiměřená analgezie s nežádoucími účinky, které lze tolerovat. V dávkách 400 ^g a vyšších je vhodné nahradit u dodatečné (druhé) tablety sílu 100 ^g za 200 ^g. Viz následující schéma. Při jediné epizodě průlomové bolesti během titrační fáze nepodávejte více než dvě (2) dávky.
LUNALDIN – TITRAČNÍ PROCES
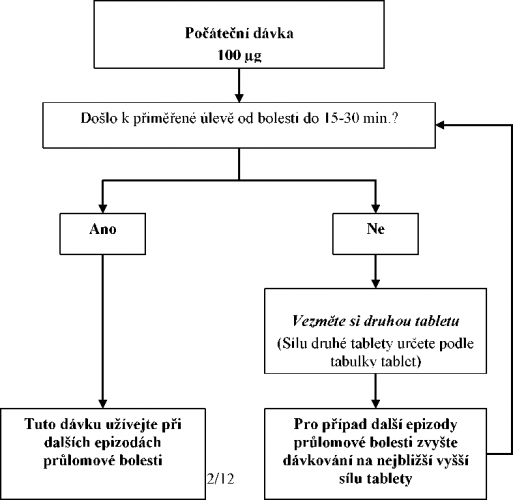
| Síla (v mikrogramech) první sublingvální tablety při epizodě průlomové bolesti | Síla (v mikrogramech) dodatečné (druhé) sublingvální tablety k užití (v případě potřeby) 15–30 minut po první tabletě |
| 100 | 100 |
| 200 | 100 |
| 300 | 100 |
| 400 | 200 |
| 600 | 200 |
| 800 | – |
Pokud je přiměřené analgezie dosaženo při vyšší dávce, ale nežádoucí účinky nejsou přijatelné, lze podávat kompromisní dávku (tam, kde je to zapotřebí, lze použít 100 ^g tabletu).
Během titrace dávky je možné pacienty poučit, aby pro jakoukoli jednotlivou dávku užívali násobky tablet s obsahem 100 mikrogramů a/nebo 200 mikrogramů. Při jedné příležitosti nesmí být užito více než čtyři (4) tablety.
Účinnost a bezpečnost dávek vyšších než 800 mikrogramů nebyly v klinických studiích u pacientů hodnoceny.
K minimalizaci rizika nežádoucích reakcí na opioidy a k usnadnění detekce správné dávky je nutné, aby pacienti byli během titrace pečlivě sledováni odborným zdravotnickým personálem.
Během titrace mají pacienti počkat s léčbou další epizody průlomové bolesti přípravkem Lunaldin alespoň 2 hodiny.
Udržovací terapie:
Jakmile je stanovena vhodná dávka (i více než jedna tableta), pacienta je třeba na této dávce udržovat a omezit spotřebu léku na maximálně čtyři dávky přípravku Lunaldin denně.
Během udržovací fáze mají pacienti počkat s léčbou další epizody průlomové bolesti přípravkem Lunaldin alespoň 2 hodiny.
Dodatečná úprava dávky:
Pokud se odezva (analgezie nebo nežádoucí účinky) na vytitrovanou dávku přípravku Lunaldin výrazně změní, možná bude třeba dávku upravit a zajistit tak optimální dávku.
Pokud pacient trpí více než čtyřmi epizodami průlomové bolesti za den po více než čtyři po sobě jdoucí dny, přehodnoťte dávku dlouhodobě působícího opioidu podávaného proti chronické bolesti. Pokud se typ nebo dávka dlouhodobě působícího opioidu změní, přehodnoťte dávku přípravku Lunaldin a vytitrujte optimální množství znovu podle potřeby pacienta.
Na opakované titrace libovolného analgetika musí vždy dohlížet odborný zdravotnický personál.
Při absenci adekvátní kontroly bolesti je nutné vzít v úvahu možnost hyperalgezie, tolerance a progrese základního onemocnění (viz bod 4.4).
Vysazení léčby:
Pokud u pacienta již nedochází k epizodám akutních atak bolesti, přípravek Lunaldin je třeba ihned vysadit. Léčba přetrvávající základní bolesti má být zachována tak, jak je předepsána.
Pokud je potřeba vysadit veškerou léčbu opioidy, musí lékař pacienta pečlivě sledovat a řešit riziko náhlých příznaků z vysazení.
Použití u dětí a dospívajících:
Lunaldin nesmí být podáván dětem a dospívajícím do 18 let vzhledem k chybějícím údajům o bezpečnosti a účinnosti.
Použití u starších pacientů:
Titraci dávky je nutno provádět zvlášť pečlivě a pacienty pečlivě sledovat, zda nejeví známky fentanylové toxicity (viz bod 4.4).
Použití u pacientů s poruchou funkce ledvin a jater:
Pacienty s dysfunkcí ledvin nebo jater je během titrační fáze přípravku Lunaldin třeba pečlivě sledovat, zda nejeví známky toxicity (viz bod 4.4).
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Pacienti bez udržovací léčby opioidy, protože zde existuje zvýšené riziko respirační deprese. Těžká respirační deprese nebo těžká obstrukce plic.
Léčba jiné akutní bolesti než bolesti průlomové.
4.4 Zvláštní upozornění a opatření pro použití
Pacienti a jejich pečovatelé musí být poučeni, že Lunaldin obsahuje léčivou látku v množství, které může být u dětí smrtelné, a že proto musí všechny tablety udržovat z dosahu a dohledu dětí.
Vzhledem k potenciálně závažným nežádoucím účinkům, které se při užívání opioidů typu přípravku Lunaldin mohou vyskytnout, je pacienty a jejich pečovatele třeba důrazně upozornit na důležitost správného užívání přípravku Lunaldin, a co dělat, pokud by se vyskytly příznaky předávkování.
Před zahájením terapie přípravkem Lunaldin je důležité stabilizovat užívání dlouhodobě působících opioidů.
Při opakovaném podávání opioidů typu fentanylu může dojít k rozvoji tolerance a fyzické popř. psychické závislosti. Je známo, že se po léčebném používání opioidů vyskytla iatrogenní závislost.
Stejně jako u všech opioidů také při užívání přípravku Lunaldin existuje riziko klinicky významné respirační deprese. Zvláštní opatrnosti během titrace přípravku Lunaldin dbejte u pacientů s chronickým obstrukčním plicním onemocněním nebo jinými potížemi, které zvyšují náchylnost na respirační deprese (například myasthenia gravis); mohlo by dojít k zesílení respirační deprese s možným respiračním selháním.
Lunaldin podávejte s maximální opatrností u pacientů, se zvýšenou citlivostí na nitrolební účinky hyperkapnie, například u pacientů se známkami zvýšeného nitrolebního tlaku, sníženého vědomí, kómatu nebo mozkového tumoru. U pacientů se zraněním hlavy mohou opioidy zakrýt klinické známky poranění. V takovém případě použijte tyto léky pouze v případě, že je to absolutně nezbytné.
Stejně jako u jiných opioidů je třeba v případě nedostatečné kontroly bolesti v reakci na zvýšenou dávku fentanylu vzít v úvahu možnost hyperalgezie navozené opioidy. Může být indikováno snížení dávek fentanylu, ukončení léčby fentanylem nebo přehodnocení léčby.
Srdeční onemocnění
Fentanyl může způsobit bradykardii. Fentanyl proto má být používán s opatrností u pacientů s předchozími nebo stávajícími bradyarytmiemi.
Údaje z intravenózních studií s fentanylem naznačují, že u starších pacientů může být snížena clearance a prodloužen poločas eliminace, a že tito mohou být citlivější na léčivou látku než mladší pacienti. U starších, kachektických a oslabených pacientů je třeba pečlivě sledovat, zda se neobjeví známky toxicity fentanylu, a v případě potřeby snížit dávku.
Lunaldin podávejte opatrně pacientům s dysfunkcí jater nebo ledvin, zvláště během titrační fáze. Použití přípravku Lunaldin u pacientů s poruchou funkce jater nebo ledvin může zvýšit biologickou dostupnost fentanylu a snížit jeho systémovou clearance, což může následně vést k akumulaci a zvýšeným a prodlouženým účinkům opioidu.
Opatrně postupujte při léčbě pacientů s hypovolemií a hypotenzí.
Lunaldin nebyl sledován u pacientů s poraněním úst a mukozitidou. U takových pacientů může hrozit riziko zvýšené systémové expozice léku, proto doporučujeme maximální opatrnost během titrace dávky.
Pokud je užívání přípravku Lunaldin zastaveno, nemělo by to mít žádné zjevné následky. Možné příznaky z vysazení jsou však úzkost, třes, pocení, bledost, nauzea a zvracení.
Serotoninový syndrom
Opatrnost se doporučuje při současném podání přípravku Lunaldin s léčivými přípravky, které ovlivňují serotonergní neurotransmiterové systémy.
K vývoji potenciálně život ohrožujícího serotoninového syndromu může dojít při současném užití se serotonergními léčivými přípravky, jako jsou selektivní inhibitory zpětného vychytávání serotoninu (SSRI) a inhibitory zpětného vychytávání serotoninu a noradrenalinu (SNRI) a s léčivými přípravky, které narušují metabolismus serotoninu (včetně inhibitorů monoaminooxidázy [IMAO]). K tomu může dojít v rámci doporučeného dávkování.
Serotoninový syndrom může zahrnovat změny duševního stavu (např. agitovanost, halucinace, kóma), autonomní nestabilitu (např. tachykardie, kolísání krevního tlaku, hypertermie), neuromuskulární abnormality (např. hyperreflexie, porucha koordinace, rigidita), a/nebo gastrointestinální příznaky (např. nauzea, zvracení, průjem).
V případě podezření na serotoninový syndrom je nutno ukončit léčbu přípravkem Lunaldin.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Fentanyl je metabolizován CYP3A4. Léčivé látky inhibující aktivitu CYP3A4, jako jsou makrolidová antibiotika (například erythromycin), azolové antifungální přípravky (například ketokonazol, itrakonazol) nebo některé inhibitory proteáz (například ritonavir) mohou zvyšovat biologickou dostupnost fentanylu snížením jeho systémové clearance, a tak potenciálně zesílit nebo prodloužit účinky opioidu. Grapefruitový džus je také znám jako inhibitor CYP3A4. Současné podávání s látkami indukujícími aktivitu CYP3A4, jako jsou antimykobakteriální látky (např. rifampicin, rifabutin), antikonvulziva (např. karbamazepin, fenytoin a fenobarbital), rostlinné přípravky (např. třezalka tečkovaná, hypericum perforatum), může snížit účinnost fentanylu. Induktory CYP3A4 vykazují účinek v závislosti na čase a může trvat minimálně 2 týdny, než dosáhnou maximálního účinku. Naopak po vysazení může trvat minimálně 2 týdny, než indukce CYP3A4 klesne. U pacientů, u kterých je léčba induktory CYP3A4 ukončena nebo je snížena jejich dávka, může být riziko zvýšení účinku nebo toxicity fentanylu. Fentanyl proto podávejte pacientům opatrně, pokud je podáván současně s inhibitory a/nebo induktory CYP3A4.
Současné užívání jiných látek tlumících činnost CNS, například jiných morfinových derivátů (analgetik a antitusik), celkových anestetik, myorelaxancií, sedativních antidepresiv, sedativních antihistaminik, barbiturátů, anxiolytik (tj. benzodiazepinů), hypnotik, antipsychotik, klonidinu a souvisejících látek může způsobit zvýšený tlumící účinek na činnost CNS. Může dojít k respirační depresi, hypotenzi a těžké sedaci.
Alkohol zesiluje sedativní účinky morfinových analgetik, proto se při užívání přípravku Lunaldin nedoporučuje současné požívání alkoholických nápojů nebo užívání léčivých přípravků obsahujících alkohol.
Užívání přípravku Lunaldin se nedoporučuje u pacientů, kteří v uplynulých 14 dnech dostávali inhibitory monoaminooxidázy (IMAO), vzhledem k tomu, že při současném užívání těchto inhibitorů s opioidními analgetiky byla hlášena silná a nepředvídatelná potenciace analgetického účinku.
Není doporučeno současné užívání parciálních opioidních agonistů/antagonistů (např. buprenorfinu, nalbufinu, pentazocinu). Mají vysokou afinitu k opioidním receptorům s relativně nízkou vlastní aktivitou, a proto působí zčásti antagonisticky proti analgetickému účinku fentanylu a u pacientů se závislostí na opioidech mohou navozovat příznaky z vysazení.
Serotonergní léky
Současné podávání fentanylu se serotonergní látkou, jako je selektivní inhibitor zpětného vychytávání seronotinu (SSRI), nebo inhibitor zpětného vychytávání serotoninu a noradrenalinu (SNRI) nebo inhibitor monoaminooxidázy (IMAO), může zvýšit riziko serotoninového syndromu, což je potenciálně život ohrožující stav.
4.6 Fertilita, těhotenství a kojení
Bezpečnost použití fentanylu během těhotenství nebyla dosud stanovena. Studie na zvířatech prokázaly reprodukční toxicitu s porušením fertility u potkanů (viz bod 5.3). Potenciální riziko pro člověka není známé. Fentanyl nemá být během těhotenství podáván, pokud to není nezbytně nutné.
Dlouhodobá léčba tímto přípravkem během těhotenství může způsobit abstinenční příznaky u novorozence.
Fentanyl nepoužívejte během porodu (ani císařským řezem) – fentanyl prochází placentou a může způsobit respirační depresi u plodu či novorozence.
Kojení
Fentanyl přechází do mateřského mléka a u kojeného dítěte může působit sedativně nebo vyvolat respirační depresi. Kojící ženy nemají fentanyl užívat a kojení se má znovu zahájit nejdříve za 5 dní po posledním podání fentanylu.
4.7 Účinky na schopnost řídit a obsluhovat stroje
U přípravku Lunaldin nebyly provedeny studie hodnotící účinky na schopnost řídit nebo obsluhovat stroje.
O opoidních analgeticích je však známo, že mohou negativně ovlivnit duševní nebo fyzické schopnosti k provádění potenciálně nebezpečných prací, například řízení vozidel nebo obsluhování strojů. Pacienti mají být upozorněni, že nemají řídit ani obsluhovat stroje, pokud budou během léčby přípravkem Lunaldin trpět závratí, budou ospalí nebo budou mít rozmazané nebo dvojité vidění.
4.8 Nežádoucí účinky
U přípravku Lunaldin lze očekávat nežádoucí účinky typické pro opioidy; tyto účinky často slábnou při delším užívání léku. Nejzávažnějšími nežádoucími účinky při užívání opioidů jsou respirační deprese (která může vést až k respirační zástavě), hypotenze a šok.
Klinické studie s přípravkem Lunaldin byly navrženy tak, aby zhodnotily bezpečnost a účinnost u pacientů léčených pro průlomovou bolest nádorového původu; všichni pacienti užívali současně opioid z důvodu perzistentní bolesti, jako je morfin s prodlouženým uvolňováním, oxykodon s prodlouženým uvolňováním nebo transdermální fentanyl. Proto není možné definitivně oddělit účinky samotného přípravku Lunaldin.
Nejčastěji pozorované nežádoucí reakce přípravku Lunaldin zahrnují typické opioidní nežádoucí reakce, jako je nauzea, zácpa, somnolence a bolest hlavy.
Tabulárně shrnuté nežádoucí účinky přípravku Lunaldin a/nebo jiných přípravků obsahujících fentanyl:
Následující nežádoucí účinky byly hlášeny při podávání přípravku Lunaldin a/nebo dalších přípravků obsahujících fentanyl během klinických studií a ze zkušeností z období po uvedení na trh.
Jsou uvedené podle tříd orgánových systémů a četnosti (velmi časté > 1/10; časté > 1/100 až < 1/10; méně časté > 1/1000 až < 1/100; není známo (z dostupných údajů nelze určit)). V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
| Třída orgánových systémů | Nežádoucí účinek podle četnosti | |||
| Velmi časté > 1/10 | Časté > 1/100 až < 1/10 | Méně časté > 1/1000 až < 1/100 | Není známo (z dostupných údajů nelze určit) | |
| Poruchy imunitního systému | Hypersenzitivita | |||
| Poruchy metabolismu a výživy | Anorexie Snížená chuť k jídlu | |||
| Psychiatrické poruchy | Deprese Paranoia Stav zmatenosti Dezorientace Změny psychického stavu Úzkost Euforická nálada Dysforie Emoční labilita Porucha pozornosti Insomnie | Halucinace Závislost na léku (návyk) Zneužití léku | ||
| Poruchy nervového systému | Závrať Bolest hlavy Somnolence | Amnezie Parosmie Dysgeuzie Tremor Letargie Hypestezie Porucha spánku | Křeče | |
| Poruchy oka | Rozmazané vidění | |||
| Srdeční poruchy | Tachykardie Bradykardie | |||
| Cévní poruchy | Hypotenze | |||
| Respirační, hrudní a mediastinální poruchy | Dyspnoe | Orofaryngeální bolest Tlak v hrdle | Respirační deprese | |
| Gastrointestinální poruchy | Nauzea | Stomatitida Zvracení Zácpa Sucho v ústech | Ulcerace v ústech Gingivální ulcerace Ulcerace na rtu Porucha vyprazdňování žaludku Bolest břicha Dyspepsie Žaludeční diskomfort Poruchy jazyka Aftozní stomatitida | Otok jazyka Průjem |
| Poruchy kůže a podkožní tkáně | Hyperhidróza | Kožní léze Vyrážka Alergický pruritus Pruritus | ||
| Noční pocení Zvýšená tendence k tvorbě modřin | ||||
| Poruchy svalové a kosterní soustavy a pojivové tkáně | Artralgie Muskuloskeletální ztuhlost Ztuhlost kloubů | |||
| Poruchy reprodukčního systému a prsu | Erektilní dysfunkce | |||
| Celkové poruchy a reakce v místě aplikace | Únava | Syndrom z vysazení* Astenie Malátnost | Zčervenání a návaly horka Periferní otok Pyrexie Abstinenční syndrom u novorozenců | |
| Poranění, otravy a procedurální komplikace | Náhodné předávkování | Pád |
* u transmukózního fentanylu byly pozorovány příznaky z vysazení opioidů jako nauzea, zvracení, průjem, úzkost, zimnice, třes a pocení
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky: http:/
4.9 Předávkování
Příznaky předávkování fentanylem jsou posílení jeho farmakologických účinků, z nichž nejzávažnější je vznik respirační deprese, která může vést až k respirační zástavě.
Bezprostřední opatření při předávkování opioidy: odstranění jakýchkoli zbytků sublingválních tablet přípravku Lunaldin z úst, fyzická a slovní stimulace pacienta a posouzení stupně vědomí. Je třeba zajistit a udržovat průchodnost dýchacích cest. Pokud to bude zapotřebí, je třeba zavést orofaryngeální vzduchovod nebo endotracheální rourku, podávat kyslík a zahájit mechanickou ventilaci dle potřeby. Má být udržována přiměřená tělesná teplota a zajištěn parenterální příjem tekutin.
K léčbě náhodného předávkování u osob bez předchozí zkušenosti s opioidy má být tam, kde je to klinicky indikováno, použit naloxon nebo jiní antagonisté opioidů, a to v souladu se Souhrnem údajů o přípravku. Při dlouhodobé respirační depresi možná bude třeba podat další dávky antagonistů opioidů.
Používáte-li naloxon nebo jiné antagonisty opioidů k léčbě předávkování u pacientů užívajících opioidy, postupujte opatrně – může dojít ke zhoršení syndromu akutního vysazení.
Pokud dojde k těžké nebo přetrvávající hypotenzi, mohlo by dojít k hypovolemii; v tom případě má být zajištěna vhodná terapie s parenterálním podáváním tekutin.
Při užívání fentanylu a jiných opioidů byl hlášen výskyt svalové rigidity, která komplikuje dýchání. V takové situaci možná bude nutná endotracheální intubace, podpůrná ventilace a podávání antagonistů opioidů a myorelaxancií.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Analgetika; opioidy; deriváty fenylpiperidinu.
ATC kód: N02AB03.
Fentanyl je silné ^-opioidní analgetikum s rychlým nástupem analgezie a krátkodobým účinkem. Jako analgetikum je přibližně 100× účinnější než morfin. Sekundární účinky fentanylu na centrální nervový systém (CNS) a respirační a gastrointestinální funkce jsou typické pro opioidní analgetika a jsou považovány za účinky společné celé této třídě látek. Mohou zahrnovat respirační depresi, bradykardii, hypotermii, obstipaci, miózu, fyzickou závislost a euforii.
Opioidy mohou ovlivňovat osu hypothalamus-hypofýza-nadledviny nebo reprodukční osu. Některé změny zahrnují zvýšení hladiny prolaktinu v séru a snížení hladin kortizolu a testosteronu v plasmě. Klinické známky a příznaky mohou být projevem těchto hormonálních změn.
Analgetické účinky fentanylu souvisejí s krevní koncentrací léčivé látky; u pacientů bez předchozí zkušenosti s opioidy jsou minimální účinné sérové koncentrace fentanylu v rozmezí 0,3–1,2 ng/ml, zatímco koncentrace 10–20 ng/ml zajistí anestezii při operaci a těžkou respirační depresi.
U pacientů s chronickými bolestmi vyvolanými nádorem, kteří dostávali stabilní udržovací dávky opioidů, bylo pozorováno statisticky významné zlepšení intenzity bolesti při použití přípravku Lunaldin oproti placebu od 10. minuty po podání (viz graf 1 níže) s významně nižší potřebou záchranné analgetické terapie.
Graf 1: Průměrný rozdíl intenzity bolesti (± SE) pro Lunaldin v porovnání s placebem (měřeno škálou dle Likerta 0–10)

Bezpečnost a účinnost přípravku Lunaldin byla ověřována u pacientů užívajících tento lék při nástupu epizody průlomové bolesti. Preventivní použití přípravku Lunaldin u předvídatelných epizod bolesti nebylo v klinických studiích ověřováno.
Fentanyl, stejně jako jiní agonisté ^-opioidních receptorů, způsobuje úměrně dávce respirační depresi. Toto riziko je vyšší u pacientů bez předchozí zkušenosti s opioidy než u osob trpících těžkými bolestmi nebo na chronické terapii opioidy. Dlouhodobá léčba opioidy obvykle vede k rozvoji tolerance sekundárních účinků.
Opioidy sice obecně zvyšují tonus hladkého svalstva močových cest, výsledný vliv však kolísá -v některých případech vede k urgentnímu močení, v jiných naopak způsobuje problémy při močení.
Opioidy zvyšují tonus a tlumí hnací kontrakce hladkého svalstva v gastrointestinálním traktu, což má za následek prodloužení transportu potravy v gastrointestinálním systému, a může být důvodem konstipačního účinku fentanylu.
5.2 Farmakokinetické vlastnosti
Fentanyl je vysoce lipofilní lék velmi rychle absorbovaný ústní sliznicí a pomaleji gastrointestinálním traktem. Perorálně podávaný fentanyl prochází intenzivním metabolickým procesem při prvním průchodu v játrech a střevech.
Lunaldin je sublingvální tableta s rychlým rozpuštěním. K rychlé absorpci fentanylu dochází po dobu zhruba 30 minut po podání přípravku Lunaldin. Absolutní biologická dostupnost přípravku Lunaldin byla spočítána na 54 %. Průměrné maximální plazmatické koncentrace fentanylu jsou v rozmezí 0,2 až
-
1.3 ng/ml (po podání 100 až 800 ^g přípravku Lunaldin) a jsou dosaženy během 22,5 až 240 minut.
5.3 Předklinické údaje vztahující se k bezpečnosti
Údaje o farmakologické bezpečnosti a toxicitě po opakovaném podávání neodhalily žádné zvláštní riziko pro člověka, které by už nebylo popsáno v jiných bodech tohoto SPC. Studie na zvířatech prokázaly sníženou plodnost a zvýšenou mortalitu u plodů potkanů. Teratogenní účinky však nebyly prokázány.
Testy mutagenity u bakterií a hlodavců přinesly negativní výsledky. Fentanyl, stejně jako jiné opioidy, vykazoval mutagenní účinky in vitro u savčích buněk. Mutagenní riziko při terapeutickém použití se zdá nepravděpodobné vzhledem k tomu, že se účinky projevily pouze při velmi vysokých koncentracích.
Studie karcinogenity (26týdenní dermální alternativní biologické zkoušky na Tg.AC transgenních myších, dvouletá studie subkutánní karcinogenity u potkanů) s fentanylem neodhalily žádná zjištění svědčící o onkogenním potenciálu. Hodnocení vzorků mozku ze studie kancerogenity u potkanů odhalilo mozkové léze u zvířat, kterým byly podávány vysoké dávky fentanyl-citrátu. Význam těchto nálezů pro člověka není známý.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
mannitol (E421)
silicifikovaná mikrokrystalická celulosa
sodná sůl kroskarmelosy
magnesium-stearát
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25 °C.
Uchovávejte v původním obalu, aby byl přípravek chráněn před vlhkostí.
6.5 Druh obalu a obsah balení
Lunaldin sublingvální tablety jsou baleny v dětských bezpečnostních blistrech OPA/Al/PVC s folií papír/polyester/Al uložených v papírové krabičce.
Obal jednotlivých lékových sil přípravku Lunaldin je barevně odlišen.
Velikost balení: balení 10 nebo 30 sublingválních tablet.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Odpadový materiál má být bezpečně zlikvidován. Pacientům a pečovatelům se má doporučit, aby nepoužité léky vrátili do lékárny, kde budou zlikvidovány v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Gedeon Richter Plc.
Gyómrói út 19–21
1103 Budapešť,
Maďarsko
8. REGISTRAČNÍ ČÍSLO(A)
Lunaldin 100 mikrogramů sublingvální tablety: 65/132/09-C Lunaldin 200 mikrogramů sublingvální tablety: 65/133/09-C Lunaldin 300 mikrogramů sublingvální tablety: 65/134/09-C Lunaldin 400 mikrogramů sublingvální tablety: 65/135/09-C Lunaldin 600 mikrogramů sublingvální tablety: 65/136/09-C
Lunaldin 800 mikrogramů sublingvální tablety: 65/137/09-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 18. 3. 2009
Datum posledního prodloužení registrace: 4. 4. 2014
Další informace o léčivu LUNALDIN
Jak
se LUNALDIN
podává: podání pod jazyk - sublingvální tableta
Výdej
léku: na lékařský předpis
Balení: Blistr
Velikost
balení: 10
Držitel rozhodnutí o registraci daného léku v České republice:
Gedeon Richter Plc., Budapešť
E-mail: info@richtergedeon.cz
Telefon: 261141200
