Souhrnné informace o léku - KYLEENA
1. NÁZEV PŘÍPRAVKU
Kyleena 19,5 mg intrauterinní inzert
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Intrauterinní inzert obsahuje levonorgestrelum 19,5 mg.
Úplný seznam pomocných látek viz bod 6.1.
Podrobné informace o rychlosti uvolňování naleznete v bodě 5.2.
3. LÉKOVÁ FORMA
Intrauterinní inzert (IUS).
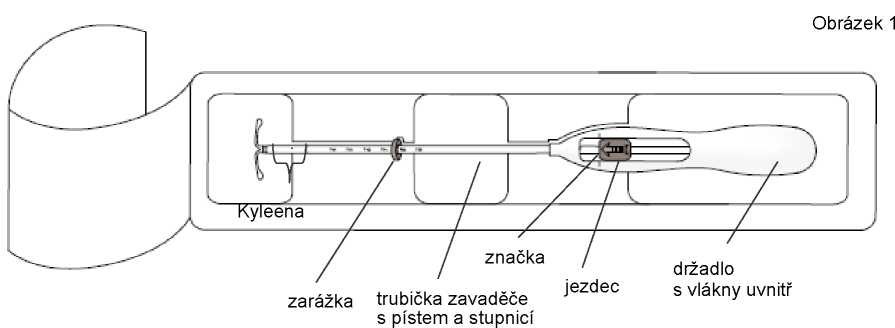
Přípravek se skládá z bělavého až nažloutlého jádra, které obsahuje léčivou látku, jádro je kryté poloprůhlednou membránou a je umístěno na vertikální část tělíska ve tvaru T. Vertikální část tělíska navíc obsahuje stříbrný kroužek, lokalizovaný v blízkosti horizontálních ramének. Bílé tělísko ve tvaru T má na jednom konci smyčku a na druhém konci dvě horizontální raménka. Ke smyčce jsou připojena modře zbarvená vlákna pro vyjmutí. Vertikální část intrauterinního systému je umístěna v zaváděcí trubičce na konci zavaděče. Zavaděč je složen z držadla a jezdce a jeho součástí je zarážka, zámek jezdce, zakřivená zaváděcí trubička a píst. Vlákna pro vyjmutí jsou umístěna v zaváděcí trubičce a držadle.
Rozměry přípravku Kyleena: 28 × 30 × 1,55 mm.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Kontracepce po dobu až 5 let.
4.2 Dávkování a způsob podání
Dávkování
Přípravek Kyleena je zaváděn do děložní dutiny a je účinný až po dobu 5 let.
Zavedení a vyjmutí/výměna
Doporučuje se, aby přípravek Kyleena aplikoval lékař, který má již zkušenosti se zaváděním IUS a/nebo lékař v zavádění přípravku Kyleena dostatečně proškolený.
Přípravek Kyleena se zavádí do děložní dutiny během 7 dnů od počátku menstruace. Přípravek Kyleena může být vyměněn za nový systém kdykoli během cyklu. Přípravek Kyleena také může být zaveden kdykoli po potratu v prvním trimestu.
Po porodu je nutno odložit zavedení až po kompletní involuci dělohy, vždy však až po ukončení šestinedělí. Jestliže dochází k involuci dělohy pomaleji, je nutno zvážit odložení zavedení až na 12. týden po porodu.
V případě obtížného zavádění a/nebo neobvyklé bolesti či krvácení během nebo následně po zavedení je nutno zvážit možnost perforace a je třeba učinit vhodné kroky, jakými jsou například klinické vyšetření a ultrazvuk. K vyloučení částečné perforace nemusí být klinické vyšetření dostatečné.
Přípravek Kyleena může být od ostatních intrauterinních systémů odlišen, protože obsahuje stříbrný kroužek, který je viditelný na ultrazvuku, a modře zbarvená vlákna pro vyjmutí. T-tělo přípravku Kyleena obsahuje síran barnatý, který umožňuje jeho zobrazení při rentgenovém vyšetření.
Kyleena se odstraňuje jemným tahem za vlákna pomocí kleští. Nejsou-li vlákna viditelná a systém je podle ultrazvukového vyšetření v děloze, pak jej lze vyjmout pomocí úzkého peánu, což si může vyžádat dilataci děložního hrdla nebo chirurgický zásah.
Systém nesmí být vyjmut později než po pěti letech. Jestliže si žena přeje používat tutéž metodu, může být nový systém zaveden okamžitě po vyjmutí původního systému.
Pokud si pacientka nepřeje otěhotnět, mělo by být odstranění systému u žen, které mají pravidelné krvácení, provedeno během 7 dní od začátku menstruace. Jestliže je systém vyjmut v jiné části cyklu, nebo žena nemá pravidelnou menstruaci, a dotyčná žena během předcházejícího týdne měla pohlavní styk, potom vzniká možnost otěhotnění. Aby byla zajištěna nepřetržitá kontracepce, je třeba zavést ihned po odstranění starého systému systém nový nebo je třeba začít používat alternativní kontracepční metody.
Po vyjmutí přípravku Kyleena je třeba zkontrolovat, zda je celý systém intaktní.
Starší ženy
Použití přípravku Kyleena u postmenopauzálních žen není indikováno.
Porucha funkce jater
Použití přípravku Kyleena u žen s poškozením jater nebylo studováno. Použití přípravku Kyleena je u žen s akutním onemocněním nebo nádorem jater kontraindikováno (viz bod 4.3).
Porucha funkce ledvin
Použití přípravku Kyleena u žen s poškozením ledvin nebylo studováno.
Pediatrická populace
Použití tohoto přípravku není před menarche indikováno. Údaje o bezpečnosti a účinnosti u dospívajících jsou uvedeny v bodě 5.1.
Způsob podání
Přípravek je za sterilních podmínek zaváděn lékařem.
Přípravek Kyleena je dodáván ve sterilním balení společně se zavaděčem, který umožňuje zavedení jednou rukou. Balení smí být otevřeno až těsně před zavedením. Nesterilizujte. Tak jak je dodáván, je přípravek Kyleena určen pouze na jedno použití. Nepoužívejte, jestliže je blistr porušený nebo otevřený. Nepoužívejte po datu exspirace, které je uvedeno na krabičce a blistru za Použitelné do.
Veškerý nespotřebovaný přípravek nebo odpad musí být zlikvidovány v souladu s místními požadavky.
Přípravek Kyleena je dodáván v krabičce společně s pacientskou kartou o zavedení. Vyplňte pacientskou kartu a po zavedení přípravku ji předejte pacientce.
Příprava k zavedení
- Proveďte vyšetření pacientky, abyste určili velikost a polohu dělohy a zjistili jakékoli příznaky akutní genitální infekce nebo jiné kontraindikace pro zavedení přípravku Kyleena. Jestliže je jakákoli pochybnost o případném těhotenství, je třeba provést těhotenský test.
- Zaveďte zrcadla, odhalte cervix a vhodným antiseptickým roztokem očistěte pochvu a čípek.
- Podle potřeby využijte asistenta.
- Přední okraj čípku uchopte vhodným držákem nebo kleštěmi, abyste stabilizovali dělohu. Jestliže je děloha zakloněna dozadu, může být vhodnější uchopit zadní okraj cervixu. Jemným tahem za kleště může být docíleno narovnání cervikálního kanálku. Kleště je třeba v pozici zafixovat a během zavádění aplikovat mírný protitah na čípek.
- Postupujte děložní sondou přes kanál děložního hrdla až k fundu, abyste změřili hloubku a určili směr děložní dutiny a vyloučili přítomnost intrauterinních abnormalit (např. septum, submukózní myomy) nebo již dříve zavedeného nitroděložního antikoncepčního přípravku, který nebyl vyjmut. Pokud se vyskytnou problémy, zvažte dilataci děložního hrdla. Pokud je potřeba dilatace děložního hrdla, zvažte použití analgetik a/nebo paracervikálního bloku.
Zavádění
-
1. Nejdříve zcela otevřete sterilní obal (obrázek 1). Potom použijte sterilní techniku a sterilní rukavice.
-
2. Posuňte jezdec dopředu ve směru
šipky do nejvzdálenější polohy, abyste zasunuli přípravek Kyleena do trubičky zavaděče (Obrázek 2).
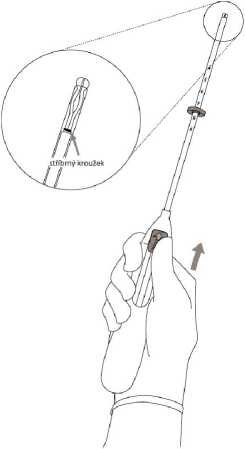
DŮLEŽITÉ! Nezasunujte posuvnou část nazpět, protože by mohlo dojít k předčasnému uvolnění přípravku Kyleena. Jakmile se přípravek Kyleena uvolní, není možné ho zasunout nazpět.
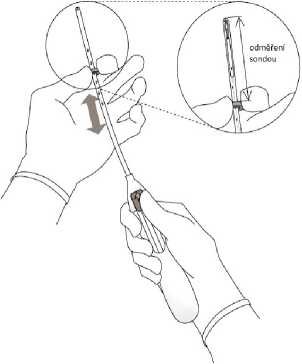
3. Držte jezdec v nejvzdálenější poloze,
nastavte horní okraj zarážky tak, aby odpovídala odměřené vzdálenosti hloubky dělohy (obrázek 3).
Obrázek 3
4. Zatímco držíte jezdec v nejvzdálenější poloze, zasunujte zavaděč přes děložní hrdlo, až bude zarážka ve vzdálenosti zhruba 1,5–2,0 cm od
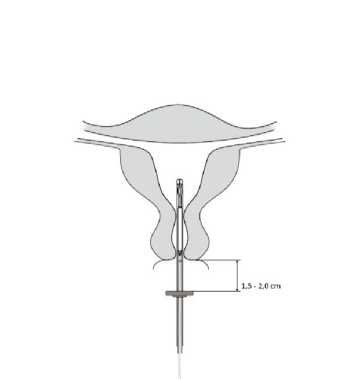
Obrázek 4
děložního hrdla (obrázek 4).
POZOR! Netlačte na zavaděč silou. Je-li to nutné, dilatujte cervikální kanál.
-
5. Zatímco držíte zavaděč na místě, uvolněte horizontální raménka přípravku Kyleena přitažením jezdce zpět až ke značce (obrázek 5).
Čekejte 5 až 10 vteřin, až se horizontální raménka zcela rozvinou.
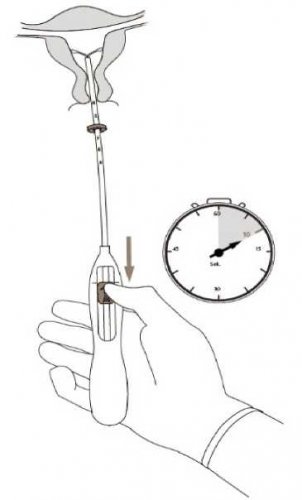
Obrázek 5
6. Šetrně vtlačte zavaděč směrem k fundu dělohy, až se zarážka dotkne čípku.
Nyní je Kyleena ve fundu (obrázek 6).
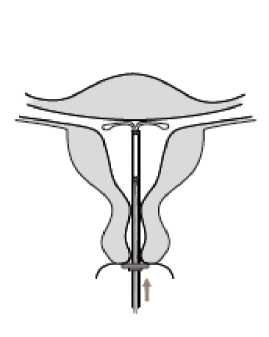
Obrázek 6
7. Držte zavaděč na místě a uvolněte přípravek Kyleena úplným posunutím jezdce zpět dolů (obrázek 7). Zatímco držíte jezdec co nejníže, vytažením jemně vyjměte zavaděč. Vlákna zkraťte tak, aby 2–3 cm zůstala viditelná vně děložního hrdla.
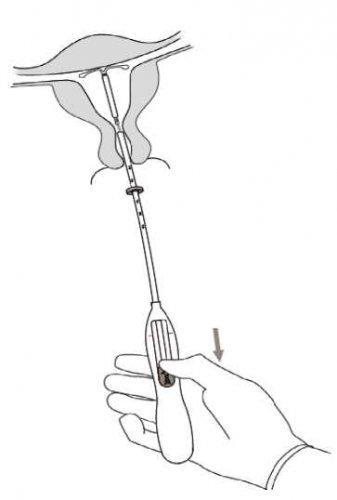
DŮLEŽITÉ! Pokud byste se domnívali, že systém není ve správné poloze, zkontrolujte jeho polohu (například ultrazvukem). Systém vyjměte, jestliže není správně umístěn v děložní dutině. Vyjmutý systém nesmí být znovu zaveden.
Vyjmutí/výměna
Pro informace o vyjmutí/výměně si prosím přečtěte bod 4.2 „Zavedení a vyjmutí/výměna“
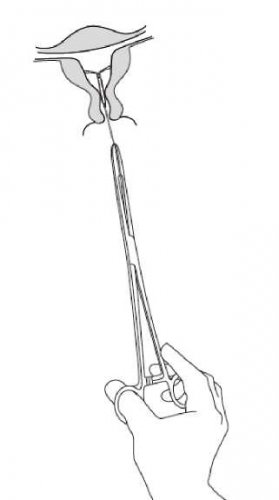
Kyleena se vyjímá peánem tažením za vlákna (obrázek 8).
Ihned po vyjmutí můžete zavést nový přípravek Kyleena.
Po vyjmutí přípravku Kyleena musí být systém zkontrolován, zda je neporušený.
Obrázek 8
4.3 Kontraindikace
Těhotenství (viz bod 4.6);
Současné nebo rekurentní infekce v oblasti pánve nebo stavy spojené se zvýšeným rizikem infekce v oblasti pánve;
Současná cervicitida nebo vaginitida;
Poporodní endometritida nebo infikovaný potrat během posledních 3 měsíců;
Cervikální intraepiteliální neoplazie do odeznění;
Zhoubné bujení dělohy nebo děložního hrdla;
Tumory citlivé na progestogen (např. rakovina prsu);
Abnormální děložní krvácení neznámé etiologie
Vrozené nebo získané anomálie dělohy včetně myomů, které mohou ovlivnit zavádění a/nebo zachování nitroděložního systému (např. jestliže deformují děložní dutinu);
Akutní onemocnění jater nebo jaterní tumor;
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Trpí-li žena některým z následujících onemocnění nebo objeví-li se některé z těchto onemocnění u ženy s již zavedeným přípravkem Kyleena, je nutno při používání postupovat opatrně a konzultovat specialistu nebo zvážit možnost vyjmutí tělíska:
- migréna, fokální migrenózní záchvaty s asymetrickou ztrátou zorného pole nebo jiné symptomy přechodné cerebrální ischemie
- neobvykle silná bolest hlavy
- žloutenka
- výrazné zvýšení krevního tlaku
- závažná arteriální onemocnění jako například mrtvice nebo infarkt myokardu
Levonorgestrel v malých dávkách může ovlivnit glukózovou toleranci. U diabetiček, kterým byl přípravek Kyleena zaveden, je proto třeba sledovat glykémii. Obecně však není třeba u diabetiček, které používají nitroděložní systém s levonorgestrelem, měnit terapeutický režim.
Lékařská vyšetření/konzultace
Před zavedením musí být žena informována o přínosu a riziku přípravku Kyleena a to i o známkách a příznacích perforace a riziku ektopického těhotenství, jak je uvedeno níže. Musí být provedeno klinické vyšetření, včetně vyšetření pánve a vyšetření prsů. Podle potřeby na základě zhodnocení lékařem by měl být proveden cervikální stěr. Musí se vyloučit těhotenství a choroby přenosné pohlavním stykem. Infekce pohlavního ústrojí musí být před zavedením zcela vyléčeny. Dále je třeba určit polohu dělohy a velikost děložní dutiny. Umístění přípravku Kyleena v děložním fundu je velmi důležité pro dosažení maximální účinnosti a minimalizaci rizika expulze. Je třeba pečlivě dodržovat pokyny pro zavádění.
Je třeba klást důraz na nacvičení správné techniky zavádění.
Zavedení a odstranění tělíska může být spojeno s bolestí a krvácením. Procedura může vyvolat vazovagální reakci (např. synkopu nebo záchvat u epileptických pacientek).
Vyšetření pacientky je nutné za 4 až 6 týdnů po zavedení z důvodu kontroly vláken a ujištění, že systém je ve správné poloze. Poté jsou další návštěvy doporučovány vždy jednou za rok, případně častěji, pokud je prohlídka klinicky indikována.
Přípravek Kyleena není vhodným postkoitálním kontracepčním prostředkem.
Použití přípravku Kyleena k léčbě těžkého menstruačního krvácení nebo k ochraně před endometriální hyperplázií během substituční léčby estrogeny nebylo zjišťováno. Proto se k léčbě těchto stavů nedoporučuje.
Ektopické těhotenství
Během klinických studií byla při používání přípravku Kyleena pozorována celková incidence ektopických těhotenství přibližně 0,20 na 100 žen za rok. Přibližně u poloviny těhotenství, která nastanou během používání Kyleena, se dá očekávat, že budou mimoděložní.
Žena, která zvažuje použití přípravku Kyleena, musí být poučena o známkách, příznacích a riziku mimoděložního těhotenství. V případě otěhotnění ženy, která používá přípravek Kyleena, je třeba vzít v úvahu možnost mimoděložního těhotenství a také tuto možnost prověřit.
U žen s mimoděložním těhotenstvím, operací vejcovodů nebo zánětem v pánevní oblasti v anamnéze je riziko mimoděložního těhotenství zvýšené. Jestliže se vyskytne bolest v podbřišku, měla by se vzít v úvahu možnost mimoděložního těhotenství, zvláště pokud se nedostaví menstruace nebo pokud žena s amenoreou začne krvácet.
Vzhledem k tomu, že mimoděložní těhotenství může poškodit fertilitu v budoucnu, je třeba pečlivě zvážit přínosy a riziko používání přípravku Kyleena v každém individuálním případě.
Ovlivnění profilu menstruačního krvácení
U většiny uživatelek přípravku Kyleena se očekává ovlivnění profilu menstruačního krvácení. Tyto změny vznikají následkem přímého působení levonorgestrelu na endometrium a nemusí korelovat s aktivitou vaječníků.
Během prvních měsíců používání se běžně vyskytuje nepravidelné krvácení a špinění. Následně má však potlačení nárůstu endometria za následek snížení délky a intenzity menstruačního krvácení. Ze slabého krvácení se často vyvine oligomenorea nebo amenorea.
Méně časté krvácení a/nebo amenorea se v klinických studiích vyvinulo postupně. Do konce pátého roku se u přibližně 26,4 % uživatelek vyvinulo nepravidelné krvácení a u 22,6 % amenorea. Pokud se menstruace nedostaví do 6 týdnů od začátku předchozí menstruace, je třeba zvážit, zda nedošlo k otěhotnění. Opakovaný těhotenský test není nutný u pacientek s amenoreou, pokud o těhotenství nesvědčí další symptomy.
Jestliže krvácení zesílí a/nebo se zvýší jeho nepravidelnost, je třeba podniknout vhodná terapeutická opatření, protože nepravidelné krvácení může být příznakem děložních polypů, hyperplázie nebo rakoviny a silné krvácení může být známkou nezpozorovaného vypuzení nitroděložního tělíska.
Infekce v oblasti pánve
Ve spojení s používáním IUS a IUD byly hlášeny případy infekce v oblasti pánve. I když jsou Kyleena a zavaděč sterilní, mohou se, vzhledem k možnosti bakteriální kontaminace během zavádění, stát mikrobiálními nosiči do horního genitálního traktu. V klinických studiích byl výskyt pánevního zánětlivého onemocnění (PID) vyšší na začátku používání přípravku Kyleena, což je konzistentní s daty, která byla publikována pro nitroděložní tělíska s mědí, u kterých byl nejvyšší výskyt pánevního zánětlivého onemocnění během prvních 3 týdnů zavedení a následně klesal.
Předtím, než je rozhodnuto o použití přípravku Kyleena, měly by být celkově u pacientek vyhodnoceny rizikové faktory spojené s pánevní infekcí (např. více sexuálních partnerů, sexuálně přenosné infekce, PID v anamnéze). Infekce v oblasti pánve, jako je PID, mohou mít vážné následky, mohou poškodit fertilitu a zvýšit riziko ektopického těhotenství.
Stejně jako u jiných gynekologických nebo chirurgických zákroků může po zavedení IUD dojít k závažným infekcím nebo sepsím (včetně sepse způsobené streptokoky skupiny A), i když k tomu dochází velice vzácně.
Jestliže se u ženy projeví rekurentní endometritida nebo pánevní zánětlivé onemocnění, případně jakákoli jiná akutní infekce, která je vážná nebo nereaguje na léčbu, musí být přípravek Kyleena vyjmut.
Při sebemenších známkách infekce je indikováno bakteriologické vyšetření, dále se také doporučuje sledování.
Expulze
Během klinických studií s přípravkem Kyleena byla expulze pozorována s nízkou incidencí, odpovídají incidenci pozorované pro jiné nitroděložní systémy a nitroděložní tělíska. K příznakům částečného nebo úplného vypuzení přípravku Kyleena patří krvácení nebo bolest. Nicméně k částečnému nebo úplnému vypuzení může dojít, aniž by to žena zpozorovala, následně pak dochází ke snížení nebo ztrátě kontracepční ochrany. Vzhledem k tomu, že Kyleena typicky postupně snižuje menstruační krvácení, zesílení menstruačního krvácení může indikovat vypuzení.
Částečně vypuzený přípravek Kyleena musí být odstraněn. Nový systém může být zaveden okamžitě, jakmile je vyloučeno těhotenství.
Je třeba poučit pacientku, jak má kontrolovat vlákna přípravku Kyleena a že je třeba, aby kontaktovala svého lékaře, pakliže vlákna nenahmatá.
Perforace
Může dojít k perforaci nebo penetraci děložního těla nebo hrdla nitroděložním systémem, nejčastěji během zavádění, přestože může být detekována později. V tomto případě může být účinnost přípravku Kyleena snížena. V případě obtíží při zavádění a/nebo zvláště silné bolesti nebo krvácení při nebo po zavádění, je třeba učinit okamžitě vhodná opatření, jakými jsou klinické vyšetření a ultrazvuk, k vyloučení perforace. V případě perforace musí být systém vyjmut; může být zapotřebí chirurgický zákrok.
V rozsáhlé prospektivní srovnávací neintervenční kohortové studii provedené u uživatelek IUD (N=61 448 žen) s dobou sledování 1 rok, byla incidence perforace 1,3 (95% CI: 1,1 – 1,6) na 1 000 zavedení v celé studijní kohortě; 1,4 (95% CI: 1,1 – 1,8) na 1 000 zavedení v kohortě s jinými IUS s obsahem levonorgestrelu a 1,1 (95% CI: 0,7 – 1,6) na 1 000 zavedení v kohortě s IUD uvolňujícím měď.
Studie prokázala, že jak kojení v době zavedení, tak zavedení do 36 týdnů po porodu, byly spojené se zvýšeným rizikem perforace (viz Tabulka 1). Oba rizikové faktory byly nezávislé na typu IUD.
Tabulka 1: Incidence perforace na 1 000 zavedení pro celou studijní kohortu sledovanou po dobu 1 roku, rozdělená podle kojení a doby od porodu v době zavedení (rodící ženy)
| Kojení v době zavedení | Nekojení v době zavedení | |
| Zavedení < 36 týdnů po porodu | 5,6 95% CI: 3,9–7,9, n=6047 zavedení) | 1,7 95% CI: 0,8–3,1, n=5927 zavedení) |
| Zavedení > 36 týdnů po porodu | 1,6 (95% CI: 0,0–9,1, n=608 zavedení) | 0,7 (95% CI: 0,5–1,1, n=41 910 zavedení) |
Během prodloužené doby sledování na 5 let v podskupině této studie (N=39 009 žen, které měly zavedený jiný levonorgestrelový IUS nebo IUD obsahující měď, kdy za dobu 5 let sledování byly k dispozici údaje od 73 % těchto žen), byla incidence perforace zjištěná kdykoliv v průběhu celého 5letého období 2,0 (95% CI: 1,6 – 2,5) na 1000 inzercí. Kojení v době zavedení a zavedení do 36 týdnů po porodu byly potvrzeny jako rizikové faktory i v podskupině sledované po dobu 5 let.
Riziko perforace může být zvýšené u žen s dělohou fixovanou v retroverzi.
Opětovné vyšetření po zavedení se má řídit pokyny uvedenými výše v bodě „Lékařské vyšetření/konzultace“, které mohou být u žen s rizikovými faktory pro perforaci v případě klinické indikace upraveny.
Ztracená vlákna
Jestliže při kontrolních vyšetřeních nejsou v děložním hrdle viditelná vlákna, která slouží k vyjmutí, je třeba vyloučit možnost nezpozorované expulze a těhotenství. Vlákna mohou být vtažena do dělohy nebo do cervikálního kanálu a mohou se znovu objevit během další menstruace. Jestliže bylo vyloučeno těhotenství, lze obvykle vlákna najít při jemné sondáži pomocí vhodného nástroje. Pokud se vlákna nenajdou, je třeba zvážit možnost expulze nebo perforace. Pro stanovení polohy přípravku Kyleena lze využít ultrazvuk. Není-li ultrazvuk dostupný, nebo není-li vyšetření úspěšné, může být použit k lokalizaci přípravku Kyleena rentgen.
Ovariální cysty/zvětšené ovariální folikuly
Vzhledem k tomu, že kontracepční účinek přípravku Kyleena je dán převážně lokálním působením, u fertilních žen obvykle zůstává ovulační cyklus zcela zachován, včetně pravidelného vývoje folikulu, uvolnění oocytu a atrézie folikulu. Atrézie folikulu je někdy opožděná a folikulogeneze pokračuje. Tyto zvětšené folikuly nelze klinicky rozlišit od ovariálních cyst. V průběhu klinických studií byly ovariální cysty (včetně hemoragických ovariálních cyst a prasklých ovariálních cyst) jako nežádoucí příhody hlášeny u přibližně 22,2 % uživatelek přípravku Kyleena. Většina těchto cyst je asymptomatická, ačkoli některé mohou být doprovázeny bolestí v pánevní oblasti nebo dyspareunií.
Ve většině případů se zvětšené folikuly samovolně vstřebají během dvou až tříměsíčního sledování, ke kterému může být vhodné použít ultrazvuk a jiná diagnostická/terapeutická opatření. Vzácně je třeba použít chirurgickou intervenci.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Poznámka: Je třeba se seznámit s příbalovými informacemi současně užívaných léků na předpis, aby se identifikovaly potenciální interakce.
Účinky jiných léčivých přípravků na přípravek Kyleena
Interakce se mohou vyskytnout v případě současného užívání s léčivými přípravky, které indukují mikrosomální enzymy, což může mít za následek zvýšení clearance pohlavních hormonů.
Léky zvyšující clearance levonorgestrelu, např.:
Fenytoin, barbituráty, primidon, karbamazepin, rifampicin a případně také oxkarbazepin, topiramát, felbamát, griseofulvin a přípravky obsahující třezalku tečkovanou.
Vliv těchto léčivých přípravků na kontracepční účinnost přípravku Kyleena není znám, nicméně se nepředpokládá, že by měly významný vliv, vzhledem k lokálnímu mechanizmu působení tohoto přípravku.
Látky s proměnlivými účinky na clearance levonorgestrelu, např.:
Pokud jsou podávány s pohlavními hormony, mnohé HIV/HCV proteázové inhibitory a nenukleozidové inhibitory reverzní transkriptázy mohou zvýšit nebo snížit plazmatickou koncentraci progestinu.
Látky snižující clearance levonorgestrelu (inhibitory enzymů):
Silné a středně silné inhibitory CYP3A4 jako jsou azolová antimykotika (např. flukonazol, itrakonazol, ketokonazol, vorikonazol), verapamil, makrolidy (např. klarithromycin, erythromycin), diltiazem a grapefruitová šťáva mohou zvýšit plazmatickou koncentraci progestinu.
Magnetická rezonance (MRI)
Neklinické testy jiných IUS s obsahem levonorgestrelu se stejnou velikostí stříbrného kroužku a tělíska ve tvaru T prokázaly, že pacientky se zavedeným přípravkem Kyleena mohou být bezpečně vyšetřovány MRI za následujících podmínek (podmíněná bezpečnost MR):
- statické magnetické pole 3 Tesla nebo méně
- sklon gradientu magnetického pole 36000 Gauss/cm (360 T/m) nebo méně
- maximální celotělová průměrná specifická míra absorpce (SAR) 4 W/kg v kontrolovaném režimu prvního stupně po dobu nepřetržitého snímkování 15 minut
4.6 Fertilita, těhotenství a kojení
Fertilita
Použití nitroděložního systému s levonorgestrelem neovlivňuje současnou ani budoucí fertilitu. Po vyjmutí nitroděložního systému uvolňujícího levonorgestrel se ženská fertilita navrací k normálu (viz bod 5.1).
Těhotenství
U těhotných žen je zavádění přípravku Kyleena kontraindikováno (viz bod 4.3).
Pokud žena otěhotní se zavedeným přípravkem Kyleena, musí být vyloučeno mimoděložní těhotenství, dále je doporučováno odstranění systému, protože jakákoli kontracepce ponechaná „in situ“ může zvýšit riziko potratu nebo předčasného porodu. Odstranění přípravku Kyleena nebo sondáž dělohy může také vyvolat spontánní potrat. Jestliže si žena přeje v těhotenství pokračovat a systém není možné vyjmout, musí být informována o riziku a případných důsledcích předčasného porodu na nedonošené dítě. Průběh takového těhotenství musí být pečlivě sledován. Ženu je třeba poučit, aby hlásila všechny příznaky, které by mohly znamenat komplikace těhotenství, např. křečovité bolesti břicha s horečkou.
Vzhledem k nitroděložní aplikaci s lokálním působením levonorgestrelu je nutné vzít v úvahu možné virilizační účinky na plod ženského pohlaví. Klinické zkušenosti s těhotenstvím při zavedeném přípravku Kyleena jsou omezené díky jeho vysoké antikoncepční spolehlivosti. Ženu je však třeba informovat, že do této doby nebylo porozeno žádné dítě s vrozenou vadou z těhotenství s nitroděložním systémem, který uvolňuje levonorgestrel in situ.
Kojení
Obecně se jeví, že v případě, kdy je 6 týdnů po porodu použita metoda pouze na bázi progestogenu, není zde žádné negativní ovlivnění růstu nebo vývoje dítěte. Nitroděložní systém, který uvolňuje levonorgestrel, neovlivňuje ani kvantitu ani kvalitu mateřského mléka. Do mateřského mléka se vylučuje malé množství progestogenu (přibližně 0,1 % z dávky levonorgestrelu).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Kyleena nemá žádný známý vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Shrnutí bezpečnostního profilu
Po zavedení přípravku Kyleena se u většiny žen objevují změny menstruačního krvácení. Postupně se s časem zvyšuje výskyt amenorey a méně častého krvácení a snižuje se četnost výskytu prodlouženého, nepravidelného a častého krvácení. V klinických studiích bylo pozorováno krvácení dle následujícího schématu:
Tabulka 2: Schéma krvácení pozorované v klinických studiích s přípravkem Kyleena
| Kyleena | Prvních 90 dní | Druhých 90 dní | Konec 1. roku | Konec 3. roku | Konec 5. roku |
| Amenorea | < 1% | 5 % | 12 % | 20 % | 23 % |
| Méně časté krvácení | 10 % | 20 % | 26 % | 26 % | 26 % |
| Časté krvácení | 25 % | 10 % | 4 % | 2 % | 2 % |
| Prodloužené krvácení* | 57 % | 14 % | 6 % | 2 % | 1 % |
| Nepravidelné krvácení* | 43 % | 25 % | 17 % | 10 % | 9 % |
Subjekty s nepravidelným krvácením a prodlouženým krvácením mohou být také zahrnuty v jedné z dalších kategorií (kromě amenorey).
Tabulka se souhrnem nežádoucích účinků
Frekvence výskytu nežádoucích účinků (ADRs) hlášených pro Kyleena je shrnutá v tabulce níže. V každé frekvenční skupině jsou nežádoucí účinky uvedeny podle klesající závažnosti. Frekvence výskytu je definována následovně:
velmi časté (> 1/10),
časté (> 1/100 až < 1/10),
méně časté (> 1/1 000 až < 1/100),
vzácné (> 1/10 000
až
< 1/1 000),
velmi vzácné (< 1/10 000).
| Třída orgánových systémů | Velmi časté | Časté | Méně časté | Vzácné |
| Psychiatrické poruchy | Depresivní nálada/Deprese | |||
| Poruchy nervového systému | Bolest hlavy | Migréna | ||
| Gastrointestinální poruchy | Bolest břicha/bolest v oblasti pánve | Nauzea | ||
| Poruchy kůže a podkožní tkáně | Akné/Seborea | Alopecie | Hirsutismus | |
| Poruchy reprodukčního systému a prsu | Změny krvácení včetně silnějšího a slabšího menstruačního krvácení, špinění, méně časté krvácení a amenorea Ovariální cysty Vulvovaginitida | Infekce horní části pohlavního ústrojí Dysmenorea Bolest prsou /diskomfort Expulze tělíska (úplná a částečná) Genitální výtok | Perforace dělohy
|
* V klinických studiích musely být ovariální cysty hlášeny jako nežádoucí účinek, v případě že byly abnormální, nefunkční a/nebo měly průměr > 3 cm při ultrazvukovém vyšetření.
Tato frekvence je založena na rozsáhlé prospektivní srovnávací neintervenční kohortové studii u žen používajících jiná IUS s obsahem levonorgestrelu a IUD s mědí, která ukázala, že zavedení v období kojení a během 36 týdnů po porodu jsou nezávislé rizikové faktory pro perforaci (viz bod 4.4 pod Perforace). V klinických studiích s přípravkem Kyleena, ve kterých byly vyloučeny kojící ženy, byla frekvence perforace „vzácná“.
Popis vybraných nežádoucích účinků
Při použití jiných IUS s obsahem levonorgestrelu byly zaznamenány případy přecitlivělosti zahrnující vyrážku, kopřivku, a angioedém.
Pokud žena otěhotní se zavedeným přípravkem Kyleena, relativní riziko mimoděložního těhotenství je zvýšeno (viz bod 4.4 pod „Ektopické těhotenství“).
Partner může během pohlavního styku cítit vlákna pro vyjmutí systému.
Následující nežádoucí účinky byly hlášeny ve spojení s procedurou zavádění nebo odstranění přípravku Kyleena: bolest v průběhu procedury, krvácení během procedury, vazovagální reakce související se zaváděním se závratí nebo synkopou. Procedura může u epileptických pacientek vyvolat epileptický záchvat.
Po zavedení IUD byly hlášeny případy sepse (včetně sepse způsobené streptokoky skupiny A) (viz bod 4.4 pod „Infekce v oblasti pánve“).
Pediatrická populace
Předpokládá se, že bezpečnostní profil přípravku Kyleena je stejný jak pro adolescenty mladší 18 let, tak pro uživatelky ve věku 18 let a starší. Údaje týkající se bezpečnosti u adolescentů viz bod 5.1.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky:
4.9 Předávkování
Není relevantní.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
ATC kód: G02BA03
Farmakoterapeutická skupina: nitroděložní systém s progestinem
Farmakodynamické účinky
Kyleena má převážně lokální progestagenní účinek v dutině děložní.
Vysoká koncentrace levonorgestrelu v endometriu tlumí endometriální estrogenové a progesteronové receptory, snižuje tak citlivost endometria vůči cirkulujícímu estradiolu. Výsledný efekt je silně antiproliferativní. V endometriu jsou patrné morfologické změny a mírná reakce na cizí těleso. Zahuštění cervikálního hlenu brání průniku spermií cervikálním kanálem. Místní prostředí uvnitř dělohy a vejcovodů inhibuje mobilitu a funkci spermií a brání tak oplodnění.
V klinických studiích s přípravkem Kyleena byla ovulace pozorována u většiny žen studované podskupiny. V prvním roce byla ovulace pozorována u 23 z 26 žen, ve druhém roce u 19 z 20 žen a ve třetím roce u všech 16 žen. Ve čtvrtém roce byla ovulace pozorována u jedné ženy zůstávající v podskupině a v pátém roce nezůstala v této podskupině žádná žena.
Klinická účinnost a bezpečnost
Kontracepční účinky přípravku Kyleena byly hodnoceny v klinické studii s 1452 ženami ve věku 1835 let, zahrnovaly 39,5 % nulipar (574) ze kterých 84,0 % (482) bylo nuligravidních používajících přípravek Kyleena. Pearl Index byl za 1 rok 0,16 (95% interval spolehlivosti 0,02–0,58) a za 5 let byl 0,29 (95% interval spolehlivosti 0,16–0,50). Četnost selhání byla přibližně 0,2 % v prvním roce a kumulativní četnost selhání za 5 let byla 1,4 %. Četnost selhání zahrnuje i těhotenství způsobená nepozorovanou expulzí nebo perforací. Použití nitroděložního systému uvolňujícího levonorgestrel neovlivňuje budoucí fertilitu. V pětileté studii s přípravkem Kyleena 116 ze 163 (71,2 %) žen, které účast ve studii přerušily z důvodu přání otěhotnět, otěhotnělo během 12-měsíčního období sledování (follow-up).
Bezpečnostní profil jiného IUS s nízkým obsahem levonorgestrelu pozorovaný ve studii s 304 dospívajícími dívkami odpovídal profilu u dospělé populace. Předpokládá se, že účinnost u dospívajících mladších 18 let je stejná jako u uživatelek ve věku 18 let a starších.
Po zavedení přípravku Kyleena je průběh menstruačního cyklu výsledkem přímého působení levonorgestrelu na endometrium a nemusí být obrazem ovariálního cyklu.
U žen s různým průběhem krvácení není zřejmý rozdíl ve vývoji folikulů, v ovulaci nebo v tvorbě estradiolu a progesteronu. V procesu inhibice proliferace endometria může stoupnout počet dní špinění v prvních měsících používání. Poté má výrazná suprese endometria za následek redukci délky a intenzity menstruačního krvácení během používání přípravku Kyleena. Slabé krvácení často přejde až v oligomenoreu nebo amenoreu. Ovariální funkce je normální a hladiny estradiolu se udržují dokonce i u žen s amenoreou.
5.2 Farmakokinetické vlastnosti
Levonorgestrel je uvolňován lokálně do děložní dutiny. Křivka uvolňování in vivo je charakterizovaná počátečním strmým poklesem, který se progresivně zmírňuje, což má za následek, že po jednom roku až do konce zamýšlené 5leté periody používání je změna malá. Odhady rychlosti uvolňování in vivo v různých časových bodech jsou uvedeny v tabulce 3.
Tabulka 3: Odhadovaná rychlost uvolňování in vivo na základě zjištěného reziduálního množství ex vivo
| čas | odhady rychlosti uvolňování in vivo [mikrogramy/24 hodin] |
| 24 dní po zavedení | 17,5 |
| 60 dní po zavedení | 15,3 |
| 1 rok po zavedení | 9,8 |
| 3 roky po zavedení | 7,9 |
| 5 let po zavedení | 7,4 |
| Průměr za první rok | 12,6 |
| Průměr během 5 let | 9,0 |
Absorpce
Po zavedení se levonorgestrel ihned uvolňuje z IUS do děložní dutiny. Více než 90 % uvolněného levonorgestrelu je systematicky dostupných. Maximální sérové koncentrace je dosaženo během prvních dvou týdnů po zavedení přípravku Kyleena. Sedm dní po zavedení byla zjištěna průměrná koncentrace levonorgestrelu 162 pg/ml (5.percentil: 81 pg/ml – 95.percentil: 308 pg/ml). Následně sérová koncentrace v čase klesá, až dosáhne průměrné koncentrace 91 pg/ml (5.percentil: 47 pg/ml –95.percentil: 170 pg/ml) po 3 letech a 83 pg/ml (5.percentil: 45 pg/ml – 95.percentil: 153 pg/ml) po 5 letech. Při použití nitroděložního systému uvolňujícího levonorgestrel vede vysoká koncentrace látky v děložní dutině k vysokému koncentračnímu gradientu přes endometrium do myometria (více než 100násobný koncentrační spád endometrium-myometrium) a k nízké koncentraci levonorgestrelu v séru (koncentrační spád endometrium-sérum více než 1 000násobný).
Distribuce
Levonorgestrel se nespecificky váže na sérový albumin a specificky na SHBG. Méně než 2 % cirkulujícího levonorgestrelu je přítomno jako volný steroid. Levonorgestrel se váže na SHBG s vysokou afinitou. V souladu s tím změny koncentrace SHBG mají za následek vzestup (při vyšších koncentracích SHBG) nebo pokles (při nižších koncentracích SHBG) celkové sérové koncentrace levonorgestrelu. Během prvních 3 měsíců po zavedení přípravku Kyleena klesla koncentrace SHBG průměrně přibližně o 30 % a zůstala relativně stabilní po dobu 5 let používání. Průměrný distribuční objem levonorgestrelu je asi 106 l.
Biotransformace
Levonorgestrel je v rozsáhlé míře metabolizován. Nejdůležitější metabolické dráhy jsou redukce A4–3-oxoskupiny a hydroxylace na pozicích 2a, ip a 16p následovaná konjugací. Na základě in vitro a in vivo studií je CYP3A4 hlavním enzymem účastnícím se metabolismu levonorgestrelu. Dostupné údaje získané in vitro naznačují, že biotransformační reakce zprostředkované CYP mohou mít menší důležitost pro levonorgestrel ve srovnání s redukcí a konjugací.
Eliminace
Celková clearance levonorgestrelu z plasmy je přibližně 1,0 ml/min/kg. Pouze stopové množství levonorgestrelu se vylučuje v nezměněné formě. Metabolity jsou vylučovány stolicí a močí v přibližném vylučovacím poměru 1. Poločas exkrece je přibližně 1 den.
Linearita/nelinearita
Farmakokinetika levonorgestrelu je závislá na koncentraci SHBG, která je samotná ovlivněna estrogeny a androgeny. Pokles koncentrace SHBG vede ke snížení koncentrace celkového levonorgestrelu v séru naznačující nelineární farmakokinetiku levonorgestrelu ve vztahu k času. Na základě zejména lokálního účinku přípravku Kyleena se neočekává žádný vliv na účinnost přípravku Kyleena.
Pediatrická populace
Farmakokinetická analýza provedená u 283 adolescentek v jednoleté studii fáze III u postmenarchálních dospívajících žen (průměrný věk 16,2, věkové rozmezí 12 až 18 let) používajících jiný IUS s obsahem levonorgestrelu ukázala mírně vyšší odhadované sérové koncentrace levonorgestrelu (přibližně 10 %) u dospívajících ve srovnání s dospělými. To odpovídá celkově nižší tělesné hmotnosti u dospívajících. Rozmezí odhadovaná u dospívajících leží nicméně v rozmezích odhadovaných pro dospělé a ukazují značnou podobnost.
U přípravku Kyleena se neočekávají žádné rozdíly ve farmakokinetice dospívajících a dospělých.
Rasové rozdíly
V asijsko pacifické oblasti (93 % asijských žen, 7 % jiná etnika) byla provedena tříletá studie fáze III s použitím jiného IUS s nízkým obsahem levonorgestrelu. Srovnání farmakokinetických charakteristik levonorgestrelu u asijské populace v této studii s kavkazskou populací z jiné studie fáze III neukázalo žádný klinický relevantní rozdíl v systemické expozici a dalších farmakokinetických parametrech. Navíc denní rychlost uvolňování IUS s obsahem levonorgestrelu byla u obou populací stejná.
U přípravku Kyleena se neočekávají žádné rozdíly ve farmakokinetice u žen různých ras.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě farmakologických studií bezpečnosti, farmakokinetiky a toxicity, včetně genotoxicity a hodnocení kancerogenního potenciálu levonorgestrelu, neodhalily žádné zvláštní riziko pro člověka. Studie na opicích, jimž bylo na 9 až 12 měsíců zavedeno tělísko s levonorgestrelem, potvrdila lokální farmakologický účinek s dobrou lokální tolerancí a nepopsala žádné známky systémové toxicity. U králíků po nitroděložní aplikaci levonorgestrelu nebyla popsána žádná embryotoxicita. Bezpečnost elastomeru tvořícího rezervoár hormonu, polyethylenového a polypropylenového materiálu, stejně tak stříbrného kroužku a kombinace eleastomeru a levonorgestrelu byla testována z hlediska genetické toxikologie ve standardních testovacích systémech in vitro i in vivo. Biokompatibilita byla testována na myších, potkanech, morčatech a králících a v in vitro testu. V žádném případě nebyla prokázána bio-inkompatibilita.
Riziko pro životní prostředí (ERA)
Studie zabývající se hodnocením rizika pro životní prostředí prokázaly, že levonorgestrel může představovat riziko pro vodní prostředí (viz bod 6.6).
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Dimetikonový elastomer
Koloidní bezvodý oxid křemičitý
Polyethylen
Síran barnatý Polypropylen
Ftalocyaninová modř
Stříbro
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
3 roky
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.5 Druh obalu a obsah balení
Přípravek je jednotlivě balen v tepelně formovaných blistrech (PETG) s oddělitelnou fólií (PE). Velikosti balení: 1×1 a 5×1.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Přípravek je dodáván ve sterilním balení, které smí být otevřeno pouze těsně před zavedením. Vždy musí být se systémem manipulováno za sterilních podmínek. Jestliže je sterilní obal porušen, systém uvnitř musí být zlikvidován v souladu s lokálními pokyny pro likvidaci biologicky nebezpečného odpadu. Stejným způsobem musí být po vyjmutí zlikvidován přípravek Kyleena a zavaděč.
Přípravek je určen k zavedení lékařem za sterilních podmínek (viz bod 4.2).
Všechen nepoužitý léčivý přípravek musí být zlikvidován v souladu s místními požadavky. Tento léčivý přípravek může představovat riziko pro životní prostředí (viz bod 5.3).
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Bayer AG
Kaiser-Wilhelm-Allee 1
51373 Leverkusen
Německo
8. REGISTRAČNÍ ČÍSLO(A)
17/460/16-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 25.1.2017
Datum posledního prodloužení registrace:
Další informace o léčivu KYLEENA
Jak
se KYLEENA
podává: intrauterinní podání - intrauterinní inzert
Výdej
léku: na lékařský předpis
Balení: Blistr
Velikost
balení: 1X1
Držitel rozhodnutí o registraci daného léku v České republice:
Bayer Pharma AG, Berlín
E-mail: info.cz@bayer.com
