Souhrnné informace o léku - KHALISSIMA
1.
Khalissima 0,125 mg/0,03 mg potahované tablety
2.
3.
Khalissima 0,125 mg/0,03 mg potahované tablety
2.
Jedna potahovaná tableta obsahuje levonorgestrelum 0,125 mg a ethinylestradiolum 0,03 mg.
Pomocná látka se známým účinkem:
Jedna tableta obsahuje 58,35 mg laktosy.
Úplný seznam pomocných látek viz bod 6.1.
3.
Potahovaná tableta.
Žluté, kulaté, bikonvexní potahované tablety na jedné straně s vyraženým „LE3“ a na druhé straně hladké.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Perorální antikoncepce.
4.2 Dávkování a způsob podání
Dávkování
Tablety se musí užívat perorálně v pořadí určeném na blistru každý den přibližně ve stejnou dobu, a v případě nutnosti se musí zapít malým množstvím tekutiny. Užívá se jedna tableta denně po dobu 21 po sobě jdoucích dnů. Užívání každého dalšího blistru se zahajuje po sedmidenním intervalu bez tablet, během kterého se obvykle dostavuje krvácení z vysazení.
Krvácení zpravidla začne během 2 až 3 dnů po užití poslední tablety a nemusí skončit před začátkem užívání nového blistru.
Pediatrická populace
Přípravek Khalissima je indikován pro použití pouze po menarche.
Způsob podání
Jak užívání přípravku Khalissima zahájit
- Nepředcházelo-li užívání hormonální kontracepce v předchozím měsíci
- Přechod z kombinovaného hormonálního perorálního kontraceptiva (COC), vaginálního kroužku nebo transdermální náplasti
- Přechod z kontracepční metody obsahující pouze progestagen (pilulka s progestagenem, injekce, implantát) nebo z nitroděložního systému uvolňujícího progestagen (IUS)
- Užívání po potratu v prvním trimestru
- Užívání po porodu nebo po potratu ve druhém trimestru
Ohledně kojení viz bod 4.6 Fertilita, těhotenství a kojení.
Užívání potahovaných tablet se zahájí 21. až 28. den po porodu nebo po potratu ve druhém trimestru. Při pozdějším zahájení užívání se doporučuje, aby po dobu prvních 7 dnů žena doplňkově používala bariérovou metodu. Pokud však již proběhl pohlavní styk, je před zahájením užívání kombinované perorální antikoncepce nutno vyloučit těhotenství, nebo žena musí vyčkat do první menstruace.
Při vynechání aktivních tablet se uplatní následující doporučení:
Přípravek Khalissima obsahuje velmi nízké dávky obou hormonů, a tak je v důsledku toho při vynechání tablety antikoncepční tolerance malá. Pokud se žena s užitím jakékoli potahované tablety opozdí o méně než 12 hodin, není antikoncepční ochrana snížena. Žena musí potahovanou tabletu užít, jakmile si vzpomene a další potahované tablety musí užívat v obvyklou dobu.
Pokud se s užitím jakékoli potahované tablety opozdí o více než 12 hodin, může být antikoncepční ochrana snížena.
Při vynechání tablet se uplatní dvě základní pravidla:
-
1. Užívání tablet nikdy nesmí být přerušeno déle než 7 dní.
-
2. Odpovídající suprese osy hypothalamus-hypofýza-vaječníky vyžaduje 7 dní nepřerušovaného užívání tablet.
-
1. týden
-
2. týden
-
3. týden
-
1. Žena by měla užít poslední vynechanou potahovanou tabletu ihned, jakmile si vzpomene, a to i tehdy, pokud to znamená, že užije dvě potahované tablety najednou. Poté pokračuje v užívání potahovaných tablet v obvyklou dobu. Užívání z následujícího blistru pak zahájí okamžitě po doužívání blistru předchozího, tj. bez přestávky mezi jednotlivými blistry. Je nepravděpodobné, že by se krvácení z vysazení objevilo před koncem užívání druhého blistru, ale v průběhu užívání tablet se může vyskytnout špinění nebo krvácení z průniku.
-
2. Rovněž je možno přestat užívat potahované tablety z aktuálního blistru. Žena potom bude mít 7denní přestávku bez tablet včetně dnů, kdy byly tablety vynechány, a poté bude pokračovat novým blistrem.
V případě závažných gastrointestinálních příznaků nemusí být vstřebávání účinných látek úplné a je zapotřebí použít doplňkových antikoncepčních opatření.
Pokud do 3 až 4 hodin po užití potahované tablety dojde ke zvracení, musí žena využít radu týkající se vynechaných potahovaných tablet. Pokud žena nechce měnit svůj běžný režim užívání tablet, musí si vzít mimořádně potahované tablety z jiného blistru.
K oddálení menstruace musí žena začít užívat nový blistr bez přestávky ihned po skončení stávajícího blistru.
Menstruaci může odložit na tak dlouho, jak si bude přát, ne však na delší dobu než do dokončení druhého blistru. Během této doby může u ženy dojít ke krvácení z průniku nebo špinění. Poté se po obvyklé 7denní přestávce bez tablet obnoví pravidelné užívání přípravku Khalissima 0,125 mg/0,03 mg.
Pokud si chce žena přesunout zahajovací den nebo začátek menstruace na jiný den v týdnu, lze jí doporučit, aby zkrátila nadcházející fázi bez tablet o tolik dní, kolik si přeje. Čím kratší je pauza, tím vyšší je riziko, že se nedostaví krvácení z vysazení a že se během druhého blistru objeví krvácení z průniku a špinění (podobně jako při oddalování menstruace).
4.3 Kontraindikace
Kombinovaná perorální antikoncepce (COC) se nemá užívat za přítomnosti žádného z dále uvedených stavů. Pokud se některý z těchto stavů objeví během užívání COC poprvé, musí se přípravek ihned vysadit.
Přítomnost nebo riziko žilního tromboembolismu (VTE)
- Žilní tromboembolismus – aktuální VTE (léčený antikoagulancii) nebo trombóza (např. hluboká žilní trombóza (DVT) nebo plicní embolie (PE)) v anamnéze
- Prokázaná dědičná nebo získaná predispozice k žilnímu tromboembolismu, jako je rezistence na aktivovaný protein C (zahrnující faktor V Leiden), nedostatek antitrombinu-III, nedostatek proteinu C, nedostatek proteinu S
- Velký chirurgický zákrok s dlouhodobou imobilizací (viz bod 4.4)
- Vysoké riziko žilního tromboembolismu v důsledku přítomnosti mnohočetných rizikových faktorů (viz bod 4.4)
Přítomnost nebo riziko arteriálního tromboembolismu (ATE)
- Arteriální tromboembolismus – aktuální arteriální tromboembolismus, arteriální tromboembolismus (např. infarkt myokard) nebo prodromální stav (např. angina pectoris) v anamnéze
- Cerebrovaskulární choroba – aktuální mrtvice, mrtvice nebo prodromální stav (např. přechodná ischemická příhoda, TIA) v anamnéze
- Prokázaná dědičná nebo získaná predispozice k arteriálnímu tromboembolismu, jako je hyperhomocysteinémie a protilátky proti fosfolipidům (protilátky proti kardiolipinu, lupus antikoagulans).
- Migréna s fokálními neurologickými příznaky v anamnéze.
- Vysoké riziko arteriálního tromboembolismu v důsledku přítomnosti mnohočetných rizikových faktorů (viz bod 4.4) nebo přítomnost jednoho závažného rizikového faktoru, jako je:
o diabetes mellitus s cévními příznaky
o těžká hypertenze
o těžká dyslipoproteinémie
- Pankreatitida nebo takový stav v anamnéze, pokud je spojena s těžkou hypertriglyceridémií
- Těžká choroba jater, aktuální nebo minulá, dokud se hodnoty jaterních funkcí nevrátí k normálu
- Přítomnost jaterních nádorů nebo jaterní nádory v anamnéze (benigní nebo maligní)
- Prokázané malignity ovlivňované pohlavními hormony (např. pohlavních orgánů nebo prsou) nebo podezření na ně
- Nediagnostikované vaginální krvácení
- Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Přípravek Khalisima je kontraindikovaný při současném užívání léčivých přípravků obsahujících ombitasvir/paritaprevir/ritonavir a dasabuvir (viz body 4.4 a 4.5).
4.4 Zvláštní upozornění a opatření pro použití
Pokud jsou přítomna jakákoli onemocnění nebo rizikové faktory uvedené níže, musí být vhodnost přípravku Khalissima s ženou prodiskutována.
-
V případě zhoršení nebo prvního výskytu jakéhokoli z těchto stavů nebo rizikových faktorů musí být ženě doporučeno, aby se obrátila na svého lékaře, aby se určilo, zda by neměla užívání přípravku Khalissima ukončit.
- Oběhové poruchy
Přítomnost jednoho závažného nebo několika rizikových faktorů choroby žil nebo arterií může rovněž být kontraindikací. Rovněž je nutno zvážit možnost antikoagulační léčby. Ženy užívající COC musí být zvlášť upozorněny na to, aby se v případě možných příznaků trombózy obrátily na svého lékaře. Při podezření na trombózu nebo při jejím potvrzení je nutno užívání COC ukončit. Kvůli teratogenitě antikoagulační léčby (kumariny) se musí zahájit odpovídající alternativní antikoncepce.
Je nutno zvážit zvýšené riziko tromboembolismu v šestinedělí (viz bod 4.6 Fertilita, těhotenství a kojení).
Riziko žilního tromboembolismu (VTE)
-
V porovnání s neužíváním, se při užívání jakékoli kombinované hormonální antikoncepce (CHC) zvyšuje riziko žilního tromboembolismu (VTE). Přípravky obsahující levonorgestrel, norgestimát nebo norethisteron jsou spojeny s nejnižším rizikem žilního tromboembolismu. Rozhodnutí o užívání přípravku Khalissima lze učinit pouze po debatě, která zajistí, že žena riziko VTE spojené s přípravkem Khalissima chápe, že chápe, jak její současné rizikové faktory toto riziko ovlivňují a že riziko VTE je vůbec nejvyšší během prvního roku užívání. Existují rovněž určité důkazy, že riziko je zvýšeno při opakovaném zahájení užívání kombinované hormonální antikoncepce po přestávce trvající 4 nebo více týdnů.
U žen, které CHC neužívají a které nejsou těhotné, dojde během jednoho roku k VTE u 2 žen z 10 000. U každé jednotlivé ženy však toto riziko může být v závislosti na přítomných rizikových faktorech mnohem vyšší (viz dále).
Odhaduje se, že z 10 000 žen, které užívají CHC obsahující levonorgestrel, se za rok žilní tromboemebolismus vyvine u asi 6.
Tento počet příhod VTE za rok je nižší, než počet předpokládaný u žen v těhotenství nebo v období po porodu.
VTE může být fatální v 1–2 % případů.
Počet příhod VTE na 10 000 žen za rok
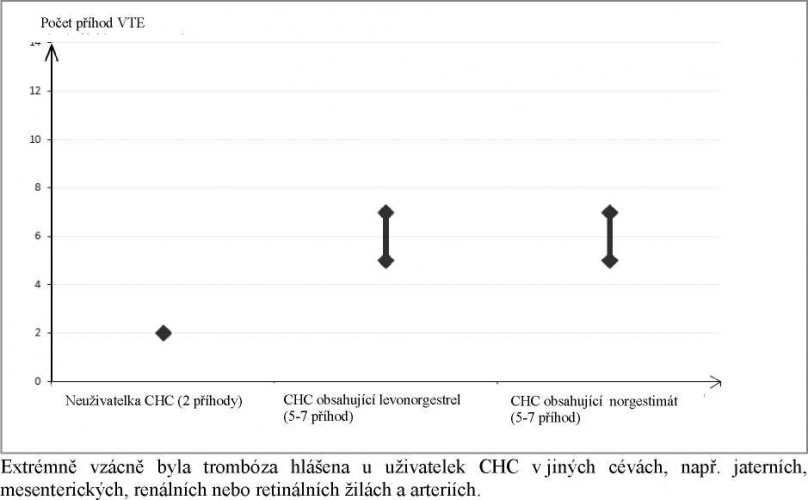
Riziko žilních tromboembolických komplikací u uživatelek CHC se může podstatně zvyšovat u ženy, která má další rizikové faktory, zvláště pokud je přítomno více rizikových faktorů (viz tabulka). Přípravek Khalissima je kontraindikován, pokud má žena více rizikových faktorů, které pro ni představují vysoké riziko žilní trombózy (viz bod 4.3). Pokud má žena více než jeden rizikový faktor, je možné, že zvýšení rizika je vyšší než součet jednotlivých faktorů – v tomto případě by mělo být zváženo její celkové riziko VTE. Pokud je poměr přínosů a rizik považován za negativní, neměla by být CHC předepisována (viz bod 4.3).
Rizikové faktory VTE
| Rizikový faktor | Poznámka |
| Obezita (index tělesné hmotnosti vyšší než 30 kg/m2) | Riziko se se zvyšujícím se indexem tělesné hmotnosti podstatně zvyšuje. Zvláště důležité je zvážit, zda nejsou přítomny i jiné rizikové faktory. |
| Dlouhodobá imobilizace, velký chirurgický zákrok, jakýkoli zákrok na dolních končetinách nebo pánvi, neurochirurgický zákrok nebo velký úraz | Za těchto situací se doporučuje užívání náplasti/pilulky/kroužku vysadit (v případě plánovaného zákroku nejméně 4 týdny předem) a užívání neobnovovat po dobu 2 týdnů po úplné remobilizaci. K zabránění neúmyslnému těhotenství je nutno používat jinou antikoncepční metodu. Pokud nebyl přípravek Khalissima vysazen |
| předem, je nutno zvážit antitrombotickou léčbu. | |
| Poznámka: dočasná imobilizace včetně cesty letadlem >4 hodiny může rovněž být rizikovým faktorem žilního tromboembolismu, zejména u žen s dalšími rizikovými faktory | |
| Pozitivní rodinná anamnéza (žilní tromboembolismus kdykoli u sourozence nebo rodiče, zejména v relativně nízkém věku, např. před 50). | Pokud je podezření na dědičnou predispozici, je nutno ženu předtím, než se rozhodne o jakémkoli použití kombinované hormonální antikoncepce, odeslat ke specialistovi k poradě. |
| Další zdravotní stavy spojené s VTE | Rakovina, systémový lupus erythematodes, hemolyticko-uremický syndrom, chronické zánětlivé onemocnění střev (Crohnova choroba nebo ulcerózní kolitida) a srpkovitá anémie |
| Vyšší věk | Zejména nad 35 let |
Není žádná shoda o možné roli varixů a povrchové tromboflebitidy v nástupu nebo progresi žilní trombózy.
Zvýšené riziko tromboembolismu v těhotenství, a zvláště během šestinedělí musí být zváženo (pro informaci o „Těhotenství a kojení “ viz bod 4.6).
V případě příznaků by mělo být ženě doporučeno, aby vyhledala naléhavou lékařskou péči a informovala lékaře, že užívá CHC.
Příznaky hluboké žilní trombózy (DVT) mohou zahrnovat:
- jednostranný otok nohy a/nebo chodidla nebo podél žíly v noze;
- bolest nebo citlivost v noze, která může být pociťována pouze vstoje nebo při chůzi;
- zvýšenou teplotu postižené nohy, zarudnutí nebo změnu barvy kůže nohy.
- náhlý nástup nevysvětlitelné dušnosti nebo rychlého dýchání;
- náhlý kašel, který může být spojený s hemoptýzou;
- ostrou bolest na hrudi;
- těžké točení hlavy nebo závrať způsobené světlem;
- rychlý nebo nepravidelný srdeční tep.
Některé z těchto příznaků (např. „dušnost“, „kašel“) nejsou specifické a mohou být nesprávně interpretovány jako častější nebo méně závažné příhody (např. infekce dýchacího traktu).
Dalšími známkami cévní okluze mohou být: náhlá bolest, otok a světle modré zbarvení končetin.
Pokud k okluzi dojde v oku, mohou se symptomy pohybovat od nebolestivého rozmazaného vidění, které může progredovat do ztráty vidění. Někdy může ke ztrátě vidění dojít téměř okamžitě.
Epidemiologické studie spojovaly používání CHC se zvýšeným rizikem arteriálního tromboembolismu (infarkt myokardu) nebo cerebrovaskulární příhody (např. tranzitorní ischemická ataka, cévní mozková příhoda). Arteriální tromboembolické příhody mohou být fatální.
Riziko arteriálních tromboembolických komplikací nebo cerebrovaskulární příhody u uživatelek kombinované hormonální antikoncepce se zvyšuje u žen s rizikovými faktory (viz tabulka). Přípravek Khalissima je kontraindikován, pokud má žena jeden závažný nebo několik rizikových faktorů ATE, které ji vystavují vysokému riziku arteriální trombózy (viz bod 4.3). Pokud je u ženy přítomno více rizikových faktorů než 1, je možné, že zvýšení rizika je vyšší, než je součet jednotlivých faktorů -v takovém případě je nutno mít na mysli celkové riziko. Pokud se má za to, že rovnováha přínosů a rizik je negativní, nesmí se CHC předepsat
Rizikové faktory ATE
| Rizikový faktor | Poznámka |
| Vyšší věk | Zejména nad 35 let |
| Kouření | Ženám je nutno doporučit, aby nekouřily, pokud hodlají užívat CHC. Ženám nad 35 let, které nadále kouří, je nutno naléhavě doporučit, aby používaly jinou antikoncepční metodu. |
| Hypertenze | |
| Obezita (index tělesné hmotnosti nad 30 kg/m2) | Riziko se se zvyšujícím se indexem tělesné hmotnosti podstatně zvyšuje. Zvláště důležité u žen s dalšími rizikovými faktory. |
| Pozitivní rodinná anamnéza (arteriální tromboembolismus kdykoli u sourozence nebo rodiče, zejména v relativně nízkém věku, např. před 50). | Pokud je podezření na dědičnou predispozici, je nutno ženu předtím, než se rozhodne o jakémkoli použití CHC, odeslat ke specialistovi k poradě. |
| Migréna | Zvýšení četnosti nebo závažnosti migrény během užívání kombinované hormonální antikoncepce (což může být prodromem cerebrovaskulární příhody) může být důvodem k okamžitému vysazení přípravku. |
| Další zdravotní stavy spojené s nežádoucími cévními příhodami | Diabetes mellitus, hyperhomocysteinémie, chlopňová srdeční choroba a fibrilace síní, dyslipoproteinémie a systémový lupus erythematodes. |
V případě příznaků by mělo být ženě doporučeno, aby vyhledala naléhavou lékařskou péči a informovala lékaře, že užívá CHC.
Příznaky cévní mozkové příhody mohou zahrnovat:
- náhlou necitlivost nebo slabost obličeje, paže nebo nohy, zvláště na jedné straně těla;
- náhlé potíže s chůzí, závratě, ztrátu rovnováhy nebo koordinace;
- náhlou zmatenost, problémy s řečí nebo porozuměním;
- náhlé potíže se zrakem na jednom nebo obou očích;
- náhlou, závažnou nebo prodlouženou bolest hlavy neznámé příčiny;
- ztrátu vědomí nebo omdlení s nebo bez záchvatu.
- bolest, nepříjemný pocit, tlak, těžkost, pocit stlačení nebo plnosti na hrudi, v paži nebo pod hrudní kostí;
- nepříjemný pocit vyzařující do zad, čelisti, hrdla, paže, žaludku;
- pocit plnosti, poruchu trávení nebo dušení;
- pocení, nauzeu, zvracení nebo závratě;
- extrémní slabost, úzkost nebo dušnost;
- rychlý nebo nepravidelný srdeční tep.
- Tumory
- Další stavy
U žen s hypertriglyceridémií nebo s tímto onemocněním v rodinné anamnéze může být při užívání COC zvýšené riziko pankreatitidy.
Přestože byly u mnohých žen užívajících COC hlášeny mírně vyšší hodnoty krevního tlaku, klinicky významný nárůst krevního tlaku je vzácný. Pouze v těchto vzácných případech je odůvodněno okamžité přerušení užívání kombinované perorální antikoncepce.
Pokud během užívání COC u stávající hypertenze konstantní zvýšené hodnoty krevního tlaku nereagují adekvátně na antihypertenzní léčbu, nebo dochází k významnému vzestupu krevního tlaku, COC musí být vysazena.
Je-li to namístě, lze užívání COC obnovit tehdy, je-li antihypertenzní terapií dosaženo normálních hodnot tlaku.
Uvádí se, že jak během těhotenství, tak během užívání COC se mohou vyskytnout nebo zhoršit následující stavy, nicméně jejich spojitost s COC je neprůkazná: žloutenka a/nebo svědění související s cholestázou, žlučové kameny, porfyrie, systémový lupus erytematodes, hemolyticko-uremický syndrom, Sydenhamova chorea, herpes gestationis, ztráta sluchu v důsledku otosklerózy, depresivní nálada. U žen s hereditárním angioedémem mohou přípravky obsahující estrogeny vyvolat nebo zhoršit příznaky angioedému.
Akutní nebo chronické poruchy funkce jater vyžadují přerušení užívání COC do doby, než se hodnoty jaterních funkcí vrátí k normálu. Recidiva cholestatické žloutenky a/nebo s cholestázou souvisejícího svědění, které se poprvé objevilo v průběhu těhotenství nebo v průběhu předchozího užívání pohlavních hormonů, vyžaduje přerušení užívání COC.
Přestože COC může mít vliv na periferní inzulínovou rezistenci a na glukózovou toleranci, potřeba úpravy terapeutického režimu u diabetiček užívajících nízkodávkovou kombinovanou perorální antikoncepci není prokázána. Diabetičky je však třeba pečlivě sledovat, zejména v počáteční fázi užívání COC.
Během užívání COC bylo zaznamenáno zhoršení endogenní deprese, epilepsie, Crohnovy choroby a ulcerózní kolitidy.
Mimořádně se může vyskytnout chloasma, a to zejména u žen s anamnézou chloasma gravidarum. Ženy se sklonem ke chloasmě se po dobu užívání kombinované perorální antikoncepce musí vyhýbat slunečnímu záření nebo ultrafialovému záření.
Před prvním nasazením nebo opětovným nasazením přípravku Khalissima by měla být získána kompletní anamnéza (včetně rodinné anamnézy) a musí být vyloučeno těhotenství. Měl by se změřit krevní tlak a mělo by být provedeno tělesné vyšetření zaměřené na kontraindikace (viz bod 4.3) a upozornění (viz bod 4.4).
Žena by také měla být informována o žilní a arteriální trombóze, včetně rizik přípravku Khalissima v porovnání s jinou CHC, o příznacích VTE a ATE, o známých rizikových faktorech a o tom, co při podezření na trombózu dělat.
Ženu je rovněž nutno poučit, aby si pečlivě přečetla příbalovou informaci a aby dodržovala uvedené pokyny. Četnost a povaha vyšetření by měly být založeny na zavedených postupech a upraveny podle individuálních potřeb ženy.
Ženy by měly být poučeny, že perorální antikoncepce nechrání před HIV infekcí (AIDS) a dalšími pohlavně přenosnými chorobami.
Zvýšení hladiny ALT
Během klinických studií u pacientek léčených pro virovou hepatitidu C (HCV) léčivými přípravky obsahujícími ombitasvir/paritaprevir/ritonavir a dasabuvir s ribavirinem nebo bez ribavirinu, došlo k zvýšení aminotransferázy (ALT) na více než pětinásobek horní hranice normálních hodnot (ULN) výrazně častěji u žen, které užívaly přípravky obsahující ethinylestradiol, jako jsou přípravky kombinované hormonální antikoncepce (CHC) (viz body 4.3 a 4.5).
Účinnost COC může být snížena v případě, že žena zapomene tablety užít, v případě těžkého zvracení nebo průjmu nebo při souběžném užívání jiných léčivých přípravků.
U všech COC se může vyskytnout nepravidelné krvácení (špinění nebo krvácení z průniku), zvláště během prvních měsíců užívání. Proto je posouzení nepravidelného krvácení smysluplné pouze po adaptačním období přibližně 3 cyklů. U uživatelek kombinace levonorgestrel/ethinylestradiol 0,125 mg/0,03 mg bylo nějaké krvácení (špinění a/nebo krvácení z průniku) v průběhu prvních 6 měsíců hlášeno u více než 50 % žen.
Pokud nepravidelnosti v krvácení přetrvávají nebo se objeví po období pravidelných cyklů, je třeba vzít v úvahu nehormonální příčiny a provést odpovídající diagnostická opatření k vyloučení malignity nebo těhotenství. Mohou zahrnovat i kyretáž.
U některých žen nemusí během intervalu bez užívání tablet dojít ke krvácení z vysazení. Pokud se COC užívá podle pokynů popsaných v bodu 4.2, je nepravděpodobné, že by žena byla těhotná. Pokud však COC nebyla užívána před prvním vynechaným krvácením pravidelně nebo nedošlo-li ke krvácení z vysazení dvakrát, je třeba před dalším užíváním COC vyloučit těhotenství.
Přípravek Khalissima obsahuje laktosu. Pacientky se vzácnými dědičnými problémy s intolerancí galaktosy, vrozeným nedostatkem laktázy nebo malabsorpcí glukosy a galaktosy nesmějí tento přípravek užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
- Poznámka: ke zjištění možných interakcí je nutné nahlédnout do preskripčních informací k současně užívané léčbě.
- Účinky jiných léčivých přípravků na přípravek Khalissima 0,125 mg/0,03 mg
Interakce se mohou objevit s léčivými přípravky, které indukují mikrozomální enzymy, což může mít za následek zvýšenou clearance pohlavních hormonů a může vést ke krvácení z průniku a/nebo k selhání kontracepce.
Postup
Enzymová indukce může být pozorována již po několika dnech léčby. Maximální enzymová indukce je obvykle pozorována během několika týdnů. Po přerušení léčby může enzymová indukce přetrvávat po dobu okolo 4 týdnů.
Krátkodobá léčba
Ženy, které se léčí některým s enzymy indukujících léčivých přípravků, by měly přechodně používat navíc k COC bariérovou kontracepční metodu nebo použít jinou metodu kontracepce. Bariérová metoda musí být používána po celou dobu léčby souběžně podávaným léčivým přípravkem a dalších 28 dní po ukončení léčby.
Pokud léčba zasáhne do období ukončení užívání tablet COC ze stávajícího blistrového balení, pak by další blistr COC měl být načat ihned po přechozím bez obvyklého intervalu bez užívání tablet.
Dlouhodobá léčba
Pokud je žena na dlouhodobé léčbě léčivou látkou, která indukuje jaterní enzymy, doporučuje se používat jinou spolehlivou nehormonální kontracepci.
V literatuře byly popsány následující interakce.
Látky zvyšující clearance COC (snižují účinnost COC enzymovou indukcí) například:
Barbituráty, bosentan, karbamazepin, fenytoin, primidon, rifampicin a léčivé přípravky na HIV ritonavir, nevirapin a efavirenz a zřejmě také felbamát, griseofulvin, oxkarbazepin, topiramát a přípravky obsahující třezalku tečkovanou (hypericum perforatum).
Látky s různými účinky na clearance COC:
Při současném podávání společně s COC mnoho kombinací inhibitorů HIV proteázy a nenukleosidových inhibitorů reverzní transkriptázy včetně kombinací s HCV inhibitory může snižovat nebo zvyšovat plasmatické koncentrace estrogenu nebo progestinů. Účinek těchto změn může být v některých případech klinicky významný.
Proto by měly být prostudovány informace o přípravku k souběžné léčbě HIV/HCV, aby byly identifikovány možné interakce, a příslušná doporučení. V případě jakýchkoliv pochyb by ženy, které jsou na léčbě inhibitory proteázy nebo nenukleosidovými inhibitory reverzní transkriptázy, měly navíc použít bariérovou kontracepční metodu.
Látky snižující clearance COC (enzymové inhibitory):
Klinický význam potenciálních interakcí s enzymovými inhibitory zůstává neznámý.
Souběžné podávání silných inhibitorů CYP3A4 může zvýšit plasmatickou koncentraci estrogenu nebo progestinu nebo obou hormonů.
Bylo zjištěno, že etoricoxib v dávkách 60 až 120 mg denně zvyšuje plasmatickou koncentraci ethinylestradiolu 1,4 až 1,6krát, zejména, je-li užíván současně s kombinovanými hormonálními kontraceptivy obsahujícími 0,035 mg ethinylestradiolu.
- Účinky přípravku Khalissima 0,125 mg/0,03 mg na jiné léčivé přípravky
- Laboratorní testy
Užívání kontracepčních steroidů může ovlivnit výsledky některých laboratorních testů, včetně biochemických parametrů jaterních, thyreoidálních, adrenálních a renálních funkcí, plasmatických hladin (vazebných) proteinů, např. kortikosteroidy vážící globulin a lipid/lipoproteinové frakce, parametry metabolismu cukrů a parametry koagulace a fibrinolýzy. Tyto změny obvykle zůstávají v rozmezí normálních laboratorních hodnot.
4.6 Fertilita, těhotenství a kojení
Těhotenství
Přípravek Khalissima 0,125 mg/0,03 mg není v těhotenství indikován.
Pokud žena během užívání přípravku Khalissima otěhotní, jeho další užívání se musí ihned ukončit. Rozsáhlé epidemiologické studie však neodhalily ani zvýšené riziko vrozených defektů u dětí narozených ženám, které před těhotenstvím užívaly antikoncepční pilulky, ani žádné teratogenní účinky, pokud byly antikoncepční pilulky užívány nechtěně během těhotenství.
Při opakovaném nasazení přípravku Khalissima je nutno zvážit zvýšené riziko VTE v poporodním období (viz bod 4.2 a 4.4).
Kojení
Kojení může být antikoncepčními pilulkami ovlivněno, protože ty mohou snižovat množství mateřského mléka a měnit jeho složení. Proto se užívání COC obecně nedoporučuje, dokud kojící matka dítě úplně neodstaví. Malá množství kontracepčních steroidů a/nebo jejich metabolitů mohou být vylučována do mateřského mléka. Tato množství mohou mít na kojence vliv.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Khalissima nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Nežádoucí účinky jsou uvedeny dle klasifikace MedDRA orgánových systémů a jsou řazeny do skupin podle četnosti výskytu s použitím následujícího pravidla: velmi časté (> 1/10); časté (> 1/100 až <1/10); méně časté (> 1/1000 až <1/100); vzácné (> 1/10 000 až <1/1000); velmi vzácné (<1/10 000); není známo (z dostupných údajů nelze určit). V každé skupině četnosti jsou nežádoucí účinky uvedeny v pořadí klesající závažnosti.
Nejčastějšími nežádoucími účinky během užívání kombinace levonorgestrel/ethinylestradiol jsou bolesti hlavy a špinění nebo krvácení z průniku.
Během užívání kombinace levonorgestrel/ethinylestradiol byly hlášeny následující nežádoucí účinky:
| Třída orgánových systémů | Časté (>1/100 až <1/10) | Méně časté (>1/1000 až <1/100) | Vzácné ( >1/10 000 až <1/1000) |
| Poruchy imunitního systému | hypersenzitivita | ||
| Poruchy metabolismu a výživy | retence tekutin | ||
| Psychiatrické poruchy | depresivní nálada, změny nálady | snížené libido | zvýšené libido |
| Poruchy nervového systému | bolest hlavy | migréna | |
| Poruchy oka | nesnášenlivost kontaktních čoček | ||
| Cévní poruchy | VTE ATE | ||
| Gastrointestinální poruchy | nauzea, bolesti břicha | zvracení, průjem | |
| Poruchy kůže a podkožní tkáně | vyrážka, kopřivka | erythema nodosum, erythema multiforme | |
| Poruchy reprodukčního systému a prsu | napětí v prsech, bolesti v prsech | zvětšení prsů | výtok z prsů, vaginální výtok |
| Vyšetření | zvýšení tělesné hmotnosti | snížení tělesné hmotnosti |
U žen užívajících CHC bylo pozorováno zvýšené riziko arteriálních a žilních trombotických a tromboembolických příhod, včetně infarktu myokardu, mrtvice, přechodné ischemické příhody, žilní trombózy a plicní embolie, jež jsou podrobněji diskutovány v bodě 4.4 Zvláštní upozornění a opatření pro použití.
Kromě toho byly u žen užívajících COC hlášeny následující závažné nežádoucí příhody, jež jsou diskutovány v bodě 4.4 Zvláštní upozornění a opatření pro použití:
- Rakovina čípku;
- hypertenze;
- hypertriglyceridémie;
- vliv na periferní inzulínovou rezistenci a glukózovou toleranci;
- jaterní nádory;
- jaterní poruchy;
- chloasma;
- Crohnova choroba, ulcerózní kolitida, epilepsie, migréna, endometrióza, děložní myom, porfyrie, systémový lupus erythematodes, herpes gestationis, Sydenhamova chorea, hemolyticko- uremický syndrom, cholestatická žloutenka; otoskleróza.
Četnost diagnózy rakoviny prsu je u uživatelek perorální antikoncepce mírně zvýšena. Protože u žen do 40 let je rakovina prsu vzácná, je vyšší počet s ohledem na celkové riziko rakoviny prsu malý. Další informace jsou uvedeny v bodech 4.3 Kontraindikace a 4.4 Zvláštní upozornění a opatření pro použití.
U žen s dědičným angioedémem mohou exogenní estrogeny symptomy angioedému vyvolat nebo zhoršit.
Interakce
Následkem interakcí jiných léků (enzymových induktorů) s perorální kontracepcí může být krvácení z průniku a/nebo selhání kontracepčního účinku (viz bod 4.5).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím:
Státního ústavu pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky:
4.9 Předávkování
O závažných nežádoucích účincích předávkování nejsou žádné zprávy. Příznaky, které mohou být předávkováním vyvolány, jsou nauzea, zvracení a u mladých dívek lehké vaginální krvácení. Specifická antidota neexistují a léčba je symptomatická.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: progestageny a estrogeny, fixní kombinace
ATC kód: G03 AA07
Antikoncepční účinky COC jsou založeny na interakci různých faktorů. Nejdůležitějšími z těchto faktorů jsou inhibice ovulace a změny cervikálního hlenu.
U 2498 žen ve věku 18 až 40 let byla provedena klinická hodnocení. Celkový Pearlův index vypočtený z těchto studií byl 0,69 (95 % interval spolehlivosti 0.30 – 1.36) založeno na 15 026 léčebných cyklech.
5.2 Farmakokinetické vlastnosti
Khalissima 0,125 mg/0,03 mg potahované tablety
2.
Jedna potahovaná tableta obsahuje levonorgestrelum 0,125 mg a ethinylestradiolum 0,03 mg.
Pomocná látka se známým účinkem:
Jedna tableta obsahuje 58,35 mg laktosy.
Úplný seznam pomocných látek viz bod 6.1.
3.
Potahovaná tableta.
Žluté, kulaté, bikonvexní potahované tablety na jedné straně s vyraženým „LE3“ a na druhé straně hladké.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Perorální antikoncepce.
4.2 Dávkování a způsob podání
Dávkování
Tablety se musí užívat perorálně v pořadí určeném na blistru každý den přibližně ve stejnou dobu, a v případě nutnosti se musí zapít malým množstvím tekutiny. Užívá se jedna tableta denně po dobu 21 po sobě jdoucích dnů. Užívání každého dalšího blistru se zahajuje po sedmidenním intervalu bez tablet, během kterého se obvykle dostavuje krvácení z vysazení.
Krvácení zpravidla začne během 2 až 3 dnů po užití poslední tablety a nemusí skončit před začátkem užívání nového blistru.
Pediatrická populace
Přípravek Khalissima je indikován pro použití pouze po menarche.
Způsob podání
Jak užívání přípravku Khalissima zahájit
- Nepředcházelo-li užívání hormonální kontracepce v předchozím měsíci
- Přechod z kombinovaného hormonálního perorálního kontraceptiva (COC), vaginálního kroužku nebo transdermální náplasti
- Přechod z kontracepční metody obsahující pouze progestagen (pilulka s progestagenem, injekce, implantát) nebo z nitroděložního systému uvolňujícího progestagen (IUS)
- Užívání po potratu v prvním trimestru
- Užívání po porodu nebo po potratu ve druhém trimestru
Ohledně kojení viz bod 4.6 Fertilita, těhotenství a kojení.
Užívání potahovaných tablet se zahájí 21. až 28. den po porodu nebo po potratu ve druhém trimestru. Při pozdějším zahájení užívání se doporučuje, aby po dobu prvních 7 dnů žena doplňkově používala bariérovou metodu. Pokud však již proběhl pohlavní styk, je před zahájením užívání kombinované perorální antikoncepce nutno vyloučit těhotenství, nebo žena musí vyčkat do první menstruace.
Vynechané tablety
Při vynechání aktivních tablet se uplatní následující doporučení:
Přípravek Khalissima obsahuje velmi nízké dávky obou hormonů, a tak je v důsledku toho při vynechání tablety antikoncepční tolerance malá. Pokud se žena s užitím jakékoli potahované tablety opozdí o méně než 12 hodin, není antikoncepční ochrana snížena. Žena musí potahovanou tabletu užít, jakmile si vzpomene a další potahované tablety musí užívat v obvyklou dobu.
Pokud se s užitím jakékoli potahované tablety opozdí o více než 12 hodin, může být antikoncepční ochrana snížena.
Při vynechání tablet se uplatní dvě základní pravidla:
-
1. Užívání tablet nikdy nesmí být přerušeno déle než 7 dní.
-
2. Odpovídající suprese osy hypothalamus-hypofýza-vaječníky vyžaduje 7 dní nepřerušovaného užívání tablet.
-
1. týden
-
2. týden
-
3. týden
-
1. Žena by měla užít poslední vynechanou potahovanou tabletu ihned, jakmile si vzpomene, a to i tehdy, pokud to znamená, že užije dvě potahované tablety najednou. Poté pokračuje v užívání potahovaných tablet v obvyklou dobu. Užívání z následujícího blistru pak zahájí okamžitě po doužívání blistru předchozího, tj. bez přestávky mezi jednotlivými blistry. Je nepravděpodobné, že by se krvácení z vysazení objevilo před koncem užívání druhého blistru, ale v průběhu užívání tablet se může vyskytnout špinění nebo krvácení z průniku.
-
2. Rovněž je možno přestat užívat potahované tablety z aktuálního blistru. Žena potom bude mít 7denní přestávku bez tablet včetně dnů, kdy byly tablety vynechány, a poté bude pokračovat novým blistrem.
- Žilní tromboembolismus – aktuální VTE (léčený antikoagulancii) nebo trombóza (např. hluboká žilní trombóza (DVT) nebo plicní embolie (PE)) v anamnéze
- Prokázaná dědičná nebo získaná predispozice k žilnímu tromboembolismu, jako je rezistence na aktivovaný protein C (zahrnující faktor V Leiden), nedostatek antitrombinu-III, nedostatek proteinu C, nedostatek proteinu S
- Velký chirurgický zákrok s dlouhodobou imobilizací (viz bod 4.4)
- Vysoké riziko žilního tromboembolismu v důsledku přítomnosti mnohočetných rizikových faktorů (viz bod 4.4)
- Arteriální tromboembolismus – aktuální arteriální tromboembolismus, arteriální tromboembolismus (např. infarkt myokard) nebo prodromální stav (např. angina pectoris) v anamnéze
- Cerebrovaskulární choroba – aktuální mrtvice, mrtvice nebo prodromální stav (např. přechodná ischemická příhoda, TIA) v anamnéze
- Prokázaná dědičná nebo získaná predispozice k arteriálnímu tromboembolismu, jako je hyperhomocysteinémie a protilátky proti fosfolipidům (protilátky proti kardiolipinu, lupus antikoagulans).
- Migréna s fokálními neurologickými příznaky v anamnéze.
- Vysoké riziko arteriálního tromboembolismu v důsledku přítomnosti mnohočetných rizikových faktorů (viz bod 4.4) nebo přítomnost jednoho závažného rizikového faktoru, jako je:
- Pankreatitida nebo takový stav v anamnéze, pokud je spojena s těžkou hypertriglyceridémií
- Těžká choroba jater, aktuální nebo minulá, dokud se hodnoty jaterních funkcí nevrátí k normálu
- Přítomnost jaterních nádorů nebo jaterní nádory v anamnéze (benigní nebo maligní)
- Prokázané malignity ovlivňované pohlavními hormony (např. pohlavních orgánů nebo prsou) nebo podezření na ně
- Nediagnostikované vaginální krvácení
- Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Přípravek Khalisima je kontraindikovaný při současném užívání léčivých přípravků obsahujících ombitasvir/paritaprevir/ritonavir a dasabuvir (viz body 4.4 a 4.5).
-
V případě zhoršení nebo prvního výskytu jakéhokoli z těchto stavů nebo rizikových faktorů musí být ženě doporučeno, aby se obrátila na svého lékaře, aby se určilo, zda by neměla užívání přípravku Khalissima ukončit.
- Oběhové poruchy
Přítomnost jednoho závažného nebo několika rizikových faktorů choroby žil nebo arterií může rovněž být kontraindikací. Rovněž je nutno zvážit možnost antikoagulační léčby. Ženy užívající COC musí být zvlášť upozorněny na to, aby se v případě možných příznaků trombózy obrátily na svého lékaře. Při podezření na trombózu nebo při jejím potvrzení je nutno užívání COC ukončit. Kvůli teratogenitě antikoagulační léčby (kumariny) se musí zahájit odpovídající alternativní antikoncepce.
Je nutno zvážit zvýšené riziko tromboembolismu v šestinedělí (viz bod 4.6 Fertilita, těhotenství a kojení).
Riziko žilního tromboembolismu (VTE)
-
V porovnání s neužíváním, se při užívání jakékoli kombinované hormonální antikoncepce (CHC) zvyšuje riziko žilního tromboembolismu (VTE). Přípravky obsahující levonorgestrel, norgestimát nebo norethisteron jsou spojeny s nejnižším rizikem žilního tromboembolismu. Rozhodnutí o užívání přípravku Khalissima lze učinit pouze po debatě, která zajistí, že žena riziko VTE spojené s přípravkem Khalissima chápe, že chápe, jak její současné rizikové faktory toto riziko ovlivňují a že riziko VTE je vůbec nejvyšší během prvního roku užívání. Existují rovněž určité důkazy, že riziko je zvýšeno při opakovaném zahájení užívání kombinované hormonální antikoncepce po přestávce trvající 4 nebo více týdnů.
U žen, které CHC neužívají a které nejsou těhotné, dojde během jednoho roku k VTE u 2 žen z 10 000. U každé jednotlivé ženy však toto riziko může být v závislosti na přítomných rizikových faktorech mnohem vyšší (viz dále).
Odhaduje se, že z 10 000 žen, které užívají CHC obsahující levonorgestrel, se za rok žilní tromboemebolismus vyvine u asi 6.
Tento počet příhod VTE za rok je nižší, než počet předpokládaný u žen v těhotenství nebo v období po porodu.
VTE může být fatální v 1–2 % případů.
Počet příhod VTE na 10 000 žen za rok

Rizikové faktory VTE
Riziko žilních tromboembolických komplikací u uživatelek CHC se může podstatně zvyšovat u ženy, která má další rizikové faktory, zvláště pokud je přítomno více rizikových faktorů (viz tabulka). Přípravek Khalissima je kontraindikován, pokud má žena více rizikových faktorů, které pro ni představují vysoké riziko žilní trombózy (viz bod 4.3). Pokud má žena více než jeden rizikový faktor, je možné, že zvýšení rizika je vyšší než součet jednotlivých faktorů – v tomto případě by mělo být zváženo její celkové riziko VTE. Pokud je poměr přínosů a rizik považován za negativní, neměla by být CHC předepisována (viz bod 4.3).
Rizikové faktory VTE
| Rizikový faktor | Poznámka |
| Obezita (index tělesné hmotnosti vyšší než 30 kg/m2) | Riziko se se zvyšujícím se indexem tělesné hmotnosti podstatně zvyšuje. Zvláště důležité je zvážit, zda nejsou přítomny i jiné rizikové faktory. |
| Dlouhodobá imobilizace, velký chirurgický zákrok, jakýkoli zákrok na dolních končetinách nebo pánvi, neurochirurgický zákrok nebo velký úraz | Za těchto situací se doporučuje užívání náplasti/pilulky/kroužku vysadit (v případě plánovaného zákroku nejméně 4 týdny předem) a užívání neobnovovat po dobu 2 týdnů po úplné remobilizaci. K zabránění neúmyslnému těhotenství je nutno používat jinou antikoncepční metodu. Pokud nebyl přípravek Khalissima vysazen |
| předem, je nutno zvážit antitrombotickou léčbu. | |
| Poznámka: dočasná imobilizace včetně cesty letadlem >4 hodiny může rovněž být rizikovým faktorem žilního tromboembolismu, zejména u žen s dalšími rizikovými faktory | |
| Pozitivní rodinná anamnéza (žilní tromboembolismus kdykoli u sourozence nebo rodiče, zejména v relativně nízkém věku, např. před 50). | Pokud je podezření na dědičnou predispozici, je nutno ženu předtím, než se rozhodne o jakémkoli použití kombinované hormonální antikoncepce, odeslat ke specialistovi k poradě. |
| Další zdravotní stavy spojené s VTE | Rakovina, systémový lupus erythematodes, hemolyticko-uremický syndrom, chronické zánětlivé onemocnění střev (Crohnova choroba nebo ulcerózní kolitida) a srpkovitá anémie |
| Vyšší věk | Zejména nad 35 let |
Není žádná shoda o možné roli varixů a povrchové tromboflebitidy v nástupu nebo progresi žilní trombózy.
Zvýšené riziko tromboembolismu v těhotenství, a zvláště během šestinedělí musí být zváženo (pro informaci o „Těhotenství a kojení “ viz bod 4.6).
Příznaky VTE (hluboká žilní trombóza a plicní embolie)
V případě příznaků by mělo být ženě doporučeno, aby vyhledala naléhavou lékařskou péči a informovala lékaře, že užívá CHC.
Příznaky hluboké žilní trombózy (DVT) mohou zahrnovat:
- jednostranný otok nohy a/nebo chodidla nebo podél žíly v noze;
- bolest nebo citlivost v noze, která může být pociťována pouze vstoje nebo při chůzi;
- zvýšenou teplotu postižené nohy, zarudnutí nebo změnu barvy kůže nohy.
- náhlý nástup nevysvětlitelné dušnosti nebo rychlého dýchání;
- náhlý kašel, který může být spojený s hemoptýzou;
- ostrou bolest na hrudi;
- těžké točení hlavy nebo závrať způsobené světlem;
- rychlý nebo nepravidelný srdeční tep.
Některé z těchto příznaků (např. „dušnost“, „kašel“) nejsou specifické a mohou být nesprávně interpretovány jako častější nebo méně závažné příhody (např. infekce dýchacího traktu).
Dalšími známkami cévní okluze mohou být: náhlá bolest, otok a světle modré zbarvení končetin.
Pokud k okluzi dojde v oku, mohou se symptomy pohybovat od nebolestivého rozmazaného vidění, které může progredovat do ztráty vidění. Někdy může ke ztrátě vidění dojít téměř okamžitě.
Riziko arteriálního tromboembolismu (ATE)
Epidemiologické studie spojovaly používání CHC se zvýšeným rizikem arteriálního tromboembolismu (infarkt myokardu) nebo cerebrovaskulární příhody (např. tranzitorní ischemická ataka, cévní mozková příhoda). Arteriální tromboembolické příhody mohou být fatální.
Rizikové faktory ATE
Riziko arteriálních tromboembolických komplikací nebo cerebrovaskulární příhody u uživatelek kombinované hormonální antikoncepce se zvyšuje u žen s rizikovými faktory (viz tabulka). Přípravek Khalissima je kontraindikován, pokud má žena jeden závažný nebo několik rizikových faktorů ATE, které ji vystavují vysokému riziku arteriální trombózy (viz bod 4.3). Pokud je u ženy přítomno více rizikových faktorů než 1, je možné, že zvýšení rizika je vyšší, než je součet jednotlivých faktorů -v takovém případě je nutno mít na mysli celkové riziko. Pokud se má za to, že rovnováha přínosů a rizik je negativní, nesmí se CHC předepsat
Rizikové faktory ATE
| Rizikový faktor | Poznámka |
| Vyšší věk | Zejména nad 35 let |
| Kouření | Ženám je nutno doporučit, aby nekouřily, pokud hodlají užívat CHC. Ženám nad 35 let, které nadále kouří, je nutno naléhavě doporučit, aby používaly jinou antikoncepční metodu. |
| Hypertenze | |
| Obezita (index tělesné hmotnosti nad 30 kg/m2) | Riziko se se zvyšujícím se indexem tělesné hmotnosti podstatně zvyšuje. Zvláště důležité u žen s dalšími rizikovými faktory. |
| Pozitivní rodinná anamnéza (arteriální tromboembolismus kdykoli u sourozence nebo rodiče, zejména v relativně nízkém věku, např. před 50). | Pokud je podezření na dědičnou predispozici, je nutno ženu předtím, než se rozhodne o jakémkoli použití CHC, odeslat ke specialistovi k poradě. |
| Migréna | Zvýšení četnosti nebo závažnosti migrény během užívání kombinované hormonální antikoncepce (což může být prodromem cerebrovaskulární příhody) může být důvodem k okamžitému vysazení přípravku. |
| Další zdravotní stavy spojené s nežádoucími cévními příhodami | Diabetes mellitus, hyperhomocysteinémie, chlopňová srdeční choroba a fibrilace síní, dyslipoproteinémie a systémový lupus erythematodes. |
Příznaky ATE
V případě příznaků by mělo být ženě doporučeno, aby vyhledala naléhavou lékařskou péči a informovala lékaře, že užívá CHC.
Příznaky cévní mozkové příhody mohou zahrnovat:
- náhlou necitlivost nebo slabost obličeje, paže nebo nohy, zvláště na jedné straně těla;
- náhlé potíže s chůzí, závratě, ztrátu rovnováhy nebo koordinace;
- náhlou zmatenost, problémy s řečí nebo porozuměním;
- náhlé potíže se zrakem na jednom nebo obou očích;
- náhlou, závažnou nebo prodlouženou bolest hlavy neznámé příčiny;
- ztrátu vědomí nebo omdlení s nebo bez záchvatu.
- bolest, nepříjemný pocit, tlak, těžkost, pocit stlačení nebo plnosti na hrudi, v paži nebo pod hrudní kostí;
- nepříjemný pocit vyzařující do zad, čelisti, hrdla, paže, žaludku;
- pocit plnosti, poruchu trávení nebo dušení;
- pocení, nauzeu, zvracení nebo závratě;
- extrémní slabost, úzkost nebo dušnost;
- rychlý nebo nepravidelný srdeční tep.
- Tumory
- Další stavy
U žen s hypertriglyceridémií nebo s tímto onemocněním v rodinné anamnéze může být při užívání COC zvýšené riziko pankreatitidy.
Přestože byly u mnohých žen užívajících COC hlášeny mírně vyšší hodnoty krevního tlaku, klinicky významný nárůst krevního tlaku je vzácný. Pouze v těchto vzácných případech je odůvodněno okamžité přerušení užívání kombinované perorální antikoncepce.
Pokud během užívání COC u stávající hypertenze konstantní zvýšené hodnoty krevního tlaku nereagují adekvátně na antihypertenzní léčbu, nebo dochází k významnému vzestupu krevního tlaku, COC musí být vysazena.
Je-li to namístě, lze užívání COC obnovit tehdy, je-li antihypertenzní terapií dosaženo normálních hodnot tlaku.
Uvádí se, že jak během těhotenství, tak během užívání COC se mohou vyskytnout nebo zhoršit následující stavy, nicméně jejich spojitost s COC je neprůkazná: žloutenka a/nebo svědění související s cholestázou, žlučové kameny, porfyrie, systémový lupus erytematodes, hemolyticko-uremický syndrom, Sydenhamova chorea, herpes gestationis, ztráta sluchu v důsledku otosklerózy, depresivní nálada. U žen s hereditárním angioedémem mohou přípravky obsahující estrogeny vyvolat nebo zhoršit příznaky angioedému.
Akutní nebo chronické poruchy funkce jater vyžadují přerušení užívání COC do doby, než se hodnoty jaterních funkcí vrátí k normálu. Recidiva cholestatické žloutenky a/nebo s cholestázou souvisejícího svědění, které se poprvé objevilo v průběhu těhotenství nebo v průběhu předchozího užívání pohlavních hormonů, vyžaduje přerušení užívání COC.
Přestože COC může mít vliv na periferní inzulínovou rezistenci a na glukózovou toleranci, potřeba úpravy terapeutického režimu u diabetiček užívajících nízkodávkovou kombinovanou perorální antikoncepci není prokázána. Diabetičky je však třeba pečlivě sledovat, zejména v počáteční fázi užívání COC.
Během užívání COC bylo zaznamenáno zhoršení endogenní deprese, epilepsie, Crohnovy choroby a ulcerózní kolitidy.
Mimořádně se může vyskytnout chloasma, a to zejména u žen s anamnézou chloasma gravidarum. Ženy se sklonem ke chloasmě se po dobu užívání kombinované perorální antikoncepce musí vyhýbat slunečnímu záření nebo ultrafialovému záření.
Lékařské vyšetření/konzultace
Před prvním nasazením nebo opětovným nasazením přípravku Khalissima by měla být získána kompletní anamnéza (včetně rodinné anamnézy) a musí být vyloučeno těhotenství. Měl by se změřit krevní tlak a mělo by být provedeno tělesné vyšetření zaměřené na kontraindikace (viz bod 4.3) a upozornění (viz bod 4.4).
Žena by také měla být informována o žilní a arteriální trombóze, včetně rizik přípravku Khalissima v porovnání s jinou CHC, o příznacích VTE a ATE, o známých rizikových faktorech a o tom, co při podezření na trombózu dělat.
Ženu je rovněž nutno poučit, aby si pečlivě přečetla příbalovou informaci a aby dodržovala uvedené pokyny. Četnost a povaha vyšetření by měly být založeny na zavedených postupech a upraveny podle individuálních potřeb ženy.
Ženy by měly být poučeny, že perorální antikoncepce nechrání před HIV infekcí (AIDS) a dalšími pohlavně přenosnými chorobami.
Zvýšení hladiny ALT
Během klinických studií u pacientek léčených pro virovou hepatitidu C (HCV) léčivými přípravky obsahujícími ombitasvir/paritaprevir/ritonavir a dasabuvir s ribavirinem nebo bez ribavirinu, došlo k zvýšení aminotransferázy (ALT) na více než pětinásobek horní hranice normálních hodnot (ULN) výrazně častěji u žen, které užívaly přípravky obsahující ethinylestradiol, jako jsou přípravky kombinované hormonální antikoncepce (CHC) (viz body 4.3 a 4.5).
Snížená účinnost
Účinnost COC může být snížena v případě, že žena zapomene tablety užít, v případě těžkého zvracení nebo průjmu nebo při souběžném užívání jiných léčivých přípravků.
Snížení kontroly cyklu
U všech COC se může vyskytnout nepravidelné krvácení (špinění nebo krvácení z průniku), zvláště během prvních měsíců užívání. Proto je posouzení nepravidelného krvácení smysluplné pouze po adaptačním období přibližně 3 cyklů. U uživatelek kombinace levonorgestrel/ethinylestradiol 0,125 mg/0,03 mg bylo nějaké krvácení (špinění a/nebo krvácení z průniku) v průběhu prvních 6 měsíců hlášeno u více než 50 % žen.
Pokud nepravidelnosti v krvácení přetrvávají nebo se objeví po období pravidelných cyklů, je třeba vzít v úvahu nehormonální příčiny a provést odpovídající diagnostická opatření k vyloučení malignity nebo těhotenství. Mohou zahrnovat i kyretáž.
U některých žen nemusí během intervalu bez užívání tablet dojít ke krvácení z vysazení. Pokud se COC užívá podle pokynů popsaných v bodu 4.2, je nepravděpodobné, že by žena byla těhotná. Pokud však COC nebyla užívána před prvním vynechaným krvácením pravidelně nebo nedošlo-li ke krvácení z vysazení dvakrát, je třeba před dalším užíváním COC vyloučit těhotenství.
Přípravek Khalissima obsahuje laktosu. Pacientky se vzácnými dědičnými problémy s intolerancí galaktosy, vrozeným nedostatkem laktázy nebo malabsorpcí glukosy a galaktosy nesmějí tento přípravek užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
- Poznámka: ke zjištění možných interakcí je nutné nahlédnout do preskripčních informací k současně užívané léčbě.
- Účinky jiných léčivých přípravků na přípravek Khalissima 0,125 mg/0,03 mg
Interakce se mohou objevit s léčivými přípravky, které indukují mikrozomální enzymy, což může mít za následek zvýšenou clearance pohlavních hormonů a může vést ke krvácení z průniku a/nebo k selhání kontracepce.
Postup
Enzymová indukce může být pozorována již po několika dnech léčby. Maximální enzymová indukce je obvykle pozorována během několika týdnů. Po přerušení léčby může enzymová indukce přetrvávat po dobu okolo 4 týdnů.
Krátkodobá léčba
Ženy, které se léčí některým s enzymy indukujících léčivých přípravků, by měly přechodně používat navíc k COC bariérovou kontracepční metodu nebo použít jinou metodu kontracepce. Bariérová metoda musí být používána po celou dobu léčby souběžně podávaným léčivým přípravkem a dalších 28 dní po ukončení léčby.
Pokud léčba zasáhne do období ukončení užívání tablet COC ze stávajícího blistrového balení, pak by další blistr COC měl být načat ihned po přechozím bez obvyklého intervalu bez užívání tablet.
Dlouhodobá léčba
Pokud je žena na dlouhodobé léčbě léčivou látkou, která indukuje jaterní enzymy, doporučuje se používat jinou spolehlivou nehormonální kontracepci.
V literatuře byly popsány následující interakce.
Látky zvyšující clearance COC (snižují účinnost COC enzymovou indukcí) například:
Barbituráty, bosentan, karbamazepin, fenytoin, primidon, rifampicin a léčivé přípravky na HIV ritonavir, nevirapin a efavirenz a zřejmě také felbamát, griseofulvin, oxkarbazepin, topiramát a přípravky obsahující třezalku tečkovanou (hypericum perforatum).
Látky s různými účinky na clearance COC:
Při současném podávání společně s COC mnoho kombinací inhibitorů HIV proteázy a nenukleosidových inhibitorů reverzní transkriptázy včetně kombinací s HCV inhibitory může snižovat nebo zvyšovat plasmatické koncentrace estrogenu nebo progestinů. Účinek těchto změn může být v některých případech klinicky významný.
Proto by měly být prostudovány informace o přípravku k souběžné léčbě HIV/HCV, aby byly identifikovány možné interakce, a příslušná doporučení. V případě jakýchkoliv pochyb by ženy, které jsou na léčbě inhibitory proteázy nebo nenukleosidovými inhibitory reverzní transkriptázy, měly navíc použít bariérovou kontracepční metodu.
Látky snižující clearance COC (enzymové inhibitory):
Klinický význam potenciálních interakcí s enzymovými inhibitory zůstává neznámý.
Souběžné podávání silných inhibitorů CYP3A4 může zvýšit plasmatickou koncentraci estrogenu nebo progestinu nebo obou hormonů.
Bylo zjištěno, že etoricoxib v dávkách 60 až 120 mg denně zvyšuje plasmatickou koncentraci ethinylestradiolu 1,4 až 1,6krát, zejména, je-li užíván současně s kombinovanými hormonálními kontraceptivy obsahujícími 0,035 mg ethinylestradiolu.
- Účinky přípravku Khalissima 0,125 mg/0,03 mg na jiné léčivé přípravky
- Laboratorní testy
Užívání kontracepčních steroidů může ovlivnit výsledky některých laboratorních testů, včetně biochemických parametrů jaterních, thyreoidálních, adrenálních a renálních funkcí, plasmatických hladin (vazebných) proteinů, např. kortikosteroidy vážící globulin a lipid/lipoproteinové frakce, parametry metabolismu cukrů a parametry koagulace a fibrinolýzy. Tyto změny obvykle zůstávají v rozmezí normálních laboratorních hodnot.
4.6 Fertilita, těhotenství a kojení
Těhotenství
Přípravek Khalissima 0,125 mg/0,03 mg není v těhotenství indikován.
Pokud žena během užívání přípravku Khalissima otěhotní, jeho další užívání se musí ihned ukončit. Rozsáhlé epidemiologické studie však neodhalily ani zvýšené riziko vrozených defektů u dětí narozených ženám, které před těhotenstvím užívaly antikoncepční pilulky, ani žádné teratogenní účinky, pokud byly antikoncepční pilulky užívány nechtěně během těhotenství.
Při opakovaném nasazení přípravku Khalissima je nutno zvážit zvýšené riziko VTE v poporodním období (viz bod 4.2 a 4.4).
Kojení
Kojení může být antikoncepčními pilulkami ovlivněno, protože ty mohou snižovat množství mateřského mléka a měnit jeho složení. Proto se užívání COC obecně nedoporučuje, dokud kojící matka dítě úplně neodstaví. Malá množství kontracepčních steroidů a/nebo jejich metabolitů mohou být vylučována do mateřského mléka. Tato množství mohou mít na kojence vliv.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Khalissima nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Nežádoucí účinky jsou uvedeny dle klasifikace MedDRA orgánových systémů a jsou řazeny do skupin podle četnosti výskytu s použitím následujícího pravidla: velmi časté (> 1/10); časté (> 1/100 až <1/10); méně časté (> 1/1000 až <1/100); vzácné (> 1/10 000 až <1/1000); velmi vzácné (<1/10 000); není známo (z dostupných údajů nelze určit). V každé skupině četnosti jsou nežádoucí účinky uvedeny v pořadí klesající závažnosti.
Nejčastějšími nežádoucími účinky během užívání kombinace levonorgestrel/ethinylestradiol jsou bolesti hlavy a špinění nebo krvácení z průniku.
Během užívání kombinace levonorgestrel/ethinylestradiol byly hlášeny následující nežádoucí účinky:
| Třída orgánových systémů | Časté (>1/100 až <1/10) | Méně časté (>1/1000 až <1/100) | Vzácné ( >1/10 000 až <1/1000) |
| Poruchy imunitního systému | hypersenzitivita | ||
| Poruchy metabolismu a výživy | retence tekutin | ||
| Psychiatrické poruchy | depresivní nálada, změny nálady | snížené libido | zvýšené libido |
| Poruchy nervového systému | bolest hlavy | migréna | |
| Poruchy oka | nesnášenlivost kontaktních čoček | ||
| Cévní poruchy | VTE ATE | ||
| Gastrointestinální poruchy | nauzea, bolesti břicha | zvracení, průjem | |
| Poruchy kůže a podkožní tkáně | vyrážka, kopřivka | erythema nodosum, erythema multiforme | |
| Poruchy reprodukčního systému a prsu | napětí v prsech, bolesti v prsech | zvětšení prsů | výtok z prsů, vaginální výtok |
| Vyšetření | zvýšení tělesné hmotnosti | snížení tělesné hmotnosti |
U žen užívajících CHC bylo pozorováno zvýšené riziko arteriálních a žilních trombotických a tromboembolických příhod, včetně infarktu myokardu, mrtvice, přechodné ischemické příhody, žilní trombózy a plicní embolie, jež jsou podrobněji diskutovány v bodě 4.4 Zvláštní upozornění a opatření pro použití.
Kromě toho byly u žen užívajících COC hlášeny následující závažné nežádoucí příhody, jež jsou diskutovány v bodě 4.4 Zvláštní upozornění a opatření pro použití:
- Rakovina čípku;
- hypertenze;
- hypertriglyceridémie;
- vliv na periferní inzulínovou rezistenci a glukózovou toleranci;
- jaterní nádory;
- jaterní poruchy;
- chloasma;
- Crohnova choroba, ulcerózní kolitida, epilepsie, migréna, endometrióza, děložní myom, porfyrie, systémový lupus erythematodes, herpes gestationis, Sydenhamova chorea, hemolyticko- uremický syndrom, cholestatická žloutenka; otoskleróza.
Četnost diagnózy rakoviny prsu je u uživatelek perorální antikoncepce mírně zvýšena. Protože u žen do 40 let je rakovina prsu vzácná, je vyšší počet s ohledem na celkové riziko rakoviny prsu malý. Další informace jsou uvedeny v bodech 4.3 Kontraindikace a 4.4 Zvláštní upozornění a opatření pro použití.
U žen s dědičným angioedémem mohou exogenní estrogeny symptomy angioedému vyvolat nebo zhoršit.
Interakce
Následkem interakcí jiných léků (enzymových induktorů) s perorální kontracepcí může být krvácení z průniku a/nebo selhání kontracepčního účinku (viz bod 4.5).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím:
Státního ústavu pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky:
4.9 Předávkování
O závažných nežádoucích účincích předávkování nejsou žádné zprávy. Příznaky, které mohou být předávkováním vyvolány, jsou nauzea, zvracení a u mladých dívek lehké vaginální krvácení. Specifická antidota neexistují a léčba je symptomatická.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: progestageny a estrogeny, fixní kombinace
ATC kód: G03 AA07
Antikoncepční účinky COC jsou založeny na interakci různých faktorů. Nejdůležitějšími z těchto faktorů jsou inhibice ovulace a změny cervikálního hlenu.
U 2498 žen ve věku 18 až 40 let byla provedena klinická hodnocení. Celkový Pearlův index vypočtený z těchto studií byl 0,69 (95 % interval spolehlivosti 0.30 – 1.36) založeno na 15 026 léčebných cyklech.
5.2 Farmakokinetické vlastnosti
Absorpce
Perorálně podaný levonorgestrel se rychle a úplně vstřebává. Maximálních sérových koncentrací okolo 2,3 ng/ml se dosáhne za asi 1,3 hodiny po užití tablet s levonorgestrelem a ethinylestradiolem. Biologická dostupnost je téměř 100 %.
Distribuce
Levonorgestrel je vázán na sérový albumin a pohlavní hormony vázající globulin (SHBG). Pouze
-
1,1 % celkové sérové koncentrace léku je přítomno jako volný steroid, asi 65 % je specificky vázáno na SHBG a asi 35 % je nespecificky vázáno na albumin. Ethinylestradiolem indukované zvýšení koncentrace SHBG ovlivňuje relativní distribuci levonorgestrelu do různých proteinových frakcí. Indukce vazebného proteinu způsobuje zvýšení frakce vázané na SHBG a snížení frakce vázané na albumin. Zdánlivý distribuční objem levonorgestrelu po jedné dávce je 129 l.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické studie (obecná toxicita, genotoxicita, karcinogenní potenciál a reprodukční toxicita) jiné neodhalily jiné účinky, než jsou ty, které lze vysvětlit na základě známého hormonálního profilu ethinylestradiolu a levonorgestrelu.
Je však třeba mít na paměti, že pohlavní steroidy mohou podporovat růst jistých na hormonech závislých tkání a nádorů.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Jádro tablety:
Laktosa
Mikrokrystalická celulosa
Povidon K30
Sodná sůl kroskarmelosy
Magnesium-stearát
Potah tablety:
Hypromelosa
Oxid titaničitý (E171)
Makrogol 400
Žlutý oxid železitý (E172)
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25 °C.
6.5 Druh obalu a obsah balení
Čirý, průhledný PVC/Al blistr obsahující 21 tablet, zabalený v hliníkovém laminovaném sáčku.
Čirý, průhledný PVC/Aclar/Al blistr obsahující 21 tablet, zabalený v hliníkovém laminovaném sáčku.
Přípravek Khalissima 0,125 mg/0,03 mg je k dispozici v baleních po 21 (1×21), 63 (3×21) a 126 (6×21) potahovaných tabletách.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
7.
Khalissima 0,125 mg/0,03 mg potahované tablety
2.
Jedna potahovaná tableta obsahuje levonorgestrelum 0,125 mg a ethinylestradiolum 0,03 mg.
Pomocná látka se známým účinkem:
Jedna tableta obsahuje 58,35 mg laktosy.
Úplný seznam pomocných látek viz bod 6.1.
3.
Potahovaná tableta.
Žluté, kulaté, bikonvexní potahované tablety na jedné straně s vyraženým „LE3“ a na druhé straně hladké.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Perorální antikoncepce.
4.2 Dávkování a způsob podání
Dávkování
Tablety se musí užívat perorálně v pořadí určeném na blistru každý den přibližně ve stejnou dobu, a v případě nutnosti se musí zapít malým množstvím tekutiny. Užívá se jedna tableta denně po dobu 21 po sobě jdoucích dnů. Užívání každého dalšího blistru se zahajuje po sedmidenním intervalu bez tablet, během kterého se obvykle dostavuje krvácení z vysazení.
Krvácení zpravidla začne během 2 až 3 dnů po užití poslední tablety a nemusí skončit před začátkem užívání nového blistru.
Pediatrická populace
Přípravek Khalissima je indikován pro použití pouze po menarche.
Způsob podání
Jak užívání přípravku Khalissima zahájit
- Nepředcházelo-li užívání hormonální kontracepce v předchozím měsíci
- Přechod z kombinovaného hormonálního perorálního kontraceptiva (COC), vaginálního kroužku nebo transdermální náplasti
- Přechod z kontracepční metody obsahující pouze progestagen (pilulka s progestagenem, injekce, implantát) nebo z nitroděložního systému uvolňujícího progestagen (IUS)
- Užívání po potratu v prvním trimestru
- Užívání po porodu nebo po potratu ve druhém trimestru
Ohledně kojení viz bod 4.6 Fertilita, těhotenství a kojení.
Užívání potahovaných tablet se zahájí 21. až 28. den po porodu nebo po potratu ve druhém trimestru. Při pozdějším zahájení užívání se doporučuje, aby po dobu prvních 7 dnů žena doplňkově používala bariérovou metodu. Pokud však již proběhl pohlavní styk, je před zahájením užívání kombinované perorální antikoncepce nutno vyloučit těhotenství, nebo žena musí vyčkat do první menstruace.
Vynechané tablety
Při vynechání aktivních tablet se uplatní následující doporučení:
Přípravek Khalissima obsahuje velmi nízké dávky obou hormonů, a tak je v důsledku toho při vynechání tablety antikoncepční tolerance malá. Pokud se žena s užitím jakékoli potahované tablety opozdí o méně než 12 hodin, není antikoncepční ochrana snížena. Žena musí potahovanou tabletu užít, jakmile si vzpomene a další potahované tablety musí užívat v obvyklou dobu.
Pokud se s užitím jakékoli potahované tablety opozdí o více než 12 hodin, může být antikoncepční ochrana snížena.
Při vynechání tablet se uplatní dvě základní pravidla:
-
1. Užívání tablet nikdy nesmí být přerušeno déle než 7 dní.
-
2. Odpovídající suprese osy hypothalamus-hypofýza-vaječníky vyžaduje 7 dní nepřerušovaného užívání tablet.
-
1. týden
-
2. týden
-
3. týden
-
1. Žena by měla užít poslední vynechanou potahovanou tabletu ihned, jakmile si vzpomene, a to i tehdy, pokud to znamená, že užije dvě potahované tablety najednou. Poté pokračuje v užívání potahovaných tablet v obvyklou dobu. Užívání z následujícího blistru pak zahájí okamžitě po doužívání blistru předchozího, tj. bez přestávky mezi jednotlivými blistry. Je nepravděpodobné, že by se krvácení z vysazení objevilo před koncem užívání druhého blistru, ale v průběhu užívání tablet se může vyskytnout špinění nebo krvácení z průniku.
-
2. Rovněž je možno přestat užívat potahované tablety z aktuálního blistru. Žena potom bude mít 7denní přestávku bez tablet včetně dnů, kdy byly tablety vynechány, a poté bude pokračovat novým blistrem.
- Žilní tromboembolismus – aktuální VTE (léčený antikoagulancii) nebo trombóza (např. hluboká žilní trombóza (DVT) nebo plicní embolie (PE)) v anamnéze
- Prokázaná dědičná nebo získaná predispozice k žilnímu tromboembolismu, jako je rezistence na aktivovaný protein C (zahrnující faktor V Leiden), nedostatek antitrombinu-III, nedostatek proteinu C, nedostatek proteinu S
- Velký chirurgický zákrok s dlouhodobou imobilizací (viz bod 4.4)
- Vysoké riziko žilního tromboembolismu v důsledku přítomnosti mnohočetných rizikových faktorů (viz bod 4.4)
- Arteriální tromboembolismus – aktuální arteriální tromboembolismus, arteriální tromboembolismus (např. infarkt myokard) nebo prodromální stav (např. angina pectoris) v anamnéze
- Cerebrovaskulární choroba – aktuální mrtvice, mrtvice nebo prodromální stav (např. přechodná ischemická příhoda, TIA) v anamnéze
- Prokázaná dědičná nebo získaná predispozice k arteriálnímu tromboembolismu, jako je hyperhomocysteinémie a protilátky proti fosfolipidům (protilátky proti kardiolipinu, lupus antikoagulans).
- Migréna s fokálními neurologickými příznaky v anamnéze.
- Vysoké riziko arteriálního tromboembolismu v důsledku přítomnosti mnohočetných rizikových faktorů (viz bod 4.4) nebo přítomnost jednoho závažného rizikového faktoru, jako je:
- Pankreatitida nebo takový stav v anamnéze, pokud je spojena s těžkou hypertriglyceridémií
- Těžká choroba jater, aktuální nebo minulá, dokud se hodnoty jaterních funkcí nevrátí k normálu
- Přítomnost jaterních nádorů nebo jaterní nádory v anamnéze (benigní nebo maligní)
- Prokázané malignity ovlivňované pohlavními hormony (např. pohlavních orgánů nebo prsou) nebo podezření na ně
- Nediagnostikované vaginální krvácení
- Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Přípravek Khalisima je kontraindikovaný při současném užívání léčivých přípravků obsahujících ombitasvir/paritaprevir/ritonavir a dasabuvir (viz body 4.4 a 4.5).
-
V případě zhoršení nebo prvního výskytu jakéhokoli z těchto stavů nebo rizikových faktorů musí být ženě doporučeno, aby se obrátila na svého lékaře, aby se určilo, zda by neměla užívání přípravku Khalissima ukončit.
- Oběhové poruchy
Přítomnost jednoho závažného nebo několika rizikových faktorů choroby žil nebo arterií může rovněž být kontraindikací. Rovněž je nutno zvážit možnost antikoagulační léčby. Ženy užívající COC musí být zvlášť upozorněny na to, aby se v případě možných příznaků trombózy obrátily na svého lékaře. Při podezření na trombózu nebo při jejím potvrzení je nutno užívání COC ukončit. Kvůli teratogenitě antikoagulační léčby (kumariny) se musí zahájit odpovídající alternativní antikoncepce.
Je nutno zvážit zvýšené riziko tromboembolismu v šestinedělí (viz bod 4.6 Fertilita, těhotenství a kojení).
Riziko žilního tromboembolismu (VTE)
-
V porovnání s neužíváním, se při užívání jakékoli kombinované hormonální antikoncepce (CHC) zvyšuje riziko žilního tromboembolismu (VTE). Přípravky obsahující levonorgestrel, norgestimát nebo norethisteron jsou spojeny s nejnižším rizikem žilního tromboembolismu. Rozhodnutí o užívání přípravku Khalissima lze učinit pouze po debatě, která zajistí, že žena riziko VTE spojené s přípravkem Khalissima chápe, že chápe, jak její současné rizikové faktory toto riziko ovlivňují a že riziko VTE je vůbec nejvyšší během prvního roku užívání. Existují rovněž určité důkazy, že riziko je zvýšeno při opakovaném zahájení užívání kombinované hormonální antikoncepce po přestávce trvající 4 nebo více týdnů.
U žen, které CHC neužívají a které nejsou těhotné, dojde během jednoho roku k VTE u 2 žen z 10 000. U každé jednotlivé ženy však toto riziko může být v závislosti na přítomných rizikových faktorech mnohem vyšší (viz dále).
Odhaduje se, že z 10 000 žen, které užívají CHC obsahující levonorgestrel, se za rok žilní tromboemebolismus vyvine u asi 6.
Tento počet příhod VTE za rok je nižší, než počet předpokládaný u žen v těhotenství nebo v období po porodu.
VTE může být fatální v 1–2 % případů.
Počet příhod VTE na 10 000 žen za rok

Rizikové faktory VTE
Riziko žilních tromboembolických komplikací u uživatelek CHC se může podstatně zvyšovat u ženy, která má další rizikové faktory, zvláště pokud je přítomno více rizikových faktorů (viz tabulka). Přípravek Khalissima je kontraindikován, pokud má žena více rizikových faktorů, které pro ni představují vysoké riziko žilní trombózy (viz bod 4.3). Pokud má žena více než jeden rizikový faktor, je možné, že zvýšení rizika je vyšší než součet jednotlivých faktorů – v tomto případě by mělo být zváženo její celkové riziko VTE. Pokud je poměr přínosů a rizik považován za negativní, neměla by být CHC předepisována (viz bod 4.3).
Rizikové faktory VTE
| Rizikový faktor | Poznámka |
| Obezita (index tělesné hmotnosti vyšší než 30 kg/m2) | Riziko se se zvyšujícím se indexem tělesné hmotnosti podstatně zvyšuje. Zvláště důležité je zvážit, zda nejsou přítomny i jiné rizikové faktory. |
| Dlouhodobá imobilizace, velký chirurgický zákrok, jakýkoli zákrok na dolních končetinách nebo pánvi, neurochirurgický zákrok nebo velký úraz | Za těchto situací se doporučuje užívání náplasti/pilulky/kroužku vysadit (v případě plánovaného zákroku nejméně 4 týdny předem) a užívání neobnovovat po dobu 2 týdnů po úplné remobilizaci. K zabránění neúmyslnému těhotenství je nutno používat jinou antikoncepční metodu. Pokud nebyl přípravek Khalissima vysazen |
| předem, je nutno zvážit antitrombotickou léčbu. | |
| Poznámka: dočasná imobilizace včetně cesty letadlem >4 hodiny může rovněž být rizikovým faktorem žilního tromboembolismu, zejména u žen s dalšími rizikovými faktory | |
| Pozitivní rodinná anamnéza (žilní tromboembolismus kdykoli u sourozence nebo rodiče, zejména v relativně nízkém věku, např. před 50). | Pokud je podezření na dědičnou predispozici, je nutno ženu předtím, než se rozhodne o jakémkoli použití kombinované hormonální antikoncepce, odeslat ke specialistovi k poradě. |
| Další zdravotní stavy spojené s VTE | Rakovina, systémový lupus erythematodes, hemolyticko-uremický syndrom, chronické zánětlivé onemocnění střev (Crohnova choroba nebo ulcerózní kolitida) a srpkovitá anémie |
| Vyšší věk | Zejména nad 35 let |
Není žádná shoda o možné roli varixů a povrchové tromboflebitidy v nástupu nebo progresi žilní trombózy.
Zvýšené riziko tromboembolismu v těhotenství, a zvláště během šestinedělí musí být zváženo (pro informaci o „Těhotenství a kojení “ viz bod 4.6).
Příznaky VTE (hluboká žilní trombóza a plicní embolie)
V případě příznaků by mělo být ženě doporučeno, aby vyhledala naléhavou lékařskou péči a informovala lékaře, že užívá CHC.
Příznaky hluboké žilní trombózy (DVT) mohou zahrnovat:
- jednostranný otok nohy a/nebo chodidla nebo podél žíly v noze;
- bolest nebo citlivost v noze, která může být pociťována pouze vstoje nebo při chůzi;
- zvýšenou teplotu postižené nohy, zarudnutí nebo změnu barvy kůže nohy.
- náhlý nástup nevysvětlitelné dušnosti nebo rychlého dýchání;
- náhlý kašel, který může být spojený s hemoptýzou;
- ostrou bolest na hrudi;
- těžké točení hlavy nebo závrať způsobené světlem;
- rychlý nebo nepravidelný srdeční tep.
Některé z těchto příznaků (např. „dušnost“, „kašel“) nejsou specifické a mohou být nesprávně interpretovány jako častější nebo méně závažné příhody (např. infekce dýchacího traktu).
Dalšími známkami cévní okluze mohou být: náhlá bolest, otok a světle modré zbarvení končetin.
Pokud k okluzi dojde v oku, mohou se symptomy pohybovat od nebolestivého rozmazaného vidění, které může progredovat do ztráty vidění. Někdy může ke ztrátě vidění dojít téměř okamžitě.
Riziko arteriálního tromboembolismu (ATE)
Epidemiologické studie spojovaly používání CHC se zvýšeným rizikem arteriálního tromboembolismu (infarkt myokardu) nebo cerebrovaskulární příhody (např. tranzitorní ischemická ataka, cévní mozková příhoda). Arteriální tromboembolické příhody mohou být fatální.
Rizikové faktory ATE
Riziko arteriálních tromboembolických komplikací nebo cerebrovaskulární příhody u uživatelek kombinované hormonální antikoncepce se zvyšuje u žen s rizikovými faktory (viz tabulka). Přípravek Khalissima je kontraindikován, pokud má žena jeden závažný nebo několik rizikových faktorů ATE, které ji vystavují vysokému riziku arteriální trombózy (viz bod 4.3). Pokud je u ženy přítomno více rizikových faktorů než 1, je možné, že zvýšení rizika je vyšší, než je součet jednotlivých faktorů -v takovém případě je nutno mít na mysli celkové riziko. Pokud se má za to, že rovnováha přínosů a rizik je negativní, nesmí se CHC předepsat
Rizikové faktory ATE
| Rizikový faktor | Poznámka |
| Vyšší věk | Zejména nad 35 let |
| Kouření | Ženám je nutno doporučit, aby nekouřily, pokud hodlají užívat CHC. Ženám nad 35 let, které nadále kouří, je nutno naléhavě doporučit, aby používaly jinou antikoncepční metodu. |
| Hypertenze | |
| Obezita (index tělesné hmotnosti nad 30 kg/m2) | Riziko se se zvyšujícím se indexem tělesné hmotnosti podstatně zvyšuje. Zvláště důležité u žen s dalšími rizikovými faktory. |
| Pozitivní rodinná anamnéza (arteriální tromboembolismus kdykoli u sourozence nebo rodiče, zejména v relativně nízkém věku, např. před 50). | Pokud je podezření na dědičnou predispozici, je nutno ženu předtím, než se rozhodne o jakémkoli použití CHC, odeslat ke specialistovi k poradě. |
| Migréna | Zvýšení četnosti nebo závažnosti migrény během užívání kombinované hormonální antikoncepce (což může být prodromem cerebrovaskulární příhody) může být důvodem k okamžitému vysazení přípravku. |
| Další zdravotní stavy spojené s nežádoucími cévními příhodami | Diabetes mellitus, hyperhomocysteinémie, chlopňová srdeční choroba a fibrilace síní, dyslipoproteinémie a systémový lupus erythematodes. |
Příznaky ATE
V případě příznaků by mělo být ženě doporučeno, aby vyhledala naléhavou lékařskou péči a informovala lékaře, že užívá CHC.
Příznaky cévní mozkové příhody mohou zahrnovat:
- náhlou necitlivost nebo slabost obličeje, paže nebo nohy, zvláště na jedné straně těla;
- náhlé potíže s chůzí, závratě, ztrátu rovnováhy nebo koordinace;
- náhlou zmatenost, problémy s řečí nebo porozuměním;
- náhlé potíže se zrakem na jednom nebo obou očích;
- náhlou, závažnou nebo prodlouženou bolest hlavy neznámé příčiny;
- ztrátu vědomí nebo omdlení s nebo bez záchvatu.
- bolest, nepříjemný pocit, tlak, těžkost, pocit stlačení nebo plnosti na hrudi, v paži nebo pod hrudní kostí;
- nepříjemný pocit vyzařující do zad, čelisti, hrdla, paže, žaludku;
- pocit plnosti, poruchu trávení nebo dušení;
- pocení, nauzeu, zvracení nebo závratě;
- extrémní slabost, úzkost nebo dušnost;
- rychlý nebo nepravidelný srdeční tep.
- Tumory
- Další stavy
U žen s hypertriglyceridémií nebo s tímto onemocněním v rodinné anamnéze může být při užívání COC zvýšené riziko pankreatitidy.
Přestože byly u mnohých žen užívajících COC hlášeny mírně vyšší hodnoty krevního tlaku, klinicky významný nárůst krevního tlaku je vzácný. Pouze v těchto vzácných případech je odůvodněno okamžité přerušení užívání kombinované perorální antikoncepce.
Pokud během užívání COC u stávající hypertenze konstantní zvýšené hodnoty krevního tlaku nereagují adekvátně na antihypertenzní léčbu, nebo dochází k významnému vzestupu krevního tlaku, COC musí být vysazena.
Je-li to namístě, lze užívání COC obnovit tehdy, je-li antihypertenzní terapií dosaženo normálních hodnot tlaku.
Uvádí se, že jak během těhotenství, tak během užívání COC se mohou vyskytnout nebo zhoršit následující stavy, nicméně jejich spojitost s COC je neprůkazná: žloutenka a/nebo svědění související s cholestázou, žlučové kameny, porfyrie, systémový lupus erytematodes, hemolyticko-uremický syndrom, Sydenhamova chorea, herpes gestationis, ztráta sluchu v důsledku otosklerózy, depresivní nálada. U žen s hereditárním angioedémem mohou přípravky obsahující estrogeny vyvolat nebo zhoršit příznaky angioedému.
Akutní nebo chronické poruchy funkce jater vyžadují přerušení užívání COC do doby, než se hodnoty jaterních funkcí vrátí k normálu. Recidiva cholestatické žloutenky a/nebo s cholestázou souvisejícího svědění, které se poprvé objevilo v průběhu těhotenství nebo v průběhu předchozího užívání pohlavních hormonů, vyžaduje přerušení užívání COC.
Přestože COC může mít vliv na periferní inzulínovou rezistenci a na glukózovou toleranci, potřeba úpravy terapeutického režimu u diabetiček užívajících nízkodávkovou kombinovanou perorální antikoncepci není prokázána. Diabetičky je však třeba pečlivě sledovat, zejména v počáteční fázi užívání COC.
Během užívání COC bylo zaznamenáno zhoršení endogenní deprese, epilepsie, Crohnovy choroby a ulcerózní kolitidy.
Mimořádně se může vyskytnout chloasma, a to zejména u žen s anamnézou chloasma gravidarum. Ženy se sklonem ke chloasmě se po dobu užívání kombinované perorální antikoncepce musí vyhýbat slunečnímu záření nebo ultrafialovému záření.
Lékařské vyšetření/konzultace
Před prvním nasazením nebo opětovným nasazením přípravku Khalissima by měla být získána kompletní anamnéza (včetně rodinné anamnézy) a musí být vyloučeno těhotenství. Měl by se změřit krevní tlak a mělo by být provedeno tělesné vyšetření zaměřené na kontraindikace (viz bod 4.3) a upozornění (viz bod 4.4).
Žena by také měla být informována o žilní a arteriální trombóze, včetně rizik přípravku Khalissima v porovnání s jinou CHC, o příznacích VTE a ATE, o známých rizikových faktorech a o tom, co při podezření na trombózu dělat.
Ženu je rovněž nutno poučit, aby si pečlivě přečetla příbalovou informaci a aby dodržovala uvedené pokyny. Četnost a povaha vyšetření by měly být založeny na zavedených postupech a upraveny podle individuálních potřeb ženy.
Ženy by měly být poučeny, že perorální antikoncepce nechrání před HIV infekcí (AIDS) a dalšími pohlavně přenosnými chorobami.
Zvýšení hladiny ALT
Během klinických studií u pacientek léčených pro virovou hepatitidu C (HCV) léčivými přípravky obsahujícími ombitasvir/paritaprevir/ritonavir a dasabuvir s ribavirinem nebo bez ribavirinu, došlo k zvýšení aminotransferázy (ALT) na více než pětinásobek horní hranice normálních hodnot (ULN) výrazně častěji u žen, které užívaly přípravky obsahující ethinylestradiol, jako jsou přípravky kombinované hormonální antikoncepce (CHC) (viz body 4.3 a 4.5).
Snížená účinnost
Účinnost COC může být snížena v případě, že žena zapomene tablety užít, v případě těžkého zvracení nebo průjmu nebo při souběžném užívání jiných léčivých přípravků.
Snížení kontroly cyklu
U všech COC se může vyskytnout nepravidelné krvácení (špinění nebo krvácení z průniku), zvláště během prvních měsíců užívání. Proto je posouzení nepravidelného krvácení smysluplné pouze po adaptačním období přibližně 3 cyklů. U uživatelek kombinace levonorgestrel/ethinylestradiol 0,125 mg/0,03 mg bylo nějaké krvácení (špinění a/nebo krvácení z průniku) v průběhu prvních 6 měsíců hlášeno u více než 50 % žen.
Pokud nepravidelnosti v krvácení přetrvávají nebo se objeví po období pravidelných cyklů, je třeba vzít v úvahu nehormonální příčiny a provést odpovídající diagnostická opatření k vyloučení malignity nebo těhotenství. Mohou zahrnovat i kyretáž.
U některých žen nemusí během intervalu bez užívání tablet dojít ke krvácení z vysazení. Pokud se COC užívá podle pokynů popsaných v bodu 4.2, je nepravděpodobné, že by žena byla těhotná. Pokud však COC nebyla užívána před prvním vynechaným krvácením pravidelně nebo nedošlo-li ke krvácení z vysazení dvakrát, je třeba před dalším užíváním COC vyloučit těhotenství.
Přípravek Khalissima obsahuje laktosu. Pacientky se vzácnými dědičnými problémy s intolerancí galaktosy, vrozeným nedostatkem laktázy nebo malabsorpcí glukosy a galaktosy nesmějí tento přípravek užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
- Poznámka: ke zjištění možných interakcí je nutné nahlédnout do preskripčních informací k současně užívané léčbě.
- Účinky jiných léčivých přípravků na přípravek Khalissima 0,125 mg/0,03 mg
Interakce se mohou objevit s léčivými přípravky, které indukují mikrozomální enzymy, což může mít za následek zvýšenou clearance pohlavních hormonů a může vést ke krvácení z průniku a/nebo k selhání kontracepce.
Postup
Enzymová indukce může být pozorována již po několika dnech léčby. Maximální enzymová indukce je obvykle pozorována během několika týdnů. Po přerušení léčby může enzymová indukce přetrvávat po dobu okolo 4 týdnů.
Krátkodobá léčba
Ženy, které se léčí některým s enzymy indukujících léčivých přípravků, by měly přechodně používat navíc k COC bariérovou kontracepční metodu nebo použít jinou metodu kontracepce. Bariérová metoda musí být používána po celou dobu léčby souběžně podávaným léčivým přípravkem a dalších 28 dní po ukončení léčby.
Pokud léčba zasáhne do období ukončení užívání tablet COC ze stávajícího blistrového balení, pak by další blistr COC měl být načat ihned po přechozím bez obvyklého intervalu bez užívání tablet.
Dlouhodobá léčba
Pokud je žena na dlouhodobé léčbě léčivou látkou, která indukuje jaterní enzymy, doporučuje se používat jinou spolehlivou nehormonální kontracepci.
V literatuře byly popsány následující interakce.
Látky zvyšující clearance COC (snižují účinnost COC enzymovou indukcí) například:
Barbituráty, bosentan, karbamazepin, fenytoin, primidon, rifampicin a léčivé přípravky na HIV ritonavir, nevirapin a efavirenz a zřejmě také felbamát, griseofulvin, oxkarbazepin, topiramát a přípravky obsahující třezalku tečkovanou (hypericum perforatum).
Látky s různými účinky na clearance COC:
Při současném podávání společně s COC mnoho kombinací inhibitorů HIV proteázy a nenukleosidových inhibitorů reverzní transkriptázy včetně kombinací s HCV inhibitory může snižovat nebo zvyšovat plasmatické koncentrace estrogenu nebo progestinů. Účinek těchto změn může být v některých případech klinicky významný.
Proto by měly být prostudovány informace o přípravku k souběžné léčbě HIV/HCV, aby byly identifikovány možné interakce, a příslušná doporučení. V případě jakýchkoliv pochyb by ženy, které jsou na léčbě inhibitory proteázy nebo nenukleosidovými inhibitory reverzní transkriptázy, měly navíc použít bariérovou kontracepční metodu.
Látky snižující clearance COC (enzymové inhibitory):
Klinický význam potenciálních interakcí s enzymovými inhibitory zůstává neznámý.
Souběžné podávání silných inhibitorů CYP3A4 může zvýšit plasmatickou koncentraci estrogenu nebo progestinu nebo obou hormonů.
Bylo zjištěno, že etoricoxib v dávkách 60 až 120 mg denně zvyšuje plasmatickou koncentraci ethinylestradiolu 1,4 až 1,6krát, zejména, je-li užíván současně s kombinovanými hormonálními kontraceptivy obsahujícími 0,035 mg ethinylestradiolu.
- Účinky přípravku Khalissima 0,125 mg/0,03 mg na jiné léčivé přípravky
- Laboratorní testy
Užívání kontracepčních steroidů může ovlivnit výsledky některých laboratorních testů, včetně biochemických parametrů jaterních, thyreoidálních, adrenálních a renálních funkcí, plasmatických hladin (vazebných) proteinů, např. kortikosteroidy vážící globulin a lipid/lipoproteinové frakce, parametry metabolismu cukrů a parametry koagulace a fibrinolýzy. Tyto změny obvykle zůstávají v rozmezí normálních laboratorních hodnot.
4.6 Fertilita, těhotenství a kojení
Těhotenství
Přípravek Khalissima 0,125 mg/0,03 mg není v těhotenství indikován.
Pokud žena během užívání přípravku Khalissima otěhotní, jeho další užívání se musí ihned ukončit. Rozsáhlé epidemiologické studie však neodhalily ani zvýšené riziko vrozených defektů u dětí narozených ženám, které před těhotenstvím užívaly antikoncepční pilulky, ani žádné teratogenní účinky, pokud byly antikoncepční pilulky užívány nechtěně během těhotenství.
Při opakovaném nasazení přípravku Khalissima je nutno zvážit zvýšené riziko VTE v poporodním období (viz bod 4.2 a 4.4).
Kojení
Kojení může být antikoncepčními pilulkami ovlivněno, protože ty mohou snižovat množství mateřského mléka a měnit jeho složení. Proto se užívání COC obecně nedoporučuje, dokud kojící matka dítě úplně neodstaví. Malá množství kontracepčních steroidů a/nebo jejich metabolitů mohou být vylučována do mateřského mléka. Tato množství mohou mít na kojence vliv.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Khalissima nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Nežádoucí účinky jsou uvedeny dle klasifikace MedDRA orgánových systémů a jsou řazeny do skupin podle četnosti výskytu s použitím následujícího pravidla: velmi časté (> 1/10); časté (> 1/100 až <1/10); méně časté (> 1/1000 až <1/100); vzácné (> 1/10 000 až <1/1000); velmi vzácné (<1/10 000); není známo (z dostupných údajů nelze určit). V každé skupině četnosti jsou nežádoucí účinky uvedeny v pořadí klesající závažnosti.
Nejčastějšími nežádoucími účinky během užívání kombinace levonorgestrel/ethinylestradiol jsou bolesti hlavy a špinění nebo krvácení z průniku.
Během užívání kombinace levonorgestrel/ethinylestradiol byly hlášeny následující nežádoucí účinky:
| Třída orgánových systémů | Časté (>1/100 až <1/10) | Méně časté (>1/1000 až <1/100) | Vzácné ( >1/10 000 až <1/1000) |
| Poruchy imunitního systému | hypersenzitivita | ||
| Poruchy metabolismu a výživy | retence tekutin | ||
| Psychiatrické poruchy | depresivní nálada, změny nálady | snížené libido | zvýšené libido |
| Poruchy nervového systému | bolest hlavy | migréna | |
| Poruchy oka | nesnášenlivost kontaktních čoček | ||
| Cévní poruchy | VTE ATE | ||
| Gastrointestinální poruchy | nauzea, bolesti břicha | zvracení, průjem | |
| Poruchy kůže a podkožní tkáně | vyrážka, kopřivka | erythema nodosum, erythema multiforme | |
| Poruchy reprodukčního systému a prsu | napětí v prsech, bolesti v prsech | zvětšení prsů | výtok z prsů, vaginální výtok |
| Vyšetření | zvýšení tělesné hmotnosti | snížení tělesné hmotnosti |
U žen užívajících CHC bylo pozorováno zvýšené riziko arteriálních a žilních trombotických a tromboembolických příhod, včetně infarktu myokardu, mrtvice, přechodné ischemické příhody, žilní trombózy a plicní embolie, jež jsou podrobněji diskutovány v bodě 4.4 Zvláštní upozornění a opatření pro použití.
Kromě toho byly u žen užívajících COC hlášeny následující závažné nežádoucí příhody, jež jsou diskutovány v bodě 4.4 Zvláštní upozornění a opatření pro použití:
- Rakovina čípku;
- hypertenze;
- hypertriglyceridémie;
- vliv na periferní inzulínovou rezistenci a glukózovou toleranci;
- jaterní nádory;
- jaterní poruchy;
- chloasma;
- Crohnova choroba, ulcerózní kolitida, epilepsie, migréna, endometrióza, děložní myom, porfyrie, systémový lupus erythematodes, herpes gestationis, Sydenhamova chorea, hemolyticko- uremický syndrom, cholestatická žloutenka; otoskleróza.
Četnost diagnózy rakoviny prsu je u uživatelek perorální antikoncepce mírně zvýšena. Protože u žen do 40 let je rakovina prsu vzácná, je vyšší počet s ohledem na celkové riziko rakoviny prsu malý. Další informace jsou uvedeny v bodech 4.3 Kontraindikace a 4.4 Zvláštní upozornění a opatření pro použití.
U žen s dědičným angioedémem mohou exogenní estrogeny symptomy angioedému vyvolat nebo zhoršit.
Interakce
Následkem interakcí jiných léků (enzymových induktorů) s perorální kontracepcí může být krvácení z průniku a/nebo selhání kontracepčního účinku (viz bod 4.5).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím:
Státního ústavu pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky:
4.9 Předávkování
O závažných nežádoucích účincích předávkování nejsou žádné zprávy. Příznaky, které mohou být předávkováním vyvolány, jsou nauzea, zvracení a u mladých dívek lehké vaginální krvácení. Specifická antidota neexistují a léčba je symptomatická.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: progestageny a estrogeny, fixní kombinace
ATC kód: G03 AA07
Antikoncepční účinky COC jsou založeny na interakci různých faktorů. Nejdůležitějšími z těchto faktorů jsou inhibice ovulace a změny cervikálního hlenu.
U 2498 žen ve věku 18 až 40 let byla provedena klinická hodnocení. Celkový Pearlův index vypočtený z těchto studií byl 0,69 (95 % interval spolehlivosti 0.30 – 1.36) založeno na 15 026 léčebných cyklech.
5.2 Farmakokinetické vlastnosti
Absorpce
Perorálně podaný levonorgestrel se rychle a úplně vstřebává. Maximálních sérových koncentrací okolo 2,3 ng/ml se dosáhne za asi 1,3 hodiny po užití tablet s levonorgestrelem a ethinylestradiolem. Biologická dostupnost je téměř 100 %.
Distribuce
Levonorgestrel je vázán na sérový albumin a pohlavní hormony vázající globulin (SHBG). Pouze
-
1,1 % celkové sérové koncentrace léku je přítomno jako volný steroid, asi 65 % je specificky vázáno na SHBG a asi 35 % je nespecificky vázáno na albumin. Ethinylestradiolem indukované zvýšení koncentrace SHBG ovlivňuje relativní distribuci levonorgestrelu do různých proteinových frakcí. Indukce vazebného proteinu způsobuje zvýšení frakce vázané na SHBG a snížení frakce vázané na albumin. Zdánlivý distribuční objem levonorgestrelu po jedné dávce je 129 l.
8.
17/332/16-C
9.
Další informace o léčivu KHALISSIMA
Jak
se KHALISSIMA
podává: perorální podání - potahovaná tableta
Výdej
léku: na lékařský předpis
Balení: Blistr
Velikost
balení: 21(1X21) II
Držitel rozhodnutí o registraci daného léku v České republice:
Sandoz s.r.o., Praha
E-mail: office.cz@sandoz.com
Telefon: 221 421 611
