Souhrnné informace o léku - JANGEE 0,02 MG/3 MG 28 POTAHOVANÝCH TABLET
1. NÁZEV PŘÍPRAVKU
Jangee 0,02 mg/3 mg 28 potahovaných tablet
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna potahovaná tableta obsahuje ethinylestradiolum 0,02 mg a drospirenonum 3 mg.
Pomocná látka se známým účinkem: Jedna potahovaná tableta obsahuje 44 mg monohydrátu laktózy.
Tato tableta neobsahuje účinné látky.
Pomocná látka se známým účinkem: Jedna potahovaná tableta obsahuje 89,5 mg laktózy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Potahovaná tableta.
Tablety s účinnou látkou: Růžové, kulaté, potahované tablety o průměru zhruba 5,7 mm. Tablety placeba: Bílé, kulaté, potahované tablety o průměru zhruba 5,7 mm.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Perorální kontraceptivum.
Rozhodnutí předepsat přípravek Jangee by mělo být provedeno po zvážení jednotlivých současných rizikových faktorů ženy, zvláště rizikových faktorů pro žilní tromboembolismus (VTE), a toho, jaké je riziko VTE u přípravku Jangee v porovnání s dalšími přípravky CHC (viz body 4.3 a 4.4).
4.2 Dávkování a způsob podání
Dávkování
Jak se přípravek Jangee užívá
Tablety se musí užívat každý den přibližně ve stejnou dobu, v případě potřeby se zapíjejí malým množstvím tekutiny, v pořadí vytištěném na blistru. Tablety se užívají nepřetržitě. Jedna tableta se má užívat denně 28 po sobě jdoucích dnů. Každé následující blistr se začíná užívat den po poslední tabletě z předchozího blistru. Krvácení z vysazení obvykle začíná za 2 až 3 dny po zahájení užívání tablet placeba (poslední řada) a nemusí skončit před zahájením užívání dalšího blistru.
- Hormonální kontraceptivum nebylo dříve používáno (v minulém měsíci)
- Přechod z jiného kombinovaného hormonálního kontraceptiva (kombinovaného perorálního kontraceptiva (COC), vaginálního kroužku nebo transdermální náplasti)
- Přechod z pouze progestagenní metody (pouze progestagenní tabletka, injekce, implantát) nebo z nitroděložního tělíska uvolňujícího progestogen („IUS“)
- Po potratu v prvním trimestru
- Po porodu nebo potratu v druhém trimestru
- Pokyny pro kojící ženy viz bod 4.6.
1. NÁZEV PŘÍPRAVKU
Jangee 0,02 mg/3 mg 28 potahovaných tablet
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Růžové tablety (tablety s účinnou látkou):
Jedna potahovaná tableta obsahuje ethinylestradiolum 0,02 mg a drospirenonum 3 mg.
Pomocná látka se známým účinkem: Jedna potahovaná tableta obsahuje 44 mg monohydrátu laktózy.
Bílé tablety (tablety s placebem):
Tato tableta neobsahuje účinné látky.
Pomocná látka se známým účinkem: Jedna potahovaná tableta obsahuje 89,5 mg laktózy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Potahovaná tableta.
Tablety s účinnou látkou: Růžové, kulaté, potahované tablety o průměru zhruba 5,7 mm. Tablety placeba: Bílé, kulaté, potahované tablety o průměru zhruba 5,7 mm.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Perorální kontraceptivum.
Rozhodnutí předepsat přípravek Jangee by mělo být provedeno po zvážení jednotlivých současných rizikových faktorů ženy, zvláště rizikových faktorů pro žilní tromboembolismus (VTE), a toho, jaké je riziko VTE u přípravku Jangee v porovnání s dalšími přípravky CHC (viz body 4.3 a 4.4).
4.2 Dávkování a způsob podání
Dávkování
Jak se přípravek Jangee užívá
Tablety se musí užívat každý den přibližně ve stejnou dobu, v případě potřeby se zapíjejí malým množstvím tekutiny, v pořadí vytištěném na blistru. Tablety se užívají nepřetržitě. Jedna tableta se má užívat denně 28 po sobě jdoucích dnů. Každé následující blistr se začíná užívat den po poslední tabletě z předchozího blistru. Krvácení z vysazení obvykle začíná za 2 až 3 dny po zahájení užívání tablet placeba (poslední řada) a nemusí skončit před zahájením užívání dalšího blistru.
Jak zahájit užívání přípravku Jangee
- Hormonální kontraceptivum nebylo dříve používáno (v minulém měsíci)
- Přechod z jiného kombinovaného hormonálního kontraceptiva (kombinovaného perorálního kontraceptiva (COC), vaginálního kroužku nebo transdermální náplasti)
- Přechod z pouze progestagenní metody (pouze progestagenní tabletka, injekce, implantát) nebo z nitroděložního tělíska uvolňujícího progestogen („IUS“)
- Po potratu v prvním trimestru
- Po porodu nebo potratu v druhém trimestru
- Pokyny pro kojící ženy viz bod 4.6.
-
1. Žena si má vzít poslední zmeškanou tabletu, jakmile si na to vzpomene, i když to bude znamenat vzít si dvě tablety najednou. Poté pokračuje v užívání tablet ve svojí obvyklou dobu, dokud se všechny tablety obsahující účinnou látku nevyužívají. 7 tablet z poslední řady (tablety placeba) je zapotřebí zlikvidovat. Užívání z následujícího blistru se musí zahájit okamžitě. Krvácení z vysazení se pravděpodobně dostaví až po využívání sekce s tabletami obsahujícími účinnou látku druhého blistru, ale během užívání tablet může dojít ke špinění nebo krvácení z průniku.
-
2. Ženě lze také poradit, aby přerušila užívání tablet obsahujících účinnou látku ze stávajícího blistru. Je třeba, aby pak užívala tablety z poslední řady (tablety placeba) až po 7 dnů včetně dnů, kdy byly tablety vynechány, a poté následuje užívání z dalšího blistru.
Jestliže žena vynechala tablety a následně neměla žádné krvácení z vysazení ve fázi užívání tablet placeba, je nutné uvažovat o možném těhotenství.
V případě závažných gastrointestinálních obtíží (např. zvracení nebo závažného průjmu) nemusí být absorpce úplná a je nutné používat další antikoncepční metody. Dojde-li během 3 – 4 hodin po užití tablety s účinnou látkou ke zvracení, je třeba co nejdříve užít novou (náhradní) tabletu. Nová tableta se má, pokud možno, užít do 12 hodin od obvyklé doby užívání. Pokud uplynulo více než 12 hodin, lze aplikovat postup při vynechání tablety uvedený v bodě 4.2 „Postup při vynechání tablet“. Jestliže žena nechce měnit svůj normální harmonogram užívání tablet, musí si vzít tabletu(y) navíc z dalšího blistru.
Přeje-li si žena oddálit krvácení, musí pokračovat v užívání tablet z dalšího blistru přípravku Jangee bez užívání tablet placeba z aktuálně užívaného blistru. Tak lze pokračovat podle přání až do využívání tablet s účinnou látkou druhého blistru. Během této doby může žena pozorovat krvácení z průniku nebo špinění. Po fázi užívání tablet placeba pak žena opět pokračuje v pravidelném užívání.
Přeje-li si žena přesunout periodu na jiný den v týdnu, než na který vychází ve stávajícím schématu užívání, lze jí doporučit, aby zkrátila fázi užívání tablet placeba – o tolik dnů, o kolik si přeje. Čím kratší bude interval, tím větší je riziko, že nedojde ke krvácení z vysazení, ale že bude docházet během užívání z následujícího blistru ke krvácení z průniku a špinění (podobně jako při oddálení periody).
Způsob podání
Perorální podání
4.3 Kontraindikace
Kombinovaná perorální kontraceptiva (COC) se nemá používat za přítomnosti jakéhokoliv z dále uvedených onemocnění. Pokud by se jakékoliv z onemocnění objevilo poprvé během používání COC, užívání přípravku je nutno okamžitě zastavit.
- Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
- Přítomnost nebo riziko žilního tromboembolismu (VTE)
- Přítomnost nebo riziko arteriálního tromboembolismu (ATE)
-
– diabetes mellitus s cévními příznaky;
-
– závažná hypertenze;
-
– závažná dyslipoproteinémie.
- Těžké jaterní onemocnění právě probíhající nebo v anamnéze až do navrácení hodnot jaterních funkcí k normálu.
- Těžká insuficience ledvin nebo akutní ledvinové selhání.
- Tumory jater (benigní či maligní) současné nebo v anamnéze.
- Zhoubná nádorová onemocnění ovlivněná pohlavními steroidy (např. pohlavních orgánů nebo prsou), známá nebo podezření na ně.
- Nediagnostikované krvácení z vagíny.
4.4 Zvláštní upozornění a opatření pro použití
Upozornění
Pokud jsou přítomna jakákoli onemocnění nebo rizikové faktory uvedené níže, měla by být vhodnost přípravku Jangee s ženou prodiskutována.
-
V případě zhoršení nebo prvního výskytu jakéhokoli z těchto stavů nebo rizikových faktorů by mělo být ženě doporučeno, aby kontaktovala svého lékaře, který stanoví, zda by měla užívání přípravku Jangee ukončit.
-
V případě podezření nebo potvrzení VTE nebo ATE musí být přerušeno užívání CHC. V případě, že je antikoagulační léčba zahájena, má být zahájeno užívání adekvátní alternativní antikoncepce a to z důvodu teratogenních účinků antikoagulační léčby (kumariny).
- Riziko žilního tromboembolismu (VTE)
Užívání jakékoli kombinované hormonální antikoncepce (CHC) zvyšuje riziko žilního tromboembolismu (VTE) ve srovnání s jejím neužíváním. Přípravky, které obsahují levonorgestrel, norgestimát nebo norethisteron jsou spojovány s nejnižším rizikem VTE. Další přípravky, jako je přípravek Jangee mohou mít až dvakrát vyšší úroveň rizika. Rozhodnutí používat jakýkoli přípravek jiný než ten, který má nejnižší riziko VTE, by mělo být učiněno po diskusi se ženou, aby se zajistilo, že rozumí riziku VTE u přípravku Jangee, rozumí, jak její současné rizikové faktory toto riziko ovlivňují a že riziko VTE je nejvyšší v prvním roce užívání léku. Existují také některé důkazy, že riziko je zvýšené, když je CHC opětovně zahájena po pauze v užívání trvající 4 týdny nebo déle.
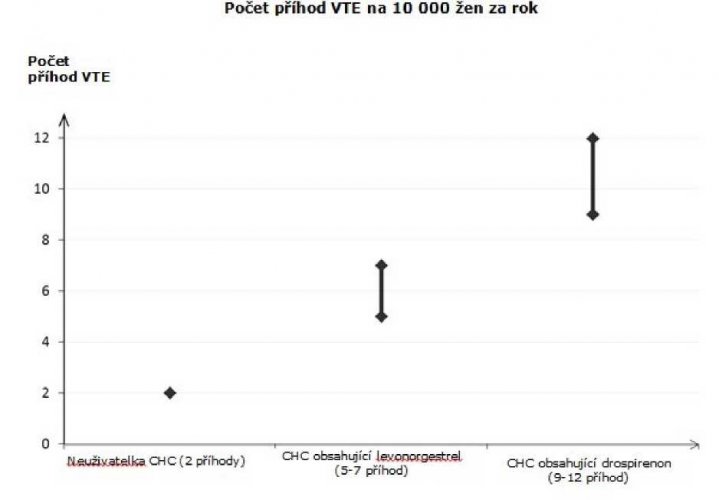
U žen, které neužívají CHC a nejsou těhotné, se asi u 2 z 10 000 vyvine VTE v průběhu jednoho roku. U každé jednotlivé ženy však může být riziko daleko vyšší v závislosti na jejích základních rizikových faktorech (viz níže).
Odhaduje se že z 10 000 žen, které používají CHC obsahující drospirenon se u 9 až 12 žen vyvine VTE během jednoho roku; v porovnání s přibližně 6 případy u žen, které používají CHC obsahující levonorgestrel.
VTE může být fatální v 1–2 % případů.
Epidemiologické studie ukázaly, že riziko VTE u perorálních kontraceptiv (OC) obsahujících drospirenon je vyšší než u OC s obsahem levonorgestrelu (tzv. přípravky druhé generace) a může být podobné riziku u OC s obsahem desogestrelu/gestodenu (tzv. přípravky třetí generace).
Epidemiologické studie také spojovaly užívání kombinovaných COC se zvýšeným rizikem arteriálního tromboembolismu (infarkt myokardu, tranzitorní ischemická porucha).
Extrémně vzácně byla hlášena trombóza u uživatelek CHC v dalších cévách, např. jaterních, mezenterických, renálních nebo retinálních žilách a tepnách.
Riziko žilních tromboembolických komplikací u uživatelek CHC se může podstatně zvyšovat u ženy, která má další rizikové faktory, zvláště pokud je přítomno více rizikových faktorů (viz tabulka). Přípravek Jangee je kontraindikován, pokud má žena více rizikových faktorů, které pro ni představují vysoké riziko žilní trombózy (viz bod 4.3). Pokud má žena více než jeden rizikový faktor, je možné, že zvýšení rizika je vyšší než součet jednotlivých faktorů – v tomto případě by mělo být zváženo její celkové riziko VTE. Pokud je poměr přínosů a rizik považován za negativní, nemá být CHC předepisována (viz bod 4.3).
Tabulka: Rizikové faktory VTE
| Rizikový faktor | Poznámka |
| Obezita (index tělesné hmotnosti nad 30 kg/m2) | Při zvýšení BMI se významně zvyšuje riziko. Zvláště důležité je zvážit, zda jsou také přítomny další rizikové faktory. |
| Prodloužená imobilizace, velký chirurgický zákrok, jakýkoli chirurgický zákrok na nohách a pánvi, neurochirurgický zákrok nebo větší trauma. Poznámka: dočasná imobilizace, včetně cestování letadlem > 4 hodiny může být také rizikovým faktorem VTE, zvláště u žen s dalšími rizikovými faktory | V těchto situacích je doporučeno ukončit užívání pilulky (v případě plánovaného chirurgického výkonu minimálně 4 týdny předem) a nezahajovat užívání do dvou týdnů po kompletní remobilizaci. Měla by se použít další antikoncepční metoda pro zabránění nechtěnému těhotenství. Antitrombotická léčba by měla být zvážena, pokud přípravek Jangee nebyl předem vysazen. |
| Pozitivní rodinná anamnéza (žilní tromboembolismus kdykoli u sourozence nebo rodiče, zvláště v relativně nízkém věku např. do 50 let věku). | Pokud je suspektní hereditární predispozice, měla by být žena před rozhodnutím o používání jakékoli CHC odeslána k odborníkovi na konzultaci |
| Další onemocnění související s VTE | Zhoubné onemocnění, systémový lupus erytematodes, hemolyticko-uremický syndrom, chronické zánětlivé onemocnění střev (Crohnova choroba nebo ulcerózní kolitida) a srpkovitá anémie |
| Vyšší věk | Zvláště nad 35 let |
Není žádná shoda o možné roli varixů a povrchové tromboflebitidy v nástupu nebo progresi žilní trombózy.
Zvýšené riziko tromboembolismu v těhotenství a zvláště během šestinedělí musí být zváženo (pro informaci o „Těhotenství a kojení “ viz bod 4.6.)
V případě příznaků by mělo být ženě doporučeno, aby vyhledala naléhavou lékařskou péči a informovala lékaře, že užívá CHC.
Příznaky hluboké žilní trombózy (DVT) mohou zahrnovat:
- jednostranný otok nohy a/nebo chodidla nebo podél žíly v noze;
- bolest nebo citlivost v noze, která může být pociťována pouze vstoje nebo při chůzi;
- zvýšenou teplotu postižené nohy, zarudnutí nebo změnu barvy kůže nohy.
- náhlý nástup nevysvětlitelné dušnosti nebo rychlého dýchání;
- náhlý kašel, který může být spojený s hemoptýzou;
- ostrou bolest na hrudi;
- těžké točení hlavy nebo závrať způsobené světlem;
- rychlý nebo nepravidelný srdeční tep.
Některé z těchto příznaků (např. „dušnost“, „kašel“) nejsou specifické a mohou být nesprávně interpretovány jako častější nebo méně závažné příhody (např. infekce dýchacího traktu). Dalšími známkami cévní okluze mohou být: náhlá bolest, otok a světle modré zbarvení končetin. Pokud nastane okluze v oku, mohou se příznaky pohybovat od nebolestivého rozmazaného vidění, které může přejít do ztráty zraku. Někdy může nastat ztráta zraku téměř okamžitě.
Epidemiologické studie spojovaly používání CHC se zvýšeným rizikem arteriálního tromboembolismu (infarkt myokardu) nebo cerebrovaskulární příhody (např. tranzitorní ischemická ataka, cévní mozková příhoda). Arteriální tromboembolické příhody mohou být fatální.
Riziko arteriálních tromboembolických komplikací nebo cerebrovaskulární příhody u uživatelek
CHC se zvyšuje u žen s rizikovými faktory (viz tabulka). Přípravek Jangee je kontraindikován, pokud má žena jeden závažný rizikový faktor nebo více rizikových faktorů ATE, které pro ni představují riziko arteriální trombózy (viz bod 4.3). Pokud má žena více než jeden rizikový faktor, je možné, že zvýšení rizika je vyšší než součet jednotlivých faktorů – v tomto případě by mělo být zváženo její celkové riziko. Pokud je poměr přínosů a rizik považován za negativní, nemá být CHC předepisována (viz bod 4.3).
Tabulka: Rizikové faktory ATE
| Rizikový faktor | Poznámka |
| Vyšší věk | Zvláště nad 35 let |
| Kouření | Ženě by mělo být doporučeno, aby nekouřila, pokud chce používat CHC. Ženám ve věku nad 35 let, které dále kouří, by mělo být důrazně doporučeno, aby používaly jinou metodu antikoncepce. |
| Hypertenze | |
| Obezita (index tělesné hmotnosti nad 30 kg/m2) | Při zvýšení BMI se významně zvyšuje riziko. Zvláště důležité u žen s dalšími rizikovými faktory |
| Pozitivní rodinná anamnéza (arteriální tromboembolismus kdykoli u sourozence nebo rodiče, zvláště v relativně nízkém věku např. do 50 let věku). | Pokud je suspektní hereditární predispozice, měla by být žena odeslána k odborníkovi na konzultaci před rozhodnutím o používání jakékoli CHC |
| Migréna | Zvýšení frekvence nebo závažnosti migrény během používání CHC (což může být prodromální známka cévní mozkové příhody) může být důvodem okamžitého ukončení léčby |
| Další onemocnění související s nežádoucími cévními příhodami | Diabetes mellitus, hyperhomocysteinémie, chlopenní srdeční vada a fibrilace síní, dyslipoproteinémie a systémový lupus erytematodes. |
1. NÁZEV PŘÍPRAVKU
Jangee 0,02 mg/3 mg 28 potahovaných tablet
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Růžové tablety (tablety s účinnou látkou):
Jedna potahovaná tableta obsahuje ethinylestradiolum 0,02 mg a drospirenonum 3 mg.
Pomocná látka se známým účinkem: Jedna potahovaná tableta obsahuje 44 mg monohydrátu laktózy.
Bílé tablety (tablety s placebem):
Tato tableta neobsahuje účinné látky.
Pomocná látka se známým účinkem: Jedna potahovaná tableta obsahuje 89,5 mg laktózy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Potahovaná tableta.
Tablety s účinnou látkou: Růžové, kulaté, potahované tablety o průměru zhruba 5,7 mm. Tablety placeba: Bílé, kulaté, potahované tablety o průměru zhruba 5,7 mm.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Perorální kontraceptivum.
Rozhodnutí předepsat přípravek Jangee by mělo být provedeno po zvážení jednotlivých současných rizikových faktorů ženy, zvláště rizikových faktorů pro žilní tromboembolismus (VTE), a toho, jaké je riziko VTE u přípravku Jangee v porovnání s dalšími přípravky CHC (viz body 4.3 a 4.4).
4.2 Dávkování a způsob podání
Dávkování
Jak se přípravek Jangee užívá
Tablety se musí užívat každý den přibližně ve stejnou dobu, v případě potřeby se zapíjejí malým množstvím tekutiny, v pořadí vytištěném na blistru. Tablety se užívají nepřetržitě. Jedna tableta se má užívat denně 28 po sobě jdoucích dnů. Každé následující blistr se začíná užívat den po poslední tabletě z předchozího blistru. Krvácení z vysazení obvykle začíná za 2 až 3 dny po zahájení užívání tablet placeba (poslední řada) a nemusí skončit před zahájením užívání dalšího blistru.
Jak zahájit užívání přípravku Jangee
- Hormonální kontraceptivum nebylo dříve používáno (v minulém měsíci)
- Přechod z jiného kombinovaného hormonálního kontraceptiva (kombinovaného perorálního kontraceptiva (COC), vaginálního kroužku nebo transdermální náplasti)
- Přechod z pouze progestagenní metody (pouze progestagenní tabletka, injekce, implantát) nebo z nitroděložního tělíska uvolňujícího progestogen („IUS“)
- Po potratu v prvním trimestru
- Po porodu nebo potratu v druhém trimestru
- Pokyny pro kojící ženy viz bod 4.6.
-
1. Žena si má vzít poslední zmeškanou tabletu, jakmile si na to vzpomene, i když to bude znamenat vzít si dvě tablety najednou. Poté pokračuje v užívání tablet ve svojí obvyklou dobu, dokud se všechny tablety obsahující účinnou látku nevyužívají. 7 tablet z poslední řady (tablety placeba) je zapotřebí zlikvidovat. Užívání z následujícího blistru se musí zahájit okamžitě. Krvácení z vysazení se pravděpodobně dostaví až po využívání sekce s tabletami obsahujícími účinnou látku druhého blistru, ale během užívání tablet může dojít ke špinění nebo krvácení z průniku.
-
2. Ženě lze také poradit, aby přerušila užívání tablet obsahujících účinnou látku ze stávajícího blistru. Je třeba, aby pak užívala tablety z poslední řady (tablety placeba) až po 7 dnů včetně dnů, kdy byly tablety vynechány, a poté následuje užívání z dalšího blistru.
Jestliže žena vynechala tablety a následně neměla žádné krvácení z vysazení ve fázi užívání tablet placeba, je nutné uvažovat o možném těhotenství.
Postup v případě gastrointestinálních obtíží
V případě závažných gastrointestinálních obtíží (např. zvracení nebo závažného průjmu) nemusí být absorpce úplná a je nutné používat další antikoncepční metody. Dojde-li během 3 – 4 hodin po užití tablety s účinnou látkou ke zvracení, je třeba co nejdříve užít novou (náhradní) tabletu. Nová tableta se má, pokud možno, užít do 12 hodin od obvyklé doby užívání. Pokud uplynulo více než 12 hodin, lze aplikovat postup při vynechání tablety uvedený v bodě 4.2 „Postup při vynechání tablet“. Jestliže žena nechce měnit svůj normální harmonogram užívání tablet, musí si vzít tabletu(y) navíc z dalšího blistru.
Jak oddálit krvácení z vysazení
Přeje-li si žena oddálit krvácení, musí pokračovat v užívání tablet z dalšího blistru přípravku Jangee bez užívání tablet placeba z aktuálně užívaného blistru. Tak lze pokračovat podle přání až do využívání tablet s účinnou látkou druhého blistru. Během této doby může žena pozorovat krvácení z průniku nebo špinění. Po fázi užívání tablet placeba pak žena opět pokračuje v pravidelném užívání.
Přeje-li si žena přesunout periodu na jiný den v týdnu, než na který vychází ve stávajícím schématu užívání, lze jí doporučit, aby zkrátila fázi užívání tablet placeba – o tolik dnů, o kolik si přeje. Čím kratší bude interval, tím větší je riziko, že nedojde ke krvácení z vysazení, ale že bude docházet během užívání z následujícího blistru ke krvácení z průniku a špinění (podobně jako při oddálení periody).
Způsob podání
Perorální podání
4.3 Kontraindikace
Kombinovaná perorální kontraceptiva (COC) se nemá používat za přítomnosti jakéhokoliv z dále uvedených onemocnění. Pokud by se jakékoliv z onemocnění objevilo poprvé během používání COC, užívání přípravku je nutno okamžitě zastavit.
- Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
- Přítomnost nebo riziko žilního tromboembolismu (VTE)
- Přítomnost nebo riziko arteriálního tromboembolismu (ATE)
-
– diabetes mellitus s cévními příznaky;
-
– závažná hypertenze;
-
– závažná dyslipoproteinémie.
- Těžké jaterní onemocnění právě probíhající nebo v anamnéze až do navrácení hodnot jaterních funkcí k normálu.
- Těžká insuficience ledvin nebo akutní ledvinové selhání.
- Tumory jater (benigní či maligní) současné nebo v anamnéze.
- Zhoubná nádorová onemocnění ovlivněná pohlavními steroidy (např. pohlavních orgánů nebo prsou), známá nebo podezření na ně.
- Nediagnostikované krvácení z vagíny.
4.4 Zvláštní upozornění a opatření pro použití
Upozornění
Pokud jsou přítomna jakákoli onemocnění nebo rizikové faktory uvedené níže, měla by být vhodnost přípravku Jangee s ženou prodiskutována.
-
V případě zhoršení nebo prvního výskytu jakéhokoli z těchto stavů nebo rizikových faktorů by mělo být ženě doporučeno, aby kontaktovala svého lékaře, který stanoví, zda by měla užívání přípravku Jangee ukončit.
-
V případě podezření nebo potvrzení VTE nebo ATE musí být přerušeno užívání CHC. V případě, že je antikoagulační léčba zahájena, má být zahájeno užívání adekvátní alternativní antikoncepce a to z důvodu teratogenních účinků antikoagulační léčby (kumariny).
- Riziko žilního tromboembolismu (VTE)
Užívání jakékoli kombinované hormonální antikoncepce (CHC) zvyšuje riziko žilního tromboembolismu (VTE) ve srovnání s jejím neužíváním. Přípravky, které obsahují levonorgestrel, norgestimát nebo norethisteron jsou spojovány s nejnižším rizikem VTE. Další přípravky, jako je přípravek Jangee mohou mít až dvakrát vyšší úroveň rizika. Rozhodnutí používat jakýkoli přípravek jiný než ten, který má nejnižší riziko VTE, by mělo být učiněno po diskusi se ženou, aby se zajistilo, že rozumí riziku VTE u přípravku Jangee, rozumí, jak její současné rizikové faktory toto riziko ovlivňují a že riziko VTE je nejvyšší v prvním roce užívání léku. Existují také některé důkazy, že riziko je zvýšené, když je CHC opětovně zahájena po pauze v užívání trvající 4 týdny nebo déle.
U žen, které neužívají CHC a nejsou těhotné, se asi u 2 z 10 000 vyvine VTE v průběhu jednoho roku. U každé jednotlivé ženy však může být riziko daleko vyšší v závislosti na jejích základních rizikových faktorech (viz níže).
Odhaduje se že z 10 000 žen, které používají CHC obsahující drospirenon se u 9 až 12 žen vyvine VTE během jednoho roku; v porovnání s přibližně 6 případy u žen, které používají CHC obsahující levonorgestrel.
V obou případech je tento počet VTE za rok menší než počet očekávaný u žen během těhotenství nebo po porodu.
VTE může být fatální v 1–2 % případů.

Epidemiologické studie ukázaly, že riziko VTE u perorálních kontraceptiv (OC) obsahujících drospirenon je vyšší než u OC s obsahem levonorgestrelu (tzv. přípravky druhé generace) a může být podobné riziku u OC s obsahem desogestrelu/gestodenu (tzv. přípravky třetí generace).
Epidemiologické studie také spojovaly užívání kombinovaných COC se zvýšeným rizikem arteriálního tromboembolismu (infarkt myokardu, tranzitorní ischemická porucha).
Extrémně vzácně byla hlášena trombóza u uživatelek CHC v dalších cévách, např. jaterních, mezenterických, renálních nebo retinálních žilách a tepnách.
Rizikové faktory VTE
Riziko žilních tromboembolických komplikací u uživatelek CHC se může podstatně zvyšovat u ženy, která má další rizikové faktory, zvláště pokud je přítomno více rizikových faktorů (viz tabulka). Přípravek Jangee je kontraindikován, pokud má žena více rizikových faktorů, které pro ni představují vysoké riziko žilní trombózy (viz bod 4.3). Pokud má žena více než jeden rizikový faktor, je možné, že zvýšení rizika je vyšší než součet jednotlivých faktorů – v tomto případě by mělo být zváženo její celkové riziko VTE. Pokud je poměr přínosů a rizik považován za negativní, nemá být CHC předepisována (viz bod 4.3).
Tabulka: Rizikové faktory VTE
| Rizikový faktor | Poznámka |
| Obezita (index tělesné hmotnosti nad 30 kg/m2) | Při zvýšení BMI se významně zvyšuje riziko. Zvláště důležité je zvážit, zda jsou také přítomny další rizikové faktory. |
| Prodloužená imobilizace, velký chirurgický zákrok, jakýkoli chirurgický zákrok na nohách a pánvi, neurochirurgický zákrok nebo větší trauma. Poznámka: dočasná imobilizace, včetně cestování letadlem > 4 hodiny může být také rizikovým faktorem VTE, zvláště u žen s dalšími rizikovými faktory | V těchto situacích je doporučeno ukončit užívání pilulky (v případě plánovaného chirurgického výkonu minimálně 4 týdny předem) a nezahajovat užívání do dvou týdnů po kompletní remobilizaci. Měla by se použít další antikoncepční metoda pro zabránění nechtěnému těhotenství. Antitrombotická léčba by měla být zvážena, pokud přípravek Jangee nebyl předem vysazen. |
| Pozitivní rodinná anamnéza (žilní tromboembolismus kdykoli u sourozence nebo rodiče, zvláště v relativně nízkém věku např. do 50 let věku). | Pokud je suspektní hereditární predispozice, měla by být žena před rozhodnutím o používání jakékoli CHC odeslána k odborníkovi na konzultaci |
| Další onemocnění související s VTE | Zhoubné onemocnění, systémový lupus erytematodes, hemolyticko-uremický syndrom, chronické zánětlivé onemocnění střev (Crohnova choroba nebo ulcerózní kolitida) a srpkovitá anémie |
| Vyšší věk | Zvláště nad 35 let |
Není žádná shoda o možné roli varixů a povrchové tromboflebitidy v nástupu nebo progresi žilní trombózy.
Zvýšené riziko tromboembolismu v těhotenství a zvláště během šestinedělí musí být zváženo (pro informaci o „Těhotenství a kojení “ viz bod 4.6.)
Příznaky VTE (hluboká žilní trombóza a plicní embolie)
V případě příznaků by mělo být ženě doporučeno, aby vyhledala naléhavou lékařskou péči a informovala lékaře, že užívá CHC.
Příznaky hluboké žilní trombózy (DVT) mohou zahrnovat:
- jednostranný otok nohy a/nebo chodidla nebo podél žíly v noze;
- bolest nebo citlivost v noze, která může být pociťována pouze vstoje nebo při chůzi;
- zvýšenou teplotu postižené nohy, zarudnutí nebo změnu barvy kůže nohy.
- náhlý nástup nevysvětlitelné dušnosti nebo rychlého dýchání;
- náhlý kašel, který může být spojený s hemoptýzou;
- ostrou bolest na hrudi;
- těžké točení hlavy nebo závrať způsobené světlem;
- rychlý nebo nepravidelný srdeční tep.
Některé z těchto příznaků (např. „dušnost“, „kašel“) nejsou specifické a mohou být nesprávně interpretovány jako častější nebo méně závažné příhody (např. infekce dýchacího traktu). Dalšími známkami cévní okluze mohou být: náhlá bolest, otok a světle modré zbarvení končetin. Pokud nastane okluze v oku, mohou se příznaky pohybovat od nebolestivého rozmazaného vidění, které může přejít do ztráty zraku. Někdy může nastat ztráta zraku téměř okamžitě.
Riziko arteriálního tromboembolismu (ATE)
Epidemiologické studie spojovaly používání CHC se zvýšeným rizikem arteriálního tromboembolismu (infarkt myokardu) nebo cerebrovaskulární příhody (např. tranzitorní ischemická ataka, cévní mozková příhoda). Arteriální tromboembolické příhody mohou být fatální.
Rizikové faktory ATE
Riziko arteriálních tromboembolických komplikací nebo cerebrovaskulární příhody u uživatelek
CHC se zvyšuje u žen s rizikovými faktory (viz tabulka). Přípravek Jangee je kontraindikován, pokud má žena jeden závažný rizikový faktor nebo více rizikových faktorů ATE, které pro ni představují riziko arteriální trombózy (viz bod 4.3). Pokud má žena více než jeden rizikový faktor, je možné, že zvýšení rizika je vyšší než součet jednotlivých faktorů – v tomto případě by mělo být zváženo její celkové riziko. Pokud je poměr přínosů a rizik považován za negativní, nemá být CHC předepisována (viz bod 4.3).
Tabulka: Rizikové faktory ATE
| Rizikový faktor | Poznámka |
| Vyšší věk | Zvláště nad 35 let |
| Kouření | Ženě by mělo být doporučeno, aby nekouřila, pokud chce používat CHC. Ženám ve věku nad 35 let, které dále kouří, by mělo být důrazně doporučeno, aby používaly jinou metodu antikoncepce. |
| Hypertenze | |
| Obezita (index tělesné hmotnosti nad 30 kg/m2) | Při zvýšení BMI se významně zvyšuje riziko. Zvláště důležité u žen s dalšími rizikovými faktory |
| Pozitivní rodinná anamnéza (arteriální tromboembolismus kdykoli u sourozence nebo rodiče, zvláště v relativně nízkém věku např. do 50 let věku). | Pokud je suspektní hereditární predispozice, měla by být žena odeslána k odborníkovi na konzultaci před rozhodnutím o používání jakékoli CHC |
| Migréna | Zvýšení frekvence nebo závažnosti migrény během používání CHC (což může být prodromální známka cévní mozkové příhody) může být důvodem okamžitého ukončení léčby |
| Další onemocnění související s nežádoucími cévními příhodami | Diabetes mellitus, hyperhomocysteinémie, chlopenní srdeční vada a fibrilace síní, dyslipoproteinémie a systémový lupus erytematodes. |
Příznaky ATE
V případě příznaků by mělo být ženě doporučeno, aby vyhledala naléhavou lékařskou péči a informovala lékaře, že užívá CHC.
Příznaky cévní mozkové příhody mohou zahrnovat:
- náhlou necitlivost nebo slabost obličeje, paže nebo nohy, zvláště na jedné straně těla;
- náhlé potíže s chůzí, závratě, ztrátu rovnováhy nebo koordinace;
- náhlou zmatenost, problémy s řečí nebo porozuměním;
- náhlé potíže se zrakem na jednom nebo obou očích;
- náhlou, závažnou nebo prodlouženou bolest hlavy neznámé příčiny;
- ztrátu vědomí nebo omdlení s nebo bez záchvatu.
- bolest, nepříjemný pocit, tlak, těžkost, pocit stlačení nebo plnosti na hrudi, v paži nebo pod hrudní kostí;
- nepříjemný pocit vyzařující do zad, čelisti, hrdla, paže, žaludku;
- pocit plnosti, poruchu trávení nebo dušení;
- pocení, nauzeu, zvracení nebo závratě;
- extrémní slabost, úzkost nebo dušnost;
- rychlý nebo nepravidelný srdeční tep.
Před zahájením užívání nebo znovuzahájením léčby přípravkem Jangee by měla být získána kompletní anamnéza (včetně rodinné anamnézy) a musí být vyloučeno těhotenství. Měl by se změřit krevní tlak a mělo by být provedeno tělesné vyšetření při zvážení kontraindikací (viz bod 4.3) a varování (viz bod 4.4). Je důležité, aby byla žena upozorněna na informace o žilní a arteriální trombóze, včetně rizika přípravku Jangee v porovnání s dalšími typy CHC, na příznaky VTE a ATE, známé rizikové faktory a co by měla dělat v případě suspektní trombózy.
Žena by také měla být informována, aby si pečlivě přečetla příbalovou informaci pro uživatele a aby dodržovala uvedené instrukce. Frekvence a povaha vyšetření by měly být založeny na stanovených postupech a upraveny podle individuálních potřeb ženy.
Ženy by také měly být informovány, že perorální antikoncepce nechrání před HIV infekcí (AIDS) a dalšími sexuálně přenosnými chorobami.
Účinnost COC může být snížena například při vynechání tablety s účinnou látkou (viz bod 4.2), v případě gastrointestinálních poruch (viz bod 4.2), nebo při současném užívání dalších léků (viz bod 4.5)
Při užívání všech kombinovaných perorálních kontraceptiv (COC) se může objevit nepravidelné krvácení (špinění nebo krvácení z průniku) a to především během prvních měsíců užívání. Proto je hodnocení jakéhokoliv nepravidelného krvácení smysluplné pouze po adaptačním intervalu v délce přibližně tří menstruačních cyklů.
Jestliže nepravidelnosti v krvácení přetrvávají nebo se vyskytnou po předchozích pravidelných cyklech, je nutné uvažovat o nehormonálních příčinách a k vyloučení malignity nebo těhotenství jsou indikována odpovídající diagnostická opatření. Mezi ně může patřit kyretáž.
U některých žen se krvácení z vysazení nemusí vyskytnout během fáze užívání tablet placeba. Pokud se COC užívala podle pokynů uvedených v bodě 4.2, je nepravděpodobné, že žena bude těhotná. Pokud se však COC neužívala podle těchto pokynů před prvním zmeškaným krvácením z vysazení nebo pokud neproběhnou krvácení dvě, před pokračujícím používáním COC se musí vyloučit těhotenství.
Růžové tablety tohoto léčivého přípravku obsahují 44 mg laktózy v jedné tabletě, bílé tablety obsahují
-
89.5 mg laktózy. Pacientky se vzácnou hereditární intolerancí galaktózy, s vrozeným deficitem laktázy nebo s malabsorpcí glukózy a galaktózy, které jsou na bezlaktózové dietě, by toto měly vzít v úvahu.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Poznámka: Informace o předepisování souběžné podávaných léků je nutno konzultovat, aby se rozpoznaly potenciální interakce.
Účinky jiných léčivých přípravků na přípravek Jangee potahované tablety.Interakce se mohou objevit s léky, které indukují mikrozomální enzymy, což může mít za následek zvýšenou clearance pohlavních hormonů a může vést ke krvácení z průniku a/nebo k selhání antikoncepce.
Postup
Enzymová indukce může být pozorována již po několika dnech léčby. Maximální enzymová indukce je obvykle pozorována během několika týdnů. Po přerušení léčby může enzymová indukce přetrvávat po dobu přibližně 4 týdnů.
Krátkodobá léčba
Ženy léčené léčivými látkami indukujícími enzymy by měly dočasně používat navíc k COC bariérovou metodu kontracepce nebo jiný způsob kontracepce. Po celou dobu léčby souběžně podávaným přípravkem a následujících 28 dnů po ukončení léčby musí být používána bariérová metoda kontracepce. Pokud léčba zasáhne do období ukončení užívání aktivních tablet COC ze stávajícího blistru, placebo tablety musí být vyřazeny a ihned má být zahájeno užívání z dalšího blistru.
Dlouhodobá léčba
Pokud je žena na dlouhodobé léčbě léčivými látkami indukujícími enzymy, doporučuje se používat jinou spolehlivou nehormonální metodu kontracepce.
Následující interakce byly popsány v literatuře.
Látky zvyšující clearance COC (snižující účinky COC enzymovou indukcí), např.:
Barbituráty, bosentan, karbamazepin, fenytoin, primidon, rifampicin a léky na HIV ritonavir, nevirapin a efavirenz a pravděpodobně také felbamát, griseofulvin, oxkarbazepin, topiramát a přípravky obsahující třezalku tečkovanou (Hypericum perforatum).
Látky s variabilními účinky na clearance COC:
Při současném užívání s COC, mnoho kombinací inhibitorů HIV proteázy a nenukleosidových inhibitorů reverzní transkriptázy, včetně kombinací s HCV inhibitory může zvyšovat nebo snižovat plazmatické koncentrace estrogenu nebo progestinů. V některých případech může být účinek těchto změn klinicky významný.
Proto je třeba prostudovat informace o přípravku k souběžné léčbě HIV/HCV, aby byly identifikovány potenciální lékové interakce a příslušná doporučení. V případě jakýchkoliv pochybností by navíc ženy léčené inhibitory proteázy nebo nenukleosidovými inhibitory reverzní transkriptázy měly používat bariérovou metodu kontracepce.
Látky snižující clearance COC (enzymové induktory):
Klinická relevance potenciálních interakcí s enzymovými induktory zůstává neznámá.
Současné podávání silných inhibitorů CYP3A4 může vést ke zvýšení plazmatické koncentrace estrogenu nebo progesteronu, nebo obou.
Ve studii s opakovaným podáváním kombinace drospirenonu (3 mg/denně)/ ethinylestradiolu (0,02 mg/denně) zvýšilo současné podávání ketokonazolu, silného inhibitoru CYP3A4, po dobu 10 dnů AUC(0–24h) drospirenonu a ethinylestradiolu 2,7 resp. 1,4násobně.
Bylo prokázáno, že etorikoxib v dávce 60 až 120 mg/denně zvyšuje plazmatickou koncentraci ethinylestradiolu 1,4 – 1,6násobně, zejména, je-li zároveň podávána kombinovaná hormonální antikoncepce obsahující 0,035 mg ethinylestradiolu.
Hlavní metabolity drospirenonu v lidské plazmě se tvoří bez působení systému cytochromu P450. Je proto nepravděpodobné, že inhibitory tohoto enzymového systému ovlivňují metabolismus drospirenonu.
- Účinky přípravku Jangee na jiné léčivé přípravky
- Jiné formy interakce
- Laboratorní vyšetření
Použití kontraceptivních steroidů může ovlivnit výsledky určitých laboratorních testů včetně biochemických parametrů funkce jater, štítné žlázy, nadledvinek a ledvin, hladiny proteinů (nosiče) v plazmě, např. globulinu vážícího kortikosteroid a lipidové/lipoproteinové frakce, parametrů metabolismu uhlovodanů a parametrů koagulace a fibrinolýzy. Změny obecně zůstávají v rozsahu normálních laboratorních hodnot. Drospirenon způsobuje zvýšení plasmatické aktivity reninu a plasmatického aldosteronu svoji mírnou antimineralokortikoidní aktivitou.
4.6 Fertilita, těhotenství a kojení
Přípravek Jangee není během těhotenství indikován.
Jestliže dojde během užívání ethinylestradiolu/drospirenonu k otěhotnění, přípravek je nutné neprodleně vysadit. Rozsáhlé epidemiologické studie však nezaznamenaly zvýšené riziko vrozených vad u dětí narozených ženám užívajících COC před otěhotněním, ani teratogenní vliv COC neúmyslně užívaných v těhotenství.
Studie se zvířaty prokázaly nežádoucí účinky během těhotenství a laktace (viz bod 5.3). Na základě těchto údajů získaných na zvířatech nelze vyloučit nežádoucí hormonální působení léčivých látek. Avšak obecné zkušenosti s užíváním COC v průběhu těhotenství neposkytují důkazy pro výskyt nežádoucích účinků u lidí.
Údaje týkající se užívání přípravku Jangee v těhotenství jsou příliš omezené, než aby bylo možno udělat závěry týkající se negativního vlivu přípravku Jangee na těhotenství, zdraví plodu nebo novorozence. V současné době nejsou k dispozici žádná relevantní epidemiologická data.
Zvýšené riziko VTE během poporodního období je třeba brát v úvahu při znovuzahájení užívání přípravku Jangee (viz bod 4.2 a 4.4).
Kojení může být COC ovlivněno, protože se může snižovat množství a měnit složení mateřského mléka. Proto se používání COC všeobecně nemá doporučovat, dokud kojící matka své dítě zcela neodstaví. Malá množství kontracepčních steroidů a/nebo jejich metabolitů mohou být vylučována do mléka během jejich užívání. Tato množství mohou mít vliv na dítě.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící účinky na schopnost řídit a obsluhovat stroje nebyly provedeny. Nebyly pozorovány žádné účinky na schopnost řídit nebo obsluhovat stroje u uživatelek COC.
4.8 Nežádoucí účinky
Závažné nežádoucí účinky u uživatelek COC viz bod 4.4.
Během užívání přípravku Jangee byly hlášeny následující nežádoucí účinky:
Níže uvedená tabulka udává nežádoucí reakce podle tříd orgánových systémů podle databáze
MedDRA (MedDRA SOCs). Četnosti jsou uvedeny na základě údajů z klinických studií
| Třída orgánových systémů | Frekvence nežádoucích účinků | ||
| Časté >1/100 až <1/10 | Méně časté (>1/1000 až <1/100) | Vzácné >1/10000 až <1/1000 | |
| Infekce a infestace | Kandidóza, herpes simplex | ||
| Poruchy imunitního systému | Alergická reakce | Astma | |
| Poruchy metabolismu a výživy | Zvýšená chuť k jídlu | ||
| Psychiatrické poruchy | Emocionální labilita | Deprese, nervozita, porucha spánku | |
| Poruchy nervového systému | Bolest hlavy | Parestezie, závratě | |
| Poruchy ucha a labyrintu | Hypoakuzie | ||
| Poruchy oka | Poruchy vidění | ||
| Srdeční poruchy | Extrasystoly, tachykardie | ||
| Cévní poruchy | Pulmonální embolie, hypertenze, hypotenze, migréna, varikózní žíly | Venózní tromboembolismus (VTE), arteriální tromboembolismus (ATE) | |
| Respirační, hrudní a mediastinální poruchy | Faryngitida | ||
| Gastrointestinální poruchy | Bolesti břicha | Nevolnost, zvracení, gastroenteritis, průjem, zácpa, gastrointestinální poruchy | |
| Poruchy kůže a podkožní tkáně | Akné | Angioedém, alopecie, ekzém, pruritus, vyrážka, suchá kůže, seborea, kožní poruchy | Erythema nodosum, erythema multiforme |
| Poruchy svalové a kosterní soustavy a pojivové tkáně | Bolest v krku, bolest v končetinách, svalové křeče | ||
| Poruchy ledvin a močových cest | Cystitis | ||
| Poruchy reprodukčního systému a prsu | Bolest prsou, zvětšení prsou, dysmenorea, metroragie | Nádory prsů, fibrocystická onemocnění prsů, galaktorea, ovariální cysta, návaly horka, menstruační poruchy, amenorrhoea, menoragie, vaginální kandidóza, vaginitida, výtok z genitálií, vulvovaginální poruchy, suchost pochvy, bolest pánve, suspektní nález z cervikálního stěru (Pap) | |
| Celkové poruchy a reakce v místě aplikace | Edémy, astenie, bolest, nadměrná žízeň, zvýšené pocení | ||
| Vyšetření | Zvýšení tělesné hmotnosti | Snížení tělesné hmotnosti |
Jsou použity nejvhodnější MedDRA termíny k popisu konkrétních nežádoucích účinků a jejich symptomů a souvisejících podmínek.
Popis vybraných nežádoucích účinků
U žen užívajících CHC bylo pozorováno zvýšené riziko arteriálních a žilních trombotických a tromboembolických příhod, včetně infarktu myokardu, cévní mozkové příhody, tranzitorních ischemických atak, žilní trombózy a plicní embolie a je podrobněji popsáno v bodě 4.4.
Následující závažné nežádoucí účinky, které byly popsány u žen užívajících COC, jsou rozvedeny v bodě 4.4:
- Venózní tromboembolická onemocnění;
- Arteriální tromboembolická onemocnění;
- Hypertenze;
- Jaterní tumory;
- Výskyt nebo zhoršení stavů, pro které spojení s užíváním COC není jednoznačné: Crohnova choroba, ulcerativní kolitida, epilepsie, děložní myomy, porfyrie, systémový lupus erythematodes, herpes gestationis, Sydenhamova chorea, hemolyticko-uremický syndrom, cholestatická žloutenka;
- Chloasma;
- Akutní či chronické poruchy funkce jater si mohou vynutit přerušení používání COC, dokud se markery jaterní funkce nevrátí k normálním hodnotám.
- U žen s dědičným angioedémem mohou exogenní estrogeny vyvolat či zhoršit příznaky angioedému.
4.9 Předávkování
S předávkováním přípravkem Jangee nejsou dosud žádné zkušenosti. Na základě zkušeností s ostatními perorálními kombinovanými kontraceptivy by se v tomto případě mohly vyskytnout tyto příznaky: nauzea, zvracení a u mladých dívek slabé vaginální krvácení. Antidota nejsou známa, a proto by léčba měla být symptomatická.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: progestogeny a estrogeny, fixní kombinace.
ATC kód: G03AA12
Pearl index pro selhání metody: 0,11 (horní hranice 95% intervalu spolehlivosti: 0,60).
Celkový Pearl Index (selhání metody + selhání pacientky): 0,31 (horní hranice 95% intervalu spolehlivosti: 0,91).
Mechanismus účinku
Antikoncepční účinek přípravku Jangee je založen na interakci různých faktorů, kdy se za nejdůležitější považuje inhibice ovulace a změny v endometriu.
Farmakodynamické účinky
Přípravek Jangee je kombinované perorální kontraceptivum obsahující ethinylestradiol a progestagen drospirenon. V terapeutických dávkách má drospirenon také antiandrogenní a mírné antimineralokortikoidní vlastnosti. Nemá žádnou estrogenní, glukokortikoidní či antiglukokortikoidní aktivitu. Toto dává drospirenonu farmakologický profil výrazně se podobající přirozenému hormonu progesteronu.
Z klinických studií vyplynulo, že slabé antimineralokortikoidní vlastnosti přípravku Jangee mají za následek jeho mírný antimineralokortikoidní účinek.
5.2 Farmakokinetické vlastnosti
Drospirenon
Absorpce
Perorálně podaný drospirenon je rychle a téměř úplně absorbován. Maximální koncentrace účinné látky v séru – asi 38 ng/ml – je dosaženo přibližně za 1 – 2 hodiny po jednorázovém podání. Biologická dostupnost je 76 – 85 %. Na biologickou dostupnost drospirenonu nemá současné požití potravy žádný vliv.
Distribuce
Po perorálním podání klesá sérová hladina drospirenonu s konečným poločasem 31 hodin.
Drospirenon je vázán na sérový albumin, není vázán na pohlavní hormony vážící globulin (SHBG) ani na kortikosteroidy vážící globulin (CBG). Jen 3 – 5 % celkové sérové koncentrace účinné látky je přítomno ve formě volného steroidu. Ethinylestradiolem indukované zvýšení SHBG neovlivňuje vazbu drospirenonu na sérové proteiny. Průměrný distribuční objem drospirenonu je 3,7 ± 1,2 l/kg.
Biotransformace
Po perorálním podání je drospirenon extenzivně metabolizován. Hlavními metabolity v plazmě jsou kyselá forma drospirenonu vznikající otevřením laktonového kruhu a 4,5-dihydrodrospirenon-3sulfát, přičemž oba vznikají redukcí a následnou sulfatací. Drospirenon je také předmětem oxidativního metabolismu katalyzovaného CYP3A4.
Drospirenon in vitro prokázal schopnost inhibovat slabě až středně silně enzymy CYP1A1, CYP2C9 a CYP3A4 cytochromu P450.
Eliminace
Rychlost metabolické clearance drospirenonu v séru je 1,5 ± 0,2 ml/min/kg. Drospirenon je vylučován v nezměněné formě pouze ve stopovém množství. Metabolity drospirenonu jsou vylučovány výkaly a močí při exkrečním poměru 1,2 až 1,4. Poločas vylučování metabolitů močí a stolicí je asi 40 hodin.
Rovnovážný stav
Během léčebného cyklu je maximální koncentrace drospirenonu v rovnovážném stavu okolo 70 ng/ml dosaženo přibližně po 8 dnech užívání. Hladiny drospirenonu v séru se akumulují přibližně faktorem 3 v důsledku poměru konečného poločasu a dávkovacího intervalu.
Zvláštní populace
Vliv poruchy funkce ledvin
Hladiny drospirenonu v rovnovážném stavu u žen s mírnou poruchou funkce ledvin (clearance kreatininu CLcr, 50–80 ml/min) byly srovnatelné s ženami, jejichž funkce ledvin byla normální. U žen se středně závažnou poruchou funkce ledvin (Clcr 30–50 ml/min) byly hladiny drospirenonu v průměru o 37% vyšší ve srovnání s ženami s normální funkcí ledvin. Léčba drospirenonem u žen s mírnou až středně těžkou poruchou funkce ledvin byla také dobře tolerována. Léčba drospirenonem nevykazovala žádný klinicky významný účinek na koncentrace draslíku v séru.
Vliv poruchy funkce jater
U dobrovolnic se středně závažnou poruchou funkce jater byl ve studii hodnotící podání jednotlivé dávky pozorován 50%ní pokles perorální clearance (CL/F) ve srovnání s ženami s normální funkcí jater. Pozorovaný pokles clearance drospirenonu u dobrovolnic se středně závažnou poruchou funkce jater ve srovnání se zdravými se neprojevil jako patrný rozdíl koncentrací draslíku v séru. Dokonce ani za přítomnosti diabetes a konkomitantní léčby spironolaktonem (dvou faktorů, které predisponují pacienta k hyperkalémii), nebyl pozorován vzestup draslíku nad hranici rozmezí normálních hodnot. Závěrem lze říci, že u pacientek s mírnou nebo středně závažnou poruchou funkce jater (Child-Pugh B) byl drospirenon dobře tolerován.
Etnické skupiny
Nebyly pozorovány žádné klinicky významné rozdíly farmakokinetiky drospirenonu nebo ethinylestradiolu mezi japonskými a kavkazskými ženami.
Absorpce
Perorálně podávaný ethinylestradiol je absorbován rychle a úplně.
Nejvyšší plazmatické koncentrace okolo 33 pg/ml je dosaženo po jednorázové perorální dávce během 1 – 2 hodin. Absolutní bioavailabilita, jako výsledek presystémové konjugace a metabolického efektu prvního průchodu játry, je přibližně 60%. Současné požití stravy snížilo biologickou dostupnost ethinylestradiolu asi u 25% sledovaných subjektů, zatímco u ostatních nebyly pozorovány.
Distribuce
Sérové hladiny ethinylestradiolu klesají ve dvou fázích, fáze konečného odbourání je charakterizována poločasem přibližně 24 hodin. Ethinylestradiol je vysoce, ale nespecificky vázán na sérový albumin (přibližně 98,5 %) a indukuje zvýšení sérových koncentrací SHBG a globulinu vážícího kortikoidy (CBG). Aparentní distribuční objem je přibližně 5 l/kg.
Biotransformace
Ethinylestradiol podléhá metabolismu prvního průchodu v tenkém střevě a v játrech. Ethinylestradiol je primárně metabolizován aromatickou hydroxylací, vzniká však velké množství různých hydroxylovaných a methylovaných metabolitů, které jsou přítomny jako volné metabolity nebo konjugované s kyselinou glukuronovou a sírovou. Metabolická clearance ethinylestradiolu je 5 ml/min/kg.
Eliminace
Ethinylestradiol není ve významném množství vylučován v nezměněné formě. Metabolity ethinylestradiolu jsou vylučovány močí a žlučí v poměru 4 : 6. Poločas exkrece metabolitů je asi 1 den.
Rovnovážný stav
Rovnovážného stavu je dosaženo během druhé poloviny léčebného cyklu a sérové hladiny ethinylestradiolu se kumulují faktorem přibližně od 2,0 do 2,3.
5.3 Předklinické údaje vztahující se k bezpečnosti
U laboratorních zvířat byly účinky drospirenonu a ethinylestradiolu omezeny na ty, které jsou spojeny s jejich známým farmakologickým působením. Zejména studie reprodukční toxicity odhalily u zvířat embryotoxické a fetotoxické účinky, které jsou považovány za druhově specifické. Při expozici drospirenonu v dávkách vyšších, než jaké jsou přijímány v přípravku Jangee, byly pozorovány účinky na diferenciaci pohlaví u plodů potkanů, ale nikoliv u plodů opic.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Tablety s účinnou látkou (růžové tablety):
Jádro tablety:
Monohydrát laktózy
Předbobtnalý (kukuřičný) škrob
Povidon K30
Sodná sůl kroskarmelózy
Polysorbát 80
Magnesium-stearát
Polyvinylalkohol
Oxid titaničitý (E171)
Makrogol 3350
Mastek
Žlutý oxid železitý (E172)
Červený oxid železitý (E172)
Černý oxid železitý (E172)
Laktóza
Povidon K30
Magnesium-stearát
Polyvinylalkohol
Oxid titaničitý (E171)
Makrogol 3350
Mastek
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
3 roky.
6.4 Zvláštní opatření pro uchovávání
Tento lék nevyžaduje žádné zvláštní podmínky uchovávání.
6.5 Druh obalu a obsah balení
Blistry z hliníkové vytlačovací fólie a PVC/PVDC fólie.
Velikost balení:
3 × 28 potahovaných tablet (21 tablet s účinnou látkou plus 7 tablet placeba)
V členské zemi EHP, ze které je tento přípravek odvážen (Portugalsko), je přípravek registrován pod názvem Drosurall. Tento název je uveden na blistru.
Text na blistru je v portugalštině.
Krabička obsahuje 3 etikety s proužky na blistr s českými zkratkami dnů v týdnu.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Laboratorios Effik, Sociedade Unipessoal, Lda., Estrada Consiglieri Pedroso, n°123, Queluz de Baixo, 2730–056 Barcarena – Portugalsko
RONCOR s.r.o., č.p. 271, 251 01 Čestlice, Česká republika
8. REGISTRAČNÍ ČÍSLO(A)
17/047/10-C/PI/001/16
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
27. 7. 2016
Další informace o léčivu JANGEE 0,02 MG/3 MG 28 POTAHOVANÝCH TABLET
Jak
se JANGEE 0,02 MG/3 MG 28 POTAHOVANÝCH TABLET
podává: perorální podání - potahovaná tableta
Výdej
léku: na lékařský předpis
Balení: Blistr
Velikost
balení: 3X28
Držitel rozhodnutí o registraci daného léku v České republice:
Laboratórios Effik, Sociedade Unipessoal, Lda, Barcarena
