Souhrnné informace o léku - EVEROLIMUS STADA
1. NÁZEV PŘÍPRAVKU
Everolimus Stada 2,5 mg tablety
Everolimus Stada 5 mg tablety
Everolimus Stada 10 mg tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tableta obsahuje everolimusum 2,5 mg.
Jedna tableta obsahuje everolimusum 5 mg.
Jedna tableta obsahuje everolimusum 10 mg.
Pomocná látka se známým účinkem
Jedna tableta obsahuje 66 mg laktosy.
Jedna tableta obsahuje 131 mg laktosy.
Jedna tableta obsahuje 262 mg laktosy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
3. LÉKOVÁ FORMATableta.
Everolimus Stada 2,5 mg tablety jsou bílé až téměř bílé oválné ploché tablety s vyrytým „EVR” na jedné straně a „2,5” na straně druhé, přibližná délka tablet je 10 mm a šířka 4 mm.
Everolimus Stada 5 mg tablety jsou bílé až téměř bílé oválné ploché tablety s vyrytým „EVR” na jedné straně a „5” na straně druhé, přibližná délka tablet je 12 mm a šířka 5 mm.
Everolimus Stada 10 mg tablety jsou bílé až téměř bílé oválné ploché tablety s vyrytým „EVR” na jedné straně a „NAT” na straně druhé, přibližná délka tablet je 15 mm a šířka 6 mm.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Hormonálně pozitivní pokročilý karcinom prsu
Everolimus Stada je v kombinaci s exemestanem indikován k léčbě postmenopauzálních žen s hormonálně pozitivním HER2 negativním pokročilým karcinomem prsu bez symptomatického viscerálního postižení s recidivou nebo progresí onemocnění po předchozí léčbě nesteroidním inhibitorem aromatáz.
Pankreatické neuroendokrinní tumory
Everolimus Stada je indikován k léčbě neresekovatelných nebo metastazujících, dobře nebo středně diferencovaných pankreatických neuroendokrinních tumorů u dospělých pacientů s progresí onemocnění.
Gastrointestinální nebo plicní neuroendokrinní tumory
Everolimus Stada je indikován k léčbě neresekovatelných nebo metastazujících, dobře diferencovaných (stupeň 1 nebo stupeň 2) nefunkčních gastrointestinálních nebo plicních neuroendokrinních tumorů u dospělých pacientů s progresí onemocnění (viz body 4.4 a 5.1).
Renální karcinom
Everolimus Stada je indikován k léčbě pacientů s pokročilým renálním karcinomem, u kterých došlo k progresi onemocnění během VEGF-cílené terapie nebo po ní.
4.2 Dávkování a způsob podání
Léčba přípravkem Everolimus Stada má být zahájena a kontrolována pouze lékařem, který má zkušenosti s používáním protinádorové terapie.
Dávkování
Pro různá dávkovací schémata je Everolimus Stada dostupný jako tablety o síle 2,5 mg, 5 mg a 10 mg.
Doporučená dávka je 10 mg everolimu jednou denně. Léčba má pokračovat tak dlouho, dokud je pozorován klinický přínos, nebo dokud se neobjeví nepřijatelné známky toxicity.
V případě vynechání dávky nemá pacient užít vynechanou dávku dodatečně, ale má užít příští předepsanou dávku v obvyklou dobu.
Úprava dávkování z důvodu nežádoucích účinků
Zvládnutí závažných a/nebo nesnesitelných podezřelých nežádoucích účinků může vyžadovat snížení dávky a/nebo dočasné přerušení léčby přípravkem Everolimus Stada. Při výskytu nežádoucích účinků stupně 1 není úprava dávky obvykle vyžadována. Pokud je nutné dávku snížit, doporučená dávka je 5 mg denně a nesmí být nižší než 5 mg denně.
Tabulka 1 shrnuje doporučení úprav dávkování pro specifické nežádoucí účinky (viz také bod 4.4).
Tabulka 1: Doporučené úpravy dávkování přípravku Everolimus Stada
| Nežádoucí účinek | Závažnost1 | Úprava dávky přípravku Everolimus Stada |
| Neinfekční pneumonitida | Stupeň 2 | Zvažte přerušení léčby, dokud se příznaky nezlepší na stupeň < 1. Zahajte znovu léčbu dávkou 5 mg denně. Ukončete léčbu, pokud nedojde k zotavení během 4 týdnů. |
| Stupeň 3 | Přerušte léčbu, dokud se příznaky nezlepší na stupeň < 1. Zvažte znovuzahájení léčby dávkou 5 mg denně. Pokud se znovu objeví toxicita na stupni 3, zvažte ukončení léčby. | |
| Stupeň 4 | Ukončete léčbu. | |
| Stomatitida | Stupeň 2 | Dočasné přerušení podávání až do zotavení na stupeň < 1. Zahajte znovu léčbu stejnou dávkou. Pokud se stomatitida objeví znovu na stupni 2, přerušte podávání do zotavení na stupeň < 1. Zahajte znovu léčbu dávkou 5 mg denně. |
| Stupeň 3 | Dočasné přerušení podávání do zotavení na stupeň < 1. Zahajte znovu léčbu dávkou 5 mg denně. | |
| Stupeň 4 | Ukončete léčbu. | |
| Jiné nehematologické toxicity (s výjimkou metabolických příhod) | Stupeň 2 | Pokud je toxicita tolerovatelná, není vyžadována úprava dávky. Pokud je toxicita netolerovatelná, přerušte dočasně léčbu do zlepšení na stupeň < 1. Zahajte znovu léčbu stejnou dávkou. Pokud se toxicita znovu objeví na stupni 2, přerušte léčbu až do zlepšení na stupeň < 1. Zahajte |
| znovu léčbu dávkou 5 mg denně. | ||
| Stupeň 3 | Dočasné přerušení léčby až do zotavení na stupeň < 1. Zvažte znovuzahájení léčby dávkou 5 mg denně. Pokud se toxicita znovu objeví na stupni 3, zvažte ukončení léčby. | |
| Stupeň 4 | Ukončete léčbu. | |
| Metabolické příhody (např. hyperglykémie, dyslipidémie) | Stupeň 2 | Není vyžadována úprava dávky. |
| Stupeň 3 | Dočasné přerušení podávání. Zahajte znovu léčbu dávkou 5 mg denně. | |
| Stupeň 4 | Ukončete léčbu. | |
| Trombocytopenie | Stupeň 2 (<75, >50×109/l) | Dočasné přerušení podávání do zotavení na stupeň < 1 (>75×109/l). Zahajte znovu léčbu stejnou dávkou. |
| Stupeň 3 & 4 (<50×109/l) | Dočasné přerušení podávání do zotavení na stupeň < 1 (>75×109/l). Zahajte znovu léčbu dávkou 5 mg denně. | |
| Neutropenie | Stupeň 2 (>1×109/l) | Není vyžadována úprava dávky. |
| Stupeň 3 (<1, >0,5×109/l) | Dočasné přerušení podávání do zotavení na stupeň < 2 (>1×109/l). Zahajte znovu léčbu stejnou dávkou. | |
| Stupeň 4 (<0,5×109/l) | Dočasné přerušení podávání do zotavení na stupeň < 2 (>1×109/l). Zahajte znovu léčbu dávkou 5 mg denně. | |
| Febrilní neutropenie | Stupeň 3 | Dočasné přerušení dávky do zotavení na stupeň < 2 (>1,25×109/l) bez horečky. Zahajte znovu léčbu dávkou 5 mg denně. |
| Stupeň 4 | Ukončete léčbu. | |
| 1 Stupnice založená na terminologii „N Criteria for Adverse Events (CTCAE | ational Cancer Institute (NCI) Common Terminology ) v3.0” | |
Zvláštní populace
Starší pacienti (>65 let)
Není nutná úprava dávkování (viz bod 5.2).
Pacienti s poruchou funkce ledvin
Není nutná úprava dávkování (viz bod 5.2).
Pacienti s poruchou funkce jater
-
– Mírná porucha funkce jater (Child-Pugh A) – doporučená dávka je 7,5 mg denně.
-
– Středně těžká porucha funkce jater (Child-Pugh B) – doporučená dávka je 5 mg denně.
-
– Těžká porucha funkce jater (Child-Pugh C) – Everolimus Stada je doporučen pouze v případě, kdy očekávaný prospěch z léčby převáží míru rizika. V tomto případě nesmí být překročena dávka 2,5 mg denně.
Pokud se během léčby změní stav funkce jater pacienta (Child-Pugh), je zapotřebí upravit dávku (viz také body 4.4 a 5.2).
Pediatrická populace
Bezpečnost a účinnost everolimu u dětí ve věku 0 až 18 let nebyla stanovena. Nejsou dostupné žádné údaje.
Způsob podání
Everolimus Stada se má podávat perorálně jednou denně, vždy ve stejnou denní dobu, důsledně buď vždy s jídlem, nebo vždy bez jídla (viz bod 5.2). Everolimus Stada tablety se polykají celé a zapíjejí se sklenicí vody. Tablety se nesmí kousat ani drtit.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku, na jiné deriváty rapamycinu nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Neinfekční pneumonitida
Neinfekční pneumonitida je skupinový účinek derivátů rapamycinu včetně everolimu. Neinfekční pneumonitida (včetně intersticiálního plicního onemocnění) byla často hlášena u pacientů užívajících everolimus (viz bod 4.8). Některé případy byly závažné a ve vzácných případech fatální. O diagnóze neinfekční pneumonitidy by se mělo uvažovat u pacientů s přítomností nespecifických respiračních příznaků a projevů, jako jsou hypoxie, pleurální výpotek, kašel nebo dušnost, a u kterých byly odpovídajícími způsoby vyšetřeny a vyloučeny infekce, nádorová onemocnění a jiné nemedicínské příčiny. Při diferenciální diagnóze neinfekční pneumonitidy (viz „Infekce” níže) by měly být vyloučeny oportunní infekce, jako je pneumonie způsobená Pneumocystis jirovecii (carinii) (PJP, PCP). Pacienti mají být poučeni, aby okamžitě hlásili výskyt jakýchkoli nových respiračních příznaků nebo jejich zhoršení.
Pacienti, u kterých se vyvinou radiologické změny připomínající neinfekční pneumonitidu a mají málo příznaků nebo žádné příznaky, mohou pokračovat v léčbě přípravkem Everolimus Stada bez úpravy dávkování. Jestliže jsou příznaky středně závažné (stupeň 2) nebo závažné (stupeň 3), může být indikováno použití kortikosteroidů až do ústupu klinických příznaků.
U pacientů, kteří užívají kortikosteroidy k léčbě neinfekční pneumonitidy, se má zvážit profylaxe pneumonie způsobené Pneumocystis jirovecii (carinii) (PJP, PCP).
Infekce
Everolimus má imunosupresivní vlastnosti a pacienti mohou být náchylnější k bakteriálním, mykotickým, virovým nebo protozoárním infekcím, včetně infekcí oportunními patogeny (viz bod 4.8). U pacientů užívajících everolimus byly popsány lokalizované a systémové infekce zahrnující pneumonie, jiné bakteriální infekce, invazivní plísňové infekce, např. aspergilózy, kandidózy nebo pneumonie způsobené Pneumocystis jirovecii (carinii) (PJP, PCP) a virové infekce včetně reaktivace virové hepatitidy B. Některé z těchto infekcí byly závažné (např. vedly k sepsi, respiračnímu nebo jaternímu selhání) a občas fatální.
Lékaři i pacienti si mají být vědomi zvýšeného rizika infekcí při léčbě přípravkem Everolimus Stada. Již dříve existující infekce mají být přiměřeně léčeny a zcela vyléčeny před zahájením léčby přípravkem Everolimus Stada. Během léčby přípravkem Everolimus Stada je nutná ostražitost k projevům a příznakům infekce; pokud byla diagnostikována infekce, musí se okamžitě zavést vhodná léčba a je zvážit přerušení nebo ukončení léčby přípravkem Everolimus Stada.
Jestliže je diagnostikována systémová invazivní plísňová infekce, musí být léčba přípravkem Everolimus Stada okamžitě a trvale zastavena a musí být zahájena vhodná antimykotická terapie.
U pacientů, kteří užívali everolimus, byly hlášeny případy pneumonie způsobené Pneumocystis jirovecii (carinii) (PJP, PCP), některé s fatálními následky. PJP/PCP mohou být spojeny s konkomitantním podáváním kortikosteroidů nebo jiných imunosupresivních přípravků. Při konkomitantním podávání kortikosteroidů nebo jiných imunosupresivních přípravků se má zvážit profylaxe PJP/PCP.
Hypersenzitivní reakce
Přecitlivělost, která se projevuje příznaky jako je mimo jiné anafylaxe, dušnost, zrudnutí, bolest na hrudníku nebo angioedém (například otok dýchacích cest nebo jazyka s respiračními poruchami nebo bez nich), byla pozorována v souvislosti s užíváním everolimu (viz bod 4.3).
Současné užívání inhibitorů angiotenzin konvertujícího enzymu (ACE)
Pacienti současně užívající ACE inhibitory (např. ramipril) čelí zvýšenému riziku angioedému (například otok dýchacích cest nebo jazyka s respiračními poruchami nebo bez nich) (viz bod 4.5).
Stomatitida
Stomatitida, včetně ulcerací a mukozitidy v dutině ústní, je nejčastěji hlášeným nežádoucím účinkem u pacientů léčených everolimem (viz bod 4.8). Stomatitida se většinou vyskytuje v prvních 8 týdnech léčby. Jednoramenná studie u postmenopauzálních pacientek s nádorem prsu léčených everolimem a exemestanem ukázala, že perorální roztok kortikosteroidu bez alkoholu, podávaný jako ústní voda během prvních 8 týdnů léčby, může snižovat výskyt a závažnost stomatitidy (viz bod 5.1). Léčba stomatitidy může proto zahrnovat profylaktické a/nebo terapeutické použití topické léčby v podobě perorálního roztoku kortikosteroidu bez alkoholu k výplachu úst. Nemají se však používat přípravky obsahující alkohol, peroxid vodíku, deriváty jódu a mateřídoušky, protože by mohlo dojít k exacerbaci stavu. Doporučuje se sledování a léčba mykotických infekcí, zvláště u pacientů léčených léky na bázi steroidů. Antimykotika se nemají použít dříve, než se diagnostikuje mykotická infekce (viz bod 4.5).
Případy selhání ledvin
U pacientů léčených everolimem byly pozorovány případy selhání ledvin (včetně akutního selhání ledvin), některé s fatálními následky (viz bod 4.8). Doporučuje se monitorovat funkci ledvin, a to zejména u pacientů s dalšími rizikovými faktory, které by mohly také poškodit funkci ledvin.
Laboratorní vyšetření a monitorování
Funkce ledvin
Bylo hlášeno zvýšení sérového kreatininu, které bylo obvykle mírné, a proteinurie (viz bod 4.8). Před zahájením léčby přípravkem Everolimus Stada a následně pak během léčby se doporučuje sledovat funkce ledvin, včetně stanovení hladiny močovinového dusíku v krvi (BUN- blood urea nitrogen), proteinů v moči a sérového kreatininu.
Glukóza v krvi
Byla hlášena hyperglykemie (viz bod 4.8). Doporučuje se monitorovat sérové hladiny glukózy nalačno před zahájením léčby přípravkem Everolimus Stada a poté pravidelně v jejím průběhu. Častější sledování je doporučené při souběžném podávání přípravku Everolimus Stada s jinými léčivými přípravky, které mohou indukovat hyperglykemii. Pokud je to možné, mělo by být před zahájením léčby přípravkem Everolimus Stada u pacienta dosaženo optimální kompenzace glykemie.
Lipidy v krvi
Byla hlášena dyslipidemie (zahrnující hypercholesterolemii a hypertriglyceridemii). Před zahájením léčby přípravkem Everolimus Stada je doporučené sledování hladin cholesterolu a triglyceridů v krvi, a po zahájení léčby se doporučuje periodické sledování spolu se zavedením příslušné farmakologické terapie.
Hematologické parametry
Bylo hlášeno snížení hladiny hemoglobinu, počtu lymfocytů, neutrofilů a krevních destiček (viz bod 4.8). Před zahájením léčby přípravkem Everolimus Stada a následně i v jejím průběhu se doporučuje monitorovat kompletní krevní obraz.
Funkční karcinoidní nádory
V randomizované, dvojitě zaslepené, multicentrické studii u pacientů s funkčními karcinoidy byla porovnávána léčba everolimem a depotním oktreotidem s placebem a depotním oktreotidem. Ve studii nebylo dosaženo primárního cíle účinnosti (přežití bez progrese [PFS]) a celkové přežití (OS) hodnocené v interim analýze bylo numericky příznivější ve větvi s placebem a oktreotidem.
U pacientů s funkčními neuroendokrinními tumory s karcinoidovým syndromem tedy nebyla bezpečnost a účinnost everolimu stanovena.
Prognostické faktory u gastrointestinálních nebo plicních neuroendokrinních tumorů
U pacientů s nefunkčním gastrointestinálním nebo plicním neuroendokrinním tumorem a s dobrými prognostickými vstupními faktory (např. primární nádor v ileu a normální hodnota chromograninu A či bez kostního postižení) je třeba před zahájením léčby everolimem individuálně posoudit přínosy a rizika léčby. Existují omezené důkazy o přínosech PFS u podskupiny pacientů s primárním původem nádoru v ileu (viz bod 5.1).
Interakce
Je třeba vyhnout se souběžnému podávání inhibitorů a induktorů CYP3A4 a/nebo nespecifické efluxní pumpy P-glykoproteinu (PgP). Pokud se nelze vyhnout současnému podání středně silných inhibitorů nebo induktorů CYP3A4 a/nebo PgP, má se zvážit úprava dávky přípravku Everolimus Stada podle odhadnuté AUC (viz bod 4.5).
Souběžná léčba silnými inhibitory CYP3A4 vede k výrazně zvýšeným koncentracím everolimu v plazmě (viz bod 4.5). V současně době nejsou dostatečné údaje, které by doporučily dávkování v tomto případě. Z tohoto důvodu není souběžná léčba přípravkem Everolimus Stada a silnými inhibitory doporučena.
Při užívání přípravku Everolimus Stada v kombinaci s perorálně podávanými substráty CYP3A4 s úzkým terapeutickým indexem je třeba dbát opatrnosti z důvodu potenciálních lékových interakcí. Pokud je Everolimus Stada užíván s perorálně podávanými substráty CYP3A4 s úzkým terapeutickým indexem (např. pimozid, terfenadin, astemizol, cisaprid, chinidin nebo deriváty námelových alkaloidů), pacient má být sledován s ohledem na možný výskyt nežádoucích účinků popsaných v souhrnu údajů o přípravku k perorálně podávaným substrátům CYP3A4 (viz bod 4.5).
Porucha funkce jater
Expozice everolimu byla zvýšena u pacientů s lehkou (Child-Pugh A), středně těžkou (Child-Pugh B) a těžkou (Child-Pugh C) poruchou funkce jater (viz bod 5.2).
U pacientů s těžkou poruchou funkce jater (Child-Pugh C) se doporučuje užívat Everolimus Stada, pokud potenciální prospěch z léčby převáží možná rizika (viz body 4.2 a 5.2).
V současné době nejsou dostupná žádná klinická data o bezpečnosti a účinnosti, která by podpořila doporučení úpravy dávkování pro zvládání nežádoucích účinků u pacientů s poruchou funkce jater.
Očkování
Během léčby přípravkem Everolimus Stada nemají být použity k očkování živé vakcíny (viz bod 4.5).
Laktóza
Everolimus Stada obsahuje laktózu. Pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, vrozeným deficitem laktázy nebo malabsorpcí glukózy a galaktózy by tento přípravek neměli užívat.
Komplikace při hojení ran
Porucha hojení ran je obecným účinkem derivátů rapamycinu, včetně everolimu. Proto je třeba dbát opatrnosti, pokud je Everolimus Stada užíván v období okolo operace.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Everolimus je substrátem pro CYP3A4 a také substrátem a středně silným inhibitorem PgP. Proto mohou být absorpce a následné vylučování everolimu ovlivněny látkami působícími na CYP3A4 a/nebo PgP. In vitro je everolimus kompetitivním inhibitorem CYP3A4 a smíšeným inhibitorem CYP2D6.
Známé a teoretické interakce s vybranými inhibitory a induktory CYP3A4 a PgP jsou uvedeny níže v tabulce 2.
Inhibitory CYP3A4 a PgP zvyšující koncentrace everolimu
Látky, které jsou inhibitory CYP3A4 nebo PgP, mohou zvyšovat koncentrace everolimu v krvi snížením metabolismu nebo efluxu everolimu z intestinálních buněk.
Induktory CYP3A4 a PgP snižující koncentrace everolimu
Látky, které jsou induktory CYP3A4 nebo PgP, mohou snižovat koncentrace everolimu v krvi zvýšením metabolismu nebo efluxu everolimu z intestinálních buněk.
Tabulka 2. Účinky jiných léčivých látek na everolimus
| Léčivá látka dle interakce | Interakce – Změna AUC/Cmax everolimu Geometrický průměr (sledované rozmezí) | Doporučení k současnému podávání |
| Silné inhibitory CYP3A4/PgP | ||
| Ketokonazol | AUC $15,3násobná (rozmezí 11,2–22,5) Cmax $4,1násobná (rozmezí 2,6–7,0) | Souběžná léčba přípravkem Everolimus Stada a silnými inhibitory není doporučena. |
| Itrakonazol, posakonazol, vorikonazol | Nebylo studováno. Lze očekávat výrazné zvýšení koncentrací everolimu. | |
| Telithromycin, klarithromycin | ||
| Nefazodon | ||
| Ritonavir, atazanavir, sachinavir, darunavir, indinavir, nelfinavir | ||
| Středně silné inhibitory CY | P3A4/PgP | |
| Erythromycin | AUC $4,4násobná (rozmezí 2,0–12,6) Cmax $2,0násobná (rozmezí 0,9–3,5) | Pokud nelze vyloučit souběžnou léčbu se středně silnými inhibitory CYP3A4 nebo PgP, je třeba dbát opatrnosti. Pokud je u pacientů potřebné současné podávání středně silných inhibitorů CYP3A4 nebo PgP, mělo by být zváženo snížení dávky na 5 mg denně nebo 2,5 mg denně. Klinické údaje spojené s touto úpravou dávky však nej sou dostupné. Doporučené úpravy dávky nemusí být optimální pro všechny jedince z důvodu variability pacientů. Proto je doporučeno bedlivé sledování nežádoucích účinků. Při ukončení podávání středně silného inhibitoru je třeba zvážit vymývací periodu po dobu nejméně 2 až 3 dní (průměrná doba eliminace pro většinu běžně užívaných středně silných inhibitorů) před návratem přípravku Everolimus Stada na dávku používanou před zahájením souběžné léčby. |
| Imatinib | AUC $ 3,7násobná Cmax $ 2,2násobná | |
| Verapamil | AUC $3,5násobná (rozmezí 2,2–6,3) Cmax $2,3násobná (rozmezí 1,3–3,8) | |
| Cyklosporin perorální podání | AUC $2,7násobná (rozmezí 1,5–4,7) Cmax $1,8násobná (rozmezí 1,3–2,6) | |
| Flukonazol | Nebylo studováno. Lze očekávat zvýšenou expozici. | |
| Diltiazem | ||
| Dronedaron | Nebylo studováno. Lze očekávat zvýšenou expozici. | |
| Amprenavir, fosamprenavir | Nebylo studováno. Lze očekávat zvýšenou expozice. | |
| Grapefruitový džus nebo jiné potraviny ovlivňující CYP3A4/PgP | Nebylo studováno. Lze očekávat zvýšenou expozici (účinky se mohou výrazně lišit). | Kombinace má být vyloučena. |
| Silné a středně silné induktory CYP3A4/PgP | ||
| Rifampicin | AUC .63 % (rozmezí 0–80 %) Cmax .58 % (rozmezí 10–70 %) | Je zapotřebí vyvarovat se souběžné léčby silnými induktory CYP3A4. Pokud je u pacientů potřebné souběžné podávání silných induktorů CYP3A4, má se zvážit zvýšení dávky přípravku Everolimus Stada z 10 mg denně až na 20 mg denně postupným zvyšováním dávky po 5 mg nebo méně čtvrtý a osmý den od počátku podávání induktoru. Tato dávka přípravku Everolimus Stada je predikována k vyrovnání AUC na rozmezí pozorované bez induktorů. Klinická data spojená s touto úpravou dávkování však neexistují. Pokud je léčba induktorem přerušena, je třeba zvážit vymývací periodu po dobu nejméně 3 až 5 dní (dostatečná doba pro výraznou enzymovou de-indukci) před návratem dávky přípravku Everolimus Stada na dávku používanou před zahájením souběžné léčby. |
| Dexamethason | Nebylo studováno. Lze očekávat sníženou expozici. | |
| Karbamazepin, fenobarbital, fenytoin | Nebylo studováno. Lze očekávat sníženou expozici. | |
| Efavirenz, nevirapin | Nebylo studováno. Lze očekávat sníženou expozici. | |
| Třezalka tečkovaná (Hypericum perforatum) | Nebylo studováno. Lze očekávat výrazně sníženou expozici. | Během léčby everolimem nemají být užívány přípravky obsahující třezalku tečkovanou. |
Látky, jejichž koncentrace v plazmě může být everolimem pozměněna
Na základě výsledků in vitro není pravděpodobné, že systémové koncentrace dosažené po perorálním podání denní dávky 10 mg způsobují inhibici PgP, CYP3A4 a CYP2D6. Nemůže však být vyloučena inhibice CYP3A4 a PgP ve střevě. Studie interakcí u zdravých dobrovolníků prokázala, že při souběžném podávání perorální dávky midazolamu, citlivého modelového substrátu CYP3A, s everolimem, došlo ke 25% zvýšení Cmax midazolamu a 30% zvýšení AUC(0-inf) midazolamu. Tento účinek je pravděpodobně způsoben inhibicí intestinálního CYP3A4 everolimem. Everolimus může ovlivnit biologickou dostupnost souběžně perorálně podávaných substrátů CYP3A4. Nelze však očekávat klinicky významný vliv na expozici systémově podávaných substrátů CYP3A4 (viz bod 4.4).
Souběžné podávání everolimu a depotního oktreotidu zvýšilo Cmin oktreotidu (everolimus/placebo) 1,47krát (geometrický průměr). Klinicky významný efekt na účinnost odpovědi na everolimus u pacientů s pokročilými neuroendokrinními tumory nebylo možné stanovit.
Souběžné podávání everolimu a exemestanu zvýšilo Cmin exemestanu o 45 % a C2h exemestanu o 64 %. Odpovídající hladiny estradiolu v ustáleném stavu (4 týdny) se v obou ramenech léčby vzájemně neodlišovaly. U pacientek s hormonálně pozitivním pokročilým karcinomem prsu užívajících kombinovanou léčbu nebylo zjištěno zvýšení výskytu nežádoucích účinků spojených s exemestanem. Zvýšení hladin exemestanu nemá pravděpodobně vliv na účinnost ani bezpečnost léčby.
Současné užívání inhibitorů angiotenzin konvertujícího enzymu (ACE)
Pacienti současně užívající ACE inhibitory (např. ramipril) čelí zvýšenému riziku angioedému (viz bod 4.4).
Očkování
Imunitní odpověď na očkování může být ovlivněna, proto může být očkování během léčby přípravkem Everolimus Stada méně účinné. V průběhu léčby přípravkem Everolimus Stada se nemají aplikovat živé vakcíny (viz bod 4.4). Příklady živých vakcín jsou: intranasální vakcína proti chřipce, vakcíny proti spalničkám, příušnicím, zarděnkám, perorální vakcína proti dětské obrně, BCG (Bacille Calmette-Guérin), proti žluté zimnici, neštovicím a TY21a proti tyfu.
4.6 Fertilita, těhotenství a kojení
Ženy ve fertilním věku / antikoncepce u mužů a žen
Ženy ve fertilním věku musí během léčby a 8 týdnů po ukončení léčby everolimem používat vysoce účinnou antikoncepci (např. perorální, injekční nebo hormonální implantační metodu kontroly početí bez estrogenu, progesteronovou antikoncepci, hysterektomii, podvaz vejcovodů, úplnou sexuální abstinenci, bariérové metody, nitroděložní tělísko [IUD – intrauterine device] a/nebo ženskou/mužskou sterilizaci). Pacientům mužského pohlaví není nutné zakazovat početí.
Těhotenství
Příslušná data o použití everolimu u těhotných žen nejsou dostupná. Studie na zvířatech prokázaly reprodukční toxicitu včetně embryotoxicity a fetotoxicity (viz bod 5.3). Potenciální riziko pro člověka není známé.
Everolimus se nedoporučuje podávat těhotným ženám ani ženám ve fertilním věku, které neužívají účinnou antikoncepci.
Kojení
Není známo, zda je everolimus vylučován do mateřského mléka žen. Bylo však zjištěno, že everolimus a/nebo jeho metabolity snadno přestupují do mléka potkaních samic (viz bod 5.3). Proto ženy, které užívají everolimus, nemají kojit během léčby a 2 týdny po poslední dávce.
Fertilita
Potenciál everolimu způsobit neplodnost u mužů a žen není známý, nicméně u pacientek ženského pohlaví byla pozorována amenorhea (sekundární amenorhea a jiné nepravidelnosti menstruačního cyklu) a přidružená nerovnováha luteinizačního hormonu (LH) a folikulostimulačního hormonu (FSH). Na základě neklinických studií může být fertilita mužů a žen léčbou everolimem snížena (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Everolimus Stada může mít malý nebo mírný vliv na schopnost řídit nebo obsluhovat stroje. Pacienti mají být informováni, aby při řízení a obsluze strojů dbali zvýšené opatrnosti, pokud se u nich během léčby přípravkem Everolimus Stada objeví únava.
4.8 Nežádoucí účinky
Souhrn bezpečnostního profilu
Bezpečnostní profil je založen na poolovaných datech od 2672 pacientů léčených everolimem v deseti klinických studiích: pěti randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích fáze III a pěti otevřených studiích fáze I a fáze II spojených se schválenými indikacemi.
Nejčastější nežádoucí účinky (výskyt >1/10) z poolovaných bezpečnostních dat byly (v sestupném pořadí): stomatitida, vyrážka, únava, průjem, infekce, nauzea, snížená chuť k jídlu, anemie, dysgeuzie, pneumonitida, periferní edém, hyperglykemie, astenie, pruritus, snížená tělesná hmotnost, hypercholesterolemie, epistaxe, kašel a bolest hlavy.
Nejčastější nežádoucí účinky stupně 3–4 (výskyt >1/100 až <1/10) byly stomatitida, anemie, hyperglykemie, infekce, únava, průjem, pneumonitida, astenie, trombocytopenie, neutropenie, dušnost, proteinurie, lymfopenie, hemoragie, hypofosfatemie, vyrážka, hypertenze, pneumonie, zvýšená hladina alaninaminotransferázy (ALT), zvýšená hladina aspartátaminotransferázy (AST) a diabetes mellitus. Stupně odpovídají stupnici CTCAE verze 3.0 a 4.03.
Tabulkový přehled nežádoucích účinků
Tabulka 3 uvádí kategorie četností nežádoucích účinků hlášených v poolovaných analýzách s ohledem na hodnocení bezpečnosti. Nežádoucí účinky jsou seřazeny podle MedDRA systému orgánových tříd a frekvence výskytu. Kategorie frekvence výskytu jsou definovány následovně: velmi časté (>1/10); časté (>1/100 až <1/10); méně časté (>1/1000 až <1/100); vzácné (>1/10000 až <1/1000); velmi vzácné (<1/10000). V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Tabulka 3. Nežádoucí účinky hlášené v klinických studiích
| Systém orgánových tříd | Frekvence | Preferovaný termín |
| Infekce a infestace | Velmi časté | Infekce a, |
| Poruchy krve a lymfatického systému | Velmi časté | Anemie |
| Časté | Trombocytopenie, neutropenie, leukopenie, lymfopenie | |
| Méně časté | Pancytopenie | |
| Vzácné | Čistá aplazie erytrocytů | |
| Poruchy imunitního systému | Méně časté | Hypersenzitivita |
| Poruchy metabolismu a výživy | Velmi časté | Snížená chuť k jídlu, hyperglykemie, hypercholesterolemie |
| Časté | Hypertriglyceridemie, hypofosfatemie, diabetes mellitus, hyperlipidemie, hypokalemie, dehydratace, hypokalcemie | |
| Psychiatrické poruchy | Časté | Nespavost |
| Poruchy nervového systému | Velmi časté | Dysgeuzie, Bolest hlavy |
| Méně časté | Ageuzie | |
| Poruchy oka | Časté | Edém očních víček |
| Méně časté | Konjunktivitida | |
| Srdeční poruchy | Méně časté | Městnavé srdeční selhání |
| Cévní poruchy | Časté | Hemoragie b, hypertenze |
| Méně časté | Návaly, hluboká žilní trombóza | |
| Respirační, hrudní a mediastinální poruchy | Velmi časté | Pneumonitida c, epistaxe, kašel |
| Časté | Dušnost | |
| Méně časté | Hemoptýza, plicní embolie | |
| Vzácné | Syndrom akutní dechové tísně | |
| Gastrointestinální poruchy | Velmi časté | Stomatitida d, průjem, nauzea |
| Časté | Zvracení, sucho v ústech, bolest břicha, slizniční zánět, bolest v ústech, dyspepsie, dysfagie | |
| Poruchy jater a žlučových cest | Časté | Zvýšená hladina aspartátaminotransferázy, zvýšená hladina alaninaminotransferázy |
| Poruchy kůže a podkožní tkáně | Velmi časté | Vyrážka, svědění |
| Časté | Suchá kůže, onemocnění nehtů, mírná alopecie, akné, erytém, onychoklaze, palmoplantární erytrodysestezie (hand-foot syndrom), kožní exfoliace, kožní léze | |
| Vzácné | Angioedém | |
| Poruchy svalové a kosterní soustavy a pojivové tkáně | Časté | Artralgie |
| Poruchy ledvin a močových cest | Časté | Proteinurie, zvýšená hladina kreatininu v krvi, selhání ledvin* |
| Méně časté | Zvýšený denní výdej moči, akutní selhání ledvin* | |
| Poruchy reprodukčního systému a prsu | Časté | Nepravidelný menstruační cyklus e |
| Méně časté | Amenorea e |
| Systém orgánových tříd | Frekvence | Preferovaný termín |
| Poruchy reprodukčního systému a prsu | Velmi časté | Únava, astenie, periferní otoky |
| Časté | Pyrexie | |
| Méně časté | Nekardiální bolest na hrudi, porucha hojení ran | |
| Vyšetření | Velmi časté | Úbytek tělesné hmotnosti |
| * Viz také „Popis vybraných nežádoucích účinků” a Zahrnuje všechny účinky ve třídě orgánových systémů „Infekce a infestace” včetně (častých) pneumonie, infekce močových cest; (méně častých) bronchitida, herpes zoster, sepse, absces a ojedinělé případy oportunních infekcí [například aspergilóza, kandidóza, pneumonie způsobená Pneumocystis jirovecii (carinii) (PJP, PCP) a hepatitida B (viz také bod 4.4)] a (vzácně) virová myokarditida b Zahrnuje odlišné typy krvácení z různých míst, které nejsou uvedené individuálně c Včetně (častých) pneumonitidy, intersticiální plicní choroby, infiltrace plic a (vzácných) plicní alveolární hemoragie, plicní toxicity a alveolitidy d Včetně (velmi častých) stomatitidy, (častých) aftózní stomatitidy, ulcerací úst a jazyka a (méně častých) glosodynie, glositida e Četnost založená na skupině žen ve věku od 10 do 55 let v poolovaných datech | ||
Popis vybraných nežádoucích účinků
-
V klinických studiích a v postmarketingových spontánních hlášeních bylo použití everolimu spojeno s vážnými případy reaktivace hepatitidy B, včetně fatálních důsledků. Reaktivace infekce je očekávaný účinek během období imunosuprese.
-
V klinických studiích a ve spontánních postmarketingových hlášeních byl everolimus spojován
-
V klinických studiích a ve spontánních postmarketingových hlášeních byl everolimus spojován s případy amenorhey (sekundární amenorhea a jiné nepravidelnosti menstruačního cyklu).
-
V klinických studiích a ve spontánních postmarketingových hlášeních byl everolimus spojován
-
V klinických studiích a ve spontánních postmarketingových hlášeních byl hlášen angioedém při konkomitantním podávání ACE inhibitorů i při léčbě bez konkomitantního podávání ACE inhibitorů (viz bod 4.4).
Starší pacienti
-
V poolované analýze s ohledem na hodnocení bezpečnosti bylo 37 % pacientů léčených everolimem ve věku 65 let a starších. Počet pacientů s nežádoucím účinkem vedoucím k ukončení léčby přípravkem byl vyšší u pacientů ve věku 65 let a starších (20 % oproti 13 %). Nejčastějšími nežádoucími účinky, které vedly k ukončení léčby, byly pneumonitida (zahrnující intersticiální plicní chorobu), stomatitida, slabost a dušnost.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky:
4.9
Hlášené zkušenosti s předávkováním u lidí jsou velmi omezené. Jednotlivé dávky až do 70 mg byly podávány s přijatelnou akutní tolerabilitou. U všech případů předávkování musí být zahájena všeobecná podpůrná opatření.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Cytostatika, jiná cytostatika, inhibitory proteinkinázy, ATC kód: L01XE10
Mechanismus účinku
Everolimus je selektivním inhibitorem mTOR (cílové místo rapamycinu u savců). mTOR je klíčová serin/threonin kináza, jejíž aktivita je u mnoha lidských nádorů zvýšená. Everolimus se váže na intracelulární protein FKBP-12 a tvoří komplex, který inhibuje aktivitu mTOR komplexu-1 (mTORC1). Inhibice mTORC1 signální kaskády interferuje s translací a syntézou proteinů redukcí aktivity ribozomální protein-S6-kinázy (S6K1) a vazebného proteinu 4E (4EBP-1) eukaryotického elongačního faktoru, které regulují proteiny zapojené do buněčného cyklu, angiogeneze a glykolýzy. S6K1 se považuje za aktivační funkční doménu 1 estrogenového receptoru zodpovědnou za aktivaci receptoru, která je nezávislá na ligandu. Everolimus redukuje hladinu vaskulárního endoteliálního růstového faktoru (VEGF), který potencuje nádorové angiogenetické procesy. Everolimus je účinný inhibitor růstu a proliferace nádorových buněk, endoteliálních buněk, fibroblastů a buněk hladkého svalstva krevních cév. Bylo prokázáno, že everolimus snižuje glykolýzu v solidních nádorech in vitro a in vivo.
Klinická účinnost a bezpečnost
Hormonálně pozitivní pokročilý karcinom prsu
Byla provedena randomizovaná, dvojitě zaslepená, multicentrická studie fáze III BOLERO-2 (studie CRAD001Y2301) porovnávající everolimus a exemestan oproti placebu a exemestanu u postmenopauzálních žen s HER2/neu negativním pokročilým karcinomem prsu s pozitivitou estrogenových receptorů s recidivou nebo progresí po předchozí léčbě letrozolem nebo anastrozolem. Randomizace byla stratifikována podle dokumentované senzitivity k předchozí hormonální léčbě a podle výskytu viscerálních metastáz. Senzitivita k předchozí hormonální léčbě byla definována (1) dokumentovaným klinickým prospěchem (úplná odpověď [CR], částečná odpověď [PR], stabilizace onemocnění >24 týdnů) po podání nejméně jedné předchozí hormonální léčby pokročilého onemocnění nebo (2) minimálně 24 měsíců adjuvantní hormonální terapie před recidivou onemocnění.
Primárním cílem studie bylo přežití bez progrese onemocnění (PFS) dokumentované pomocí RECIST kritérií (Response Evaluation Criteria in Solid Tumors) na základě vyhodnocení zkoušejícím (lokální radiologické hodnocení). Podpůrné analýzy přežití bez progrese byly založené na nezávislém centrálním radiologickém hodnocení.
Sekundární cíle zahrnovaly celkové přežití (OS), míru objektivní odpovědi, míru klinického prospěchu, bezpečnost, změnu v kvalitě života (QoL) a dobu do zhoršení ECOG PS (Eastern Cooperative Oncology Group performance status).
Celkem bylo randomizováno 724 pacientek v poměru 2:1 k užívání kombinace everolimu (10 mg denně) s exemestanem (25 mg denně) (n=485) nebo placeba s exemestanem (25 mg denně) (n=239). V době finální analýzy celkového přežití (OS) byl medián trvání léčby everolimem 24,0 týdne (rozmezí 1,0–199,1 týdne). Medián trvání léčby exemestanem byl delší ve skupině užívající everolimus s exemestanem – 29,5 týdne (1,0–199,1) v porovnání s 14,1 týdne (1,0–156,0) ve skupině užívající placebo + exemestan.
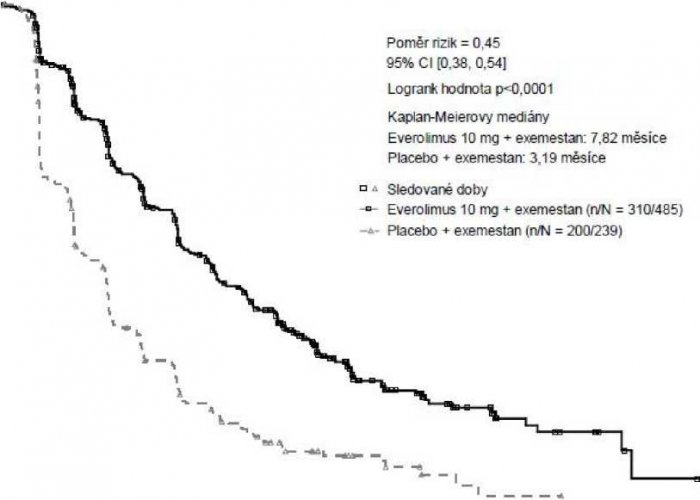
Výsledky účinnosti pro primární cílový ukazatel byly získány na základě finální analýzy PFS (viz tabulka 4 a obrázek 1). V době progrese onemocnění pacientky v rameni s placebem a exemestanem nemohly přecházet do ramene s everolimem.
Tabulka 4. BOLERO-2 výsledky účinnosti
| Hodnocené parametry | Everolimus3 n=485 | Placeboa n=239 | Poměr rizik | Hodnota P |
| Medián přežití bez progrese onemocnění (měsíce) (95% CI) | ||||
| Radiologické hodnocení zkoušejícím | 7,8 (6,9 až 8,5) | 3,2 (2,8 až 4,1) | 0,45 (0,38 až 0,54) | <0,0001 |
| Nezávislé radiologické hodnocení | 11,0 (9,7 až 15,0) | 4,1 (2,9 až 5,6) | 0,38 (0,31 až 0,48) | <0,0001 |
| Medián celkového přežití (měsíce) (95% CI) | ||||
| Medián celkového přežití | 31,0 (28,0 – 34,6) | 26,6 (22,6 – 33,1) | 0,89 (0,73 – 1,10) | 0,1426 |
| Nejlepší celková odpověď (%) (95% CI) | ||||
| Míra objektivní odpovědi b | 12,6 % (9,8 až 15,9) | 1,7 % (0,5 až 4,2) | n/ad | <0,0001e |
| Míra klinického prospěchu c | 51,3 % (46,8 až 55,9) | 26,4 % n/ad (20,9 až 32,4) | <0,0001e | |
| a Plus exemestan b Míra objektivní odpovědi = podíl pacientů s úplnou nebo částečnou dopovědí c Míra klinického prospěchu = podíl pacientů s úplnou nebo částečnou odpovědí nebo stabilizací onemocnění >24 týdny d Není relevantní e p hodnota je získána exaktním Cochran-Mantel-Haenszelovým testem za použití stratifikované verze permutačního testu dle Cochran-Armitage. | ||||
| 0 | 6 | 12 | 18 | 24 | 30 | 36 | 42 | 48 | 54 60 66 | 72 | 78 | 84 | 90 | 96 | 102 | 108 | 114 | 120 |
| Počet pacientů v | riziku | Doba (týdny) | ||||||||||||||||
| Doba (týdny) 0 | 6 | 12 | 18 | 24 | 3® | 36 | 42 | 48 | 54 50 56 | 72 | 78 | 84 | 90 | 96 | 102 | 108 | 114 | 120 |
| Hveroimius 485 | 436 | 366 | 304 | 257 | 221 | 185 | 158 | 124 | 91 56 50 | 35 | 24 | 22 | 13 | 10 | 8 | 2 | 1 | 0 |
| Placebo 239 | 190 | 132 | 96 | 67 | 50 | 39 | 30 | 21 | 15 10 8 | 5 | 3 | 1 | 1 | 1 | 0 | 0 | 0 | 0 |
Odhadované přežití bez progrese onemocnění bylo též podpořeno výsledky plánované analýzy podskupin při hodnocení zkoušejícím. Pozitivní účinky léčby everolimem a exemestanem byly pozorovány u všech hodnocených podskupin (věk, senzitivita k předchozí hormonální léčbě, počet postižených orgánů, stav pouze kostních metastáz při zahájení léčby a výskyt viscerálních metastáz a napříč hlavními demografickými a prognostickými skupinami) a s odhadovaným poměrem rizik oproti placebu a exemestanu v rozmezí 0,25 až 0,60.
Při porovnání léčebných ramen nebyly mezi dobami do zhoršení (>5 %) v globálních a funkčních doménách při hodnocení dotazníkem QLQ-C30 zjištěny žádné rozdíly.
Pokročilé pankreatické neuroendokrinní tumory (pNET)
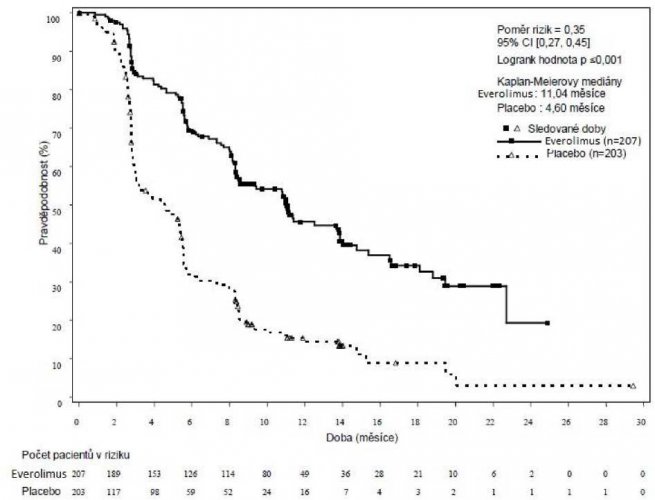
Multicentrická, randomizovaná, dvojitě zaslepená studie fáze III RADIANT-3 (studie CRAD001C2324) porovnávající everolimus s nejlepší podpůrnou léčbou (BSC) oproti placebu s nejlepší podpůrnou léčbou u pacientů s pokročilým pankreatickým neuroendokrinním tumorem prokázala statisticky významný klinický prospěch everolimu oproti placebu 2,4násobným prodloužením mediánu přežití bez progrese (PFS) (11,04 měsíce oproti 4,6 měsíce), (HR 0,35; 95% CI: 0,27, 0,45; p<0,0001) (viz tabulka 5 a obrázek 2).
Studie RADIANT-3 zahrnovala pacienty s dobře a středně diferencovanými pankreatickými neuroendokrinními tumory, jejichž onemocnění progredovalo během předchozích 12 měsíců. Léčba somatostatinovými analogy byla povolená jako součást nejlepší podpůrné léčby.
Primárním cílem studie bylo přežití bez progrese dokumentované pomocí RECIST kritérií (Response Evaluation Criteria in Solid Tumors). Po radiologicky prokázané progresi nádoru mohli být pacienti odslepeni investigátorem. Ti, kteří byli randomizováni do skupiny s placebem, mohli potom užívat everolimus v otevřené fázi studie.
Sekundární cíle zahrnovaly bezpečnost, míru objektivní odpovědi, trvání odpovědi a celkové přežití.
Celkem bylo randomizováno 410 pacientů v poměru 1:1 k užívání everolimu 10 mg/den (n=207) nebo placeba (n=203). Demograficky bylo rozdělení dobře vyvážené (medián věku 58 let, 55 % mužů, 78,5 % bílé rasy). Padesát osm procent pacientů v obou ramenech užívalo před vstupem do studie systémovou terapii. Medián trvání léčby v zaslepené studii byl 37,8 týdnů (rozmezí 1,1–129,9 týdnů) pro pacienty užívající everolimus a 16,1 týdnů (rozmezí 0,4–147,0 týdnů) pro pacienty užívající placebo.
Po progresi onemocnění nebo po odslepení studie bylo 172 z 203 pacientů (84,7 %) původně randomizovaných do placebové větve převedeno na otevřené užívání everolimu. Medián trvání léčby po odslepení byl 47,7 týdne u všech pacientů; 67,1 týdne u 53 pacientů randomizovaných k everolimu, kteří byli převedeni na otevřené užívání everolimu a 44,1 týdne u 172 pacientů randomizovaných k placebu, kteří byli převedeni na otevřené užívání everolimu.
Tabulka 5. RADIANT-3 – výsledky účinnosti
| Populace | Everolimus n=207 | Placebo n=203 | Poměr rizik (95% CI) | Hodnota p |
| Medián přežití bez progrese onemocnění (měsíce | (95% CI) | |||
| Radiologické hodnocení | 11,04 | 4,60 | 0,35 | <0,0001 |
| zkoušejícím | (8,41, 13,86) | (3,06, 5,39) | (0,27, 0,45) | |
| Nezávislé radiologické | 13,67 | 5,68 | 0,38 | <0,0001 |
| hodnocení | (11,17, 18,79) | (5,39, 8,31) | (0,28, 0,51) | |
| Medián celkového přežití | 'měsíce) (95% CI) | |||
| Medián celkového přežití | 44,02 | 37,68 | 0,94 | 0,300 |
| (35,61, 51,75) | (29,14, 45,77) | (0,73, 1,20) | ||
70 g
2 ód
i
ra £
40
Počet pacientů v riziku
Everolimus 207 189
Placebo 203 117
14 1S
Doba (měsíce)
Poměr rizik = 0,35
95% Cl [0,27,0,45]
Logrank hodnota p šQ.001
Kaplan-Meierovy mediány
Everolimus: 11.04 měsíce Placebo: 4,60 měsíce
- ■ a Sledované doby —----Everolimus (n=2O7)
. . Placebo (n=203)
Pokročilý neuroendokrinní tumor gastrointestinálního nebo plicního původu Multicentrická, randomizovaná, dvojitě zaslepená studie fáze III RADIANT-4 (studie CRAD001T2302) porovnávající everolimus s nejlepší podpůrnou léčbou oproti placebu s nejlepší podpůrnou léčbou u pacientů s pokročilým dobře diferencovaným (stupeň 1 nebo stupeň 2) nefunkčním neuroendokrinním tumorem gastrointestinálního nebo plicního původu bez anamnézy a bez příznaků karcinoidového syndromu.
Primárním cílovým parametrem studie bylo přežití bez progrese dokumentované pomocí RECIST kritérií (Response Evaluation Criteria in Solid Tumors) na základě nezávislého radiologického posouzení. Podpůrná PFS analýza byla založena na lokálním posouzení zkoušejícím. Sekundární cílové parametry zahrnovaly celkové přežití (OS), míru objektivní odpovědi, míru kontroly nemoci, bezpečnost a změnu kvality života (FACT-G) a dobu do zhoršení WHO výkonnostního stavu (WHO PS).
Celkem bylo randomizováno 302 pacientů v poměru 2:1 k užívání everolimu 10 mg/den (n=205) nebo placeba (n=97). Demografické charakteristiky i charakteristiky onemocnění byly celkově vyvážené (medián věku 63 let [rozmezí 22 až 86], 76 % bělochů, předchozí léčba somatostatinovými analogy [SSA] v anamnéze). Medián trvání léčby v zaslepené části studie byl 40,4 týdnů pro pacienty užívající everolimus a 19,6 týdnů pro pacienty užívající placebo. Pacienti v rameni s placebem nebyli v době progrese převedeni na everolimus.
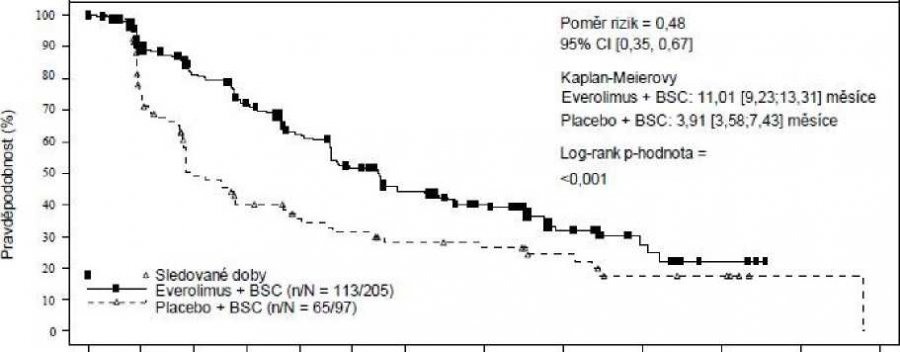
Výsledky účinnosti pro primární cílový parametr studie byly získány z konečné analýzy PFS (viz tabulka 6 a obrázek 3).
Tabulka 6. RADIANT-4 – Výsledky přežití bez progrese onemocnění
| Populace | Everolimus n=205 | Placebo n=97 | Poměr rizik (95% CI) | Hodnota p a |
| Medián přežití bez progrese (měsíce) (95% CI) | ||||
| Nezávislé radiologické hodnocení | 11,01 (9,2–13,3) | 3,91 (3,6–7,4) | 0,48 (0,35–0,67) | <0,0001 |
| Radiologické hodnocení zkoušejícím | 13,96 (11,2–17,7) | 5,45 (3,7–7,4) | 0,39 (0,28–0,54) | <0,0001 |
| a Rozvrstvený log-rank test | ||||
0 2 4 6 s 10 12 15 1S 21 24 27 50
Období (měsíce)
Počet pacientů v riziku
| Doba(mésice) | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 15 | 18 | 21 | 24 | 27 | 30 |
| Evero euus | 205 | 168 | 145 | 124 | 101 | 81 | 65 | 52 | 26 | 10 | 3 | 0 | 0 |
| Placebo | 97 | 65 | 39 | 30 | 24 | 21 | 17 | 15 | 11 | ó | 5 | 1 | 0 |
V podpůrných analýzách byl pozorován pozitivní efekt léčby u všech podskupin s výjimkou podskupiny pacientů s primárním místem vzniku nádoru v ileu (ileum: HR=1,22 [95% CI: 0,56–2,65]; non-ileum: HR=0,34 [95% CI: 0,22–0,54]; plíce: HR=0,43 [95% CI: 0,24–0,79]) (viz obrázek 4).
Věk
WHO PS
Předchozí
SSA
Předchozí chemoterapie
-L.l—
-EH
-D--
—a-
Primámi místo
tumoru
Stupeň tumoru
Nádorová jatemí zátěž
Výchozí hodnoty CgA Výchozí hodnoty NSE
Ne (N=225)
Plíce (N=90) Heum(N=71)
Non-ileum* (N=141) Stupeň 1 (N=194) Stupeň 2 (N=107) <10% (N=228) >10%(N=72) >2×ULN (N=139) <2×ULN (N=138) >ULN (N=87) <ULN(N=188)
■o—
–
----□-
-----fl-------
---D
■0--------
-------[3
--------D-
—0(—
□--
i---------------------------------------------------------------------------------------------------------------------------
c.i
Ve prospěch
2 3 4 5
Placebo + BSC
Everolimus + BSC
- Non-ileum žaludek, tlusté střevo, rektum, apendix. cekům, duodenuni. jejunum. karcinom neznámého primárního původu a další tumory gastromtestmálnilio původu
ULN: Horní hranice normálu
CgA: Chromogranm A
NSE: Neuron-specifícká enoláza
Poměr rizik (95% CI) dle Coxova modelu
V předem plánované interim analýze celkového přežití (OS) po 101 úmrtích (ze 191 potřebných pro konečnou analýzu) a při 33měsíčním sledování bylo pozorováno zlepšení v rameni s everolimem; nicméně nebyl zaznamenán statisticky významný rozdíl v OS (HR=0,73 [95% CI: 0,48–1,11; p=0,071]).
Mezi oběma rameny nebyl pozorován žádný rozdíl v čase do definitivního zhoršení WHO PS (> 1 bod) a čase do definitivního zhoršení celkového skóre FACT-G (> 7 bodů).
Pokročilý renální karcinom
Byla provedena mezinárodní, multicentrická, randomizovaná, dvojitě zaslepená studie fáze III RECORD-1 (studie CRAD001C2240) porovnávající everolimus 10 mg/den a placebo, v obou případech v kombinaci s nejlepší podpůrnou léčbou, u pacientů s metastazujícím renálním karcinomem, jejichž onemocnění progredovalo během léčby nebo po léčbě VEGFR-TKI (inhibitory tyrosinkinázy receptoru vaskulárního endoteliálního růstového faktoru) (sunitinibem, sorafenibem nebo sunitinibem a sorafenibem). Byla povolena také předchozí léčba bevacizumabem a interferonem-a. Pacienti byli rozčleněni podle prognostického skóre Memorial Sloan-Kettering Cancer Center (MSKCC) (do skupin s příznivým vs. středním vs. vysokým rizikem) a podle předchozí protinádorové terapie (1 vs. 2 předchozí VEGFR-TKI).
Primárním cílem bylo přežití bez progrese onemocnění, dokumentované pomocí RECIST kritérií (Response Evaluation Criteria in Solid Tumours) a hodnocené prostřednictvím zaslepené, nezávislé centrální hodnotící komise. Sekundární cíle zahrnovaly bezpečnost, objektivní míru odpovědi nádoru, celkové přežití, příznaky související s onemocněním a kvalitu života. Po radiologicky prokázané progresi nádoru mohli být pacienti odslepeni investigátorem: ti, kteří byli randomizováni do skupiny s placebem, mohli potom užívat everolimus 10 mg/den v otevřené fázi studie. Nezávislá komise monitorující data (Independent Data Monitoring Committee) doporučila ukončit tuto studii v době druhé interim analýzy, jelikož bylo dosaženo primárního cíle.
Celkem bylo randomizováno 416 pacientů v poměru 2:1 do skupiny s everolimem (n=277) nebo placebem (n=139). Demograficky bylo rozdělení dobře vyvážené (celkový medián věku [61 let; rozmezí 27–85], 78 % mužů, 88 % bílé rasy, počet předchozí VEGFR-TKI léčby [1–74 %, 2–26 %]). Medián trvání léčby v zaslepené studii byl 141 dní (rozmezí 19–451 dní) pro pacienty užívající everolimus a 60 dní (rozmezí 21–295 dní) pro pacienty užívající placebo.
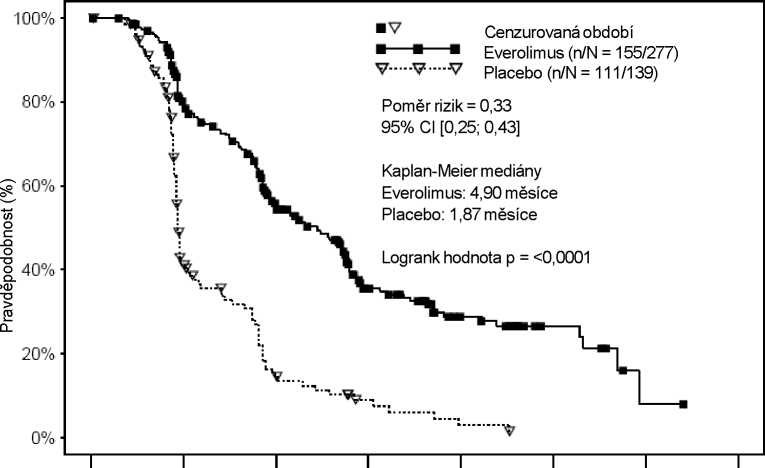
Everolimus oproti placebu prokázal vyšší účinnost ve smyslu dosažení primárního cíle, přežití bez progrese onemocnění, se statisticky významným 67% snížením rizika progrese nebo úmrtí (viz tabulka 7 a obrázek 5).
Tabulka 7. RECORD-1 – Výsledky přežití bez progrese onemocnění
| Populace | n | Everolimus n=277 | Placebo n=139 | Poměr rizik (95%CI) | Hodnota p |
| Medián přežití bez progrese onemocnění (měsíce) (95% CI) | |||||
| Primární analýza | |||||
| Všichni (zaslepená, nezávislá centrální hodnotící komise) | 416 | 4,9 (4,0–5,5) | 1,9 (1,8–1,9) | 0,33 (0,25–0,43) | <0,0001a |
| Podpůrná/analýza senzitivity | |||||
| Všichni (lokální hodnocení zkoušejícím) | 416 | 5,5 (4,6–5,8) | 1,9 (1,8–2,2) | 0,32 (0,25–0,41) | <0,0001a |
| MSKCC prognostické skóre (zaslepená analýza, nezávislá centrální hodnotící komise) | |||||
| Příznivé riziko | 120 | 5,8 (4,0–7,4) | 1,9 (1,9–2,8) | 0,31 (0,19–0,50) | <0,0001 |
| Střední riziko | 235 | 4,5 (3,8–5,5) | 1,8 (1,8–1,9) | 0,32 (0,22–0,44) | <0,0001 |
| Vysoké riziko | 61 | 3,6 (1,9–4,6) | 1,8 (1,8–3,6) | 0,44 (0,22–0,85) | 0,007 |
| a Stratifikovaný log-rank test | |||||
| 0 | 2 | 4 | |
| Počet pacientů dosud v riziku Čas (měsíce) 0 | 2 | 4 | |
| Everolimus | 277 | 192 | 115 |
| Placebo | 139 | 47 | 15 |
| 6 | 8 | 10 | 12 | 14 |
| Čas (měsíce) | ||||
| 6 | 8 | 10 | 12 | 14 |
| 51 | 26 | 10 | 1 | 0 |
| 6 | 2 | 0 | 0 | 0 |
Šestiměsíční míra přežití bez progrese onemocnění byla 36 % pro léčbu everolimem a 9 % pro placebo.
Potvrzené objektivní odpovědi nádoru byly pozorovány u 5 pacientů (2 %), kteří užívali everolimus, zatímco u pacientů s placebem nebyla pozorována žádná odpověď. Proto tedy prospěch z přežití bez progrese onemocnění odráží primárně populaci se stabilizací onemocnění (což odpovídá 67 % pacientů ve skupině s everolimem).
Nebyl prokázán statisticky významný rozdíl v celkovém přežití (poměr rizik 0,87; interval spolehlivosti: 0,65–1,17; p=0,177). Přechod na podávání everolimu v otevřené fázi studie po progresi onemocnění u pacientů zařazených do skupiny s placebem zmařilo možnost odhalení jakýchkoli s léčbou souvisejících rozdílů v celkovém přežití.
Ostatní studie
Stomatitida je nejčastěji hlášeným nežádoucím účinkem u pacientů léčených everolimem (viz bod 4.4 a 4.8). V postmarketingové jednoramenné studii u postmenopauzálních žen s pokročilým nádorem prsu (n=92) byla ke snížení výskytu a závažnosti stomatitidy pacientkám v době zahájení léčby everolimem (10 mg denně) a exemestanem (25 mg denně) podávána topická léčba orálním roztokem dexamethasonu 0,5 mg/5 ml bez alkoholu jako výplach úst (4 krát denně během prvních 8 týdnů léčby). Výskyt stomatitidy stupně >2 v týdnu 8 byl 2,4 % (n=2/85 hodnotitelných pacientek), což bylo méně než dříve hlášený výskyt. Výskyt stomatitidy stupně 1 byl 18,8 % (n=16/85) a nebyl hlášen žádný případ stomatitidy stupně 3 nebo 4. Celkový bezpečnostní profil v této studii byl shodný s profilem everolimu známým v onkologických a TSC (komplex tuberózní sklerózy) indikacích, s výjimkou mírně zvýšené četnosti orální kandidózy, která byla hlášena u 2,2 % (2/92) pacientek.
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s everolimem u všech podskupin pediatrické populace s pankreatickým neuroendokrinním tumorem, neuroendokrinním tumorem hrudníku a s renálním karcinomem (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Absorpce
U pacientů s pokročilými solidními nádory bylo za podmínek nalačno nebo po lehkém jídle bez tuků dosaženo maximální koncentrace (Cmax) everolimu v mediánu času 1 hodiny po denním podání 5 mg a 10 mg everolimu. Hodnota Cmax je v rozmezí 5 mg a 10 mg závislá na dávce. Everolimus je substrátem a středně silným inhibitorem PgP.
Vliv jídla
U zdravých jedinců snížila strava s vysokým obsahem tuků systémovou expozici k everolimu 10 mg (měřeno plochou pod křivkou AUC) o 22 % a maximální plazmatickou koncentraci Cmax o 54 %. Strava s mírným obsahem tuků snížila AUC o 32 % a Cmax o 42 %. Strava však neměla zjevný účinek na časový profil koncentrace postabsorpční fáze.
Distribuce
Distribuční poměr krev/plazma everolimu, který je závislý na koncentraci v rozmezí 5 až 5000 ng/ml, je 17 % až 73 %. Přibližně 20% koncentrace everolimu v krvi se u pacientů s nádorem, užívajících everolimus v dávce 10 mg/den, nachází v plazmě. Vazba na plazmatické proteiny je přibližně 74 %, a to jak u zdravých dobrovolníků, tak i u pacientů se středně těžkou poruchou funkce jater. U pacientů s pokročilými solidními nádory byl distribuční objem Vd 191 l pro zdánlivý centrální kompartment a 517 l pro zdánlivý periferní kompartment.
Biotransformace
Everolimus je substrátem CYP3A4 a PgP. Po perorálním podání je everolimus hlavní cirkulující složkou v lidské krvi. V lidské krvi bylo detekováno šest hlavních metabolitů everolimu zahrnujících tři monohydroxylované metabolity, dva hydrolytické produkty s otevřeným kruhem a fosfatidylcholinový konjugát everolimu. Tyto metabolity byly také identifikovány u zvířecích druhů zkoušených ve studiích toxicity a prokázaly přibližně 100násobně nižší účinnost oproti samotnému everolimu. Z tohoto důvodu je everolimus považován za látku odpovědnou za většinu celkové farmakologické aktivity.
Eliminace
Střední hodnota clearance po perorálním podání (CL/F) everolimu v dávce 10 mg denně byla u pacientů s pokročilými solidními nádory 24,5 l/hod. Průměrný eliminační poločas everolimu je přibližně 30 hodin.
U pacientů s nádory nebyly provedeny žádné specifické studie vylučování everolimu. Jsou však dostupné údaje ze studií u pacientů po transplantaci. Po jednorázovém podání radioaktivně značeného everolimu v kombinaci s cyklosporinem bylo 80 % radioaktivity nalezeno ve stolici a pouze 5 % bylo vyloučeno močí. Původní účinná látka nebyla detekována ani ve stolici, ani v moči.
Farmakokinetika v rovnovážném stavu
Po podání everolimu pacientům s pokročilými solidními nádory byl rovnovážný stav AUC0-T v rozmezí dávek 5 až 10 mg denně závislý na dávce. Rovnovážného stavu bylo dosaženo během 2 týdnů. Hodnota Cmax je v rozmezí dávek 5 až 10 mg úměrná dávce, tmax je dosaženo za 1 až 2 hodiny po podání dávky. V rovnovážném stavu byla významná korelace mezi AUC0-T a nejnižší koncentrací po předchozí dávce.
Zvláštní populace
Porucha funkce jater
Bezpečnost, tolerabilita a farmakokinetika everolimu byly hodnoceny ve dvou studiích s jednorázovým perorálním podáním tablet everolimu 8 a 34 subjektům s poruchou funkce jater oproti subjektům s normální funkcí jater.
-
V první studii byla průměrná AUC everolimu u 8 jedinců se středně těžkou poruchou funkce jater (Child-Pugh B) dvojnásobná oproti AUC u 8 jedinců s normální funkcí jater.
Ve druhé studii, zahrnující 34 subjekty s různým stupněm poruchy funkce jater ve srovnání se zdravými dobrovolníky, došlo u subjektů s mírnou poruchou funkce jater (Child-Pugh A) k 1,6násobnému zvýšení expozice (tj. AUC0-inf), u subjektů se středně těžkou poruchou funkce jater (Child-Pugh B) k 3,3násobnému zvýšení expozice a u subjektů s těžkou poruchou funkce jater (Child-Pugh C) k 3,6násobnému zvýšení expozice.
Simulace farmakokinetiky opakovaného podávání podporuje doporučené dávkování u subjektů s poruchou funkce jater odpovídající jejich Child-Pugh klasifikaci.
Na základě výsledků obou studií je u pacientů s poruchou funkce jater doporučena úprava dávky (viz body 4.2 a 4.4).
Porucha funkce ledvin
-
V populační farmakokinetické analýze zahrnující 170 pacientů s pokročilými solidními nádory nebyl zjištěn významný vliv clearance kreatininu (25–178 ml/min) na CL/F everolimu. Porucha funkce ledvin po transplantaci (clearance kreatininu v rozmezí 11–107 ml/min) neovlivnila farmakokinetiku everolimu u transplantovaných pacientů.
Starší pacienti
-
V populační farmakokinetické analýze u pacientů s nádory nebyl zjištěn významný vliv věku (27–85 let) na clearance everolimu po perorálním podání.
5.3 Předklinické údaje vztahující se k bezpečnosti
5.3 Předklinické údaje vztahující se k bezpečnostiPředklinický bezpečnostní profil everolimu byl zkoumán u myší, potkanů, miniprasat, opic a králíků. Hlavními cílovými orgány byly u několika druhů reprodukční orgány samců a samic (degenerace testikulárních tubulů, snížený obsah spermií v nadvarlatech, atrofie dělohy); plíce (zvýšení počtu alveolárních makrofágů) u potkanů a myší; slinivka (degranulace exokrinních buněk u opic, vakuolizace exokrinních buněk u miniprasat a degenerace buněk ostrůvků pankreatu u opic), a oči (zákal přední části čočky) pouze u potkanů. Menší změny v ledvinách byly pozorovány u potkanů (exacerbace ukládání na věku závisejícího lipofuscinu v tubulárním epitelu a narůstání hydronefrózy) a u myší (exacerbace dosavadních lézí). Na ledvinách opic a miniprasat nebyly pozorovány žádné známky toxicity.
Everolimus patrně může způsobit spontánní exacerbaci základního onemocnění (chronickou myokarditidu u potkanů, infekci virem Coxsackie v plazmě a srdci u opic, zamoření zažívacího traktu kokcidiemi u miniprasat, kožní léze u myší a opic). Tyto nálezy byly obvykle pozorovány při hladinách systémové expozice v rozmezí terapeutické expozice nebo vyšší, s výjimkou nálezů u potkanů, které se vzhledem k vysoké tkáňové distribuci vyskytly i při expozici nižší, než je terapeutická.
Ve studii fertility potkaních samců byla testikulární morfologie ovlivněna při dávkách 0,5 mg/kg a vyšších. Motilita spermií, jejich počet a plazmatické hladiny testosteronu byly sníženy při dávce 5 mg/kg, která způsobila pokles fertility samců. V tomto případě byla prokázána reverzibilita.
Reprodukční fertilita samic nebyla ve studiích na zvířatech ovlivněna. Perorální dávky everolimu však u samic potkanů v dávkách > 0,1 mg/kg (odpovídá přibližně 4 % AUC0–24h u pacientů léčených denní dávkou 10 mg) vedly ke zvýšení preimplantačních ztrát.
Everolimus přestupoval přes placentu a působil toxicky na plod. U potkanů everolimus způsobil embryo/fetoxicitu při systémové expozici nižší než terapeutické, což se projevilo úmrtností plodů a poklesem jejich hmotnosti. Incidence změn na skeletu a malformací (např. rozštěp sterna) byly zvýšeny při dávkách 0,3 a 0,9 mg/kg. U králíků se embryotoxicita projevila zvýšeným rozsahem pozdních resorpcí.
Studie genotoxicity pokrývající relevantní cíle sledování genotoxicity neprokázaly klastogenní ani mutagenní účinky. Podávání everolimu po dobu až 2 let v nejvyšších dávkách nenaznačilo u myší a potkanů žádný onkogenní potenciál. Tyto dávky odpovídají 3,9 a 0,2násobku očekávané klinické expozice.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Butylhydroxytoluen (E321)
Hypromelosa 2910 (E464)
Laktosa
Krospovidon typ A (E1202)
Magnesium-stearát
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
2 roky.
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní teplotní podmínky uchovávání. Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
OPA/Al/PVC // Al blistry
Everolimus Stada 2,5mg, 5 mg a 10 mg je dostupný v baleních po 10, 30 nebo 90 tabletách.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7.
STADA Arzneimittel AG
Stadastrasse 2 – 18
61118 Bad Vilbel
Německo
8. REGISTRAČNÍ ČÍSLO(A)
Everolimus Stada 2,5 mg tablety: 44/976/16-C
Everolimus Stada 5 mg tablety: 44/977/16-C
Everolimus Stada 10 mg tablety:44/978/16-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 20. 6. 2018
Další informace o léčivu EVEROLIMUS STADA
Jak
se EVEROLIMUS STADA
podává: perorální podání - tableta
Výdej
léku: na lékařský předpis
Balení: Blistr
Velikost
balení: 10
Držitel rozhodnutí o registraci daného léku v České republice:
STADA Arzneimittel AG, Bad Vilbel
E-mail: info@stada-pharma.cz
Telefon: +420 257 888 111
