Souhrnné informace o léku - DYSPORT
1. NÁZEV PŘÍPRAVKU:
DYSPORT 500 Speywood jednotek prášek pro injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Léčivá látka: Botulini toxinum typus A
500 Speywood jednotek * (U) suché substance v jedné injekční lahvičce
*1 Speywood jednotka (U) je definována jako střední letální intraperitoneální dávka pro myš.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA: Prášek pro injekční roztok.
Popis přípravku: bílý sterilní prášek ve formě pelety.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Dysport 500 Speywood jednotek je indikován k léčbě:
– symptomatické při fokální spasticitě postihující horní končetinu u dospělých
– dynamické deformity nohy ve smyslu pes equinus na podkladě spasticity u ambulantních pacientů s dětskou mozkovou obrnou (DMO) od 2 let věku, pouze ve specializovaných centrech s vyškoleným personálem.
– spastické torticollis dospělých
– blefarospasmu dospělých
– hemifaciálního spasmu dospělých
– těžké primární axilární hyperhidrózy rezistentní na konzervativní léčbu
– přechodného zlepšení vzhledu středně hlubokých až hlubokých
- glabelárních vrásek (svislé linie mezi obočím) viditelných při zamračení a/nebo
- laterálních periorbitálních vrásek (vějířovité vrásky, tzv. crow's feet) viditelných při maximálním úsměvu
u dospělých mladších 65 let, jestliže závažnost těchto linií má důležitý psychologický dopad na pacienta.
4.2 Dávkování a způsob podání
Jednotky přípravku Dysport jsou specifické pro přípravek a nejsou zaměnitelné s jiným přípravkem obsahujícím botulinový toxin typu A.
Dysport by měl být podáván pouze náležitě vyškoleným lékařem.
Instrukce k rekonstituci jsou specifické pro injekční lahvičku o velikosti 500 Speywood jednotek. Tyto objemy poskytují koncentrace specifické pro použití pro jednotlivé indikace.
| Výsledná dávka Speywood jednotek na ml | Množství rozpouštědla * pro injekční lahvičku o velikosti 500 Speywood jednotek |
| 500 SJ | 1 ml |
| 200 SJ | 2,5 ml |
| 100 SJ | 5 ml |
*Injekční roztok 0,9% chloridu sodného bez konzervačních látek
Střední část zátky by měla být očištěna alkoholem bezprostředně před probodnutím septa. Používá se sterilní jehla 23 nebo 25 gauge nebo sterilní jehla o velikosti 29 – 30 gauge pro indikace glabelárních vrásek.
K léčbě spasticity u pediatrických pacientů s DMO, kdy se přípravek dávkuje podle tělesné hmotnosti, může být nutné další zředění k dosažení konečného objemu pro podání.
Symptomatická léčba fokální spasticity postihující horní končetinu u dospělých:
Dávkování:
Dávkování během prvního a následných sezení by mělo být přizpůsobeno jednotlivci v závislosti na velikosti, počtu a umístění potřebných svalů, závažnosti spasticity, přítomnosti lokální svalové slabosti, reakci pacienta na předchozí léčbu a/nebo předchozím výskytu nežádoucích účinků daných přípravkem Dysport. Celková dávka podaná při jednom terapeutickém sezení je 500 Speywood jednotek, 1000 Speywood jednotek a 1500 Speywood jednotek a má být rozdělena mezi vybrané svaly tak, jak je uvedeno v tabulce níže. Dávky vyšší než 1000 Speywood jednotek až do 1500 Speywood jednotek se smí podávat pouze, pokud se injekce podává i do svalů ramene.
Obecně by neměl být podán víc než 1 ml do jakéhokoliv jednoho místa podání.
Maximální celková podaná dávka nesmí přesáhnout 1500 U, a to ani v případě, že je léčivý přípravek současně aplikován i do jiných svalů, než jsou svaly horní končetiny. Dávky přípravku Dysport větší než 1500 U nebyly při léčbě spasticity horní končetiny u dospělých studovány.
| Injikované svaly | Doporučená dávka přípravku Dysport (ve Speywood jednotkách) |
| Flexor carpi radialis (FCR) | 100–200 U |
| Flexor carpi ulnaris (FCU) | 100–200 U |
| Flexor digitorum profundus (FDP) | 100–200 U |
| Flexor digitorum superficialis (FDS) | 100–200 U |
| Flexor Pollicis Longus | 100–200 U |
| Adductor Pollicis | 25–50 U |
| Brachialis | 200–400 U |
| Brachioradialis | 100–200 U |
| Biceps Brachii (BB) | 200–400 U |
| Pronator Teres | 100–200 U |
| Triceps Brachii (dlouhá hlava) | 150–300 U |
| Pectoralis Major | 150–300 U |
| Subscapularis | 150–300 U |
| Latissimus Dorsi | 150–300 U |
Třebaže skutečné místo injekce může být určeno palpací, doporučuje se využití technik pro stanovení místa injekce, jako je např. elektromyografie, elektrická stimulace nebo ultrazvuk. Opakovaná léčba přípravkem Dysport by měla být podána, jestliže se účinek předchozí injekce zmenšil, ale ne dříve než 12 týdnů od předchozí injekce. Většina pacientů v klinických studiích byla opětovně léčena v intervalu 12–16 týdnů; nicméně někteří pacienti měli delší trvání odpovědi, až 20 týdnů. Stupeň a typ svalové spasticity v době opakování injekce může vyžadovat úpravu dávky přípravku Dysport a změnu svalů, které mají být injikovány. Klinické zlepšení lze očekávat jeden týden po podání přípravku Dysport.
Údaje o pacientech, kterým byl přípravek aplikován do horní končetiny ve více než 3 cyklech v dávkách vyšších než 1000 U, jsou omezené.
Pediatrická populace: Bezpečnost a účinnost přípravku Dysport v léčbě spasticity horní končetiny u dětí nebyla prokázána.
Starší pacienti (<65 let): Dle klinické zkušenosti nebyly identifikovány rozdíly v odpovědi na léčbu mezi staršími a mladšími pacienty. Obecně platí, že starší pacienti by měli být sledováni, aby se vyhodnotila jejich tolerance vůči přípravku Dysport s ohledem na vyšší četnost doprovodných onemocnění a jiných lékových terapií.
Způsob podání
Při léčbě fokální spasticity postihující horní končetinu u dospělých se Dysport ředí 0,9% roztokem chloridu sodného pro injekce, čímž vznikne roztok přípravku Dysport obsahující buď 100 jednotek v 1 ml, 200 jednotek v 1 ml nebo 500 jednotek v 1 ml. Dysport se v této indikaci podává intramuskulárně do svalů uvedených výše.
Dynamická deformita nohy ve smyslu pes equinus na podkladě spasticity u dětí s DMO ve věku od dvou let a výše:
Dávkování:
Dávkování během prvního a následných sezení má být přizpůsobeno jednotlivci v závislosti na velikosti, počtu a umístění svalů zahrnutých do léčby, závažnosti spasticity, přítomnosti lokální svalové slabosti, reakci pacienta na předchozí léčbu a/nebo předchozího výskytu nežádoucích účinků souvisejících s botulotoxiny.
Maximální celková dávka přípravku Dysport podaná při jednom terapeutickém sezení nesmí překročit 15 U/kg při jednostranné injekci do dolní končetiny nebo 30 U/kg při oboustranné injekci. Navíc celková dávka přípravku Dysport podaná při jednom sezení nesmí překročit 1000 U nebo 30 U/kg, podle toho, co je nižší. Celková podaná dávka se má rozdělit mezi postižené spastické svaly dolní končetiny/dolních končetin. Pokud je to možné, dávka má být rozdělena na více než 1 injekční místo v každém jednotlivém svalu. V kterémkoli místě injekce nemá být podáno více než 0,5 ml přípravku Dysport. Viz níže uvedená tabulka doporučeného dávkování.
| Sval | Rozmezí doporučené dávky pro jeden sval na jednu nohu (U/kg tělesné hmotnosti) | Počet injekčních míst v jednom svalu |
| Distální | ||
| Gastrocnemius | 5 až 15 U/kg | Až do 4 |
| Soleus | 4 až 6 U/kg | Až do 2 |
| Tibialis posterior | 3 až 5 U/kg | Až do 2 |
| Celková dávka | Až do 15 U/kg/nohu |
I když skutečné umístění injekce může být určeno pohmatem, doporučuje se k zaměření místa injekce použít techniky k zavedení injekce, např. elektromyografie, elektrické stimulace nebo ultrazvuku.
Opakovaná léčba přípravkem Dysport by měla být podána v případě, že se snížil účinek předchozí injekce, ale ne dříve než 12 týdnů po předchozí injekci. Většina pacientů v klinických studiích dostávala opakovanou léčbu mezi 16.-22. týdnem; nicméně někteří pacienti mají delší trvání odpovědi, tj. 28 týdnů. Stupeň a vzorec svalové spasticity v okamžiku opakovaného podání injekce mohou vyžadovat změny dávky přípravku Dysport a svalů určených k injekci.
Klinické zlepšení lze očekávat během dvou týdnů po injekci.
Způsob podání
Při léčbě spasticity u pediatrických pacientů s DMO se přípravek Dysport 500 Speywood jednotek ředí 1,0 ml 0,9% roztoku chloridu sodného pro injekce, čímž vznikne roztok přípravku Dysport obsahující 500 jednotek v 1 ml. Dysport se v této indikaci podává intramuskulárně, jak je popsáno výše.
Spastická torticollis:
Dávkování:
Dospělí a starší pacienti:
Dávky doporučené pro torticollis lze podat dospělým každého věku za předpokladu, že mají normální hmotnost a žádné známky snížené krční svalové hmoty. Redukovaná dávka je vhodná u pacientů s podváhou a u starších pacientů, kde může být snížená svalová hmota.
Iniciální doporučená dávka pro léčbu spastické torticollis je 500 U pro pacienta, podaná rozděleně do 2 nebo 3 nejaktivnějších krčních svalů.
Při následujícím podání může být dávka přizpůsobena klinické odpovědi a pozorovaným nežádoucím účinkům. Doporučuje se rozmezí dávky od 250 do 1000 U. Vyšší dávka už může být spojena se zvýšením nežádoucích účinků, zvláště dysfagie. Maximální podaná dávka nesmí přesáhnout 1000 U. Injekce by měly být opakovány přibližně každých 16 týdnů nebo tak, jak je třeba k udržení odpovědi, ale ne častěji než každých 12 týdnů.
Při rotační torticollis se rozmístí 500 U podáním 350 U do musculus splenius capitis ipsilaterálně ve směru rotace brady/hlavy a 150 U do musculus sternocleidomastoideus kontralaterálně k rotaci.
Při laterocollis se rozmístí 500 U podáním 350 U do ipsilaterálního musculus splenius capitis a 150 U do ipsilaterálního musculus sternocleidomastoideus. U případů spojených s elevací ramene může vyžadovat léčbu také ipsilaterální musculus trapezoideus nebo musculus levator scapulae, a to při viditelné hypertrofii svalu nebo podle elektromyografických nálezů (EMG). Pokud je třeba dát injekci do 3 svalů, rozmístí se 500 U podáním 300 U do musculus splenius capitis, 100 U do musculus sternocleidomastoideus a 100 U do třetího svalu.
Při retrocollis se rozmístí 500 U podáním 250 U do každého musculus splenius capitis. Oboustranná injekce do musculus splenius může zvýšit riziko slabosti krčních svalů.
Všechny ostatní formy torticollis vysoce závisí na znalosti specialisty a na EMG, aby byly určeny a léčeny nejaktivnější svaly. EMG by mělo být užíváno diagnosticky pro všechny komplexní formy torticollis, pro přehodnocení po neúspěšné injekci u nekomplexních případů, a pro zavádění injekce do hlubokých svalů nebo u pacientů s nadváhou se špatně palpovatelnými krčními svaly.
Ústup symptomů při torticollis lze očekávat během týdne po injekci. Injekce by měly být opakovány zhruba každých 12 týdnů nebo podle potřeby k prevenci návratu příznaků.
Pediatrická populace:
Bezpečnost a účinnost přípravku Dysport v léčbě spastické torticollis u dětí nebyla prokázána.
Způsob podání
Při léčbě spastické torticollis se Dysport 500 Speywood jednotek ředí 1,0 ml 0,9% roztoku chloridu sodného pro injekce, čímž vznikne roztok přípravku Dysport obsahující 500 jednotek v 1 ml. Dysport se podává intramuskulárně do výše uvedených svalů.
Dávkování:
Dospělí a starší pacienti:
V klinických studiích zkoumajících dávku použitého přípravku Dysport pro léčbu benigního esenciálního blefarospasmu byla dávka 40 U na jedno oko významně účinná. Dávka 80 U na jedno oko měla za následek delší trvání účinku. Nicméně, výskyt místních nežádoucích účinků, specificky ptózy, souvisel s výší dávky. V léčbě blefarospasmu a hemifaciálního spasmu by neměla maximální dávka překročit celkovou dávku 120 jednotek na jedno oko.
Injekce 10 U (0,05ml) by měly být podány mediálně a 10 U (0,05 ml) laterálně do spojení mezi preseptální a orbitální část horního (3 a 4) a dolního musculus orbicularis oculi (5 a 6) každého oka. Aby se snížilo riziko ptózy, je třeba se vyvarovat injekce blízko musculus levator palpebrae superioris.
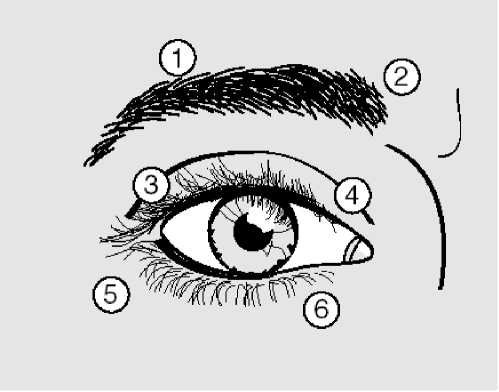
Pro injekce do horního víčka by měla být jehla směrována vně z jeho středu, aby nebyl zasažen musculus levator. Přiložený diagram by měl pomoci v umístění injekcí. Začátek ústupu symptomů lze očekávat během 2 až 4 dnů s maximálním efektem během 2 týdnů.
Injekce by měly být opakovány zhruba každých 12 týdnů nebo podle potřeby k prevenci návratu příznaků, ale nikoli častěji než každých 12 týdnů. Při následujícím podání, pokud je počáteční léčba považovaná za nedostatečnou, může být zapotřebí zvýšit dávku na 60 jednotek: 10 U (0,05 ml) mediálně a 20 U (0,1 ml) laterálně, na 80 jednotek: 20 U (0,1 ml) mediálně a 20 U (0,1 ml) laterálně, nebo až na 120 jednotek: 20 U (0,1 ml) mediálně a 40 U (0,2 ml) laterálně nad a pod každé oko podle výše popsaného způsobu. Je možné injikovat rovněž místa v musculus frontalis nad obočím (1 a 2), pokud zdejší spasmus interferuje s viděním.
V případě jednostranného blefarospasmu se injekce omezí na postižené oko.
Pacienti s hemifaciálním spasmem mají být léčeni jako při jednostranném blefarospasmu.
Doporučené dávky lze podat dospělým každého věku včetně starších pacientů.
Pediatrická populace:
Bezpečnost a účinnost přípravku Dysport v léčbě blefarospasmu a hemifaciálního spasmu u dětí nebyla prokázána.
Způsob podání
Při léčbě blefarospasmu a hemifaciálního spasmu se ředí Dysport 500 Speywood jednotek 2,5 ml 0,9% roztoku chloridu sodného pro injekce, čímž vznikne roztok přípravku Dysport obsahující 200 jednotek v 1 ml. Přípravek Dysport se podává subkutánní injekcí mediálně a laterálně do spojení mezi preseptální a orbitální částí horního i dolního musculus orbicularis oculi.
Dávkování:
Dospělí a starší pacienti:
Doporučená úvodní dávka je 100 U na axillu. Pokud nedosáhneme požadovaného efektu, v následujících injekcích je možné podat až 200 U na axillu. Maximální podaná dávka nesmí přesáhnout 200 U na axillu. Oblast injekcí by měla být určena předem pomocí jodového-škrobového testu. Obě axilly se očistí a desinfikují. Poté se podají intradermální injekce do 10 míst, každá s obsahem 10 U, celkem 100 U na axillu. Maximální účinek by měl být patrný ve druhém týdnu po injekci. Ve většině případů zajistí doporučená dávka odpovídající potlačení sekrece potu přibližně po dobu 48 týdnů. Čas další aplikace by měl být určen individuálně, když se sekrece potu pacienta vrátí k původní sekreci, ale ne častěji než každých 12 týdnů. Jsou určité známky kumulativního účinku opakovaných dávek, proto by čas každého podání u daného pacienta měl být vyhodnocen individuálně.
Pediatrická populace:
Bezpečnost a účinnost přípravku Dysport v léčbě axilární hyperhidrózy u dětí nebyla prokázána.
Způsob podání:
Při léčbě axilární hyperhidrózy se Dysport 500 Speywood jednotek ředí 2,5 ml 0,9% roztoku chloridu sodného pro injekce, čímž vznikne roztok přípravku Dysport obsahující 200 jednotek v 1 ml. Při léčbě axilární hyperhidrózy se přípravek Dysport podává intradermální injekcí do 10 míst.
Středně hluboké až hluboké glabelární vrásky a/nebo laterální periorbitální vrásky
Dávkování:
Léčebný interval závisí na individuální odpovědi pacienta po vyhodnocení dosavadní léčby.
Interval léčby přípravkem Dysport nemá být častější než každé 3 měsíce.
Odličte a desinfikujte pokožku lokálním antiseptikem.
Intramuskulární injekce má být provedena pomocí sterilní jehly o velikosti 29–30 gauge.
Doporučená místa injekce pro glabelární vrásky a laterální periorbitální vrásky jsou popsána níže:
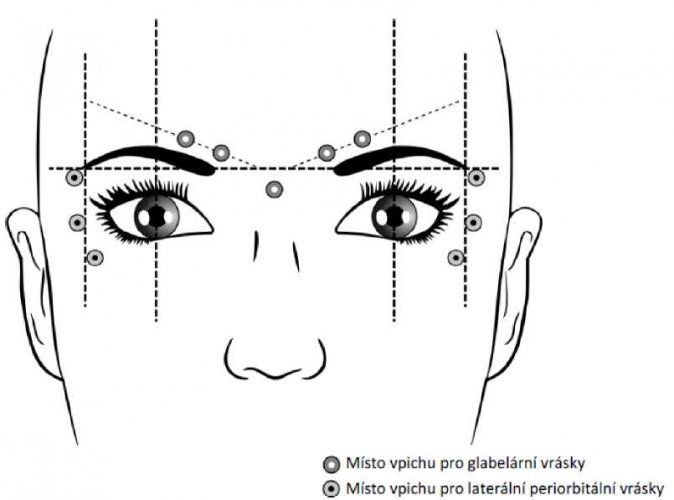
Glabelární vrásky
Doporučená dávka je 50 Speywood jednotek (0,25 ml) rozdělených do 5 injekčních míst, 10 Speywood jednotek (0,05 ml) se aplikuje intramuskulárně do každého z následujících 5 míst: 2 injekce do každého m. corrugator a jedna injekce do m. procerus v blízkosti nasofrontálního úhlu, jak je znázorněno na obrázku výše:
Anatomické orientační body lze snadněji identifikovat, jsou-li pozorovány a palpovány při maximálním zamračení. Před podáním injekce umístěte palec nebo ukazovák pevně pod hranu orbity, aby se zabránilo extravazaci pod hranu orbity.
Během injekce by měla jehla směřovat vzhůru a mediálně. Aby se snížilo riziko ptózy, vyhněte se injekcím v blízkosti m. levator palpebrae superioris, zvláště u pacientů s větším m. depressor supercilii. Injekce do m. corrugator musí být podány do centrální části tohoto svalu, nejméně 1 cm nad hranu orbity.
Interval aplikace závisí na individuální odpovědi pacienta po posouzení lékařem. V klinických studiích bylo prokázáno trvání optimálního účinku u glabelárních vrásek po dobu až 4 měsíců od aplikace. U některých pacientů trval účinek léčby i 5 měsíců (viz bod 5.1).
Laterální periorbitální vrásky
Doporučená dávka na každou stranu je 30 Speywood jednotek (60 Speywood jednotek celkem na obě strany, 0,30 ml rekonstituovaného roztoku) přípravku Dysport, tato dávka má být rozdělena do 3 injekčních míst; do každého místa injekce se má podat intramuskulárně 10 Speywood jednotek (0,05 ml rekonstituovaného roztoku).
Injekce má být podána laterálně (v úhlu 20–30°) ke kůži a velmi superficiálně. Všechna místa injekce mají být do vnější části musculus orbicularis oculi a dostatečně daleko od okraje orbity (přibližně 1–2 cm), jak je naznačeno výše.
Anatomické orientační body lze snadněji identifikovat pohledem a pohmatem při maximálním úsměvu. Je nutné věnovat pozornost tomu, aby se zabránilo injekci do musculus zygomaticus major/minor, aby nedošlo k poklesu koutku a vzniku asymetrického úsměvu.
Pediatrická populace:
Použití přípravku Dysport za účelem přechodného zlepšení výskytu středně hlubokých až hlubokých glabelárních vrásek nebo laterálních periorbitálních vrásek u pacientů mladších 18-ti let se nedoporučuje.
Způsob podání:
Při léčbě středně hlubokých až hlubokých glabelárních vrásek nebo laterálních periorbitálních vrásek se Dysport 500 Speywood jednotek ředí 2,5 ml 0,9% roztoku chloridu sodného pro injekce, čímž vznikne roztok přípravku Dysport obsahující 200 jednotek v 1 ml.
Přípravek Dysport se podává intramuskulární injekcí, jak je detailně popsáno výše.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Byly hlášeny nežádoucí účinky jako následek rozšíření účinku toxinu z místa podání do vzdálených míst (viz bod 4.8). Pacienti léčení léčebnými dávkami mohou udávat nadměrnou svalovou slabost. Riziko takových nežádoucích účinků může být potlačeno použitím nejnižší účinné dávky a nepřekročením doporučené dávky.
Přípravek Dysport by měl být užíván s opatrností a pod přísným dohledem u pacientů se subklinickými nebo klinickými známkami patrné poruchy neuromuskulárního přenosu (např. myasthenia gravis). Tito pacienti mohou mít na přípravky jako je Dysport zvýšenou citlivost, která může vést k nadměrné slabosti svalů.
Při léčbě spasticity u pediatrických pacientů s dětskou mozkovou obrnou má být přípravek Dysport použit pouze u dětí starších než 2 roky.
Doporučené dávkování a frekvence podání přípravku Dysport se nesmí překročit (viz bod 4.2).
Přípravek Dysport by měl být podán s opatrností u pacientů s existujícími polykacími nebo dechovými problémy, neboť tyto problémy se mohou zhoršit po rozšíření účinku toxinu do příslušných svalů. Aspirace se vyskytla v ojedinělých případech a je rizikem u léčených pacientů s chronickým respiračním onemocněním.
Velmi vzácné případy smrti, příležitostně v souvislosti s dysfagií, pneumopatií (včetně, ale nikoliv výlučně s dušností, respiračním selháním a respirační zástavou) a/nebo u pacientů s významnou asthenií byly hlášeny po léčbě botulotoxinem A nebo B.
Pacienti s poruchou mající za následek porušený nervosvalový přenos, s obtížemi polykacími a respiračními jsou více v riziku, že se u nich tyto účinky objeví. U těchto pacientů musí být léčba podána pod kontrolou specialisty a pouze jestliže prospěch z léčby převáží riziko.
Pacienti a jejich ošetřovatelé musí být upozorněni na nezbytnost okamžité lékařské péče v případě problémů s polykáním, řečí nebo s respiračními poruchami.
Přípravek Dysport se nesmí používat k léčbě spasticity u pacientů, u kterých se vyvinula fixní kontraktura.
Tvorba protilátek proti botulinovému toxinu byla zaznamenána u malého počtu pacientů léčených přípravkem Dysport. Klinicky mohou být neutralizující protilátky zjištěny značným snížením odpovědi na léčbu a/nebo potřebou trvalého užívání vyšších dávek.
Stejně jako u jakékoli intramuskulární injekce by měl být přípravek Dysport použit u pacientů s prodlouženou krvácivostí, s infekcí nebo se zánětem v navrhovaném místě injekce pouze, když je to zcela nezbytné.
Před aplikací přípravku Dysport za účelem korekce glabelárních vrásek je nezbytné prostudovat pacientovu anatomii obličeje. Je třeba vzít v úvahu asymetrii obličeje, ptózu, nadměrnou dermatochalasii, zjizvení a jakékoli změny anatomie v důsledku předchozích chirurgických zákroků.
Přípravek Dysport se má použít pouze k léčbě jediného pacienta. Veškerý nepoužitý zbytek přípravku by se měl zlikvidovat v souladu s bodem 6.6. Zvláštní opatrnosti je třeba při přípravě a podání přípravku; při inaktivaci a likvidaci veškerého nepoužitého naředěného roztoku (viz bod 6.6).
Tento přípravek obsahuje malé množství albuminu. Riziko přenosu virové infekce po použití lidské krve nebo přípravků z krve nemůže být vyloučeno s absolutní jistotou.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Účinek botulotoxinu může být zvýšen léky, které přímo nebo nepřímo interferují s neuromuskulární funkcí a takové léky by měly být používány s opatrností u pacientů léčených botulotoxinem.
4.6 Fertilita, těhotenství a kojení
Existují omezená data o použití komplexu klostridiový botulotoxin typ A-hemaglutinin u těhotných žen. Studie u zvířat nesignalizují přímé ani nepřímé škodlivé účinky co se týče těhotenství, embryonálního/fetálního vývoje, porodu nebo poporodního vývoje jiné než při vysokých dávkách způsobujících toxicitu u matek (viz bod 5.3).
Dysport 500 Speywood jednotek by měl být podán během těhotenství pouze tehdy, pokud prospěch léčby převáží nad jakýmkoli potenciálním rizikem pro plod. Z preventivních důvodů je vhodné vyvarovat se užití přípravku Dysport 500 Speywood jednotek během 1. trimestru těhotenství. Při podání těhotné ženě je třeba na možné riziko upozornit.
Není známo, zda je komplex klostridiový botulotoxin A-hemaglutinin vylučován do mateřského mléka. Exkrece komplexu klostridiového botulotoxinu A-hemaglutininu do mléka nebyla studována ani u zvířat. Použití komplexu botulotoxin A-hemaglutinin během laktace se nedoporučuje.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Existuje potenciální riziko svalové slabosti nebo poruch zraku, které, pokud se vyskytnou, mohou dočasně narušit schopnost řídit a obsluhovat stroje.
4.8 Nežádoucí účinky
Velmi časté (> 1/10), časté (>1/100 až <1/10), méně časté (>1/1 000 až <1/100), vzácné (>1/10 000 až <1/1 000), velmi vzácné (<1/10 000), není známo (z dostupných údajů nelze určit).
Obecně
U 25 % pacientů léčených přípravkem Dysport v programu klinických studií byl zaznamenán některý z nežádoucích účinků.
Následující nežádoucí účinky se objevily u léčených pacientů napříč indikacemi včetně blefarospasmu, hemifaciálního spasmu, torticollis, spasticity spojené s dětskou mozkovou obrnou nebo cévní mozkovou příhodou, axilární hyperhidrózy a středně hlubokých až hlubokých glabelárních vrásek a laterálních periorbitálních vrásek.
Poruchy nervového systému:
Vzácné: neuralgická amyotrofie
Poruchy kůže a podkožní tkáně:
Méně časté: svědění
Vzácné: kožní vyrážka
Celkové poruchy a reakce v místě aplikace:
Časté: astenie, únava, onemocnění podobné chřipce, bolest/modřina v místě injekce.
Navíc byly hlášeny následující nežádoucí účinky specifické pro individuální indikace:
Symptomatická léčba fokální spasticity postihující horní končetinu u dospělých:
Následující nežádoucí účinky byly pozorovány u dospělých pacientů léčených přípravkem Dysport z důvodu fokální spasticity postihující horní končetinu:
Celkové poruchy a reakce v místě aplikace:
Časté: reakce v místě injekce (např. bolest, erytém, otok), astenie, únava, onemocnění podobné chřipce
Poruchy svalové a kosterní soustavy a pojivové tkáně:
Časté: svalová slabost, svalová a kosterní bolest, bolest v končetinách
Poruchy nervového systému:
Hypertonie
Gastrointestinální poruchy: Méně časté: dysfagie*
* Četnost dysfagie byla odvozena ze souhrnných údajů z otevřených studií. Dysfagie nebyla pozorována v dvojitě zaslepené studii pro indikaci horní končetiny.
Dynamická deformita nohy ve smyslu pes equinus na podkladě spasticity u pediatrických pacientů s dětskou mozkovou obrnou od 2 let věku:
Následující nežádoucí účinky, obvykle mírné nebo střední intenzity, byly pozorovány u pacientů léčených přípravkem Dysport pro dětskou spasticitu nohou v důsledku dětské mozkové obrny.
Poruchy svalové a kosterní soustavy a pojivové tkáně:
Časté: myalgie, svalová slabost
Poruchy ledvin a močových cest:
Časté: močová inkontinence
Celkové poruchy a reakce v místě aplikace:
Časté: onemocnění podobné chřipce, reakce v místě injekce (např. bolest, erytém, modřina atd.), porucha chůze, únava
Méně časté: astenie
Poranění, otravy a procedurální komplikace:
Časté: pád
Spastická torticollis:
Následující nežádoucí účinky, obvykle mírné nebo střední intenzity, byly pozorovány u pacientů léčených přípravkem Dysport pro spastickou torticollis:
Poruchy nervového systému:
Časté: bolest hlavy, závrať, paréza obličeje
Poruchy oka:
Časté: rozmazané vidění, snížená zraková ostrost
Méně časté: diplopie, ptóza
Respirační, hrudní a mediastinálníporuchy:
Časté: dysfonie, dušnost
Vzácné: aspirace
Gastrointestinální poruchy:
Velmi časté: dysfagie, sucho v ústech
Méně časté: nauzea
Poruchy svalové a kosterní soustavy a pojivové tkáně:
Velmi časté: svalová slabost
Časté: bolest krku, muskuloskeletální bolest, myalgie, bolest v končetinách, muskuloskeletální ztuhlost
Méně časté: svalová atrofie, porucha čelisti
Dysfagie se jevila závislá na dávce a objevila se nejčastěji po injekci do m. sternocleidomastoideus. Měkká strava je třeba do odeznění příznaků.
Blefarospasmus a hemifaciální spasmus:
Následující nežádoucí účinky, obvykle mírné nebo střední intenzity, byly pozorovány u pacientů léčených přípravkem Dysport pro blefarospasmus a hemifaciální spasmus:
Poruchy nervového systému:
Časté: paréza obličeje
Méně časté: paréza n. facialis
Poruchy oka:
Velmi časté: ptóza
Časté: diplopie, syndrom suchého oka, nadměrné slzení
Vzácné: oftalmoplegie
Poruchy kůže a podkožní tkáně:
Časté: edém očního víčka
Vzácné: entropie
Nežádoucí účinky se mohou objevit v důsledku hluboké nebo chybně umístěné injekce přípravku Dysport dočasně paralyzující jiné sousední svalové skupiny.
Axilární hyperhidróza:
Následující nežádoucí účinky byly pozorovány u pacientů léčených přípravkem Dysport pro hyperhidrózu:
Poruchy nervového systému:
Méně časté: závrať, bolest hlavy, parestezie, mimovolné záškuby očního víčka
Cévní poruchy:
Méně časté: zrudnutí
Respirační, hrudní a mediastinálníporuchy:
Časté: dyspnoe
Méně časté: epistaxe
Poruchy kůže a podkožní tkáně:
Časté: kompenzační pocení
Poruchy svalové a kosterní soustavy a pojivové tkáně:
Časté: bolest ramene, bolest horní části paže a krku, myalgie ramene a lýtka
Středně hluboké až hluboké glabelární vrásky:
Následující nežádoucí účinky byly pozorovány u pacientů léčených přípravkem Dysport za účelem přechodného zlepšení vzhledu středně hlubokých až hlubokých glabelárních vrásek.
Poruchy oka:
Časté: astenopie, ptóza očního víčka, edém očního víčka, nadměrné slzení, suché oči, svalové záškuby
Méně časté: rozmazané vidění, diplopie, zhoršení vidění, poruchy oční hybnosti
Celkové poruchy a reakce v místě aplikace:
Velmi časté: reakce v místě injekce (včetně bolesti, modřiny, svědění, parestezie, erytému, vyrážky). Pozn.: tyto reakce byly také často pozorovány ve skupině s placebem.
Strana 12 (celkem 21)
Poruchy imunitního systému:
Méně časté: hypersenzitivita
Poruchy pohybového systému a pojivové tkáně:
Časté: slabost svalu/ů v blízkosti injekce.
Poruchy nervového systému:
Velmi časté: bolest hlavy
Časté: paréza obličeje
Poruchy kůže a podkoží:
Méně časté: kožní vyrážka, svědění.
Středně hluboké až hluboké laterální periorbitální vrásky
Poruchy nervového systému
Časté: bolest hlavy, přechodná paréza obličeje (přechodná paréza obličejových svalů v blízkosti míst injekce)
Poruchy oka
Časté: edém očního víčka, ptóza očního víčka
Méně časté: suché oko
Celkové poruchy a reakce v místě aplikace
Časté: reakce v místě injekce (např. hematom, svědění, edém)
Post-marketingová zkušenost
Profil nežádoucích účinků hlášených společnosti během post-marketingového užívání odráží farmakologii přípravku a odpovídá nežádoucím účinkům během klinických studií. Po uvedení přípravku na trh byly hlášeny případy hypersenzitivity.
Velmi vzácně byly hlášeny nežádoucí účinky z rozšíření účinku toxinu z místa injekce do vzdálených míst (nadměrná svalová slabost, dysfagie, aspirační pneumonie, jež může být fatální) (viz bod 4.4).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím Státního ústavu pro kontrolu léčiv, Šrobárova 48, 100 41 Praha 10, internetové stránky:
4.9 Předávkování
Excesívní dávky mohou způsobit vzdálenou a hlubokou nervosvalovou paralýzu. Předávkování může vést ke zvýšenému riziku vstupu neurotoxinu do krevního oběhu a může způsobit komplikace spojené s účinkem perorální otravy botulotoxinem (např. poruchy polykání a dysfonie). Pokud způsobí excesívní dávky paralýzu respiračních svalů, může být zapotřebí respirační podpora. Neexistuje žádné specifické antidotum, nelze očekávat úspěšnost antitoxinu a doporučuje se celková podpůrná péče.
Příznaky předávkování se nemusí objevit bezprostředně po injekci. V případě náhodné injekce nebo orálního příjmu by měl být pacient lékařsky sledován až po dobu několika týdnů na známky a/nebo příznaky nadměrné svalové slabosti nebo svalové paralýzy.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Jiná periferně působící myorelaxancia
Clostridium botulinum typ A toxin – haemaglutinin komplex blokuje periferní cholinergní přenos na neuromuskulárním spojení blokádou uvolňování acetylcholinu na presynaptické membráně. Toxin účinkuje na nervovém zakončení, kde antagonizuje ty pochody, jež jsou spouštěny Ca2+ a vrcholí uvolněním transmiteru. Nepůsobí na postganglionární cholinergní přenos nebo postganglionární sympatický přenos.
Účinek toxinu zahrnuje iniciální krok navázání, čímž se toxin rychle a dychtivě připojí na presynaptickou nervovou membránu. Druhotně nastává krok internalizace, v němž toxin prochází presynaptickou membránu, aniž působí počátek paralýzy. Nakonec toxin inhibuje uvolnění acetylcholinu přerušením Ca2+ zprostředkovaného mechanismu uvolnění acetylcholinu, čímž zmenšuje potenciál plotének a působí paralýzu.
Obnova přenosu vzruchu se objevuje postupně, tak jak pučí nová nervová zakončení a tvoří se kontakt s postsynaptickou motorickou ploténkou. Tento proces trvá u experimentálních zvířat 6–8 týdnů.
Během klinického vývoje přípravku Dysport k léčbě středně hlubokých až hlubokých glabelárních vrásek vrásek a laterálních periorbitálních vrásek bylo do různých klinických studií zahrnuto více než 4500 pacientů a přibližně 3800 pacientů bylo exponováno přípravku Dysport.
Středně hluboké až hluboké glabelární vrásky:
-
V klinických studiích bylo 2032 pacientů s indikací středně hluboké až hluboké glabelární vrásky léčeno doporučenou dávkou 50 Speywood jednotek. Z toho 305 pacientů bylo léčeno 50 Speywood jednotkami v rámci dvou pivotních, dvojitě slepých, placebem kontrolovaných studiích fáze III, 1200 pacientů bylo léčeno 50 Speywood jednotkami v rámci dlouhodobé otevřené studie fáze III s opakovanou dávkou. Zbývající pacienti byli léčeni v rámci podpůrných a dose-ranging studií.
Střední doba nástupu účinku byla 2 až 3 dny po aplikaci, maximální účinek byl pozorován 30. den po aplikaci. V obou pivotních placebem kontrolovaných studiích fáze III přípravek Dysport výrazně snížil závažnost glabelárních vrásek po dobu až 4 měsíců. V jedné z pivotních studií byl účinek stále významný i po 5 měsících.
Hodnocení investigátorů 30 dní po aplikaci potvrdilo, že 90 % (273 z 305) pacientů reagovalo na léčbu (vykázali žádné nebo mírné glabelární vrásky při maximálním zamračení) ve srovnání s 3 % pacientů (4 ze 153) léčených placebem. Pět měsíců po aplikaci 17 % (32 ze 190) pacientů léčených přípravkem Dysport stále odpovídalo na léčbu ve srovnání s 1% (1 z 92) pacientů léčených
Strana 14 (celkem 21)
v příslušné studii placebem. Vlastní hodnocení pacientem, které bylo provedeno 30 dní po aplikaci při maximálním zamračení, ukázalo odpověď u 82 % (251 z 305) pacientů léčených přípravkem Dysport a u 6 % (9 ze 153) pacientů léčených placebem. Dle hodnocení zkoušejících byl podíl pacientů s dvoustupňovým zlepšením při maximálním zamračení 77 % (79 ze 103) v jedné z pivotních studií fáze III, kde bylo toto posuzováno.
Podskupina 177 pacientů měla před zahájením léčby středně hluboké až hluboké glabelární vrásky viditelné v klidu. Hodnocení této podskupiny investigátory 30 dní po léčbě ukázalo, že 71 % (125 ze 177) pacientů ze skupiny léčené přípravkem Dysport odpovídalo na léčbu ve srovnání s 10 % (8 z 87) pacientů léčených placebem.
Dlouhodobá otevřená studie s opakovanou aplikací dávky ukázala, že střední doba nástupu účinku 3 dny je zachována i při opakovaném podání dávky. Podíl odpovědi při maximálním zamračení určený investigátorem v den 30 se zachoval během opakovaných cyklů (dosahoval 80 % až 91 % během 5 cyklů). Odpověď v klidu během cyklů s opakovanou dávkou byla konzistentní ve srovnání se studiemi s jednou dávkou, dle investigátorů reagovalo na léčbu 30 dní po aplikaci 56 – 74 % pacientů.
Žádný z klinických cílů nezahrnoval objektivní hodnocení psychologického dopadu.
Laterální periorbitální vrásky:
-
V klinických dvojitě zaslepených studiích bylo 308 pacientů se středně hlubokými nebo hlubokými laterálními periorbitálními vráskami viditelnými při maximálním úsměvu léčeno doporučenou dávkou 30 Speywood jednotek na každou stranu. Z toho 252 bylo léčeno v dvojitě zaslepené, placebem kontrolované studii fáze III, a 56 pacientů bylo léčeno v dvojitě zaslepené studii fáze II zkoumající dávku.
-
7,2 % (6/83).
-
V analýze po skončení studie ve stejném čase, 4 týdny po injekci, 75 % (189/252) pacientů léčených přípravkem Dysport zaznamenalo při maximálním úsměvu zlepšení nejméně o 1 stupeň, v porovnání s pouhými 19 % (16/83) pacientů léčených placebem.
Celkem 315 subjektů bylo zařazeno do otevřené extenze studie fáze III, ve které mohly být léčeny současně laterální periorbitální vrásky i glabelární linie.
Pacienti léčení přípravkem Dysport v dvojitě zaslepené a v otevřené studii fáze III dostali medián 3 dávek k léčbě laterálních periorbitálních vrásek. Střední interval mezi injekcemi v případě laterálních periorbitálních vrásek byl převážně stanoven designem protokolu a pohyboval se v rozmezí 85 – 108 dní. Výsledky ukázaly, že účinek přetrvával při opakované léčbě po dobu jednoho roku.
Úroveň spokojenosti pacientů v týdnech 4, 16 a 52 ukazuje, že po první léčbě přípravkem Dysport bylo 165/252 subjektů (65,5 %) velmi spokojeno nebo spokojeno se vzhledem svých laterálních periorbitálních vrásek.
V týdnu 16, 4 týdny po druhé léčbě přípravkem Dysport u pacientů randomizovaných k této léčbě nebo po první léčbě u pacientů randomizovaných k léčbě placebem byl podíl subjektů velmi spokojených a spokojených 233/262 (89,0 %). V 52. týdnu, kdy subjekty absolvovaly až 5 cyklů léčby přípravkem Dysport, z nichž poslední byl ve 48. týdnu, byl podíl subjektů velmi spokojených a spokojených 255/288 (84,7 %).
Žádný pacient nevykazoval pozitivní testy na toxin-neutralizující protilátky po opakované léčbě přípravkem Dysport v průběhu jednoho roku.
Symptomatická léčba fokální spasticity postihující horní končetinu u dospělých:
Účinnost a bezpečnost přípravku Dysport v rámci léčby spasticity horní končetiny byla vyhodnocena v randomizované, multicentrické, dvojitě zaslepené, placebem kontrolované studii, která zahrnovala 238 pacientů (159 léčeno přípravkem Dysport, 79 na placebu) se spasticitou horní končetiny, kteří byli nejméně 6 měsíců po cévní mozkové příhodě nebo po post-traumatickém postižení mozku.
Primárním cílovým parametrem účinnosti byla změna svalového tonu v týdnu 4 ve srovnání se stavem před léčbou u primárně plánované skupiny svalů (PTMG), zahrnující zevní flexory prstů (m. flexor digitorum profundus a m. flexor digitorum superficialis), nebo flexory zápěstí (m. flexor carpi radialis a m. carpi ulnaris), nebo flexory lokte (m. brachialis a případně ještě m. brachioradialis), měřeno modifikovanou Ashworthovou škálou (MAS). Sekundárním cílovým parametrem účinnosti bylo vyhodnocení odpovědi na léčbu v týdnu 4 ve srovnání s placebem na základě Physician's Global Assessment (PGA). Hlavní výsledky dosažené v týdnu 4 a 12 jsou uvedeny níže:
| Týden 4 | Týden 12 | |||||
| Placebo (N=79) | Dysport (500 jednotek) (N=80) | Dysport (1000 jednotek) (N=79) | Placebo (N=79) | Dysport (500 jednotek) (N=80) | Dysport (1000 jednotek) (N=79) | |
| Průměrná změna od výchozí hodnoty svalového tonu v PTMG na MAS získaná metodou nejmenších čtverců | –0,3 | –1,2 | –1,4 | –0,1 n=75 | –0,7 n=76 | –0,8 n=76 |
| Průměrná změna PGA odpovědi na léčbu získaná metodou nejmenších čtverců | 0,7 | 1,4* | 1,8 | 0,4 n=75 | 0,5 n=76 | 1,0* n=76 |
| Průměrná změna od základních hodnot svalového tonu ve flexorech zápěstí na MAS získaná metodou nejmenších čtverců | –0,3 n=54 | –1,4 n=57 | –1,6 n=58 | –0,3 n=52 | –0,7* n=54 | –0,9* n=56 |
| Průměrná změna od základních hodnot svalového tonu v zevních flexorech prstů na MAS získaná metodou nejmenších čtverců | –0,3 n=70 | –0,9* n=66 | –1,2 n=73 | –0,1 n=67 | –0,4* n=62 | –0,6* n=70 |
| Průměrná změna od základních hodnot svalového tonu ve flexorech lokte na MAS získaná metodou nejmenších čtverců | –0,3 n=56 | –1,0* n=61 | –1,2** n=48 | –0,3 n=53 | –0,7* n=58 | –0,8* n=46 |
| Průměrná změna základních hodnot svalového tonu v extensorech ramene na MAS (1) | –0,4 n=12 | –0,6 n=7 | –0,7 n=6 | 0,0 n=12 | –0,9 n=7 | 0,0 n=6 |
| *p<0,05; ** p<0,0001; (1) Nebyly provedeny žádné statistické testy z důvodu nízkého počtu léčených pacientů. | ||||||
Za účelem zhodnocení účinku léčby na funkční postižení sloužil Disability Assessment Scale (DAS). Výsledky DAS respondérů pro hlavní cíl léčby (ITT populace) jsou uvedeny níže:
| Léčená skupina | Týden 4 % Respondéři | Týden12 % Respondéři |
| Dysport 500U | 50,0 | 41,3 |
| n=80 | n=76 | |
| p = 0,13 | p = 0,11 | |
| Dysport 1000U | 62,0 | 55,7 |
| n=78 | n=76 | |
| p = 0,0018 | p = 0,0004 | |
| Placebo | 39,2 n=79 | 32,9 n=75 |
*Oblasti zahrnuty v DAS jsou hygiena, pozice končetiny, oblékání a bolest.
Jak 500 Speywood jednotek tak 1000 jednotek mělo za následek signifikantní zlepšení v úhlu spasticity a stupni spasticity, jak bylo hodnoceno dle Tardieu Scale v týdnu 4 u všech svalových skupin (prst, zápěstí a ohýbače lokte) při srovnání s placebem. Snížení stupně spasticity při dávce 1000 Speywood jednotek bylo signifikantní také v týdnu 12 u všech svalových skupin při srovnání s placebem.
Dysport 1000 Speywood jednotek statisticky zlepšil v týdnu 4 aktivní rozsah pohybu (AROM) klinicky významným rozdílem v lokti (+18,3 stupně), zápěstí (+35,2 stupně) a prstových svalech (+11,8 stupně), zatímco u skupiny s placebem nedošlo k žádnému zlepšení. Dysport 500 Speywood jednotek prokázal podobný přínos na AROM pouze u svalů na prstech.
Zlepšení ve snadném použití dlahy danou osobou bylo statisticky signifikantně větší u skupin léčených Dysportem 1000 Speywood jednotek a 500 Speywood jednotek než u skupin s placebem v týdnu 4 a 12.
V následné otevřené prodloužené studii byla opakovaná léčba podávána na základě klinické potřeby po minimálně 12 týdnech. Dávky vyšší než 1000 U a až do 1500 U byly povoleny pouze v případě, že se injekce podávala i do svalů ramene. Po opakovaném podání se účinnost přípravku Dysport při injekčním podání do svalů horní končetiny udržuje po dobu až 1 roku při hodnocení pomocí MAS (jak dokládá podíl respondérů v rozmezí od 75% do 80% v otevřené studii ve srovnání s 75% ve studii kontrolované placebem) a PGA. Účinnost přípravku Dysport na pasivní funkce (dle Disability Assessment Scale), spasticitu (dle Tardieu Scale), AROM a snadné použití dlahy byla také zachována nebo zlepšena.
Dynamická deformita nohy ve smyslu pes equinus na podkladě spasticity u pediatrických pacientů s dětskou mozkovou obrnou od 2 let věku
Dvojitě zaslepená, placebem kontrolovaná multicentrická studie (Study Y-55–52120–141) byla provedena u dětí s dynamickou deformitou nohy ve smyslu pes equinus na podkladě spasticity u dětí s dětskou mozkovou obrnou. Celkem 235 pacientů dosud neléčených i dříve léčených botulotoxinem se stupněm 2 nebo vyšším modifikované Ashworthovy škály (MAS), bylo zařazeno k léčbě přípravkem Dysport 10 jednotek/kg/nohu, 15 jednotek/kg nohu nebo placebem. 41 % pacientů bylo léčeno bilaterálně s celkovou dávkou přípravku Dysport 20 jednotek/kg nebo 30 jednotek/kg. Primární proměnnou účinnosti byla průměrná změna od výchozí hodnoty MAS plantárních flexorů kotníku ve 4. týdnu. Sekundární proměnnou účinnosti byla průměrná změna na základě Physicians Global Assessment (PGA) a průměrná změna skóre podle škály dosažení cíle (Goal Attainment Scale, GAS) ve 4. týdnu. Pacienti byli sledováni po dobu alespoň 12 týdnů po léčbě a až maximálně 28 týdnů. Po dokončení této studie bylo pacientům nabídnuto, aby vstoupili do jejího otevřeného prodloužení (Study Y-55–52120–147).
| Parametr | Placebo (N=77) | DYSPORT | |
| 10 U/kg/nohu (N=79) | 15 U/kg/nohu (N=79) | ||
| Průměrná změna od výchozí hodnoty MAS plantárních flexorů kotníku získaná metodou nejmenších čtverců 4. týden 12. týden | –0,5 –0,5 | -0 9 ** –0,8 | -1 0 *** -1 0 *** |
| Průměrná změna PGA odpovědi na léčbu [b] získaná metodou nejmenších čtverců 4. týden 12. týden | 0,7 0,4 | 1 5 *** 0,8 * | 1 5 *** 1,0 ** |
| Průměrná změna skóre GAS [a] získaná metodou nejmenších čtverců 4. týden 12. týden | 46,2 45,9 |
| 50,9 ** 50,5 * |
| p< 0,05; **p< 0,003; *** p< 0,0006 v porovnání s placebem [a] GAS škála hodnotí pokroky směrem k dosažení cílů, které byly vybrány ze seznamu 12 kategorií při vstupu do studie. 5 nejčastěji zvolených cílů tvořilo zlepšení způsobu chůze (70,2 %), zlepšení rovnováhy (32,3 %), snížení frekvence pádů (31,1 %), snížení frekvence klopýtnutí (19,6 %) a zlepšení výdrže (17,0 %) | |||
Bylo pozorováno zlepšení spasticity plantárních flexorů kotníku při vyhodnocení podle Tardieu škály. V porovnání s placebem došlo ke statisticky významnému zlepšení stupně spasticity (Y) v obou skupinách léčených přípravkem Dysport, s dávkou 10 U/kg/nohu i 15 U/kg/nohu, ve 4. a 12. týdnu a změna úhlu zarážky (Xv3) byla významná ve skupině léčené přípravkem Dysport s dávkou 10 U/kg/nohu ve 12. týdnu a při dávce 15 U/kg/nohu ve 4. a 12. týdnu.
U obou skupin léčených přípravkem Dysport s dávkou 10 U/kg/nohu i 15 U/kg/nohu, bylo prokázáno významné zlepšení celkového skóre observační škály chůze (Observational Gait Scale, OGS) od výchozí hodnoty ve 4 týdnu v porovnání s placebem a statisticky významně vyšší podíl pacientů odpovídal na léčbu v parametru počátečního kontaktu nohy s podložkou při chůzi (initial foot contact) v rámci OGS ve 4. a 12. týdnu.
Rodiče vyplnili modul Paediatric Quality of Life Inventory specifický pro DMO. Ve skupinách léčených přípravkem Dysport s dávkou 10 U/kg/nohu and 15 U/kg/nohu došlo ve 12. týdnu ke Strana 18 (celkem 21)
statisticky významnému zlepšení výchozí hodnoty únavy v porovnání s placebem. V ostatních dílčích hodnoceních nebyla pozorována žádná další statisticky významná zlepšení.
Po dokončení studie 216 pacientů vstoupilo do otevřeného prodloužení studie (Y-55–52120–147), ve kterém mohli dostávat opakovanou léčbu podle klinické potřeby. Injekce mohly být aplikovány do distálních (gastrocnemius, soleus a tibialis posterior) i proximálních (svaly zadní strany stehna a adduktory kyčle) svalů, včetně možnosti víceúrovňové injekce. Účinek byl pozorován v průběhu opakovaných sezení po dobu až 1 roku a byl hodnocen podle MAS, PGA a GAS.
5.2 Farmakokinetické vlastnosti
Farmakokinetické studie s botulinovým toxinem činí u zvířat problémy z důvodu velké síly, použité nepatrné dávky, velké molekulární hmotnosti sloučeniny a obtíží s označením toxinu k dosažení dostatečně vysoké specifické aktivity. Studie užívající toxin značený I125 ukázaly, že navázání na receptor je specifické a nasytitelné, a že vysoká hustota receptorů pro toxin je faktor přispívající k vysoké síle. Odezva na dávku a dobu u opic ukázala, že u nízkých dávek bylo opoždění 2–3 dny s maximálním účinkem pozorovaným 5–6 dní po injekci. Trvání působení, měřeného změnami vyrovnání očí a svalové paralýzy, kolísalo mezi 2 týdny a 8 měsíci. Tento charakter je pozorován také u lidí a je přisuzován procesu navázání, internalizace a změn na neuromuskulárním spojení.
5.3 Předklinické údaje vztahující se k bezpečnosti
Ve studiích chronické toxicity provedených u potkanů až do 12 U/zvíře nebyly žádné náznaky systémové toxicity. Studie reprodukční toxicity u těhotných potkanů a králíků, kterým byl podán komplex botulotoxin A-hemaglutinin denní intramuskulární injekcí v dávkách 79 U/kg u potkanů a 42 U/kg u králíků neukázaly embryonální/fetální toxicitu.
Bylo pozorováno několik případů maternální toxicity spojené se ztrátou implantace při vysokých dávkách u obou druhů zvířat. Komplex botulotoxin A-hemaglutinin nevykázal žádnou teratogenní aktivitu ani u potkanů ani u králíků a nebyly pozorovány ani účinky na F1 generaci u potkanů. Fertilita samců a samic byla snížena v důsledku sníženého páření v důsledku svalové paralýzy při vysokých dávkách.
Ve studii juvenilní toxicity byli potkani po podávání každý týden od odstavení 21. den postnatálně až do 13 týdnů věku, což je srovnatelné s dětmi od 2 let do rané dospělosti (11 ošetření v průběhu 10 týdnů, až do celkové dávky asi 33 U/kg) nevykazovali nežádoucí účinky na postnatální růst (včetně kosterních hodnocení), reprodukční, neurologický a neurobehaviorální vývoj.
Účinky u reprodukčních studií a neklinických studií chronické a juvenilní toxicity byly omezeny na změny injikovaných svalů souvisejících s mechanismem účinku komplexu botulotoxin A-hemaglutinin.
Po podání komplexu botulotoxin A-hemaglutinin do oka králíků nedošlo k žádnému podráždění očí.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Lidský albumin, monohydrát laktosy.
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, proto tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky.
6.3 Doba použitelnosti
V originálním balení: 2 roky.
Po naředění:
Chemická a fyzikální stabilita roztoku po otevření před použitím byla prokázána po dobu 24 hodin při 2 °C – 8 °C.
Z mikrobiologického hlediska má být přípravek použit okamžitě. Není-li použit okamžitě, doba a podmínky uchování přípravku po otevření před použitím jsou v odpovědnosti uživatele a normálně by doba neměla být delší než 24 hodin při 2 °C až 8 °C, pokud rekonstituce/ředění (atd.) neproběhlo za kontrolovaných a validovaných aseptických podmínek.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 oC – 8 oC). Chraňte před mrazem.
Dysport 500 Speywood jednotek musí být uchováván v chladničce na pracovišti, kde se aplikují injekce, a neměl by být dán pacientovi k uschování doma.
Naředěný Dysport 500 Speywood jednotek může být uchováván v chladničce při teplotě 2 oC – 8 oC až 24 hodin před použitím za aseptických a kontrolovaných podmínek.
6.5 Druh obalu a obsah balení
Skleněná injekční lahvička, hliníkový uzávěr s odtrhovacím plastovým kroužkem, krabička.
Obsah balení: 1 nebo 2 injekční lahvičky po 500 jednotkách.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Rekonstituce musí být provedena v souladu s pravidly správné praxe, zvláště se zřetelem na asepsi.
Dysport 500 Speywood jednotek musí být rekonstituován roztokem chloridu sodného pro injekci o koncentraci 9 mg/ml (0,9%) (viz bod 4.2), což poskytne čirý roztok s obsahem 500 Speywood jednotek léčivé látky.
Bezprostředně po léčbě pacienta by měl být jakýkoli zbytek přípravku Dysport 500 Speywood jednotek (v injekční lahvičce nebo injekční stříkačce) inaktivován ředěným roztokem chlornanu (1 % volného chloru).
Rozlitý Dysport 500 Speywood jednotek má být utřen savým hadříkem namočeným v ředěném roztoku chlornanu.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Ipsen Pharma
65 quai Georges Gorse
92100 Boulogne-Billancourt
Francie
8. REGISTRAČNÍ ČÍSLO
63/060/91-S/C
9. DATUM PRVNÍ REGISTRACE / PRODLOUŽENÍ REGISTRACE
Datum první registrace: 3.10.1991
Datum posledního prodloužení registrace: 9.7.2014
Další informace o léčivu DYSPORT
Jak
se DYSPORT
podává: subkutánní/intramuskulární podání - prášek pro injekční roztok
Výdej
léku: na lékařský předpis
Balení: Injekční lahvička
Velikost
balení: 1
Držitel rozhodnutí o registraci daného léku v České republice:
Ipsen Pharma, Boulogne-Billancourt
E-mail: info@ipsen.cz
