Souhrnné informace o léku - DEPO-PROVERA
1. NÁZEV PŘÍPRAVKU
DEPO-PROVERA
Injekční suspenze
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Léčivá látka: Medroxyprogesteroni acetas 150 mg/ml.
Pomocné látky: propylparaben, methylparaben
Úplný seznam pomocných látek viz bod 6.1
3. LÉKOVÁ FORMA
Injekční suspenze.
Popis přípravku: bílá suspenze.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
-
A. Antikoncepce (potlačení ovulace).
-
B. Endometrióza.
-
C. Adjuvantní nebo paliativní léčba recidivujícího nebo metastazujícího karcinomu endometria nebo ledvin.
-
D. Léčba hormon-dependentního recidivujícího karcinomu prsu.
-
E. Léčba vazomotorických potíží v menopauze.
Protože ztráta kostní hmoty (BMD) se může objevit u žen různých věkových skupin, které dlouhodobě užívají injekce MPA (medroxyprogesteron-acetát) (viz bod 4.4), měl by být zvážen poměr rizika a přínosu a rovněž brán v úvahu úbytek kostní hmoty (BMD) objevující se během těhotenství a/nebo kojení.
Použití u dospívajících (12–18 let)
Vzhledem k tomu, že dlouhodobý účinek ztráty kostní hmoty spojený s podáváním přípravku DEPO-PROVERA během kritického období pro růst kostní hmoty není znám, je použití přípravku DEPO-PROVERA u dospívajících indikováno pouze tehdy, když byly ostatní antikoncepční metody shledány jako nevhodné nebo nepřijatelné (viz bod 4.4).
4.2 Dávkování a způsob podávání
Pediatrická populace
Přípravek DEPO-PROVERA není indikovaný před menarché (viz bod 4.1). Až na obavy týkající se ztráty kostní hmoty se očekává, že bezpečnost a účinnost přípravku DEPO-PROVERA jsou u dospívajících dívek po menarché a u dospělých žen stejné.
Injekční stříkačka přípravku DEPO-PROVERA by měla být těsně před použitím důkladně protřepána, aby bylo zajištěno, že podávaná dávka bude homogenní suspenzí. Léčba by měla být zahájena lékařem nebo zdravotnickým pracovníkem.
-
A. Antikoncepce (potlačení ovulace): Doporučená dávka je 150 mg přípravku DEPO-PROVERA v hluboké intramuskulární injekci každé tři měsíce.
První injekce: pro zajištění antikoncepce během prvního cyklu použití by měla být podána první dávka během prvních pěti dnů normálního menstruačního cyklu. Je-li injekce podána podle těchto instrukcí, není vyžadována žádná další metoda antikoncepce.
Další dávky: Druhá a další injekce by měly být podávány v intervalu 13 týdnů. Pokud je z jakéhokoli důvodu interval od předchozí injekce delší než 13 týdnů, mělo by být před podáním další injekce vyloučeno těhotenství. Účinnost přípravku závisí na dodržení doporučeného dávkovacího schématu.
Po porodu: Pokud žena nekojí, doporučuje se podat injekci během prvních pěti dnů po porodu (pro větší jistotu že pacientka není gravidní). Pokud je nutné podat injekci v jinou dobu, je nutné vyloučit těhotenství.
Kojí-li pacientka, doporučuje se injekci podat ne dříve než 6 týdnů po porodu, kdy je enzymový systém novorozence již rozvinutější (viz bod 4.6).
Přechod z jiné metody antikoncepce: Při přechodu z jiné metody antikoncepce by měl být přípravek DEPO-PROVERA podáván způsobem, který zajistí průběžnou antikoncepční ochranu na základě mechanismu účinku obou metod (např. pacientky, které přecházejí z perorální antikoncepce, by měly dostat první injekci přípravku DEPO-PROVERA během sedmi dnů poté, co užily poslední antikoncepční tabletku).
-
B. Endometrióza: Doporučená dávka přípravku DEPO-PROVERA v této indikaci je 50 mg týdně nebo 100 mg každé dva týdny intramuskulárně po dobu nejméně 6 měsíců.
-
C. Karcinom endometria a ledvin: Jako počáteční léčba se doporučuje intramuskulámě podávat jednou týdně dávky 400 až 1000 mg přípravku DEPO-PROVERA. Pokud během několika týdnů nebo měsíců dojde ke zlepšení a stabilizaci onemocnění, může jako udržovací terapie postačit pouze dávka 400 mg za měsíc.
-
D. Karcinom prsu: Doporučené dávkovací schéma je 500 mg přípravku DEPO-PROVERA denně intramuskulárně po dobu 28 dnů. Poté by pacientka měla být převedena na udržovací terapii, s dávkami 500 mg 2× týdně tak dlouho, dokud je přítomna odpověď na léčbu.
-
E. Potíže v menopauze: Doporučená dávka je 150 mg přípravku DEPO-PROVERA intramuskulámě každé tři měsíce.
Hepatální insuficience: Vliv jaterního onemocnění na farmakokinetiku přípravku DEPO-PROVERA není znám. Jelikož je přípravek DEPO-PROVERA téměř výlučně eliminován v játrech, může být nedostatečně metabolizován u pacientek se závažnou jaterní nedostatečností (viz bod 4.3).
Renální insuficience: Vliv onemocnění ledvin na farmakokinetiku přípravku DEPO-PROVERA není znám. Jelikož je přípravek DEPO-PROVERA téměř výlučně eliminován v játrech, není úprava dávkování považována u žen s renální insuficiencí za nutnou.
4.3 Kontraindikace
Přípravek DEPO-PROVERA je kontraindikovaný u pacientek:
- se známou hypersenzitivitou na léčivou látku, na steroidy nebo kteroukoli pomocnou látku uvedenou v bodě 6.1
- se závažnou jaterní nedostatečností
- těhotných nebo při podezření na těhotenství
- při vaginálním krvácení z nejasných příčin.
Kontraindikace u pacientek, kterým byl přípravek DEPO-PROVERA předepsán jako antikoncepce nebo při gynekologických obtížích: přípravek DEPO-PROVERA je kontraindikovaný při malignitě v oblasti prsu a pohlavních orgánů, nebo při podezření na ni.
4.4 Zvláštní upozornění a opatření pro použití
Neočekávané krvácení, které se vyskytne během léčby MPA, musí být vyšetřeno.
Riziko vzniku nádoru
Dlouhodobé sledování pacientek, kterým byly podány injekce intramuskulárního medroxyprogesteron-acetátu (DMPA) 150 mg, zjistilo mírné nebo žádné zvýšení celkového rizika nádorů prsu a žádné zvýšení rizika ovariálních, jaterních nebo cervikálních nádorů, dále trvající ochranný účinek snižující riziko karcinomu endometria.
Před použitím přípravku DEPO-PROVERA by měla být pacientka pečlivě vyšetřena. Vyšetření před nasazením léčby by mělo vyloučit přítomnost novotvaru v oblasti genitálu nebo prsů. Toto upozornění se nevztahuje na pacientky, které budou dostávat přípravek DEPO-PROVERA v terapii karcinomu endometria, prsu nebo ledvin.
Výsledky některých epidemiologických studií naznačují, že existuje malý rozdíl v riziku diagnózy karcinomu prsu u žen, které užívají nebo užívaly hormonální antikoncepci, v porovnání s těmi, které ji nikdy neužívaly. Riziko u současných a nedávných uživatelek DMPA je malé, s ohledem na celkové riziko karcinomu prsu, zvláště u mladých žen (viz níže), a po 10 letech od posledního užití není patrné. Délka užívání se nezdá být významná.
| Věk při poslední injekci MPA | Počet případů na 10,000 žen, které nikdy MPA neužívaly | Předpokládaný počet dalších případů na 10,000 uživatelek MPA |
| 20 | Méně než 1 | Výrazně méně než 1 |
| 30 | 44 | 2–3 |
| 40 | 160 | 10 |
+při užívání po dobu 5 let
Tromboembolické poruchy
Ačkoli medroxyprogesteron-acetát nemá zřejmě příčinnou souvislost s indukcí trombotické nebo tromboembolické poruchy, neměl by být u žádné pacientky užívající přípravek DEPO-PROVERA, u které se vyskytne tato příhoda, např. plicní embolie, cévní mozková příhoda, retinální trombóza nebo hluboká žilní trombóza, tento přípravek znovu podáván. Ženy s předchozí anamnézou tromboembolické poruchy nebyly sledovány v klinických hodnoceních a žádné informace, které by dokládaly bezpečnost podání přípravku DEPO-PROVERA této populaci nejsou dostupné.
Anafylaxe a anafylaktická reakce
Pokud se objeví anafylaktická reakce, měla by být ihned zahájena příslušná léčba. Závažné anafylaktické reakce vyžadují okamžitou léčbu.
Vzhledem k tomu, že přípravek obsahuje methylparaben a propylparaben, může vyvolat alergické reakce (i opožděné). V případě výskytu alergické reakce nesmí být přípravek již znovu podán (viz bod 4.3).
Změny tělesné hmotnosti a retence tekutin
DEPO-PROVERA může způsobit, zvláště ve vysokých dávkách, používaných v léčbě u pacientek se zhoubnými nádory, přírůstek tělesné hmotnosti a retenci tekutin. Přípravek musí být proto podáván opatrně pacientkám, jejichž předchozí onemocnění by mohlo být přírůstkem hmotnosti nebo retencí tekutin nepříznivě ovlivněno.
Vysoké dávky přípravku DEPO-PROVERA podávané pacientkám se zhoubným nádorem mohou v některých případech vyvolat cushingoidní příznaky, například měsícovitý obličej, retenci tekutin, poruchy glukózové tolerance a vzestup krevního tlaku.
Uhlohydráty/metabolizmus
U některých pacientek léčených progestiny může dojít ke snížení glukózové tolerance. Během této léčby je třeba pečlivě sledovat pacientky s diabetem.
Psychiatrické poruchy
Pacientky, které byly v minulosti léčeny pro deprese, by měly být během léčby přípravkem DEPO-PROVERA pečlivě sledovány. Některé pacientky si mohou při léčbě přípravkem DEPO-PROVERA stěžovat na depresivní stavy obdobné premenstruální tenzi.
Laboratorní vyšetření
Při odesílání vzorků na patologické vyšetření by měl být patolog informován o tom, že pacientka je léčena přípravkem DEPO-PROVERA. Lékař by měl být informován o tom, že určitá endokrinologická vyšetření a vyšetření jaterních testů a krevních složek mohou být při léčbě progestiny ovlivněna:
-
a) Snížení hladiny steroidů v plazmě/moči (např. progesteron, estradiol, pregnanediol, testosteron, kortison).
-
b) Hladiny gonadotropinu v plazmě a moči jsou snížené (např. LH, FSH).
-
c) Koncentrace pohlavní hormony vázajícího globulinu (SHBG) jsou snížené.
Nepravidelný menstruační cyklus
Většina žen užívajících injekční suspenzi MPA udává poruchy menstruačního cyklu (např. nepravidelné nebo nepředvídatelné krvácení/špinění, vzácně těžké nebo trvalé krvácení). Pacientky by měly být vhodně informovány o možnosti výskytu poruch menstruačního cyklu a možného prodloužení anovulace. S rostoucí dobou užívání injekční suspenze MPA si stále méně pacientek stěžuje na nepravidelné krvácení a více jich udává amenorheu.
Přípravek DEPO-PROVERA má prolongovaný antikoncepční účinek. Střední doba do početí pro ženy, které otěhotní, je 10 měsíců po podání poslední injekce, s rozpětím od 4 do 31 měsíců a nemá souvislost s délkou podávání.
Poruchy očí
Jestliže dojde k částečné nebo úplné ztrátě zraku, k náhlému vzniku exoftalmu, diplopie nebo migrény, je třeba vyčkat s dalším podáváním přípravku až do doby oftalmologického vyšetření. Jestliže vyšetření odhalí edém papily nebo retinální cévní léze, přípravek by neměl být dále podáván.
Předchozí léčba, každoroční anamnéza a fyzikální vyšetření by měly být zaměřeny na prsy a pánevní orgány.
Funkce jater
Pokud se u pacientky užívající přípravek DEPO-PROVERA objeví žloutenka, je vhodné zvážit ukončení podávání léku (viz bod 4.3).
Ochrana před sexuálně přenosnými infekcemi
Ženy mají být informovány, že přípravek DEPO-PROVERA neposkytuje ochranu před sexuálně přenosnými infekcemi (STI), včetně infekcí HIV (AIDS), avšak injekce DMPA je sterilní, takže při správném podání je nevystaví STI. Bezpečné sexuální praktiky včetně správného a konzistentního používání kondomů snižuje riziko přenosu STI, včetně HIV, pohlavním stykem.
Přínosy a rizika jednotlivých metod antikoncepce musí být pro každou ženu vyhodnoceny individuálně.
Ztráta kostní hmoty (BMD)
Používání injekcí MPA snižuje sérové hladiny estrogenu a je spojeno s významnou ztrátou hustoty kostních minerálů spolu s tím, jak se kostní metabolizmus adaptuje na nižší hladiny estrogenu. Ztráta kostní hmoty je větší při delším užívání, ale zdá se, že se hustota kostní hmota zvyšuje poté, co se podávání přípravku DEPO-PROVERA přeruší a ovariální produkce estrogenů vzroste.
Ztráta kostní hmoty je obzvláště závažná během dospívání a časné dospělosti, kritického období pro růst kostní hmoty. Není známo, zda používání injekcí MPA mladšími ženami snižuje maximální dosaženou hustotu kosti a zvyšuje tak riziko zlomenin ve vyšším věku.
Studie zkoumající účinky i.m. DMPA na hustotu kostní hmoty u dospívajících žen ukázala, že jeho podání bylo spojeno s významným poklesem hustoty kostních minerálů od výchozích hodnot. U malého počtu žen, které byly sledovány po ukončení podávání přípravku DEPO-PROVERA, se střední hustota kostních minerálů vrátila blízko k výchozím hodnotám po 1 – 3 letech po ukončení podávání. U dospívajících může být přípravek DEPO-PROVERA použit ale jen poté, co byly s pacientkou diskutovány ostatní antikoncepční metody a tyto shledány nedostačující či nevhodné.
U ženy jakéhokoli věku, pokud vyžaduje užívání MPA po dobu delší než 2 roky, by měl být pečlivě přehodnocen poměr přínosu a rizika léčby.
Zvláště u žen se zdravotními rizikovými faktory osteoporózy by měly být před použitím přípravku DEPO-PROVERA zváženy jiné metody antikoncepce.
Významné rizikové faktory osteoporózy jsou:
- Užívání alkoholu a/nebo tabáku
- Chronické užívání léků snižujících kostní hmotu, např. antikonvulziva nebo kortikosteroidy
- Nízký BMI nebo poruchy příjmu potravy, např. anorexie nebo bulimie
- Spontánní zlomenina v anamnéze
- Osteoporóza v rodinné anamnéze
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Aminoglutethimid podávaný současně s přípravkem DEPO-PROVERA může výrazně snížit jeho biologickou dostupnost. Ženy užívající přípravek z důvodu antikoncepce by měly být seznámeny s možností snížené účinnosti při současném užívání aminoglutethimidu nebo jakéhokoliv podobného léčiva.
Užíváním přípravku DEPO-PROVERA mohou být ovlivněna následující laboratorní vyšetření:
-
– hladina gonadotropinů;
-
– hladina progesteronu v plazmě;
-
– hladina pregnandiolu v moči;
-
– hladina testosteronu v plazmě (u mužů);
-
– hladina estrogenů v plazmě (u žen);
-
– hladina kortizolu v plazmě;
-
– glukózový toleranční test;
-
– metopironový test.
Někteří pacienti užívající MPA mohou mít potlačenou funkci nadledvin. MPA může snížit hladinu ACTH a hydrokortizonu v krvi.
Je vhodné informovat ošetřujícího lékaře/laboratoř, že kromě endokrinních biomarkerů, může použití MPA v onkologii také způsobit částečnou adrenální insuficienci (pokles odpovědi hypofyzoadrenální osy) během metyraponového testu. Tudíž schopnost adrenální kůry reagovat na ACTH by měla být jasně demonstrována předtím, než je podán metyrapon.
4.6 Fertilita, těhotenství a kojení
Těhotenství
Přípravek DEPO-PROVERA je kontraindikovaný u těhotných žen.
Některé údaje naznačují souvislost mezi intrauterinní expozicí progestinům v prvním trimestru těhotenství a abnormalitami genitálií u mužských a ženských plodů. Pokud je přípravek DEPO-PROVERA používán v průběhu těhotenství nebo pokud pacientka otěhotní v průběhu léčby tímto přípravkem, měla by být informována o možném riziku pro plod.
Na základě výsledků 1 studie byli novorozenci z neplánovaných těhotenství, která vznikla v průběhu 1
-
– 2 měsíců po podání injekce medroxyprogesteron-acetátu v dávce 150 mg i.m., vystaveni zvýšenému riziku nízké porodní váhy, což mělo za následek i vyšší riziko novorozenecké úmrtnosti. Celkové riziko je však velmi nízké, neboť otěhotnění při užívání medroxyprogesteron-acetátu v dávce 150 mg i.m., se nepředpokládá.
U dětí, které byly vystaveny účinkům medroxyprogesteron-acetátu in utero a byly sledovány až do dospívání, nebyly prokázány žádné nežádoucí účinky na zdraví včetně tělesného, intelektuálního, sexuálního nebo sociálního vývoje.
Kojení
Nízká detekovatelná množství léku byla identifikována v mléce matek užívajících medroxyprogesteron-acetát. U kojících matek léčených medroxyprogesteron-acetátem v dávce 150 mg i.m. nebylo složení mléka a jeho množství nežádoucím způsobem ovlivněno. Novorozenci a děti vystavené působení medroxyprogesteron-acetátu v mateřském mléce byli hodnoceni s ohledem na vývojové a behaviorální účinky během puberty. Nebyly pozorovány žádné nežádoucí účinky. Vzhledem k omezenému počtu údajů o účinku MPA na kojence mladší 6 týdnů se nedoporučuje podání přípravku DEPO-PROVERA dříve než 6 týdnů po porodu, kdy je enzymový systém novorozence rozvinutější.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek DEPO-PROVERA nemá žádný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Níže uvedená tabulka uvádí seznam nežádoucích účinků léčivého přípravku s četností podle údajů o celkové kauzalitě z klinických hodnocení, ve kterých bylo zapsáno více než 4200 žen, které dostávaly DMPA jako antikoncepci po dobu až 7 let. Tyto nejčastěji hlášené nežádoucí účinky (> 5 %) zahrnovaly zvýšení hmotnosti (69 %), snížení hmotnosti (25 %), bolest hlavy (16 %), nervozitu (11 %), bolest břicha nebo břišní diskomfort (11 %), závrať (6 %) a pokles libida (6 %).
| Třída orgánových systémů | Velmi časté > 1/10 | Časté > 1/100 až < 1/10 | Méně časté> 1/1000 až < 1/100 | Vzácné > 1/10000 až < 1/1000 |
| Poruchy imunitního systému | Přecitlivělost na léčivý přípravek | Anafylaktoidní reakce, anafylaktická reakce | ||
| Endokrinní poruchy | Prodloužená anovulace | |||
| Poruchy metabolismu a výživy | Zvýšená chuť k jídlu, snížená chuť k jídlu | |||
| Psychiatrické poruchy | Nervozita | Pokles libida, deprese | Nespavost | Anorgasmie |
| Poruchy nervového systému | Bolest hlavy | Závrať | Somnolence, záchvat | |
| Cévní poruchy | Nával horka | Embolie a trombóza | ||
| Gastrointestinální poruchy | Nauzea, bolest břicha, břišní diskomfort, břišní distenze | |||
| Poruchy jater a žlučových cest | Jaterní porucha | Žloutenka | ||
| Poruchy kůže a podkožní tkáně | Akné, alopecie, vyrážka | Hirsutismus, kopřivka, svědění | Získaná lipodystrofie* | |
| Poruchy svalové a kosterní soustavy a pojivové tkáně | Bolest zad | Artralgie, svalový spasmus | ||
| Poruchy reprodukčního systému a prsu | Citlivost prsů, Vaginální výtok | Dysfunkční děložní krvácení (nepravidelné, zvýšené, snížené, špinění), pánevní bolest, galaktorea | Zánět pochvy, amenorea, eroze děložního čípku,bolest prsů, cervikální výtok |
| Třída orgánových systémů | Velmi časté > 1/10 | Časté > 1/100 až < 1/10 | Méně časté> 1/1000 až < 1/100 | Vzácné > 1/10000 až < 1/1000 |
| Celkové poruchy a reakce v místě aplikace | Otok/retence tekutin, astenie | Reakce v místě aplikace injekce*, bolest/citlivost v místě vpichu*, přetrvávající atrofie/indentace/tvo rba důlků v místě vpichu*, uzlina/bulka v místě vpichu*, únava, pyrexie | ||
| Vyšetření | Zvýšení hmotnosti, snížení hmotnosti | Snížení hustoty kostní tkáně, snížená glukózová tolerance | ||
| *Nežádoucí účinky léčivého přípravku | hlášené po uvedení přípravku na trh | |||
Níže uvedená tabulka uvádí seznam nežádoucích účinků léčivého přípravku s četností podle údajů o celkové kauzalitě z fáze 3 klinické studie, která hodnotila účinnost a bezpečnost přípravku DMPA v gynekologii. Tyto nejčastěji (> 5 %) hlášené nežádoucí účinky léčivého přípravku zahrnovaly dysfunkční děložní krvácení (19 %), bolest hlavy (12 %), nauzeu (10 %):
| Třída orgánových systémů | Velmi časté > 1/10 | Časté > 1/100 až < 1/10 | Méně časté> 1/1000 až < 1/100 | Četnost neznámá (z dostupných údajů nelze určit) |
| Poruchy imunitního systému | Přecitlivělost na léčivý přípravek | Anafylaktická reakce, anafylaktoidní reakce, angioedém | ||
| Endokrinní poruchy | Prodloužená anovulace | |||
| Psychiatrické poruchy | Deprese, nespavost, nervozita | |||
| Poruchy nervového systému | Bolest hlavy | Závrať | Somnolence | |
| Cévní poruchy | Embolie a trombóza | |||
| Gastrointestinální poruchy | Nauzea | |||
| Poruchy jater a žlučových cest | Žloutenka, cholestatická žloutenka | |||
| Poruchy kůže a podkožní tkáně | Alopecie, akné, kopřivka, svědění | Hirsutismus | Získaná lipodystrofie*, vyrážka |
| Třída orgánových systémů | Velmi časté > 1/10 | Časté > 1/100 až < 1/10 | Méně časté> 1/1000 až < 1/100 | Četnost neznámá (z dostupných údajů nelze určit) |
| Poruchy reprodukčního systému a prsu | Dysfunkční děložní krvácení (nepravidelné, zvýšené, snížené, špinění) | Cervikální výtok, bolest prsů, citlivost prsů | Galaktorea | Amenorea, eroze děložního čípku |
| Celkové poruchy a reakce v místě aplikace | Pyrexie, únava, , reakce v místě aplikace injekce*, přetrvávající atrofie/indentace /tvorba důlků v místě vpichu* | Otok, retence tekutin, uzlina/bulka v místě vpichu*, bolest/citlivost v místě vpichu* | ||
| Vyšetření | Zvýšení hmotnosti | Snížená glukózová tolerance, snížení hmotnosti | ||
| *Nežádoucí účinky léčivého přípravku hlášené po uvedení přípravku na trh | ||||
Níže uvedená tabulka uvádí seznam nežádoucích účinků léčivého přípravku s četností podle údajů o celkové kauzalitě získaných od 1 337 pacientů, kteří dostávali MPA ve 4 pivotních studiích, které hodnotily účinnost a bezpečnost přípravku MPA u onkologických indikací.
| Třída orgánových systémů | Velmi časté > 1/10 | Časté > 1/100 až < 1/10 | Méně časté > 1/1000až < 1/100 | Vzácné > 1/10000 až < 1/1000 | Četnost neznámá (z dostupných údajů nelze určit) |
| Poruchy krevního a lymfatického systému | Krevní dyzkrasie | ||||
| Poruchy imunitního systému | Přecitlivělost na léčivý přípravek | Anafylaktoidní reakce, anafylaktická reakce | |||
| Endokrinní poruchy | Účinky podobné kortikoidům | Prodloužená anovulace | |||
| Poruchy metabolismu a výživy | Zvýšená chuť k jídlu, snížená chuť k jídlu | Hyperkalcémi e, zhoršení diabetes mellitus | |||
| Psychiatrické poruchy | Nervozita | Pokles libida, deprese | Nespavost | Anorgasmie | Zmatenost |
| Třída orgánových systémů | Velmi časté > 1/10 | Časté > 1/100 až < 1/10 | Méně časté > 1/1000až < 1/100 | Vzácné > 1/10000 až < 1/1000 | Četnost neznámá (z dostupných údajů nelze určit) |
| Poruchy nervového systému | Bolest hlavy | Závrať | Somnolence, záchvat | Adrenergní účinky, ztráta koncentrace | |
| Poruchy oka | Zhoršení zraku, diabetická katarakta | ||||
| Cévní poruchy | Nával horka | Embolie a trombóza | |||
| Gastrointestiná lní poruchy | Nauzea, zvracení, zácpa, bolest břicha, břišní diskomfort, břišní distenze | Průjem, sucho v ústech | |||
| Poruchy jater a žlučových cest | Jaterní porucha | Žloutenka | |||
| Poruchy kůže a podkožní tkáně | Akné, alopecie, vyrážka | Hirsutismus, kopřivka, svědění | Získaná lipodystrofie* | ||
| Poruchy svalové a kosterní soustavy a pojivové tkáně | Bolest zad | Atralgie, Svalový spasmus | |||
| Poruchy ledvin a močových cest | Glykosurie | ||||
| Poruchy reprodukčního systému a prsu | Citlivost prsů, vaginální výtok | Dysfunkční děložní krvácení (nepravidelné, zvýšené, snížené, špinění), pánevní bolest galaktorea | Zánět pochvy, amenorea, eroze děložního čípku, bolest prsů, cervikální výtok |
| Třída orgánových systémů | Velmi časté > 1/10 | Časté > 1/100 až < 1/10 | Méně časté > 1/1000až < 1/100 | Vzácné > 1/10000 až < 1/1000 | Četnost neznámá (z dostupných údajů nelze určit) |
| Celkové poruchy a reakce v místě aplikace | Otok/retence tekutin, astenie | Reakce v místě aplikace injekce*, bolest/citlivost v místě vpichu*, přetrvávající atrofie/indenta ce/tvorba důlků v místě vpichu*, uzlina/bulka v místě vpichu*, únava, pyrexie | |||
| Vyšetření | Zvýšení hmotnosti , snížení hmotnosti | Snížení hustoty kostní tkáně, snížená glukózová tolerance | Zvýšení počtu krevních destiček | ||
| *Nežádoucí účinky léčivého přípravku hlášené po uvedení přípravku na trh | |||||
Zkušenosti s dalšími nežádoucími účinky hlášenými po uvedení přípravku na trh:
Intramuskulární forma:
Po uvedení přípravku na trh byly ve vzácných případech hlášeny případy osteoporózy včetně osteoporotických zlomenin u pacientů, kteří užívají DMPA IM.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky:
4.9 Předávkování
Přípravek DEPO-PROVERA je dobře snášen. U žen v reprodukčním věku může jednorázová dávka přípravku DEPO-PROVERA způsobit přechodné změny menstruačního cyklu (tzn. krvácení při vysazení progestinu). Velmi vysoké dávky přípravku DEPO-PROVERA, používané při onkologické léčbě, mohou vyvolat celou řadu symptomů včetně přibývání na váze (spolu s mírnou retencí tekutin), malátnost a v některých případech účinky podobné účinkům kortikoidů. Samozřejmě v těchto případech by docházelo i k anovulaci u žen a snížené endogenní produkci testosteronu u mužů.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: hormony, ATC kód: L02AB02
DEPO-PROVERA je gestagen bez estrogenních účinků a má minimální androgenní účinek. Přípravek DEPO-PROVERA, podaný v příslušných dávkách, potlačuje sekreci hypofyzárních gonadotropinů, což u žen v reprodukčním věku zabraňuje zrání folikulů s následnou anovulací. U mužů přípravek DEPO-PROVERA, podaný v příslušných dávkách, inhibuje funkci Leydigových buněk, tj. potlačuje produkci endogenního testosteronu.
Dávka 5 nebo 10 mg medroxyprogesteron-acetátu, podávaná denně po dobu 10 dní, má na vyvolání optimální sekreční změny endometria připraveného estrogeny účinek ekvivalentní 20 mg parenterálního progesteronu podávaného denně po dobu l0 dní.
Perorálně podaný medroxyprogesteron-acetát navíc vede k typickým gestagenním změnám cervikálního hlenu (inhibuje arborizaci hlenu) a zvyšuje počet intermediárních buněk v maturačním indexu poševního epitelu.
-
V případě specifických forem hormonálně-dependentních nádorů může být protinádorový účinek přípravku DEPO-PROVERA ve farmakologických dávkách založen na ovlivnění osy hypothalamus-hypofýza-gonády, dále na účincích na estrogenové receptory a metabolismus steroidů na tkáňové úrovni.
-
V kontrolované klinické studii vykazovaly dospělé ženy užívající MPA injekce (150 mg i.m.) po dobu alespoň 5 let pokles průměrné kostní hustoty v oblasti páteře a kyčle přibližně o 5 – 6% v porovnání s kontrolní skupinou, ve které nedošlo k žádné významné změně. Pokles hustoty kostní hmoty byl výraznější během prvních dvou let užívání, v dalších letech docházelo pouze k menším poklesům. Průměrné změny v oblasti lumbální páteře byly –2,86%, –4,11%, –4,89%, –4,93% a –5,38% po 1, 2, 3, 4 a 5 letech. Průměrný pokles v oblasti celé kyčle a krčku femuru byl podobný.
Po ukončení podávání injekcí MPA (150 mg i.m.) došlo k nárůstu BMD směrem k původním hodnotám. Delší trvání léčby bylo spojeno s pomalejší obnovou BMD.
Změny BMD u dospívajících dívek (12 – 18 let)
Výsledky z otevřené nerandomizované klinické studie zkoumající injekce MPA (150 mg i.m. každých 12 týdnů až po 240 týdnů (4,6 let), s následným sledováním po ukončení podávání u dospívajících dívek (12 – 18 let) také ukázaly, že MPA i.m. byl spojen s významným poklesem BMD oproti výchozímu stavu. Mezi subjekty, kterým byly aplikovány > 4 injekce/60 týdnů byl průměrný pokles v BMD lumbální páteře –2,1% po 240 týdnech (4,6 let); průměrný pokles pro celou kyčel byl –6,4% a pro krček femuru –5,4%. Následné sledování po ukončení podávání ukázalo, že (podle průměrných hodnot) BMD lumbální páteře se vrátila k výchozím hodnotám přibližně za 1 rok po ukončení léčby a BMD kyčle se vrátila k výchozím hodnotám přibližně za 3 roky po ukončení léčby. Je ale nutné vzít v úvahu, že hodně subjektů svoji účast ve studii ukončilo a tyto výsledky jsou tedy založeny na malém počtu subjektů (n=71 v 60. týdnu a n=25 v 240. týdnu po ukončení léčby). Naproti tomu s uživatelkami DMPA neporovnatelná kohorta rozdílných neléčených subjektů s rozdílnými výchozími hodnotami kostních parametrů vykazovala průměrné nárůsty BMD v 240. týdnu o 6,4% u lumbální páteře, 1,7% u celé kyčle a 1,9% u krčku femuru.
5.2 Farmakokinetické vlastnosti
Absorpce
Po intramuskulárním podání se medroxyprogesteron-acetát (MPA) uvolňuje pomalu, čímž se vytváří nízká, ale dlouho přetrvávající hladina přípravku. Po intramuskulární aplikaci dosahují hladiny maxima po 4 až 20 dnech. MPA je v krevním oběhu zjistitelný ještě 7–9 měsíců po intramuskulární injekci.
Distribuce v organismu
Přibližně 90–95% MPA se váže na proteiny. Distribuční objem se uvádí v rozmezí 20 ± 3 litry. MPA prochází hematoencefalickou bariérou a vylučuje se do mateřského mléka.
Biotransformace
MPA je metabolizován v játrech.
Eliminace z organismu
Poločas eliminace po intramuskulární aplikaci je 6 týdnů. MPA je primárně vylučován žlučí do stolice. Přibližně 30% i.m. podané dávky je vyloučeno močí během 4 dnů.
5.3 Předklinické údaje vztahující se k bezpečnosti
Kancerogeneze, mutageneze, poškození fertility
Dlouhodobé intramuskulární podávání medroxyprogesteron-acetátu (DMPA) mělo vliv na tvorbu tumorů mléčných žláz u psů. Není k dispozici důkaz o kancerogenním účinku spojeném s perorálním podáním medroxyprogesteron-acetátu potkanům a myším.
Medroxyprogesteron-acetát nebyl mutagenní v baterii in vitro nebo in vivo testů genetické toxicity. Medroxyprogesteron-acetát ve vysokých dávkách je látkou s antifertilitním účinkem a vysoké dávky mohou poškozovat fertilitu až do ukončení léčby.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Polysorbát 80, methylparaben, propylparaben, makrogol 3000, chlorid sodný, hydroxid sodný a/nebo kyselina chlorovodíková ( na úpravu pH), voda na injekci
6.2 Inkompatibility
Nebyly zjištěny žádné fyzikálně-chemické inkompatibility.
6.3 Doba použitelnosti
5 let
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25 °C.
6.5 Druh obalu a obsah balení
-
a) skleněná lahvička, pryžová zátka, plastový kryt (pertl)
-
b) jednorázová injekční stříkačka z bezbarvého skla, na jedné straně pryžový kryt, na druhé straně pryžový píst s plastovým (PP) nástavcem, samostatně sterilně balená jehla na jedno použití s krytem, v zataveném fóliovém blistru a krabičce.
Velikost balení:
Lahvičky o obsahu 150 mg/ml, 500 mg/3,3 ml a 1000 mg/6,7 ml
Jednorázová stříkačka o obsahu 150 mg/ml
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
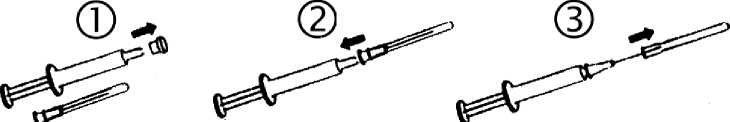
Před použitím je nutno lahvičkou řádně zatřepat, aby podaná dávka vytvořila homogenní suspenzi.
-
1. Sejmout kryt stříkačky
-
2. Nasadit za sterilních podmínek jehlu.
-
3. Sejmout kryt jehly. Nyní je stříkačka připravená k použití.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Pfizer, spol. s r.o., Stroupežnického 17, 150 00 Praha 5, Česká republika
8. REGISTRAČNÍ ČÍSLO
56/111/82-C
9. DATUM PRVNÍ REGISTRACE / PRODLOUŽENÍ REGISTRACE
Datum první registrace: 9. března 1982
Datum posledního prodloužení registrace: 9. září 2015
Další informace o léčivu DEPO-PROVERA
Jak
se DEPO-PROVERA
podává: intramuskulární podání - injekční suspenze
Výdej
léku: na lékařský předpis
Balení: Injekční lahvička
Velikost
balení: 1X3,3ML
Držitel rozhodnutí o registraci daného léku v České republice:
Pfizer, spol. s r.o., Praha
E-mail: Medicalinfo.cz@pfizer.com
Telefon: 283 004 111
