Příbalový leták - DEPO-PROVERA
1. Co je přípravek DEPO-PROVERA a účinky
Přípravek DEPO-PROVERA je indikován:
-
1. Jako kontraceptivum (potlačení ovulace).
-
2. V léčbě endometriózy.
-
3. V léčbě vazomotorických potíží v menopauze.
-
4. Jako adjuvantní nebo paliativní léčba recidivujícího nebo metastazujícího karcinomu endometria nebo ledvin.
-
5. V léčbě hormon-dependentního recidivujícího karcinomu prsu.
Protože ztráta kostní hmoty (BMD) se může objevit u žen různých věkových skupin, které dlouhodobě užívají injekce MPA (medroxyprogesteron-acetát), měl by být zvážen poměr rizika a přínosu a rovněž brán v úvahu úbytek kostní hmoty (BMD) objevující se během těhotenství a/nebo kojení.
Přípravek DEPO-PROVERA je přípravek s gestagenními vlastnostmi, který postrádá estrogenní účinky a jehož androgenní účinky jsou minimální.
Ve vhodných dávkách DEPO-PROVERA tlumí sekreci hypofyzárních gonadotropinů, což vede k zabránění zrání folikulů a k anovulaci u žen v reprodukčním věku.
U mužů potlačuje DEPO-PROVERA ve vhodných dávkách funkci Leydigových buněk; vede tedy k potlačení endogenní produkce testosteronu.
Dávka 5 mg nebo 10 mg medroxyprogesteron-acetátu podávaná denně po dobu 10 dnů má na vyvolání optimální sekreční změny endometria připraveného estrogeny stejný účinek jako 20 mg progesteronu aplikovaného parenterálně každý den po dobu 10 dnů. Medroxyprogesteron-acetát aplikovaný perorálně vyvolává rovněž typické gestagenní změny cervikálního hlenu (inhibuje arborizaci hlenu) a zvyšuje počet intermediárních buněk v maturačním indexu vaginálního epitelu.
Protinádorové působení přípravku DEPO-PROVERA ve farmakologických dávkách u určitých forem hormon-dependentních nádorů může souviset s ovlivněním osy hypotalamus-hypofýza-gonády, estrogenních receptorů a metabolismu steroidů na tkáňové úrovni.
Stejně jako progesteron má i medroxyprogesteron-acetát termogenní vlastnosti. Při použití velmi vysokých dávek během terapie některých nádorů (500 mg a více za den) se mohou manifestovat účinky podobné kortikoidním.
Po intramuskulární aplikaci se medroxyprogesteron-acetát (MPA) pomalu uvolňuje, čímž se tvoří nízká, ale trvalá hladina. Doba do dosažení maximálních hladin je přibližně 4 až 20 dnů od intramuskulárního podání. Hladiny MPA jsou detekovatelné ještě za 7 až 9 měsíců po intramuskulární injekci. MPA se přibližně z 90–95 % váže na bílkoviny krevní plazmy. Uváděný distribuční objem je 20±3 l. MPA přestupuje hematoencefalickou bariéru a vylučuje se do mateřského mléka.
MPA je metabolizován v játrech. Poločas eliminace po intramuskulární aplikaci je 6 týdnů. MPA je primárně vylučován žlučí do stolice. Přibližně 30% i.m. podané dávky je vyloučeno močí během 4 dnů.
2. Čemu musíte věnovat pozornost, než začnete přípravek DEPO-PROVERA používat
Nepoužívejte přípravek DEPO-PROVERA
- jestliže jste alergický(á) na medroxyprogesteron-acetát (MPA), steroidy nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6)
- se závažnou jaterní nedostatečností
- těhotných nebo při podezření na těhotenství
- při vaginálním krvácení z nejasných příčin
Kontraindikace u pacientek, kterým byl přípravek DEPO-PROVERA předepsán jako antikoncepce nebo při gynekologických obtížích: přípravek DEPO-PROVERA je kontraindikovaný při malignitě v oblasti prsu a pohlavních orgánů, nebo při podezření na ni.
Upozornění a opatření
Před použitím přípravku DEPO-PROVERA se poraďte se svým lékařem, lékárníkem nebo zdravotní sestrou.
Neočekávané krvácení, které se vyskytne během léčby MPA, musí být vyšetřeno.
Riziko vzniku nádoru
Dlouhodobé sledování pacientek, kterým byly podány injekce intramuskulárního medroxyprogesteron-acetátu (DMPA) 150 mg, zjistilo mírné nebo žádné zvýšení celkového rizika nádorů prsu a žádné zvýšení rizika ovariálních, jaterních nebo cervikálních nádorů, dále trvající ochranný účinek snižující riziko karcinomu endometria.
Tromboembolické poruchy
Ačkoli medroxyprogesteron-acetát nemá zřejmě příčinnou souvislost s indukcí trombotické nebo tromboembolické poruchy, neměl by být u žádné pacientky užívající přípravek DEPO-PROVERA, u které se vyskytne tato příhoda, např. plicní embolie, cévní mozková příhoda, retinální trombóza nebo hluboká žilní trombóza, tento přípravek znovu podáván. Ženy s předchozí anamnézou tromboembolické poruchy nebyly sledovány v klinických hodnoceních a žádné informace, které by dokládaly bezpečnost podání přípravku DEPO-PROVERA této populaci, nejsou dostupné.
Anafylaxe a anafylaktická reakce
Pokud se objeví anafylaktická reakce, měla by být ihned zahájena příslušná léčba. Závažné anafylaktické reakce vyžadují okamžitou léčbu.
Vzhledem k tomu, že přípravek obsahuje methylparaben a propylparaben, může vyvolat alergické reakce (i opožděné). V případě výskytu alergické reakce nesmí být přípravek již znovu podán.
Změny tělesné hmotnosti a retence tekutin
DEPO-PROVERA může způsobit, zvláště ve vysokých dávkách, používaných v léčbě u pacientek se zhoubnými nádory, přírůstek tělesné hmotnosti a retenci tekutin. Přípravek musí být proto podáván opatrně pacientkám, jejichž předchozí onemocnění by mohlo být přírůstkem hmotnosti nebo retencí tekutin nepříznivě ovlivněno.
Vysoké dávky přípravku DEPO-PROVERA podávané pacientkám se zhoubným nádorem mohou v některých případech vyvolat cushingoidní příznaky, například měsícovitý obličej, retenci tekutin, poruchy glukózové tolerance a vzestup krevního tlaku.
Uhlohydráty/metabolizmus
U některých pacientek léčených progestiny může dojít ke snížení glukózové tolerance. Během této léčby je třeba pečlivě sledovat pacientky s diabetem.
Psychiatrické poruchy
Pacientky, které byly v minulosti léčeny pro deprese, by měly být během léčby přípravkem DEPO-PROVERA pečlivě sledovány. Některé pacientky si mohou při léčbě přípravkem DEPO-PROVERA stěžovat na depresivní stavy obdobné premenstruální tenzi.
Laboratorní vyšetření
Při odesílání vzorků na patologické vyšetření by měl být patolog informován o tom, že pacientka je léčena přípravkem DEPO-PROVERA. Lékař by měl být informován o tom, že určitá endokrinologická vyšetření a vyšetření jaterních testů a krevních složek mohou být při léčbě progestiny ovlivněna:
-
a) Snížení hladiny steroidů v plazmě/moči (např. progesteron, estradiol, pregnanediol, testosteron, kortison).
-
b) Hladiny gonadotropinu v plazmě a moči jsou snížené (např. LH, FSH).
-
c) Koncentrace pohlavní hormony vázajícího globulinu (SHBG) jsou snížené.
Nepravidelný menstruační cyklus
Většina žen užívajících injekční suspenzi MPA udává poruchy menstruačního cyklu (např. nepravidelné nebo nepředvídatelné krvácení/špinění, vzácně těžké nebo trvalé krvácení). Pacientky by měly být vhodně informovány o možnosti výskytu poruch menstruačního cyklu a možného prodloužení anovulace. S rostoucí dobou užívání injekční suspenze MPA si stále méně pacientek stěžuje na nepravidelné krvácení a více jich udává amenorheu.
Přípravek DEPO-PROVERA má prolongovaný antikoncepční účinek. Střední doba do početí pro ženy, které otěhotní, je 10 měsíců po podání poslední injekce, s rozpětím od 4 do 31 měsíců a nemá souvislost s délkou podávání.
Poruchy očí
Jestliže dojde k částečné nebo úplné ztrátě zraku, k náhlému vzniku exoftalmu, diplopie nebo migrény, je třeba vyčkat s dalším podáváním přípravku až do doby oftalmologického vyšetření. Jestliže vyšetření odhalí edém papily nebo retinální cévní léze, přípravek by neměl být dále podáván.
Předchozí léčba, každoroční anamnéza a fyzikální vyšetření by měly být zaměřeny na prsy a pánevní orgány.
Funkce jater
Pokud se u pacientky objeví žloutenka, je vhodné zvážit ukončení podávání léku.
Přípravek DEPO-PROVERA neposkytuje ochranu před infekcí HIV, např. AIDS, ani jinými pohlavně přenosnými infekcemi
Bezpečné sexuální chování včetně správného a důsledného používání kondomů snižuje riziko přenosu pohlavně přenosných infekcí, včetně HIV, pohlavním stykem.
Informace, jak snížit riziko nákazy pohlavně přenosnými infekcemi včetně HIV, získáte od svého lékaře.
Ztráta kostní hmoty
Používání injekcí MPA snižuje sérové hladiny estrogenu a je spojeno s významnou ztrátou hustoty kostních minerálů spolu s tím, jak se kostní metabolizmus adaptuje na nižší hladiny estrogenu. Ztráta kostní hmoty je větší při delším užívání, ale zdá se, že se hustota kostní hmota zvyšuje poté, co se podávání přípravku DEPO-PROVERA přeruší a ovariální produkce estrogenů vzroste. Ztráta kostní hmoty je obzvláště závažná během dospívání a časné dospělosti, kritického období pro růst kostní hmoty. Není známo, zda používání injekcí MPA mladšími ženami snižuje maximální dosaženou hustotu kosti a zvyšuje tak riziko zlomenin ve vyšším věku.
Studie zkoumající účinky i.m. DMPA na hustotu kostní hmoty u dospívajících žen ukázala, že jeho podání bylo spojeno s významným poklesem hustoty kostních minerálů od výchozích hodnot. U malého počtu žen, které byly sledovány po ukončení podávání přípravku DEPO-PROVERA, se střední hustota kostních minerálů vrátila blízko k výchozím hodnotám po 1 – 3 letech po ukončení podávání. U dospívajících může být přípravek DEPO-PROVERA použit, ale jen poté, co byly s pacientkou diskutovány ostatní antikoncepční metody a tyto shledány nedostačující či nevhodné.
U ženy jakéhokoli věku, pokud vyžaduje užívání MPA po dobu delší než 2 roky, by měl být pečlivě přehodnocen poměr přínosu a rizika léčby.
Zvláště u žen se zdravotními rizikovými faktory osteoporózy by měly být před použitím přípravku DEPO-PROVERA zváženy jiné metody antikoncepce.
Významné rizikové faktory osteoporózy jsou:
- Užívání alkoholu a/nebo tabáku
- Chronické užívání léků snižujících kostní hmotu, např. antikonvulziva nebo kortikosteroidy
- Nízký BMI nebo poruchy příjmu potravy, např. anorexie nebo bulimie
- Spontánní zlomenina v anamnéze
- Osteoporóza v rodinné anamnéze
Děti a dospívající
Přípravek DEPO-PROVERA není indikovaný před menarché. Až na obavy týkající se ztráty kostní hmoty se očekává, že bezpečnost a účinnost přípravku DEPO-PROVERA jsou u dospívajících dívek po menarché a u dospělých žen stejné.
Další léčivé přípravky a přípravek DEPO-PROVERA
Prosím, informujte svého lékaře, lékárníka nebo zdravotní sestru o všech lécích, které užíváte nebo jste užívala v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu. Některé léky se mohou s přípravkem DEPO-PROVERA vzájemně ovlivňovat
Aminoglutethimid podávaný současně s přípravkem DEPO-PROVERA může výrazně snížit jeho biologickou dostupnost a tím také snížit antikoncepční účinek.
Podáváním přípravku DEPO-PROVERA mohou být ovlivněny výsledky těchto laboratorních vyšetření:
-
a) Hladiny gonadotropinů.
-
b) Plazmatické hladiny progesteronu.
-
c) Koncentrace pregnandiolu v moči.
-
d) Plazmatické hladiny testosteronu (u mužů).
-
e) Plazmatické hladiny estrogenů (u žen).
-
f) Plazmatické hladiny kortizolu.
-
g) Glukózový toleranční test.
-
h) Metopironový test.
Někteří pacienti užívající MPA mohou mít potlačenou funkci nadledvin. MPA může snížit hladinu ACTH a hydrokortizonu v krvi.
Je vhodné informovat ošetřujícího lékaře/laboratoř, že kromě endokrinních biomarkerů může použití MPA v onkologii také způsobit částečnou adrenální insuficienci (pokles odpovědi hypofyzoadrenální osy) během metyraponového testu. Tudíž schopnost adrenální kůry reagovat na ACTH by měla být jasně demonstrována předtím, než je podán metyrapon.
Těhotenství a kojení
Přípravek DEPO-PROVERA je kontraindikovaný u těhotných žen. Jestliže se domníváte, že můžete být těhotná nebo plánujete otěhotnět, myslíte, že jste otěhotněla během používání přípravku DEPO-PROVERA, sdělte to okamžitě lékaři či lékárníkovi.
Pokud kojíte, injekce Vám nebude podána dříve než 6 týdnů po porodu, kdy je organizmus novorozence vyvinutější. Přípravek DEPO-PROVERA může být předáván mateřským mlékem kojenému novorozenci, nicméně nebyly zaznamenány žádné známky poškození dítěte.
Poraďte se se svým lékařem dříve, než začnete užívat jakýkoliv lék.
Řízení dopravních prostředků a obsluha strojů
Žádný účinek na schopnost řídit nebo obsluhovat stroje nebyl u přípravku DEPO-PROVERA pozorován.
Přípravek DEPO-PROVERA obsahuje methylparaben (E218), propylparaben (E216)
Methylparaben (E218) a propylparaben (E216) mohou způsobit alergické reakce (pravděpodobně zpožděné) a výjimečně bronchospasmus (zúžení průdušek).
3. Jak se přípravek DEPO-PROVERA používá
Způsob a cesta podání
Způsob podání
Intramuskulární injekce.
Návod ke správnému užívání
Lahvička
Těsně před použitím je třeba lahvičku řádně protřepat, aby byla podána skutečně homogenní suspenze.
Jednorázová injekce
Protřepejte stříkačku tak, aby se vytvořila homogenní suspenze.
Odstraňte kryt.
Sterilně nasaďte jehlu.
Po odstranění krytu jehly je stříkačka připravená k použití.
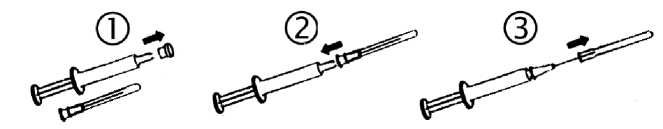
Dávkování
ANTIKONCEPCE (potlačení ovulace)
Doporučená dávka je 150 mg přípravku DEPO-PROVERA hluboko intramuskulárně každé tři měsíce.
První injekce: pro zajištění antikoncepce během prvního cyklu použití by měla být podána první dávka během prvních pěti dnů normálního menstruačního cyklu. Je-li injekce podána podle těchto instrukcí, není vyžadována žádná další metoda antikoncepce.
Další dávky: Druhá a další injekce by měly být podávány v intervalu 13 týdnů. Pokud je z jakéhokoli důvodu interval od předchozí injekce delší než 13 týdnů, mělo by být před podáním další injekce vyloučeno těhotenství. Účinnost přípravku závisí na dodržení doporučeného dávkovacího schématu.
Po porodu: Pokud žena nekojí, doporučuje se podat injekci během prvních pěti dnů po porodu (pro větší jistotu že pacientka není gravidní). Pokud je nutné podat injekci v jinou dobu, je nutné vyloučit těhotenství.
Kojí-li pacientka, doporučuje se injekci podat ne dříve než 6 týdnů po porodu, kdy je enzymový systém novorozence již rozvinutější.
Přechod z jiné metody antikoncepce: Při přechodu z jiné metody antikoncepce by měl být přípravek DEPO-PROVERA podáván způsobem, který zajistí průběžnou antikoncepční ochranu na základě mechanismu účinku obou metod (např. pacientky, které přecházejí z perorální antikoncepce, by měly dostat první injekci přípravku DEPO-PROVERA během sedmi dnů poté, co užily poslední antikoncepční tabletku).
ENDOMETRIÓZA
Doporučená dávka přípravku DEPO-PROVERA v této indikaci je 50 mg týdně nebo 100 mg každé dva týdny intramuskulárně po dobu nejméně 6 měsíců.
VAZOMOTORICKÉ POTÍŽE V MENOPAUZE
Doporučená dávka je 150 mg přípravku DEPO-PROVERA intramuskulárně každé tři měsíce.
KARCINOM ENDOMETRIA A LEDVIN
Jako počáteční léčba se doporučuje intramuskulárně podávat jednou týdně dávky 400–1000 mg přípravku DEPO-PROVERA. Pokud během několika týdnů nebo měsíců dojde ke zlepšení a stabilizaci onemocnění, může jako udržovací terapie postačit pouze dávka 400 mg za měsíc.
KARCINOM PRSU
Doporučené dávkovací schéma je 500 mg přípravku DEPO-PROVERA denně intramuskulárně po dobu 28 dnů. Poté by nemocná měla být převedena na udržovací terapii, s dávkami 500 mg 2× týdně tak dlouho, dokud je přítomna odpověď na léčbu.
Hepatální insuficience: Jelikož je přípravek DEPO-PROVERA téměř výlučně eliminován v játrech, může být nedostatečně metabolizován u pacientek se závažnou jaterní nedostatečností.
Renální insuficience: Jelikož je přípravek DEPO-PROVERA téměř výlučně eliminován v játrech, není úprava dávkování považována u žen s renální insuficiencí za nutnou.
4. Vedlejší účinky
Podobně jako všechny léky může mít i přípravek DEPO-PROVERA nežádoucí účinky, které se ale nemusí vyskytnout u každého. Pokud kterýkoliv z nežádoucích účinků začne být závažný nebo zaznamenáte jakýkoliv nežádoucí účinek, který není uvedený v této příbalové informaci, sdělte to svému lékaři nebo lékárníkovi.
Velmi časté:(mohou postihnout více než 1 z 10 pacientů)
- nervozita
- bolest hlavy
- zvýšení tělesné hmotnosti
- snížení tělesné hmotnosti
- nevolnost
- dysfunkční děložní krvácení (nepravidelné, zvýšené, snížené, špinění)
Časté:(mohou postihnout až 1 z 10 pacientů)
- deprese
- pokles libida
- závrať
- bolest břicha
- břišní diskomfort
- roztažení břicha (distenze)
- ztráta vlasů
- akné
- vyrážka
- bolest zad
- poševní výtok
- výtok z děložního hrdla
- citlivost prsů
- zadržování tekutin, otok
- tělesná slabost (astenie)
- přecitlivělost na léčivý přípravek
- nespavost
- kopřivka
- svědění
- bolest prsů
- horečka
- únava
- reakce v místě podání injekce přetrvávající ztenčení/vpáčení/tvorba důlků v místě vpichu
- zvýšená chuť k jídlu
- snížená chuť k jídlu
- zvracení
- zácpa
Méně časté:(mohou postihnout až 1 ze 100 pacientů)
- záchvat
- nával horka
- jaterní porucha
- abnormální ochlupení (hirsutismus)
- tvorba mléka mimo dobu kojení
- pánevní bolest
- účinky podobné kortikoidům
- zhoršení diabetes mellitus (cukrovka)
- zvýšené množství vápníku v krvi (hyperkalcémie)
- průjem
- sucho v ústech
- ospalost
- uzlina/bulka v místě vpichu
- bolest /citlivost v místě vpichu
Vzácné:(mohou postihnout až 1 z 1 000 pacientů)
- anafylaktická a anafylaktoidní reakce (projevující se akutní dušností, otokem rtů, hrdla či očních víček)
- prodloužená nepřítomnost ovulace
- neschopnost dosáhnout orgasmu při pohlavním styku
- embolie a tvorba krevních sraženin
- žloutenka
- získané změny v přeměně/rozložení tělesného tuku (lipodystrofie)
- bolest kloubů
- nepřítomnost menstruace
- zánět pochvy
- narušení struktury sliznice děložního čípku
- snížení hustoty kostní tkáně
- snížená glukózová tolerance
- svalové napětí/stahy
Není známo:četnost nelze z dostupných údajů určit
- cholestatická žloutenka
- zmatenost
- ztráta koncentrace
- uvolňování adrenalinu
- diabetický šedý zákal
- zhoršení zraku
- vylučování cukru do moči
- zvýšení počtu krevních destiček
- otok kůže, podkoží nebo sliznic (angioedém)
- poruchy ve složení krve
Možný účinek na Váš menstruační cyklus
Většina žen užívajících injekční suspenzi přípravku DEPO-PROVERA udává poruchy menstruačního cyklu (např. nepravidelné nebo nepředvídatelné krvácení/špinění, vzácně těžké nebo trvalé krvácení). S rostoucí dobou užívání injekční suspenze přípravku DEPO-PROVERA si stále méně pacientek stěžuje na nepravidelné krvácení a více jich udává vynechání menstruace.
Možný účinek na Vaše kosti
Používání injekcí přípravku DEPO-PROVERA snižuje sérové hladiny estrogenu. Nízké hladiny estrogenu mohou způsobovat slábnutí kostí (snížením hustoty kostní hmoty). Ztráta kostní hmoty je větší při delším užívání, ale zdá se, že se znovu zvyšuje poté, co se podávání přípravku DEPO-PROVERA přeruší a produkce estrogenů vaječníky vzroste.
U ženy jakéhokoli věku, pokud vyžaduje užívání přípravku DEPO-PROVERA po dobu delší než 2 roky, by měl být pečlivě přehodnocen poměr přínosu a rizika léčby.
Níže jsou uvedeny rizikové faktory pro rozvoj osteoporózy:
- Užívání alkoholu a/nebo tabáku
- Dlouhodobé užívání léků snižujících kostní hmotu, např. léky pro léčbu epilepsie nebo steroidy
- Nízký BMI nebo poruchy příjmu potravy, např. anorexie nebo bulimie
- Spontánní zlomenina v anamnéze (nezpůsobené pádem)
- Osteoporóza u rodinných příslušníků
Dospívající (do věku 18 let)
Kosti dospívajících jsou rychle rostoucí a zesilující. Kosti jsou nejsilnější v době dosažení dospělosti, což je důležitý ochranný faktor proti osteoporóze v pozdějším věku. Studie zkoumající účinky i.m. přípravku DEPO-PROVERA na hustotu kostní hmoty u dospívajících žen ukázala, že jeho podání bylo spojeno s významným poklesem hustoty kostních minerálů od výchozích hodnot. U malého počtu žen, které byly sledovány po ukončení podávání přípravku DEPO-PROVERA, se střední hustota kostních minerálů vrátila blízko k výchozím hodnotám po 1 – 3 letech po ukončení podávání. U dospívajících může být přípravek DEPO-PROVERA použit, ale jen poté, co byly s pacientkou diskutovány ostatní antikoncepční metody a tyto shledány nedostačující či nevhodné.
Při používání přípravku DEPO-PROVERA může mít pravidelné cvičení, dodržování zdravé životosprávy včetně dostatečného přísunu vápníku (např. mléčné výrobky) a vitaminu D (např. v rybím oleji) pozitivní vliv na Vaše kosti.
Možné riziko nádorového onemocnění
Studie žen, které užívaly antikoncepční přípravky, prokázala, že u žen užívajících injekční přípravek DEPO-PROVERA není zvýšené riziko rozvoje nádorového onemocnění vaječníků, dělohy, děložního čípku nebo jater.
Rakovina prsu se vyskytuje vzácně ve věku méně než 40 let, riziko se s věkem zvyšuje.
Zdá se, že riziko rakoviny prsu je mírně zvýšené u žen, užívajících injekční antikoncepci v porovnání s ženami stejného věku, které hormonální antikoncepci nepoužívají.
Toto by mělo být zváženo při předepisování přípravku DEPO-PROVERA. Není jasné, zda podávání injekcí přípravku DEPO-PROVERA způsobuje zvýšené riziko rakoviny prsu. Může to být způsobeno tím, že tyto ženy jsou vyšetřovány častěji, a tak je rakovina prsu diagnostikována dříve. Rozsah rakoviny prsu se zdá být menší u žen používajících přípravek DEPO-PROVERA oproti ženám, které tyto přípravky nepoužívají.
Riziko nálezu rakoviny prsu není ovlivněno délkou podávání injekčního přípravku, ale věkem, ve kterém je podávání ukončeno. Důvodem pro to je, že s věkem se významně zvyšuje riziko rakoviny prsu. Deset let po ukončení podávání injekční hormonální antikoncepce je riziko nálezu rakoviny prsu stejné jako u žen, které hormonální antikoncepci nikdy nepoužívaly.
U 10 000 žen, které používaly injekční přípravek DEPO-PROVERA po dobu až pěti let, ale ukončily její užívání do dvaceti let věku, byl vyhodnocen méně než 1 případ rakoviny prsu navíc do deseti let po ukončení podávání injekčního přípravku v porovnání s počtem zjištěným u 10 000 žen, které nikdy injekční antikoncepci nepoužívaly.
U žen, které ukončí používání injekční antikoncepce po pěti letech do 30 let věku, by byly odhadem 2 –3 případy rakoviny prsu navíc (oproti 44 případům rakoviny prsu na 10 000 žen v této věkové skupině, které nikdy nepoužívaly injekční antikoncepci).
U žen, které ukončí používání injekční antikoncepce po pěti letech do 40 let věku, by bylo odhadem 10 případů rakoviny prsu navíc (oproti 160 případům rakoviny prsu na 10 000 žen v této věkové skupině, které nikdy nepoužívaly injekční antikoncepci).
Další rizika:
Jestliže se u Vás rozvine
náhlá částečná nebo celková ztráta vidění, dvojité vidění, poruchy srážlivosti krve jako je plicní embolie (krevní sraženina v plicích) nebo mrtvice, nesmíte dostat další injekci přípravku DEPO-PROVERA- migréna, konzultujte toto s lékařem ještě předtím, než dostanete další injekci přípravku DEPO-PROVERA.
- žloutenka (zežloutnutí kůže nebo očí), konzultujte toto s lékařem ještě předtím, než dostanete další injekci přípravku DEPO-PROVERA.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři, lékárníkovi nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
webové stránky:
Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek DEPO-PROVERA uchovávat
- Uchovávejte mimo dohled a dosah dětí.
- Přípravek DEPO-PROVERA nepoužívejte po uplynutí doby použitelnosti, uvedené na krabičce za Použitelné do:. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce. Vzhledem k tomu, že se balení přípravku DEPO-PROVERA může skládat z více částí (jednorázová injekční stříkačka a samostatně sterilně balená jehla), z nichž každá má svoji dobu použitelnosti, řídí se celková doba použitelnosti přípravku kratší z nich.
- Při teplotě do 25 °C
Pečlivě zlikvidujte suspenzi přípravku DEPO-PROVERA, která nebyla injekcí podána. Stříkačky a jehly nesmí být NIKDY znovu použity. Všechen nepoužitý přípravek musí být po podání bezpečně zlikvidován v souladu s místními požadavky.
6. Obsah balení a další informace
Co přípravek DEPO-PROVERA obsahuje
Léčivou látkou je medroxyprogesteroní acetas (MPA) 150 mg.
Pomocnými látkami jsou makrogol 3000, methylparaben (E 218), propylparaben (E 216), chlorid sodný, polysorbát 80, hydroxid sodný/kyselina chlorovodíková na úpravu pH, voda na injekci
Jak přípravek DEPO-PROVERA vypadá a co obsahuje toto balení
Přípravek DEPO-PROVERA je bílá nebo téměř bílá suspenze pro intramuskulární injekci (injekce podávaná do svalu). Přípravek je dodáván v obalech:
-
a) skleněná lahvička, pryžová zátka, plastový kryt (pertl)
-
b) jednorázová injekční stříkačka z bezbarvého skla, na jedné straně pryžový kryt, na druhé straně pryžový píst s plastovým (PP) nástavcem, samostatně sterilně balená jehla na jedno použití s krytem, v zataveném fóliovém blistru a krabičce.
Velikost balení:
Lahvičky o obsahu 150 mg/ml, 500 mg/3,3 ml a 1000 mg/6,7 ml Jednorázová stříkačka o obsahu 150 mg/ml
Na trhu nemusí být k dispozici všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Držitel rozhodnutí o registraci
Pfizer, spol. s r.o.
Stroupežnického 17
150 00 Praha 5
Česká republika
Výrobce
Pfizer Manufacturing Belgium NV
Rijksweg 12
B-2870 Puurs
Belgie
Tato příbalová informace byla naposledy revidována: 3. 7. 2018
11
Další informace o léčivu DEPO-PROVERA
Jak
se DEPO-PROVERA
podává: intramuskulární podání - injekční suspenze
Výdej
léku: na lékařský předpis
Balení: Injekční lahvička
Velikost
balení: 1X3,3ML
Držitel rozhodnutí o registraci daného léku v České republice:
Pfizer, spol. s r.o., Praha
E-mail: Medicalinfo.cz@pfizer.com
Telefon: 283 004 111
