Souhrnné informace o léku - BOCOUTURE
1. NÁZEV PŘÍPRAVKU
BOCOUTURE 50 jednotek prášek pro injekční roztok
BOCOUTURE 100 jednotek prášek pro injekční roztok
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ"
BOCOUTURE 50 jednotek:
Jedna injekční lahvička obsahuje toxinum botulinicum typus A 50 jednotek (150 kD), sine complex proteine.
BOCOUTURE 100 jednotek:
Jedna injekční lahvička obsahuje toxinum botulinicum typus A 100 jednotek (150 kD), sine complex proteine.
* Toxinum botulinicumtypus A sine complex proteine, očištěný od kultur Clostridium botulinum (Hall kmen)
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Prášek pro injekční roztok (prášek pro injekci)
Bílý prášek
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
BOCOUTURE je indikován k přechodnému zlepšení vzhledu vrásek v horní části obličeje u dospělých do
65 let, jestliže závažnost těchto vrásek má důležitý psychologický dopad na pacienta:
- středně výrazných až výrazných vertikálních vrásek mezi obočím viditelných při maximálním zamračení (glabelární vrásky) a/nebo
- středně výrazných až výrazných laterálních periorbitálních vrásek viditelných při maximálním úsměvu (vějířovité vrásky, tzv. crow's feet) a/nebo
- středně výrazných až výrazných horizontálních vrásek na čele viditelných při maximální kontrakci
4.2 Dávkování a způsob podání
Podrobné informace o klinických studiích přípravku BOCOUTURE v porovnání s konvenčním botulotoxinem typu A (900 kD) viz bod 5.1.
BOCOUTURE má podávat pouze lékař s příslušnou kvalifikací a doloženou odbornou zkušeností s aplikací botulotoxinu typu A.
Vertikální vrásky mezi obočím viditelné při maximálním zamračení (glabelární vrásky) Rekonstituovaný přípravek BOCOUTURE v dávce 4 jednotky je injekčně podáván do každého z pěti míst: 2 injekce do každého musculus corrugator a 1 injekce do musculus procerus, to odpovídá standardní dávce 20 jednotek. Dávka může být lékařem zvýšena až na 30 jednotek, pokud to vyžaduje individuální potřeba pacienta, s nejméně 3měsíčním intervalem mezi léčebnými kúrami.
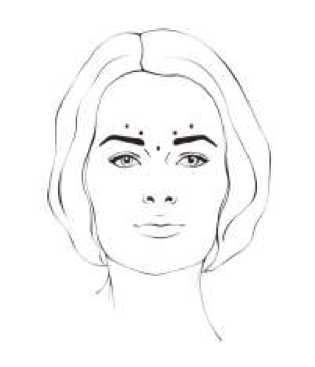
Zlepšení vertikálních vrásek mezi obočím viditelných při maximálním zamračení (glabelární vrásky) obecně nastává během 2 – 3 dnů, s pozorovaným maximálním účinkem 30. den. Účinek přetrvává až 4 měsíce od injekce.
Laterální periorbitální vrásky viditelné při maximálním úsměvu (vějířovité vrásky, tzv. crow's feet)
Rekonstituovaný přípravek BOCOUTURE v dávce 4 jednotky je injekčně podáván bilaterálně do každého ze tří míst vpichu. Jedna injekce se podá přibližně 1 cm laterálně od okraje kosti očnicového oblouku. Další dvě
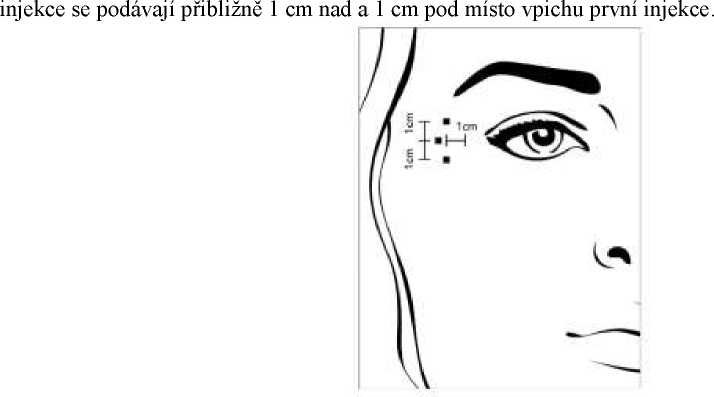
Celková doporučená běžná dávka pro jednu léčbu je 12 jednotek na každé straně (celková dávka: 24 jednotek).
Zlepšení laterálních periorbitálních vrásek viditelných při maximálním úsměvu (vějířovité vrásky, tzv. crow's feet) většinou nastává během prvních 6 dnů, s maximálním pozorovaným účinkem 30. den. Účinek přetrvává až 4 měsíce od aplikace injekce.
V současné době nejsou k dispozici údaje o účinnosti a bezpečnosti přípravku pro více než dvě injekce u laterálních periorbitálních vrásek viditelných při maximálním úsměvu v odstupu 4 měsíců.
Horizontální vrásky na čele viditelné při maximální kontrakci
Doporučená celková dávka se pohybuje mezi 10 až 20 jednotkami dle individuální potřeby pacientů, přičemž mezi léčebnými kúrami má být nejméně 3měsíční interval. Rekonstituovaný přípravek BOCOUTURE v celkové dávce 10 jednotek až 20 jednotek je injekčně podáván do musculus frontalis na pěti místech ve stejné výšce nejméně 2 cm nad okrajem orbity. Do jednoho místa injekce se aplikuje objem 2 jednotky, 3 jednotky či 4 jednotky, dle celkové dávky.
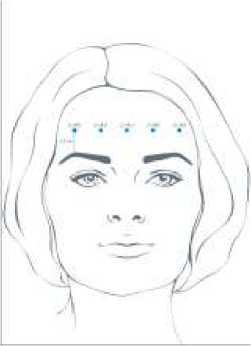
Zlepšení horizontálních vrásek na čele viditelných při maximální kontrakci obvykle nastává během prvních 7 dnů, s maximálním pozorovaným účinkem 30. den. Účinek přetrvává až 4 měsíce od aplikace injekce.
V současné době nejsou k dispozici údaje o účinnosti a bezpečnosti přípravku pro více než dvě léčebné kúry horizontálních vrásek na čele viditelných při maximální kontrakci v odstupu 4 až 5 měsíců.
Všechny indikace
Pokud během 1 měsíce po injekci nedojde ke zlepšení, je možné zvážit následující přístupy:
- Analýza příčin selhání, např. příliš nízká dávka, nesprávná injekční technika, možný rozvoj protilátek neutralizujících toxin
- Úprava dávky podle analýzy posledního selhání léčby
- Přehodnocení vhodnosti léčby botulotoxinem typu A coby adekvátní terapie
- V případě nepřítomnosti nežádoucích účinků v průběhu první léčebné kúry lze zahájit další cyklus léčby při zachování minimálně tříměsíčního intervalu mezi úvodní a opakovanou léčbou.
Jsou k dispozici omezené klinické údaje ze studií fáze 3 o použití přípravku BOCOUTURE u pacientů nad 65 let. Dokud u této skupiny nebudou k dispozici další údaje, přípravek BOCOUTURE není pro pacienty nad 65 let doporučen.
Bezpečnost a účinnost přípravku BOCOUTURE při léčbě vertikálních vrásek mezi obočím viditelných při maximálním zamračení, laterálních periorbitálních vrásek viditelných při maximálním úsměvu a horizontálních vrásek na čele viditelných při maximální kontrakci u dětí a dospívajících do 18 let nebyla studována. Proto není přípravek BOCOUTURE v pediatrické populaci doporučen.
Způsob podání
Všechny indikace
Rekonstituovaný přípravek BOCOUTURE je určen k intramuskulární aplikaci.
Po rekonstituci musí být přípravek BOCOUTURE použit okamžitě a smí být použit pouze pro léčbu jednoho pacienta během jediného léčebného zákroku.
Rekonstituovaný přípravek BOCOUTURE je aplikován tenkou sterilní jehlou (např. 30–33 G/průměr 0,200,30 mm/délka 13 mm). Doporučuje se injekční objem přibližně 0,04 až 0,1 ml do jednoho místa injekce.
Pokyny pro rekonstituci léčivého přípravku před podáním a pro likvidaci injekčních lahviček jsou uvedeny v bodu 6.6.
Intervaly mezi jednotlivými léčebnými kúrami nemají být kratší než tři měsíce. V případě selhání léčby nebo sníženého účinku po opakovaných injekcích je zapotřebí použít alternativní léčebné metody.
Vertikální vrásky mezi obočím viditelné při maximálním zamračení (glabelární vrásky)
Před a při aplikaci injekce je nutné pevně přiložit palec nebo ukazováček pod okraj orbity, aby se zabránilo difúzi roztoku do této oblasti. Jehla má být během aplikace injekce orientována superiorně a mediálně. Aby se snížilo riziko blefaroptózy, je nutné se vyhnout aplikaci injekce v blízkosti musculus levator palpebrae superioris a v kraniální části musculus orbicularis oculi. Injekce do musculus corrugator supercilii se musí provádět v centrální části tohoto svalu, nejméně 1 cm nad hranou orbity.
Laterální periorbitální vrásky viditelné při maximálním úsměvu (vějířovité vrásky, tzv. crow's feet)
Injekce se podává intramuskulárně do musculus orbicularis oculi, přímo pod dermis, aby se předešlo difúzi přípravku BOCOUTURE. Ke snížení rizika ptózy rtu je nutné se vyhnout injekci v blízkosti musculus zygomaticus major.
Horizontální vrásky na čele viditelné při maximální kontrakci
Je třeba zabránit paralýze hlubších svalových vláken injekcí přípravku BOCOUTURE poblíž okraje orbity, aby se snížilo riziko ptózy obočí.
4.3 Kontraindikace
- Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1
- Generalizované poruchy svalové aktivity (např. myasthenia gravis, Lambert-Eatonův syndrom)
- Infekce nebo zánět v navrhovaném místě aplikace.
4.4 Zvláštní upozornění a opatření pro použití
Obecné
Před podáním přípravku BOCOUTURE se musí lékař nejprve seznámit s anatomií pacienta a změnami vyvolanými předchozími chirurgickými výkony.
Musí být zajištěno, aby přípravek BOCOUTURE nebyl aplikován do krevní cévy.
Je třeba vzít v úvahu, že horizontální vrásky na čele nemusí být pouze dynamické, ale mohou být též způsobeny ztrátou elasticity kůže (např. ve spojitosti se stárnutím nebo poškozením od slunečního záření). V takovém případě pacient nemusí reagovat na léčbu přípravky obsahujícími botulotoxin.
BOCOUTURE musí být používán s opatrností:
- pokud je přítomna krvácivá porucha jakéhokoli typu
- u pacientů užívajících antikoagulační léčbu nebo jiné léky, které by mohly mít antikoagulační účinek.
Lokální a vzdálené šíření toxinu
Nežádoucí účinky mohou nastat u chybně umístěných injekcí botulotoxinu typu A s dočasnou paralýzou okolních skupin svalů.
Byly hlášeny nežádoucí účinky pravděpodobně související se šířením botulotoxinu typu A do vzdálených míst od místa podání (viz bod 4.8).
Pacienti léčení terapeutickými dávkami mohou zaznamenat nadměrnou svalovou slabost.
Pacienti nebo ošetřovatelé mají být upozorněni, aby vyhledali okamžitě lékařskou pomoc, pokud se vyskytnou poruchy polykání, řeči nebo dýchání.
Stávající neuromuskulární poruchy
Injekce přípravku BOCOUTURE se nedoporučuje u pacientů s anamnézou dysfagie a aspirace. BOCOUTURE musí být používán s opatrností:
- u pacientů trpících amyotrofní laterární sklerózou
- u pacientů s jiným onemocněním způsobujícím periferní neuromuskulární dysfunkci
- pokud je v cílovém svalu výrazná slabost nebo atrofie.
Hypersenzitivní reakce
Při použití přípravků obsahujících botulotoxin typu A byly hlášeny hypersenzitivní reakce. Pokud se vyskytnou závažné (anafylaktické reakce) a/nebo okamžité hypersenzitivní reakce, je třeba nasadit vhodnou léčbu.
Tvorba protilátek
Příliš častá aplikace může zvýšit riziko tvorby protilátek, což může vést k selhání léčby (viz bod 4.2). Potenciál pro tvorbu protilátek je možno minimalizovat podáváním nejnižší účinné dávky v indikovaných minimálních intervalech mezi injekcemi.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie lékových interakcí.
Účinek botulotoxinu může být teoreticky potencován aminoglykosidovými antibiotiky nebo jinými léčivými přípravky, které interferují s neuromuskulárním přenosem, např. tubokurarinová svalová relaxancia.
Proto současná léčba přípravkem BOCOUTURE a aminoglykosidovými antibiotiky nebo spektinomycinem vyžaduje zvýšenou pozornost. Periferní svalová relaxancia musí být používána s opatrností, v případě nutnosti je třeba snížit úvodní dávku relaxancia nebo užít střednědobě působící substanci, jako je vekuronium a atrakurium, místo substance působící dlouhodobě.
4-aminochinoliny mohou snížit účinek přípravku BOCOUTURE.
4.6 Fertilita, těhotenství a kojení
Těhotenství
Nejsou k dispozici žádné adekvátní údaje o použití botulotoxinu typu A u těhotných žen. Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3). Není známé možné riziko pro lidi.
BOCOUTURE nemá být používán u těhotných žen, pokud to není bezpodmínečně nutné a pokud potenciální přínos neodůvodňuje riziko.
Kojení
Není známo, zda se botulotoxin typu A vylučuje do mateřského mléka. Proto přípravek BOCOUTURE nemá být během kojení používán.
Fertilita
Nejsou k dispozici klinické údaje týkající se použití botulotoxinu typu A. U králíků nebyly zjištěny žádné nežádoucí účinky na fertilitu samců ani samic (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
BOCOUTURE má malý nebo mírný vliv na schopnost řídit a obsluhovat stroje. Pacienti mají být poučeni, aby neřídili či nevykonávali jiné potenciálně rizikové činnosti, pokud se u nich vyskytne únava, svalová slabost, závratě, poruchy vidění či pokles očních víček.
4.8 Nežádoucí účinky
Obvykle jsou nežádoucí účinky pozorovány během několika prvních týdnů po injekci a jsou přechodné. Nežádoucí účinky mohou být způsobeny léčivou látkou, injekční procedurou i kombinací obou příčin.
Nežádoucí účinky nezávislé na indikaci
Nežádoucí účinky související s aplikací
Výkon může být spojen s lokální bolestí, zánětem, parestézií, hypestézií, citlivostí, edémem, erytémem, svěděním, lokalizovanou infekcí, hematomem, krvácením a/nebo modřinami v důsledku injekčního podání. Bolest a/nebo strach související s injekcí mohou způsobit vasovagální reakce, včetně přechodného symptomatického snížení krevního tlaku, nauzey, tinitu a mdloby.
Nežádoucí účinky spojené s botulotoxinem typu A
Lokální svalová slabost představuje očekávané farmakologické působení botulotoxinu typu A ve svalové tkáni. Blefaroptóza, která může souviset s injekční technikou, je ve shodě s farmakologickým působením přípravku BOCOUTURE.
Šíření toxinu
Po podání botulotoxinu v jiných indikacích byly velmi vzácně hlášeny nežádoucí účinky v důsledku šíření toxinu do vzdálených míst od místa podání způsobující symptomy odpovídající účinkům botulotoxinu typu A (nadměrná svalová slabost, dysfagie a aspirační pneumonitida někdy s fatálním výsledkem) (viz bod 4.4). Tyto nežádoucí účinky nelze při použití přípravku BOCOUTURE zcela vyloučit.
Hypersenzitivní reakce
Vzácně byly hlášeny závažné a/nebo okamžité hypersenzitivní reakce včetně anafylaxe, sérové nemoci, kopřivky, edému měkkých tkání a dušnosti. Některé z těchto reakcí byly hlášeny po použití běžného botulotoxinu typu A buď samotného, nebo v kombinaci s jinými látkami, o nichž je známo, že způsobují podobné reakce.
Nežádoucí účinky z klinických zkušeností
Frekvence výskytu nežádoucích účinků uvedená níže vychází z klinické zkušenosti.
Frekvence je definována následujícím způsobem: velmi časté (> 1/10), časté (> 1/100 až < 1/10), méně časté (> 1/1000 až < 1/100), vzácné (> 1/10000 až < 1/1000), velmi vzácné (< 1/10000).
Vertikální vrásky mezi obočím viditelné při maximálním zamračení (glabelární vrásky)
Při použití přípravku BOCOUTURE byly hlášeny následující nežádoucí účinky.
Infekce a infestace
Méně časté: bronchitida, nasofaryngitida, onemocnění podobné chřipce
Psychiatrické poruchy
Méně časté: nespavost
Poruchy nervového systému
Časté: bolest hlavy
Poruchy oka
Méně časté: otok víčka, ptóza očního víčka, rozmazané vidění
Poruchy kůže a podkožní tkáně
Méně časté: svědění, uzlíky v kůži, ptóza obočí
Poruchy svalové a kosterní soustavy a pojivové tkáně
Časté: poruchy svalů (zvednutí obočí)
Méně časté: záškuby ve svalech, svalové křeče, obličejová asymetrie (asymetrické obočí)
Celkové poruchy a reakce v místě aplikace
Méně časté: hematom v místě vpichu, bolest v místě vpichu (lokální), citlivost, únava, pocit nepohody
(pocit těžkých víček/obočí)
Cévní poruchy:
Méně časté: hematom
Laterální periorbitální vrásky viditelné při maximálním úsměvu (vějířovité vrásky, tzv. crow's feet)
Při použití přípravku BOCOUTURE byly hlášeny následující nežádoucí účinky:
Poruchy oka
Časté: otok víčka, suché oko
Celkové poruchy a reakce v místě aplikace
Časté: hematom v místě vpichu
Vrásky v horní části obličeje
Při použití přípravku BOCOUTURE byly hlášeny následující nežádoucí účinky:
Poruchy nervového systému
Velmi časté: bolest hlavy
Časté: hypestezie
Celkové poruchy a reakce v místě aplikace
Časté: hematom v místě vpichu, bolest v místě vpichu injekce, erytém v místě injekce,
pocit nepohody (pocit tíhy v oblasti čela)
Poruchy oka
Časté: ptóza víčka, suché oko
Poruchy kůže a podkožní tkáně:
Méně časté: ptóza obočí
Poruchy svalové a kosterní soustavy a pojivové tkáně
Časté: obličejová asymetrie
Gastrointestinální poruchy
Časté: nauzea
Hlášeny byly symptomy připomínající chřipku a hypersenzitivní reakce jako otok, edém (i vzdálený od místa vpichu injekce), erytém, svědění, vyrážka (lokalizovaná i generalizovaná) a dušnost.
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky: http: /
4.9 Předávkování
Příznaky předávkování:
Zvýšené dávky botulotoxinu typu A mohou způsobit silnou neuromuskulární paralýzu v místech od vpichu vzdálených s různými symptomy. Příznaky mohou zahrnovat celkovou slabost, ptózu, diplopii, dýchací obtíže, potíže při řeči, paralýzu dýchacích svalů nebo potíže při polykání, které mohou způsobit aspirační pneumonii.
Léčba předávkování:
V případě předávkování má být pacient pod lékařským dohledem se sledováním symptomů nadměrné svalové slabosti nebo svalové paralýzy. Může být zapotřebí symptomatická léčba. Jestliže dojde k paralýze dýchacích svalů, může být zapotřebí nasadit respirační podporu.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: myorelaxancia, jiná periferně působící myorelaxancia ATC kód: M03AX01
Botulotoxin typu A blokuje periferní uvolňování acetylcholinu na presynaptických zakončeních cholinergních nervů. Nervová zakončení neuromuskulárních spojů dále neodpovídají na nervové impulzy a sekrece neurotransmiteru v motorických koncových ploténkách je blokována (chemická denervace). Mechanizmus obnovení přenosu vzruchu spočívá v tvorbě nových nervových zakončení a obnovení propojení s koncovými motorickými ploténkami.
Mechanismus účinku
Mechanizmus účinku botulotoxinu typu A na cholinergní nervová zakončení může být popsán ve 4 následných krocích:
- Vazba: Těžký řetězec botulotoxinu typu A se váže s výjimečně vysokou selektivitou a afinitou na receptory nacházející se pouze na cholinergních zakončeních.
- Internalizace: Konstrikce membrány na nervových zakončeních a absorpce toxinu dovnitř (endocytóza).
- Translokace: Konečný amino-segment neurotoxinového těžkého řetězce tvoří póry ve vesikulární membráně, jsou rozštěpeny disulfidické vazby a lehký neurotoxinový řetězec prochází póry do cytosolu.
- Účinek: Po uvolnění lehkého neurotoxinového řetězce se velmi specificky štěpí cílový protein (SNAP 25), který je nezbytný pro uvolnění acetylcholinu.
K úplnému obnovení funkce koncových plotének / přenosu vzruchu dochází obvykle během 3 – 4 měsíců po intramuskulární injekci, kdy nervová zakončení vyrostou a znovu se spojí s motorickou ploténkou.
Výsledky klinických studií
Vertikální vrásky mezi obočím viditelné při maximálním zamračení (glabelární vrásky)
Celkem 994 subjektů se středně výraznými až výraznými svislými vráskami mezi obočím při maximálním zamračení bylo zařazeno do studií přípravku BOCOUTURE v indikaci glaberálních vrásek. Z těchto subjektů bylo 169 (> 18 let) léčeno přípravkem BOCOUTURE ve střední periodě pivotní fáze III dvojitě slepé placebem kontrolované studie a 236 subjektů bylo léčeno v otevřeném prodloužení (OLEX) této studie. Úspěšnost léčby byla definována jako hodnocení „žádné“ či „mírné“ na 4bodové stupnici obličejových vrásek stanovené hodnotitelem ve 4. týdnu při maximálním zamračení. Studie prokázala statisticky signifikantní a klinicky relevantní účinnost 20 jednotek přípravku BOCOUTURE ve srovnání s placebem. Celková míra úspěšnosti byla 51,5 % ve skupině léčené přípravkem BOCOUTURE vs. 0 % v placebo skupině. V pivotní studii nebylo u žádného pacienta léčeného přípravkem BOCOUTURE zaznamenáno zhoršení. To bylo potvrzeno vyšším počtem reagujících na léčbu ve dni 30 podle měřítka faciálních vrásek při maximálním zamračení, a to při hodnocení jak hodnotiteli, tak samotnými pacienty, s významně vyšším podílem reagujících na léčbu ve skupině užívající 20 jednotek přípravku BOCOUTURE ve srovnání se skupinou s placebem.
Analýza subskupiny prokazuje nižší účinnost u pacientů nad 50 let ve srovnání s pacienty mladšími. V této subskupině bylo zahrnuto 113 subjektů ve věku 50 let a méně a 56 subjektů nad 50 let. Účinnost u mužů je nižší než u žen. Bylo zahrnuto 33 mužských a 136 ženských subjektů.
Ve dvou srovnávacích, prospektivních, multicentrických, randomizovaných, dvojitě zaslepených studiích (n = 631) s jednorázovými dávkami (20, respektive 24 jednotek) byla prokázána terapeutická ekvivalence přípravku BOCOUTURE se srovnávaným přípravkem Vistabel/Botox obsahujícím komplex botulotoxinu typu A (onabotulinumtoxin A, 900 kD). Výsledky studie prokázaly, že přípravek BOCOUTURE a srovnávaný přípravek mají podobný profil účinnosti a bezpečnosti u pacientů se středně závažnými až závažnými glabelárními vráskami při použití v dávkovém konverzním poměru 1:1 (viz bod 4.2).
Dlouhodobá bezpečnost při opakované léčbě (20 jednotek) glaberálních vrásek byla prokázána ve studii fáze III s obdobím léčby až dva roky a podáváním až 8 injekčních cyklů za sebou (MRZ 60201–0609, n=796) [Rzany et al., 2013].
Laterální periorbitální vrásky viditelné při maximálním úsměvu (vějířovité vrásky, tzv. crow's feet) Ve studii fáze III bylo celkem 111 subjektů se středně závažnými až závažnými laterálními periorbitálními vráskami viditelnými při maximálním úsměvu (vějířovité vrásky, tzv. crow's feet) léčeno během 1 cyklu 12 jednotkami přípravku BOCOUTURE nebo placebem na každé straně (pravé/levé okolí oka) a porovnávalo se schéma podání injekce do 3 míst a do 4 míst. Úspěšnost léčby byla definována jako alespoň 1 bodové zlepšení na 4bodové stupnici hodnocené nezávislým hodnotitelem ve 4. týdnu pomocí standardizovaných digitálních fotografií pořízených při maximálním úsměvu pro obě oblasti očí v porovnání s výchozím stavem. Schéma se 3 i 4 injekcemi prokázalo superioritu proti placebu. Při injekci do 3 míst došlo ke zlepšení laterálních periorbitálních vrásek u 69,9 % subjektů ve skupině léčené přípravkem BOCOUTURE v porovnání s 21,4 % subjektů v placebo skupině a při injekci do 4 míst došlo ke zlepšení laterálních periorbitálních vrásek u 68,7 % subjektů ve skupině léčené přípravkem BOCOUTURE v porovnání s 14,3 % subjektů v placebo skupině. U žádného pacienta léčeného přípravkem BOCOUTURE nebylo pozorováno zhoršení. To bylo potvrzeno vyšším počtem reagujících na léčbu v den 30, kteří byli hodnoceni na 4bodové stupnici při maximálním úsměvu, a to jak hodnotiteli, tak samotnými pacienty, kdy se ukázal signifikantně vyšší podíl reagujících na léčbu, kterým bylo aplikováno 12 jednotek přípravku BOCOUTURE ke každému oku v porovnání se skupinou s placebem.
Účinnost a bezpečnost 54 až 64 jednotek přípravku BOCOUTURE v kombinované léčbě vrásek v horní části obličeje (glabelární vrásky viditelné při zamračení, laterální periorbitální vrásky a horizontální vrásky na čele) byla hodnocena v placebem kontrolované studii fáze III, která zahrnovala 156 subjektů. Respondenti byli definováni jako pacienti se skóre „žádné“ či „mírné“ při maximální kontrakci stanoveném hodnotitelem na 5bodových Merzových estetických stupnicích. Analýza prokázala statisticky významné léčebné rozdíly a vysoké procento respondentů u přípravku BOCOUTURE při léčbě glabelárních vrásek viditelných při zamračení, laterálních periorbitálních vrásek a horizontálních vrásek na čele, a také u všech tří oblastí současně:
Celkem 82,9 % subjektů léčených přípravkem BOCOUTURE prokázalo zlepšení u glabelárních vrásek viditelných při zamračení, kdežto u pacientů léčených placebem nebyl žádný respondent. U laterálních periorbitálních vrásek bylo zlepšení pozorováno u celkem 63,8 % subjektů léčených přípravkem BOCOUTURE ve srovnání s 2,0 % subjektů léčených placebem. Celkem 71,4 % subjektů léčených přípravkem BOCOUTURE prokázalo zlepšení u horizontálních vrásek na čele, kdežto mezi subjekty léčenými placebem byl pouze jeden respondent (2,0 %). U všech tří oblastí současně bylo zlepšení zaznamenáno u většiny subjektů ve skupině léčené přípravkem BOCOUTURE (54,3 %) a u žádného subjektu ve skupině léčené placebem (0,0 %).
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem BOCOUTURE u všech podskupin pediatrické populace v léčbě vrásek způsobených svalovou činností (informace o použití u pediatrické populace viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Obecná charakteristika léčivé látky
Klasické studie kinetiky a distribuce nemohou být s botulotoxinem typu A provedeny, jelikož léčivá látka se aplikuje ve velmi malých množstvích (pikogramy v injekci) a rychle a ireverzibilně se váže na cholinergní nervová zakončení.
Nativní botulotoxin typu A je komplex o velké molekulové hmotnosti, který mimo neurotoxin (150 kD) obsahuje další netoxické proteiny jako hemaglutiny a nehemaglutiny. Na rozdíl od konvenčních přípravků obsahujících komplex botulotoxinu typu A, BOCOUTURE obsahuje čistý (150 kD) neurotoxin, sine complex proteine a má tudíž nízký obsah cizorodých bílkovin. Obsah cizorodých bílkovin je považován za jeden z faktorů sekundárního selhání léčby.
Botulotoxin typu A po intramuslulární injekci podléhá retrográdnímu axonickému transportu. Retrográdní transsynaptický přechod aktivního botulotoxinu typu A do CNS ale nebyl v terapeuticky relevantních dávkách popsán.
Botulotoxin typu A navázaný na receptor endocytózou vstupuje do nervových zakončení a po dosažení cílového proteinu (SNAP 25) se štěpí intracelulárně. Volné cirkulující molekuly botulotoxinu typu A, které nebyly navázány na nervové presynaptické cholinergní konečné receptory, jsou fagocytovány nebo pinocytovány a rozloženy jako ostatní volné cirkulující proteiny.
Distribuce účinné látky u pacientů
Farmakokinetické studie s přípravkem BOCOUTURE nebyly u lidí provedeny z výše uvedených důvodů.
5.3 Předklinické údaje vztahující se k bezpečnosti
Předklinické údaje založené na konvenčních studiích kardiovaskulární a intestinální bezpečnosti neprokazují žádné zvláštní riziko u lidí.
Nálezy systémové toxicity ve studiích chronické toxicity přípravku BOCOUTURE u zvířat většinou souvisely s farmakodynamickým účinkem, např. atonie, paréza a atrofie svalu, do kterého byla injekce podána.
Nebyly nalezeny známky místní nesnášenlivosti. Reprodukční studie s přípravkem BOCOUTURE neprokázaly nežádoucí účinky na samčí a samičí fertilitu u králíků, ani účinky na embryofetální vývoj či na pre- a postnatální vývoj u potkanů a/nebo králíků. Přesto, podávání přípravku BOCOUTURE v různých intervalech (denně či méně často) ve studiích embryotoxicity v dávkách vykazujících snížení hmotnosti u matky v týdenních až 2týdenních intervalech zvýšilo počet potratů u králíků a mírné snížení tělesné hmotnosti plodu u potkanů. Předpoklad kontinuální systémové expozice samic během (neznámé) senzitivní fáze organogeneze jako nezbytný předpoklad pro vyvolání teratogenních účinků nemůže být v těchto studiích nezbytně přijat. Podobně i bezpečnostní hranice s ohledem na klinickou terapii byly obecně nízké z hlediska vysokých klinických dávek.
S přípravkem BOCOUTURE nebyly prováděny žádné studie genotoxicity či kancerogenity.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Lidský albumin
Sacharosa
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky, s výjimkou přípravků uvedených v bodu 6.6.
6.3 Doba použitelnosti
3 roky
Rekonstituovaný přípravek
Po rekonstituci byla doložena chemická a fyzikální stabilita na 24 hodin při teplotě 2 °C – 8 °C. Z mikrobiologického hlediska má být přípravek použit okamžitě. Není-li použit okamžitě, doba a podmínky uchovávání přípravku po otevření před použitím jsou v odpovědnosti uživatele a normálně by doba neměla být delší než 24 hodin při 2 °C-8 °C, pokud rekonstituce neproběhla za kontrolovaných a validovaných aseptických podmínek.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25 °C.
Podmínky uchovávání rekonstituovaného přípravku viz bod 6.3.
6.5 Druh obalu a obsah balení
Injekční lahvička (sklo třídy I) se zátkou (bromobutylová pryž) a fólií garantující neporušenost obalu (hliník).
Velikost balení: 1, 2, 3 a 6 injekčních lahviček.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Rekonstituce
Před použitím se přípravek BOCOUTURE rekonstituuje 0,9 % roztokem chloridu sodného (9 mg/ml).
Rekonstituce a ředění musejí probíhat v souladu s pravidly správné klinické praxe, zvláště pak s ohledem na aseptické podmínky.
Doporučuje se připravovat roztok a plnit injekční stříkačku nad plastem potaženou papírovou utěrkou, která zachytí případné rozlití roztoku. Správné množství roztoku chloridu sodného se vtáhne do injekční stříkačky. K rekonstituci se doporučuje krátká zkosená jehla velikosti 20–27 gauge. Po vertikálním zavedení jehly skrz gumovou zátku se rozpouštědlo aplikuje zvolna do injekční lahvičky, aby se zamezilo tvorbě pěny. Lahvička musí být zlikvidována, pokud rozpouštědlo není vtaženo vakuem do lahvičky. Stříkačka se vyjme z injekční lahvičky a přípravek BOCOUTURE se smíchá s rozpouštědlem opatrným kroužením/přetáčením injekční lahvičky nahoru a dolů – netřepejte silně. V případě potřeby se jehla použitá k rekonstituci ponechá v lahvičce a požadované množství roztoku se natáhne novou sterilní jehlou vhodnou k podání injekce.

Rekonstituovaný přípravek BOCOUTURE je čirý, bezbarvý roztok.
BOCOUTURE nesmí být použit, pokud je rekonstituovaný přípravek zakalený, obsahuje sraženiny nebo viditelné částice.
Možná ředění přípravků BOCOUTURE 50 a 100 jednotek jsou uvedena v následující tabulce:
| Výsledná dávka (v jednotkách na 0,1 ml) | Přidané rozpouštědlo (chlorid sodný 9 mg/ml (0,9 %) roztok pro injekci) | |
| Lahvička obsahující 50 jednotek | Lahvička obsahující 100 jednotek | |
| 5 jednotek | 1 ml | 2 ml |
| 4 jednotky | 1,25 ml | 2,5 ml |
Veškerý roztok pro injekce, který je uchováván po více než 24 hodin i všechen nepoužitý roztok pro injekce má být zlikvidován.
Bezpečná likvidace injekčních lahviček, injekčních stříkaček a použitého materiálu
Všechny nepoužité injekční lahvičky, zbytky roztoku v injekční lahvičce a/nebo injekční stříkačky musejí být autoklávovány. Alternativně může být zbytek přípravku BOCOUTURE inaktivován jedním z následujících roztoků: 70% ethanol, 50% isopropanol, 0,1% SDS (aniontový detergent), naředěný roztok hydroxidu sodného (0,1 N NaOH) nebo chlornanu sodného (nejméně 0,1% NaClO).
Po inaktivaci nesmějí být použité injekční lahvičky, injekční stříkačky a materiál vyhozeny, ale musejí být uloženy do vhodných kontejnerů a zlikvidovány v souladu s místními nařízeními.
Doporučení v případě nehody při manipulaci s botulotoxinem typu A
- Veškerý vysypaný nebo rekonstituovaný vylitý přípravek je nutné otřít: buď se použije absorpční materiál napuštěný některým z uvedených roztoků v případě prášku, nebo suchým absorpčním materiálem v případě vylití rekonstituovaného přípravku.
- Kontaminované povrchy se musí vyčistit absorpčním materiálem napuštěným některým z uvedených roztoků a poté osušit.
- Jestliže se injekční lahvička rozbije, opatrně posbírejte kusy skla a vytřete přípravek, jak je výše uvedeno, dejte pozor, abyste se nepořezali.
- Při kontaktu přípravku s pokožkou opláchněte postiženou plochu velkým množstvím vody.
- Při vniknutí do očí důkladně oči propláchněte velkým množstvím vody nebo roztokem pro výplach očí.
- Jestliže se přípravek dostane do kontaktu s poraněním, s pořezanou nebo popraskanou pokožkou, omyjte ránu velkým množstvím vody a podnikněte příslušná lékařská opatření podle injekčně podané dávky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Merz Pharmaceuticals GmbH
Eckenheimer LandstraBe 100
60318 Frankfurt/Main
Německo
Tel.: +49–69/15 03–1
Fax: +49–69/15 03–200
8. REGISTRAČNÍ ČÍSLO(A)
BOCOUTURE 50 jednotek: 63/776/10-C
BOCOUTURE 100 jednotek: 63/438/16-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
BOCOUTURE 50 jednotek:
Datum první registrace: 29. 9. 2010
Prodloužení registrace: 1. 6. 2016
BOCOUTURE 100 jednotek:
Datum první registrace: 9. 11. 2016
Další informace o léčivu BOCOUTURE
Jak
se BOCOUTURE
podává: intramuskulární podání - prášek pro injekční roztok
Výdej
léku: na lékařský předpis
Balení: Injekční lahvička
Velikost
balení: 6
Držitel rozhodnutí o registraci daného léku v České republice:
Merz Pharmaceuticals GmbH, Frankfurt am Main
E-mail: petra.arz@merz.de
Telefon: +49 69 1503 775
