Souhrnné informace o léku - YANIMO RESPIMAT 2,5 MIKROGRAMŮ/2,5 MIKROGRAMŮ
'V Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8.
1
Yanimo Respimat 2,5 mikrogramů/2,5 mikrogramů, roztok k inhalaci
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Podaná dávka obsahuje tiotropium 2,5 mikrogramu (jako tiotropii bromidum monohydricum) a olodaterolum 2,5 mikrogramu (jako olodateroli hydrochloridum) v jednom vstřiku.
Podaná dávka je dávka, která je po průchodu náustkem pacientovi k dispozici.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Roztok k inhalaci
Čirý bezbarvý roztok k inhalaci
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Yanimo Respimat je indikován jako udržovací bronchodilatační léčba ke zmírnění symptomů u dospělých pacientů s chronickou obstrukční plicní nemocí (CHOPN).
4.2 Dávkování a způsob podání
Dávkování
Přípravek je určen pouze k inhalaci. Náplň lze vložit a použít pouze s inhalátorem Respimat.
Jednu léčivou dávku tvoří dva vstřiky z inhalátoru Respimat.
Dospělí
Doporučená dávka přípravku je 5 mikrogramů tiotropia a 5 mikrogramů olodaterolu podaná jako dva vstřiky z inhalátoru Respimat jednou denně, ve stejnou denní dobu.
Doporučená dávka nemá být překročena.
Starší pacienti
Starší pacienti mohou používat přípravek Yanimo Respimat v doporučené dávce.
Porucha funkce jater a ledvin
Yanimo Respimat obsahuje tiotropium, které se vylučuje převážně renální cestou, a olodaterol, který se převážně metabolizuje v játrech.
Porucha _ funkce , jater
Pacienti s lehkou a středně těžkou poruchou funkce jater mohou používat přípravek Yanimo Respimat v doporučené dávce.
Neexistují žádné dostupné údaje o použití přípravku Yanimo Respimat u pacientů s těžkou poruchou funkce jater.
Porucha funkce ledvin
Pacienti s poruchou funkce ledvin mohou používat přípravek Yanimo Respimat v doporučené dávce. Pacienti se středně těžkou až těžkou poruchou funkce ledvin (clearance kreatininu < 50 ml/min) viz body 4.4 a 5.2.
Přípravek Yanimo Respimat obsahuje olodaterol. Existuje omezená zkušenost s použitím olodaterolu u pacientů s těžkou poruchou funkce ledvin.
Pediatrická populace
Neexistují žádné relevantní zkušenosti s použitím přípravku Yanimo Respimat u pediatrické populace (do 18 let věku).
Způsob podání
K zajištění správného podání léčivého přípravku musí být pacientovi ukázáno, jak správně používat inhalátor, lékařem nebo jiným zdravotnickým pracovníkem.
Návod k použití
Úvod
Yanimo Respimat (tiotropii bromidum a olodaterolum). Seznamte se s tímto návodem k použití před tím, než začnete přípravek Yanimo Respimat používat.
Inhalátor budete používat pouze JEDNOU DENNĚ. Při každém použití proveďte DVA VSTŘIKY.
Náustek
Vzduchový ventil
Tlačítko uvolňující dávku
Bezpečnostní pojistka
Průhled ný vnější obal
Prorážecí část
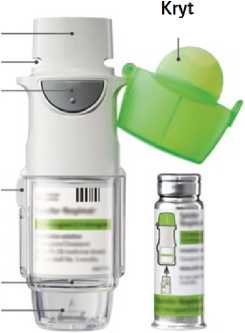
Zásobník
- Pokud jste přípravek Yanimo Respimat nepoužíval(a) déle než 7 dní, proveďte jeden vstřik s inhalátorem otočeným náustkem směrem k zemi.
- Pokud jste přípravek Yanimo Respimat nepoužíval(a) déle než 21 dnů, opakujte kroky 4 až 6
- Nedotýkejte se prorážecí části uvnitř průhledného vnějšího obalu.
Jak o přípravek Yanimo Respimat pečovat
Očištění náustku včetně jeho vnitřní kovové součásti provádějte pouze vlhkou látkou nebo papírovým kapesníkem, a to nejméně jedenkrát týdně.
Funkci inhalátoru přípravku Yanimo Respimat neovlivňují žádné menší změny barvy náustku. V případě potřeby otřete vnější část inhalátoru přípravku Yanimo Respimat vlhkým hadříkem.
Kdy si obstarat nový inhalátor Yanimo Respimat
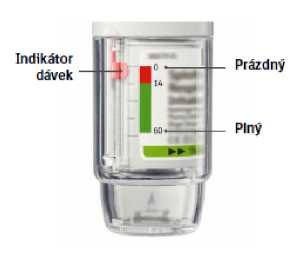
- Inhalátor Yanimo Respimat obsahuje 60 vstřiků (30 léčivých dávek), pokud jej používáte podle pokynů (dva vstřiky jednou denně).
- Indikátor dávek přibližně ukazuje zbývající množství léku.
- Když ukazatel vstoupí do červené oblasti stupnice, znamená to, že léčba vystačí přibližně ještě na 7 dní (14 vstřiků) a je třeba si obstarat lékařský předpis na nový inhalátor.
- Jakmile indikátor počtu dávek dosáhne konce červené stupnice, inhalátor Yanimo Respimat se automaticky uzamkne – nelze již podat další dávku. V tomto okamžiku již průhledným vnějším obalem nelze otáčet.
- Přípravek Yanimo Respimat je nutno zlikvidovat nejpozději po třech měsících používání od přípravy pro první použití, a to i v případě, že lék nebyl zcela spotřebován.
Příprava inhalátoru k prvnímu použití
| 1. Sejměte průhledný vnější obal
| |
| 2. Vložte zásobník
| |
| 3. Vraťte průhledný vnější obal na své místo
| Průhledný vnější obal |
| 4. Otočte průhledný vnější obal
| |
| 5. Otevřete kryt
|
| 6. Stiskněte
Váš inhalátor je nyní připraven k použití. Tyto kroky nebudou mít žádný vliv na počet dávek, které budete mít k dispozici. Po přípravě bude Váš inhalátor schopen dodat 60 vstřiků (30 léčivých dávek). | Tlačítko – s uvolňující dávku \ |
Denní používání inhalátoru
| OTÁČEJTE
| |
| OTEVŘETE
|
- Pomalu a plně vydechněte
- Sevřete rty těsně kolem konce náustku, aniž byste jimi překryl(a) vzduchový ventil. Nasměrujte inhalátor směrem
k zadní vnitřní části Vašeho krku.
- Během pomalého a hlubokého nádechu ústy STISKNĚTE prstem tlačítko uvolňující dávku a pokračujte v pomalém nádechu tak dlouho jak je to pro Vás možné.
- Zadržte dech na 10 sekund nebo na tak dlouho, jak je to pro Vás možné.
- Opakujte kroky „Otáčejte“, „Otevřete“, „Stiskněte“ celkem pro 2 vstřiky.
- Přiklopte víčko, dokud nebudete potřebovat Váš inhalátor znovu použít.
4.3 Kontraindikace
Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
Hypersenzitivita na atropin nebo jeho deriváty, např. ipratropium nebo oxitropium v anamnéze.
4.4 Zvláštní upozornění a opatření pro použití
Astma
Yanimo Respimat se nesmí používat při astmatu. Účinnost a bezpečnost přípravku Yanimo Respimat u astmatu nebyla hodnocena.
Yanimo Respimat není indikován pro akutní použití
Yanimo Respimat není indikován k léčbě akutních záchvatů bronchospasmu, tj. jako úlevová terapie.
Paradoxní bronchospasmus
Podobně jako u jiných inhalačních léků může Yanimo Respimat vyvolat paradoxní bronchospasmus, který může mít život ohrožující průběh. Pokud dojde k paradoxnímu bronchospasmu, podávání přípravku Yanimo Respimat je nutno ihned přerušit a zahájit alternativní léčbu.
Anticholinergní účinky spojené s tiotropiem
Glaukom s úzkým úhlem, hyperplazie prostaty nebo obstrukce hrdla močového měchýře
Vzhledem k anticholinergním vlastnostem tiotropia je nutno Yanimo Respimat podávat s opatrností u pacientů s glaukomem s úzkým úhlem, hyperplazií prostaty nebo obstrukcí hrdla močového měchýře.
Oční symptomy
Pacienti musí být upozorněni, aby jim sprej nevnikl při aplikaci do očí. Musí být poučeni o tom, že by mohlo dojít k vyvolání nebo ke zhoršení glaukomu s úzkým úhlem, bolestem očí nebo očnímu diskomfortu, přechodnému rozmazanému vidění, vizuálnímu haló nebo duhovému vidění spojenému se zarudnutím očí v důsledku překrvení spojivky a otoku rohovky. Pokud se některé z kombinací těchto očních příznaků objeví, musí pacienti používání přípravku Yanimo Respimat ukončit a ihned vyhledat pomoc lékaře.
Zubní kazy
Sucho v ústech, které se vyskytuje při léčbě anticholinergiky, může být při dlouhodobé expozici spojeno se zubním kazem.
Pacienti s poruchou funkce ledvin
Vzhledem k tomu, že u pacientů se středně těžkou až těžkou poruchou funkce ledvin (clearance kreatininu < 50 ml/min) dochází ke zvyšování plazmatické koncentrace tiotropia, může být Yanimo Respimat těmto pacientům podáván jen v případech, kdy očekávaný přínos léčby převyšuje její potenciální rizika. S léčbou pacientů s těžkou poruchou renálních funkcí nejsou dlouhodobé zkušenosti (viz 5.2).
Kardiovaskulární účinky
Z klinických studií byli vyloučeni pacienti s anamnézou infarktu myokardu během posledního roku, s nestabilní nebo život ohrožující srdeční arytmií, pacienti hospitalizovaní pro srdeční selhání během posledního roku, nebo s diagnózou paroxysmální tachykardie (>100 tepů za minutu). Proto jsou zkušenosti s těmito skupinami pacientů omezené. Yanimo Respimat je nutno u těchto skupin pacientů používat opatrně.
Podobně jako jiné léky ze skupiny beta2-adrenergních agonistů může olodaterol vyvolat u některých pacientů klinicky významné kardiovaskulární účinky, které se projevují zvýšením tepové frekvence, krevního tlaku a/nebo přítomností příznaků. V případě, že se takové účinky objeví, je nutné zvážit možné přerušení léčby. Navíc bylo hlášeno, že beta-adrenergní agonisté vedou ke změnám křivky EKG, jako je oploštění T vln a deprese segmentu ST, ačkoli klinický význam těchto pozorování není znám.
Beta2-adrenergní agonisty s dlouhodobým účinkem je třeba podávat opatrně u pacientů s kardiovaskulárním onemocněním, zejména při ischemické chorobě srdeční, těžké kardiální dekompenzaci, srdečních arytmiích, hypertrofické obstrukční kardiomyopatii, hypertenzi, při přítomnosti aneurysmatu, u pacientů s křečovými stavy nebo s tyreotoxikózou, u pacientů se známým nebo suspektním prodloužením intervalu QT (například QT > 0,44 s) a u pacientů, kteří jsou nadměrně vnímaví k sympatomimetickým aminům.
Hypokalemie
Beta2-adrenergní agonisté mohou u některých pacientů vyvolat významnou hypokalemii, která má potenciál působit nežádoucí kardiovaskulární účinky. Pokles draslíku v séru je obvykle přechodný a nevyžaduje suplementaci. U pacientů se závažnou CHOPN může být hypokalemie potencována hypoxií a současným podáváním jiných léků (viz bod 4.5), což může zvýšit náchylnost ke vzniku srdečních arytmií.
Hyperglykemie
Inhalace vysokých dávek beta2-adrenergních agonistů může vést ke zvýšení plazmatické glukózy.
Anestezie
V případě plánované operace s použitím halogenových uhlovodíkových anestetik je nutná opatrnost z důvodu zvýšené náchylnosti k nežádoucím kardiálním účinkům beta-agonisticky působících bronchodilatancií.
Yanimo Respimat nesmí být používán spolu s jinými léky obsahujícími dlouhodobě působící beta2-adrenergní agonisty.
Pacienti, kteří pravidelně používají beta2-adrenergní agonisty s krátkodobým účinkem (například čtyřikrát denně), musí být poučeni o jejich používání pouze k symptomatické úlevě od akutních dýchacích potíží.
Yanimo Respimat se nemá používat častěji než jednou denně.
Hypersenzitivita
Podobně jako u všech léků také po podání přípravku Yanimo Respimat mohou nastat reakce okamžité hypersenzitivity.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Ačkoliv nebyly prováděny oficiální studie in vivo zabývající se lékovými interakcemi mezi přípravkem Yanimo Respimat a dalšími léky, přípravek Yanimo Respimat byl současně inhalačně podáván s jinými léky užívanými při léčbě CHOPN, včetně krátkodobě působících beta2-sympatomimetik a inhalačních kortikosteroidů a to bez vzniku klinických projevů lékových interakcí.
Anticholinergní léky
Současné podávání tiotropium-bromidu, jedné ze složek přípravku Yanimo Respimat, s jinými léky obsahujícími anticholinergika nebylo hodnoceno, a proto se nedoporučuje.
Adrenergní léky
Současné podávání jiných léčivých přípravků působících na adrenergní receptory (samotných nebo jako součást kombinované léčby) může umocnit nežádoucí účinky přípravku Yanimo Respimat.
Deriváty xanthinu, steroidy nebo diuretika
Současná léčba deriváty xanthinu, steroidy nebo diuretiky nešetřícími kalium může umocnit hypokalemický účinek adrenergních agonistů (viz bod 4.4).
Betablokátory
Beta-adrenergní blokátory mohou oslabit nebo působit proti účinku olodaterolu. Je nutno zvážit podávání kardioselektivních betablokátorů a při léčbě je nutná opatrnost.
Inhibitory MAO a tricyklická antidepresiva, léky prodlužující QTc interval
Inhibitory monoaminooxidázy nebo tricyklická antidepresiva či jiné léky, o kterých je známo, že prodlužují QTc interval, mohou zesílit účinek přípravku Yanimo Respimat na kardiovaskulární systém.
Farmakokinetické lékové interakce
Při současném podávání s flukonazolem, který byl použit jako modelový inhibitor CYP2C9, nebyl pozorován ve studiích lékových interakcí žádný významný vliv na systémovou expozici olodaterolu.
Současné podávání spolu s ketokonazolem, který je silným inhibitorem P-gp a CYP3A4, vedlo ke zvýšení systémové expozice olodaterolu přibližně o 70 %. Není nutná žádná úprava dávky.
Výzkum in vitro ukázal, že olodaterol v plazmatických koncentracích, kterých je dosahováno v klinické praxi, neinhibuje enzymy CYP nebo transportéry léků.
4.6 Fertilita, těhotenství a kojení
Těhotenství
Tiotropium
Existuje velmi omezené množství údajů o použití tiotropia u těhotných žen. Studie provedené u zvířat nenaznačují přímé nebo nepřímé zdraví škodlivé účinky s ohledem na reprodukční toxicitu při klinicky významných dávkách (viz bod 5.3).
Olodaterol
Pro olodaterol nejsou dostupné žádné klinické údaje týkající se expozice v těhotenství. Předklinické údaje u olodaterolu odhalily účinky typické pro beta-adrenergní agonisty při vysokých násobcích terapeutických dávek (viz bod 5.3).
Jako preventivní opatření se upřednostňuje nepodávat přípravek Yanimo Respimat během těhotenství.
Podobně jako další beta2-adrenergní agonisté, může olodaterol, jedna ze složek přípravku Yanimo Respimat, bránit porodu z důvodu relaxačního účinku na hladkou svalovinu dělohy.
Kojení
Klinické údaje o kojících ženách používajících tiotropium a/nebo olodaterol nejsou k dispozici.
Ve studiích provedených u zvířat byla přítomnost tiotropia a olodaterolu a/nebo jejich metabolitů zjištěna během laktace v mléku samic potkanů, ale není známo, zda tiotropium a/nebo olodaterol přechází do mateřského mléka u člověka.
Je třeba učinit rozhodnutí, zda pokračovat/přerušit kojení nebo zda pokračovat/přerušit léčbu přípravkem Yanimo Respimat, je nutno zvažovat přínos kojení pro dítě a přínos léčby pro matku.
Fertilita
Klinické údaje týkající se fertility nejsou pro pro tiotropium a olodaterol nebo kombinaci obou látek k dispozici. Předklinické studie provedené s jednotlivými látkami tiotropium a olodaterol neprokázaly žádný nežádoucí účinek na fertilitu (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
Nebyly provedeny žádné studie účinků na schopnost řídit a obsluhovat stroje.
Pacienti však musí být informováni o tom, že při použití přípravku Yanimo Respimat byly hlášeny případy závratí a rozmazaného vidění. Proto je nutno doporučit opatrnost během řízení nebo při obsluze strojů. Pokud se tyto příznaky objeví, je nutné vyvarovat se potenciálně riskantních činností, jako je řízení nebo obsluha strojů.
4.8 Nežádoucí účinky
-
a. Souhrn bezpečnostního profilu
-
b. Tabulkový souhrn nežádoucích účinků
Četnosti přiřazené k níže uvedeným nežádoucím účinkům jsou založeny na hrubé frekvenci výskytu nežádoucích účinků (tj. příhod přisuzovaných přípravku Yanimo Respimat) pozorovaných ve skupině pacientů s CHOPN používajících dávku 5 mikrogramů tiotropia/5 mikrogramů olodaterolu (1707 pacientů), shrnuté z 7 aktivní látkou nebo placebem kontrolovaných klinických studií s paralelním uspořádáním skupin a s trváním léčby v rozsahu 4 až 52 týdnů.
Nežádoucí účinky, hlášené ve všech klinických studiích s přípravkem Yanimo Respimat, jsou uvedeny níže a rozděleny podle tříd orgánových systémů.
Zahrnují rovněž všechny nežádoucí účinky hlášené pro jednotlivé léčivé látky přípravku.
Četnost výskytu je definována za použití následující konvence:
Velmi časté (>1/10); časté (>1/100 až <1/10); méně časté (>1/1 000 až <1/100); vzácné (>1/10 000 až <1/1 000); velmi vzácné (<1/10 000), není známo (z dostupných údajů nelze určit).
| Třída orgánových systémů | Nežádoucí účinek | Frekvence |
| Infekce a infestace | Nazofaryngitida | Vzácné |
| Poruchy metabolismu a výživy | Dehydratace | Není známo |
| Poruchy nervového systému | Závrať | Méně časté |
| Nespavost | Méně časté | |
| Bolest hlavy | Méně časté | |
| Poruchy oka | Rozmazané vidění | Vzácné |
| Glaukom | Není známo | |
| Zvýšený nitrooční tlak | Není známo | |
| Srdeční poruchy | Fibrilace síní | Méně časté |
| Tachykardie | Méně časté | |
| Palpitace | Méně časté | |
| Supraventrikulární tachykardie | Vzácné | |
| Cévní poruchy | Hypertenze | Méně časté |
| Respirační, hrudní a mediastinální poruchy | Kašel | Méně časté |
| Dysfonie | Méně časté | |
| Laryngitida | Vzácné | |
| Faryngitida | Vzácné | |
| Epistaxe | Vzácné | |
| Bronchospasmus | Není známo | |
| Zánět dutin | Není známo | |
| Gastrointestinální poruchy | Sucho v ústech | Časté |
| Zácpa | Méně časté | |
| Orofaryngeální kandidóza | Vzácné | |
| Gingivitida | Vzácné | |
| Nauzea | Vzácné | |
| Střevní obstrukce, včetně paralytického ileu | Není známo | |
| Dysfagie | Není známo | |
| Refluxní choroba jícnu | Není známo |
| Třída orgánových systémů | Nežádoucí účinek | Frekvence |
| Glossitida | Není známo | |
| Stomatitida | Není známo | |
| Zubní kazy | Není známo | |
| Poruchy kůže a podkožní tkáně | Hypersenzitivita | Vzácné |
| Angioneurotický edém | Vzácné | |
| Kopřivka | Vzácné | |
| Pruritus | Vzácné | |
| Anafylaktická reakce | Není známo | |
| Kožní vyrážka | Není známo | |
| Kožní infekce, vředy na kůži | Není známo | |
| Suchá kůže | Není známo | |
| Poruchy svalové a kosterní soustavy a pojivové tkáně | Artralgie | Vzácné |
| Bolest zad1 | Vzácné | |
| Otoky kloubů | Není známo | |
| Poruchy ledvin a močových cest | Retence moči | Vzácné |
| Infekce močových cest | Vzácné | |
| Dysurie | Vzácné |
1nežádoucí účinek hlášený u přípravku Yanimo Respimat, nebyl však hlášen u jednotlivých léčivých látek
-
c. Popis vybraných nežádoucích účinků
Přípravek Yanimo Respimat kombinuje anticholinergní a beta2-adrenergní vlastnosti jednotlivých léčivých látek – tiotropia a olodaterolu.
Profil nežádoucích účinků anticholinergik
-
V dlouhodobých klinických studiích s přípravkem Yanimo Respimat trvajících 52 týdnů bylo nejčastěji pozorovaným nežádoucím anticholinergním účinkem sucho v ústech, které se vyskytlo u přibližně 1,7 % pacientů léčených přípravkem Yanimo Respimat a u 2,7 % pacientů ve skupině léčených dávkou 5 mikrogramů tiotropia respektive u 1 % pacientů léčených dávkou 5 mikrogramů olodaterolu. Sucho v ústech vedlo k přerušení léčby u 1 z 1029 pacientů (0,1%) léčených přípravkem Yanimo Respimat.
Závažné nežádoucí účinky související s anticholinergním působením zahrnují glaukom, zácpu, střevní obstrukci včetně paralytického ileu a retenci moči.
Profil nežádoucích účinků beta2-adrenergních agonistů
-
V dlouhodobých klinických studiích s přípravkem Yanimo Respimat trvajících 52 týdnů byly nejčastěji pozorovanými nežádoucími adrenergními účinky palpitace, tachykardie a hypertenze.
-
d. Jiné zvláštní skupiny pacientů
Výskyt anticholinergních nežádoucích účinků se může zvyšovat s rostoucím věkem pacientů.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky:
4.9 Předávkování
O předávkování přípravkem Yanimo Respimat existují omezené informace. Yanimo Respimat byl zkoumán v dávkách až 5 mikrogramů/10 mikrogramů (tiotropium/olodaterol) u pacientů s CHOPN, a v dávkách až 10 mikrogramů/40 mikrogramů (tiotropium/olodaterol) u zdravých jedinců; žádné klinicky významné účinky nebyly pozorovány. Předávkování by mohlo vést k přehnaným anti-muskarinovým účinkům tiotropia a/nebo k přehnaným B2-agonistickým účinkům olodaterolu.
Příznaky
Předávkování anticholinergikem tiotropiem
Vysoké dávky tiotropia mohou vyvolat anticholinergní příznaky a projevy.
Nicméně po inhalaci jednotlivé dávky až 340 mikrogramů tiotropium-bromidu nebyly u zdravých dobrovolníků zaznamenány žádné systémové anticholinergní nežádoucí účinky. Dále mimo sucha v ústech/hrdle a sucha nosní sliznice nebyly zaznamenány žádné významné nežádoucí účinky při podávání dávky až 40 mikrogramů tiotropia v roztoku k inhalaci po dobu 14 dní u zdravých dobrovolníků s výjimkou zřetelného snížení sekrece slin od 7. dne.
Předávkování p2-agonisiou olodaterolem
Předávkování olodaterolem pravděpodobně vyvolá přehnané účinky typické pro beta2-adrenergní agonisty, jako je například ischemie myokardu, hypertenze nebo hypotenze, tachykardie, arytmie, palpitace, závrať, nervozita, nespavost, úzkost, bolest hlavy, třes, suchost úst, svalové spazmy, nauzea, únava, malátnost, hypokalemie, hyperglykemie a metabolická acidóza.
Léčba předávkování
Léčbu přípravkem Yanimo Respimat je třeba přerušit. Je indikována podpůrná a symptomatická léčba. V závažných případech je nutná hospitalizace. Lze zvážit podávání kardioselektivních betablokátorů, ale pouze s krajní opatrností, protože použití léků vyvolávajících beta-adrenergní blokádu může vyprovokovat bronchospasmus.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Léčiva k terapii onemocnění spojených s obstrukcí dýchacích cest; Sympatomimetika v kombinaci s anticholinergiky
ATC kód: R03AL06
Mechanismus účinku
Yanimo Respimat
Yanimo Respimat je kombinovaný inhalační roztok obsahující fixní dávku tiotropia, antagonisty muskarinových receptorů s dlouhodobým účinkem (LAMA), a olodaterolu, beta2-adrenergního agonisty s dlouhodobým účinkem (LABA). Tato fixní kombinace LAMA/LABA se podává pomocí inhalátoru Yanimo Respimat, který při aplikaci vytváří jemnou mlžinu.
Dvě léčivé látky přípravku poskytují aditivní bronchodilatační účinek díky svým různým mechanismům působení. Protože se zdá, že muskarinové receptory převažují v centrálních dýchacích cestách, zatímco B2-adrenergní receptory jsou více exprimovány v periferních dýchacích cestách, kombinace tiotropia a olodaterolu má poskytovat optimální bronchodilataci ve všech oblastech plic.
Tiotropium
Tiotropium-bromid je dlouhodobě působící specifický antagonista muskarinových receptorů. Má podobnou afinitu k jednotlivým subtypům muskarinových receptorů M1 až M5. V dýchacích cestách se tiotropium-bromid kompetitivně a reverzibilně váže na M3 receptory hladké svaloviny průdušek, antagonizuje cholinergní (bronchokonstrikční) účinky acetylcholinu, což vede k uvolnění hladkého svalstva průdušek. Účinek byl závislý na dávce a trval déle než 24 hodin. Tiotropium-bromid je jako dusíkaté kvartérní anticholinergikum při inhalačním podání topicky (broncho-) selektivní a vykazuje přijatelné terapeutické rozmezí předtím, než se mohou objevit systémové anticholinergní účinky.
Olodaterol
Olodaterol vykazuje u člověka vysokou afinitu a vysokou selektivitu k beta2-adrenergním receptorům. In vitro studie ukázaly, že olodaterol má 241× vyšší agonistickou aktivitu na beta2-adrenergních receptorech ve srovnání s beta1-adrenergními receptory a 2299× vyšší agonistickou aktivitu ve srovnání s beta3-adrenergními receptory.
Po lokálním podání inhalací uplatňuje tato sloučenina své farmakologické účinky po vazbě na beta2-adrenergní receptory jejich aktivací.
Aktivace těchto receptorů v dýchacích cestách vede ke stimulaci enzymu intracelulární adenylátcyklázy, který zprostředkovává syntézu cyklického 3',5'-adenosin-monofosfátu (cAMP). Zvýšené hladiny cAMP navozují bronchodilataci relaxací hladkých svalových buněk v dýchacích cestách.
Olodaterol má preklinický profil dlouhodobě působícího selektivního agonisty beta2-adrenergních receptorů (LABA) s rychlým nástupem účinku, který přetrvává nejméně 24 hodin.
Beta-adrenergní receptory se dělí na tři podtypy. Beta1-adrenergní receptory jsou exprimovány převážně v srdeční hladké svalovině, beta2-adrenergní receptory převážně v hladké svalovině dýchacích cest a beta3-adrenergní receptory převážně v tukové tkáni. Beta2-agonisté vyvolávají bronchodilataci. Ačkoliv beta2-adrenergní receptor představuje převládající typ adrenergních receptorů v hladké svalovině dýchacích cest, jsou tyto receptory přítomny též na povrchu různých druhů jiných buněk, včetně plicních epiteliálních a endoteliálních buněk a také v srdci. Přesná funkce beta2-receptorů v srdci není známa, ale jejich přítomnost zvyšuje možnost, že dokonce i vysoce selektivně působící beta2-adrenergní agonisté mohou mít kardiální účinky.
Účinky na srdeční elektrofyziologii
Tiotropium
Ve studii zaměřené na hodnocení QT intervalu, která zahrnovala 53 zdravých dobrovolníků, nevedlo podávání tiotropia ve formě prášku k inhalaci v dávce 18 mikrogramů a 54 mikrogramů (tj. trojnásobek terapeutické dávky) po dobu 12 dní k významnému prodloužení intervalu QT na křivce EKG.
Olodaterol
Účinek olodaterolu na hodnotu QT/QTc intervalu křivky EKG byl zkoumán u 24 zdravých dobrovolníků mužského a ženského pohlaví ve dvojitě zaslepené, randomizované, placebem a aktivní látkou (moxifloxacinem) kontrolované studii. Bylo prokázáno, že ve srovnání s placebem, podání olodaterolu v jednotlivých dávkách 10, 20, 30 a 50 mikrogramů během 20 minut až 2 hodin vedlo k průměrné změně QT intervalu od výchozího stavu závislé na dávce, kdy bylo pozorováno prodloužení o 1,6 (po 10 mikrogramech olodaterolu) až 6,5 ms (po 50 mikrogramech olodaterolu), s horní hranicí oboustranných 90% intervalů spolehlivosti nižší, než 10 ms. Tato změna byla platná pro všechny velikosti dávek pro individuálně korigovanou hodnotu QT (QTcI).
Účinek 5 mikrogramů a 10 mikrogramů olodaterolu na srdeční frekvenci a rytmus byl hodnocen za použití kontinuálního 24hodinového EKG záznamu (monitorace Holterem) u podskupiny 772 pacientů v placebem kontrolované studii fáze 3 s délkou trvání 48 týdnů. Ve vztahu k dávce nebo času nebyly pozorovány žádné trendy nebo zákonitosti, pokud jde o průměr velikosti změny srdeční frekvence nebo předčasných srdečních stahů. Pokud jde o předčasné srdeční stahy, změny mezi výchozím stavem a koncem léčby nesvědčily o významných rozdílech mezi olodaterolem v dávce 5 mikrogramů, 10 mikrogramů a placebem.
Yanimo Respimat
Dvě 52 týdnů trvající randomizované dvojitě zaslepené studie s přípravkem Yanimo Respimat zahrnovaly 5162 pacientů s CHOPN. Ve složené analýze se počet subjektů se změnou korigovaného QT intervalu podle srdeční frekvence (QTcF; Fridericiova korekce) od výchozího stavu > 30 ms za 40 minut po podání dávky v den 85, 169 a 365 pohyboval v rozsahu 3,1 %, 4,7 % a 3,6 % ve skupině s přípravkem Yanimo Respimat, ve srovnání s 4,1 %, 4,4 % a 3,6 % u olodaterolu 5 mikrogramů, a ve srovnání s 3,4 %, 2,3 %, a 4,6 % ve skupině s tiotropiem 5 mikrogramů.
Klinická účinnost a bezpečnost
Fáze III klinického programu u Yanimo Respimat zahrnovala tři randomizované dvojitě zaslepené studie:
-
(i) dvě replikované 52 týdnů trvající studie s paralelním uspořádáním skupin srovnávající Yanimo Respimat s tiotropiem 5 mikrogramů a olodaterolem 5 mikrogramů (1029 pacientů používalo Yanimo Respimat) (Studie 1 a 2)
-
(ii) jedna 6 týdnů trvající studie s cross-over (překříženým) designem, srovnávající Yanimo Respimat s tiotropiem 5 mikrogramů a olodaterolem 5 mikrogramů a placebem (139 pacientů používalo Yanimo Respimat) (Studie 3)
-
V těchto studiích byly srovnávané léčivé látky, tj. tiotropium 5 mikrogramů, olodaterol 5 mikrogramů a placebo, podávány pomocí inhalátoru Respimat.
Charakteristiky pacientů
Většina z 5162 pacientů zařazených do mezinárodních 52 týdnů trvajících studií (Studie 1 a 2) byli muži (73 %), běloši (71 %) nebo Asiaté (25 %), s průměrným věkem 64 let. Průměrná hodnota parametru post-bronchodilatačního FEV1 činila 1,37 l (stadium GOLD 2 (50 %), GOLD 3 (39 %), GOLD 4 (11 %)). Průměrná hodnota odpovědi na podání B2-agonisty představovala 16,6 % hodnoty výchozího stavu (0,171 l). Jako souběžná plicní medikace byly povoleny i inhalační steroidy (47 %) a xanthiny (10 %).
6 týdnů trvající studie (Studie 3) byla provedena v Evropě a Severní Americe. Většina z 219 zařazených pacientů byli muži (59 %), běloši (99 %), s průměrným věkem 61,1 roku. Průměrná hodnota parametru post-bronchodilatačního FEV1 byla 1,55 l (stadium GOLD 2 (64 %), GOLD 3 (34 %), GOLD 4 (2 %)). Průměrná odpověď na působení B2-agonisty činila 15,9 % hodnoty výchozího stavu (0,193 l). Jako souběžná plicní medikace byly povoleny i inhalační steroidy (41 %) a xanthiny (4 %).
Vliv na plicní funkce
-
V 52 týdnů trvající studii vedlo používání přípravku Yanimo Respimat jednou denně ráno k jasnému zlepšení plicních funkcí během 5 minut po podání první dávky ve srovnání s tiotropiem 5 mikrogramů (průměrný nárůst hodnoty FEV1 činil 0,137 l u přípravku Yanimo Respimat oproti 0,058 l u tiotropia
-
V obou studiích bylo pozorováno významné zlepšení hodnoty parametru FEV1 AUC0–3h a hodnoty parametru trough FEV1 po 24 týdnech léčby (primární sledované cílové parametry plicních funkcí) u přípravku Yanimo Respimat, ve srovnání s tiotropiem 5 mikrogramů a olodaterolem 5 mikrogramů (Tabulka 1).
Tabulka 1 Rozdíl v hodnotě parametru FEV1 AUC0–3h a trough FEV1 u přípravku Yanimo
Respimat ve srovnání s tiotropiem 5 mikrogramů, olodaterolem 5 mikrogramů po 24 týdnech (Studie 1 a 2)
| FEVi AUCo-3h | Trough FEV1 odpověď | |||||||
| Studie 1 | Studie 2 | Studie 1 | Studie 2 | |||||
| n | Průměr | n | Průměr | n | Průměr | n | Průměr | |
| Yanimo Respimat oproti | 522 | – | 502 | – | 521 | – | 497 | – |
| Tiotropium 5 mikrogramů | 526 | 0,117 l | 500 | 0,103 l | 520 | 0,071 l | 498 | 0,050 l |
| Olodaterol 5 mikrogramů | 525 | 0,123 l | 507 | 0,132 l | 519 | 0,082 l | 503 | 0,088 l |
výchozí hodnota FEV1 před léčbou: Studie 1 = 1,16 l; Studie 2 = 1,15 l p<0,0001 pro všechna srovnání
n = počet pacientů
Pacienti s vyšší mírou bronchiální reverzibility ve výchozím stavu vykázali obecně po podání přípravku Yanimo Respimat větší bronchodilatační odpověď než pacienti s nižší mírou bronchiální reverzibility ve výchozím stavu.
Zvýšený bronchodilatační účinek přípravku Yanimo Respimat ve srovnání s tiotropiem 5 mikrogramů a olodaterolem 5 mikrogramů se udržoval po celou dobu 52 týdnů léčebné periody. Podávání přípravku Yanimo Respimat také vedlo ke zlepšení ranní a večerní hodnoty vrcholové výdechové rychlosti (PEFR) ve srovnání s tiotropiem 5 mikrogramů a olodaterolem 5 mikrogramů při hodnocení podle denních záznamů pacientů.
V 6 týdnů trvající studii dokázal přípravek Yanimo Respimat významně zvýšit hodnotu parametru FEV1 při srovnání s tiotropiem 5 mikrogramů, olodaterolem 5 mikrogramů a placebem (p<0,0001) a to po dobu celého dávkového intervalu v délce 24 hodin (Tabulka 2).
Tabulka 2 Průměrné rozdíly v hodnotě FEV1 (l) během 3 hodin, 12 hodin a 24 hodin
a rozdíly v hodnotě trough FEV1 (l) u přípravku Yanimo Respimat ve srovnání s tiotropiem 5 mikrogramů, olodaterolem 5 mikrogramů a placebem po 6 týdnech (Studie 3)
| n | 3 hodiny průměr | n | 12 hodin průměr | 24 hodin 1 průměr1 | Trough | |
| Yanimo Respimat oproti | 138 | 138 | ||||
| Tiotropium 5 mikrogramů | 137 | 0,109 | 135 | 0,119 | 0,110 | 0,079 |
| Olodaterol 5 mikrogramů | 138 | 0,109 | 136 | 0,126 | 0,115 | 0,092 |
| Placebo | 135 | 0,325 | 132 | 0,319 | 0,280 | 0,207 |
výchozí FEV1 před léčbou = 1,30 l
1primární cílový parametr p<0,0001 pro všechna srovnání
Kvalita života ve vztahu ke zdraví
Podávání přípravku Yanimo Respimat vedlo ke zlepšení kvality života související se zdravím, o čemž svědčí snížení celkového skóre dotazníku SGRQ (St. George Respiratory Questionnaire). Po 24 týdnech léčby došlo ke statisticky významnému zlepšení průměrné hodnoty celkového skóre SGRQ u přípravku Yanimo Respimat ve srovnání s tiotropiem 5 mikrogramů a olodaterolem 5 mikrogramů (Tabulka 3); zlepšení byla patrná ve všech doménách dotazníku SGRQ. Více pacientů léčených pomocí přípravku Yanimo Respimat prokázalo klinicky významné zlepšení celkového skóre dotazníku SGRQ (MCID, definováno jako snížení nejméně o 4 jednotky od výchozího stavu) ve srovnání s tiotropiem 5 mikrogramů (57,5 % oproti 48,7 %, p=0,0001), a olodaterolem 5 mikrogramů (57,5 % oproti 44,8 %, p<0,0001).
Tabulka 3: Celkové skóre dotazníku SGRQ po 24 týdnech léčby
| n | Léčebný průměr (změna od výchozího stavu) | Rozdíl proti přípravku Yanimo Respimat | ||
| Průměr (hodnota p) | ||||
| Celkové skóre | Výchozí stav | 43,5 | ||
| Yanimo Respimat | 979 | 36,7 (-6,8) | ||
| Tiotropium 5 mikrogramů | 954 | 37,9 (-5,6) | –1,23 (p=0,025) | |
| Olodaterol 5 mikrogramů | 954 | 38,4 (-5,1) | –1,69 (p=0,002) | |
n = počet pacientů
Ve dvou dalších placebem kontrolovaných klinických studiích o délce trvání 12 týdnů bylo za primární sledovaný cíl zvoleno celkové skóre SGRQ coby měřítko kvality života vztažené ke zdravotnímu stavu.
Ve 12 týdnů trvajících studiích prokázal přípravek Yanimo Respimat zlepšení v průměrném celkovém skóre SGRQ (primární sledovaný cíl) o –4,9 jednotky (95% CI: –6,9; –2,9; p < 0,0001) a o –4,6 jednotky (95% CI: –6,5; –2,6; p < 0,0001) v porovnání s placebovou větví. V souhrnné podpůrné analýze 12 týdnů trvajících studií byl podíl pacientů s klinicky významným snížením celkového skóre SGRQ (definovaným jako pokles o nejméně 4 jednotky od výchozího stavu) po 12 týdnech větší při užívání přípravku Yanimo Respimat (52 % [206/393]) v porovnání s léčbou tiotropiem 5 mikrogramů (41 % [159/384]; poměr šancí: 1,56 (95% CI: 1,17; 2,07), p = 0,0022) a placebem (32 % [118/370]; poměr šancí: 2,35 (95% CI: 1,75; 3,16), p < 0,0001).
Dušnost
Po 24 týdnech léčby dosáhlo průměrné fokální skóre TDI hodnoty 1,98 jednotky u přípravku Yanimo Respimat, s významným zlepšením ve srovnání s léčbou tiotropiem 5 mikrogramů (průměrný rozdíl 0,36, p=0,008) a s olodaterolem 5 mikrogramů (průměrný rozdíl 0,42 (p=0,002).
Více pacientů léčených pomocí přípravku Yanimo Respimat mělo klinicky významné zlepšení fokálního skóre TDI (MCID, definováno jako hodnota nejméně 1 jednotky) ve srovnání s tiotropiem 5 mikrogramů (54,9 % oproti 50,6 %, p=0,0546) a s olodaterolem 5 mikrogramů (54,9 % oproti 48,2 %, p=0,0026).
Používání úlevové medikace
Pacienti léčení pomocí přípravku Yanimo Respimat používali v menší míře úlevovou léčbu salbutamolem v ranních a večerních hodinách ve srovnání s pacienty léčenými tiotropiem 5 mikrogramů a olodaterolem 5 mikrogramů (průměrná hodnota používání úlevové medikace během dne činila u přípravku Yanimo Respimat 0,76 použití za den ve srovnání s 0,97 použitími za den u tiotropia 5 mikrogramů a 0,87 použitími za den u olodaterolu 5 mikrogramů, p<0,0001; průměrná hodnota používání úlevové medikace během noci činila u přípravku Yanimo Respimat 1,24 použití za den ve srovnání s 1,69 použitími za den u tiotropia 5 mikrogramů a 1,52 použitími za den u olodaterolu 5 mikrogramů, p<0,0001).
Stupnice globálního hodnocení pacientem (PGR)
Pacienti léčení pomocí přípravku Yanimo Respimat pociťovali výraznější zlepšení svých dýchacích obtíží ve srovnání s pacienty používajícími tiotropium 5 mikrogramů a olodaterol 5 mikrogramů při měření na stupnici PGR (Patienťs Global Rating scale).
Exacerbace
U tiotropia 5 mikrogramů bylo již dříve prokázáno statisticky významné snížení rizika exacerbací CHOPN ve srovnání s placebem. Exacerbace CHOPN byly zahrnuty jako dodatečný cílový parametr v 52 týdnů trvajících pivotních studiích (Studie 1 a 2). V souhrnné analýze údajů byl poměr pacientů s nejméně jednou středně těžkou či těžkou exacerbací CHOPN 27,7 % u přípravku Yanimo Respimat a 28,8 % u tiotropia 5 mikrogramů (p=0,39). Tyto studie nebyly navrženy specificky k hodnocení účinku různých druhů léčby na exacerbace CHOPN.
Kapacita plic, dechový diskomfort a tolerance zátěže
Účinek přípravku Yanimo Respimat na kapacitu plic, dechový diskomfort a toleranci zátěže s ohledem na vzniklé příznaky byl hodnocen ve třech randomizovaných dvojitě zaslepených studiích u pacientů s CHOPN:
-
(i) dvě replikované 6 týdnů trvající studie s cross-over designem srovnávající přípravek Yanimo Respimat s tiotropiem 5 mikrogramů, olodaterolem 5 mikrogramů a placebem v průběhu konstantní cyklistické zátěže (450 pacientů používalo přípravek Yanimo Respimat) (Studie 4 a 5)
-
(ii) jedna 12 týdnů trvající studie s paralelním uspořádáním skupin srovnávající přípravek Yanimo Respimat s placebem v průběhu konstantní cyklistické zátěže (139 pacientů používalo přípravek Yanimo Respimat) a konstantní zátěže rychlou chůzí (podskupina pacientů) (Studie 6).
Přípravek Yanimo Respimat významně zlepšil kapacitu plic v klidu dvě hodiny po podání dávky ve srovnání s tiotropiem 5 mikrogramů (0,114 l, p<0,0001; Studie 4, 0,088 l, p=0,0005; Studie 5), olodaterolem 5 mikrogramů (0,119 l, p<0,0001; Studie 4, 0,080, p=0,0015; Studie 5) a placebem (0,244 l, p<0,0001; Studie 4, 0,265, p<0,0001; Studie 5) po 6 týdnech léčby.
Ve studii 4 a 5 přípravek Yanimo Respimat významně zlepšil toleranci zátěže v průběhu konstantní cyklistické zátěže ve srovnání s placebem po 6 týdnech léčby (Studie 4: geometrický průměr času výdrže činil 454 sekund u přípravku Yanimo Respimat ve srovnání s 375 sekundami u placeba (zlepšení o 20,9 %, p<0,0001); Studie 5: geometrický průměr času výdrže představoval 466 sekund u přípravku Yanimo Respimat ve srovnání s 411 sekundami u placeba (zlepšení o 13,4 %, p<0,0001).
Ve studii 6 přípravek Yanimo Respimat po 12 týdnech léčby významně prodloužil toleranci zátěže v průběhu konstantní cyklistické zátěže ve srovnání s placebem (geometrický čas výdrže činil 528 sekund u přípravku Yanimo Respimat ve srovnání s 464 sekundami u placeba (zlepšení o 13,8 %, p=0,021).
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s přípravkem Yanimo Respimat u všech podskupin pediatrické populace v indikaci chronická obstrukční plicní nemoc (CHOPN) v souladu se zproštěním povinnosti u přípravků stejné skupiny (viz bod 4.2 pro informace o pediatrickém použití).
5.2 Farmakokinetické vlastnosti
-
a. Všeobecný úvod
-
b. Obecné charakteristiky léčivé látky po podání léčivého přípravku
Absorpce
Tiotropium: Údaje o vylučování močí naznačují, že po inhalaci pomocí inhalátoru RESPIMAT mladými zdravými dobrovolníky dosáhne systémové cirkulace přibližně 33% inhalované dávky. Perorální roztok má absolutní biologickou dostupnost 2–3 %. Maximální plazmatické koncentrace tiotropia byly zaznamenány 5–7 minut po inhalaci pomocí inhalátoru RESPIMAT.
Olodaterol: U zdravých dobrovolníků byla absolutní biologická dostupnost olodaterolu po inhalaci odhadnuta přibližně na 30 %, zatímco absolutní biologická dostupnost byla nižší než 1 % při podání ve formě perorálního roztoku. Olodaterol obecně dosahuje maximální plazmatické koncentrace během 10 až 20 minut po inhalaci pomocí inhalátoru RESPIMAT.
Distribuce
Tiotropium je ze 72 % vázáno na plazmatické proteiny a jeho distribuční objem je 32 l/kg. Studie u potkanů ukázaly, že tiotropium neproniká ve významném množství přes hematoencefalickou bariéru.
Olodaterol je vázán na plazmatické proteiny přibližně z 60 % a distribuční objem je 1110 l. Olodaterol je substrátem transportérů P-gp, OAT1, OAT3 a OCT1. Olodaterol není substrátem následně uvedených transportérů: BCRP, MRP, OATP2, OATP8, OATP-B, OCT2 a OCT3.
Biotransformace
Tiotropium: Rozsah biotransformace je nízký. To je zřejmé z vylučování močí, kdy je 74 % sloučeniny vyloučeno v nezměněné podobě po intravenózním podání. Ester tiotropia je neenzymaticky štěpen na alkohol (N-methylskopin) a na kyselinu (dithienylglykolová kyselina), které na muskarinové receptory nepůsobí. Studie in vitro s lidskými jaterními mikrozomy a lidskými hepatocyty ukazují, že jistá část léku (< 20 % dávky po intravenózním podání) je metabolizována oxidací závislou na cytochromu P450 (CYP) 2D6 a 3A4 a následnou konjugací s glutathionem na řadu metabolitů II. řádu.
Olodaterol je významně metabolizován přímou glukuronidací a O-demethylací na své methoxy skupině, poté následuje konjugace. Ze šesti identifikovaných metabolitů se pouze nekonjugovaný produkt demethylace váže na beta2-receptory. Tento metabolit však nelze detekovat v plazmě při chronické inhalaci doporučené terapeutické dávky nebo dávek až 4× vyšších. Do O-demethylace olodaterolu jsou zapojeny izoenzymy CYP2C9 a CYP2C8 cytochromu P450 se zanedbatelným příspěvkem CYP3A4, zatímco do tvorby glukuronidů olodaterolu bylo prokázáno zapojení izoforem uridindifosfátglykosyltransferázy UGT2B7, UGT1A1, 1A7 a 1A9.
Eliminace
Tiotropium: Celková clearance u zdravých dobrovolníků byla 880 ml/min. Intravenózně podané tiotropium je vylučováno hlavně močí v nezměněné formě (74 %). Po inhalačním podání roztoku pacientům s CHOPN činí vylučování močí v rovnovážném stavu 18,6 % dávky, zbytek představuje zejména nevstřebaný lék ze střeva, vylučovaný stolicí. Renální clearance tiotropia překračuje rychlost glomerulární filtrace, což svědčí o jeho aktivní sekreci do moči. Efektivní poločas tiotropia nastává u pacientů s CHOPN mezi 27–45 hodinami po inhalaci.
Olodaterol: Celková clearance olodaterolu u zdravých dobrovolníků je 872 ml/min a renální clearance je 173 ml/min. Po intravenózním podání olodaterolu značeného [14C] se 38 % radioaktivní dávky zjistilo v moči a 53 % bylo zjištěno ve stolici. Množství nezměněného olodaterolu zjištěného v moči po intravenózním podání bylo 19 %. Po perorálním podání pouze 9 % radioaktivní látky (0,7 % nezměněného olodaterolu) bylo zjištěno v moči, zatímco hlavní část byla zjištěna ve stolici (84 %). Více než 90 % dávky bylo vyloučeno během 6 respektive 5 dní po intravenózním respektive perorálním podání. Po inhalaci představovalo vylučování nezměněného olodaterolu močí během dávkového intervalu u zdravých dobrovolníků v rovnovážném stavu 5–7 % dávky. Plazmatické koncentrace olodaterolu po inhalaci klesají multifázicky s terminálním poločasem přibližně 45 hodin.
-
c. Charakteristiky u pacientů
5.3 Předklinické údaje vztahující se k bezpečnosti
Tiotropium + olodaterol
Účinky v neklinických studiích s kombinací tiotropium/olodaterol byly pozorovány pouze při expozicích, které jsou považovány za dostatečně nadhodnocené oproti maximální expozici u lidí, což svědčí pro malý význam v rámci klinického používání.
Tiotropium
Studie genotoxicity a kancerogenního potenciálu neodhalily žádné zvláštní riziko pro člověka. Nežádoucí účinky s ohledem na těhotenství, embryonální/fetální vývoj, porod nebo postnatální vývoj, bylo možno demonstrovat jen při úrovni dávek toxických pro matky. Tiotropium-bromid nevedl k projevům teratogenity u potkanů nebo králíků. Respirační změny (iritace), urogenitální změny (prostatitida) a reprodukční toxicita byly pozorovány při lokálních nebo systémových expozicích vyšších než pětinásobek terapeutické expozice.
Olodaterol
Studie genotoxicity a kancerogenního potenciálu neodhalily žádné zvláštní riziko pro člověka. Byl pozorován zvýšený výskyt mesovariálního leiomyomu u potkanů a děložního leiomyomu a leiomyosarkomu u myší. To je považováno za účinek celé lékové třídy, který je pozorován u hlodavců při dlouhodobé expozici vysokým dávkám B2-agonistů. Až do současnosti nejsou B2-agonisté spojováni se vznikem zhoubných nádorů u lidí.
U potkanů se neobjevily žádné teratogenní účinky po inhalaci dávek až 1054 mikrogramů/kg/den (přibližně 2600násobek expozice u člověka (AUC(0–24)) u dávky 5 mikrogramů). U březích králíků plemene NZW vedla podaná inhalovaná dávka 2489 mikrogramů/kg/den (přibližně 7130násobek expozice u člověka u dávky olodaterolu 5 mikrogramů na základě AUC(0–24) k charakteristické fetální toxicitě vyplývající ze stimulace beta-adrenergních receptorů; která zahrnovala nerovnoměrné osifikace, zkrácení/ohnutí kostí, částečné rozevření oka, rozštěp patra, kardiovaskulární abnormality. Žádné významné účinky nenastaly při inhalaci dávky 974 mikrogramů/kg/den (přibližně 1353násobek dávky 5 mikrogramů na základě AUC(0–24)).
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Benzalkonium-chlorid
Dihydrát dinatrium-edetátu
Čištěná voda
Roztok kyseliny chlorovodíkové 1 mol/l (k úpravě pH)
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
3 roky
Od prvního použití: 3 měsíce
6.4 Zvláštní opatření pro uchovávání
Chraňte před mrazem.
6.5 Druh obalu a obsah balení
Druh a materiál obalu, který je v kontaktu s přípravkem:
Roztok je naplněn do polyethylen/polypropylenového zásobníku s polypropylenovým víčkem se vsazeným silikonovým těsnícím kroužkem. Zásobník je vložen do hliníkové nádobky.
Jeden zásobník obsahuje 4 ml roztoku k inhalaci.
Velikosti balení a dodávané prostředky:
Jednoduché balení: 1 inhalátor Respimat a 1 zásobník poskytující 60 vstřiků (30 léčivých dávek).
Dvojité balení: 2 jednoduchá balení, každé obsahuje 1 inhalátor Respimat a 1 zásobník poskytující 60 vstřiků (30 léčivých dávek).
Trojité balení: 3 jednoduchá balení, každé obsahuje 1 inhalátor Respimat a 1 zásobník poskytující 60 vstřiků (30 léčivých dávek).
Osminásobné balení: 8 jednoduchých balení, každé obsahuje 1 inhalátor Respimat a 1 zásobník poskytující 60 vstřiků (30 léčivých dávek).
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Boehringer Ingelheim International GmbH
Binger Strasse 173
D-55216 Ingelheim am Rhein
Německo
8. REGISTRAČNÍ ČÍSLO(A)
14/363/15-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
29. 7. 2015
Další informace o léčivu YANIMO RESPIMAT 2,5 MIKROGRAMŮ/2,5 MIKROGRAMŮ
Jak
se YANIMO RESPIMAT 2,5 MIKROGRAMŮ/2,5 MIKROGRAMŮ
podává: inhalační podání - roztok k inhalaci
Výdej
léku: na lékařský předpis
Balení: Vícedávkový obal
Velikost
balení: 2X60DÁV+1INH
Držitel rozhodnutí o registraci daného léku v České republice:
Boehringer Ingelheim International GmbH, Ingelheim am Rhein
E-mail: infocz@boehringer-ingelheim.com
