Souhrnné informace o léku - NUTRIFLEX OMEGA PERI
1. NÁZEV PŘÍPRAVKU
Nutriflex Omega peri infuzní emulze
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Emulze připravená k přímé intravenózní infuzi po smíchání obsahu jednotlivých komor obsahuje:
| Z horní komory (roztok glukózy) | v 1 000 ml | v 1 250 ml | v 1875 ml | ve 2 500 ml |
| Glucosum monohydricum | 70,40 g | 88,00 g | 132,0 g | 176,0 g |
| odp. glucosum | 64,00 g | 80,00 g | 120,0 g | 160,0 g |
| Natrii dihydrogenophosphas dihydricus | 0,936 g | 1,170 g | 1,755 g | 2,340 g |
| Zinci acetas dihydricus | 5,280 mg | 6,600 mg | 9,900 mg | 13,20 mg |
| Ze střední komory (tuková emulze) | v 1 000 ml | v 1 250 ml | v 1875 ml | ve 2 500 ml |
| Triglycerida saturata media | 20,00 g | 25,00 g | 37,50 g | 50,00 g |
| Sojae oleum raffinatum | 16,00 g | 20,00 g | 30,00 g | 40,00 g |
| Omega-3 acidorum triglycerida | 4,000 g | 5,000 g | 7,500 g | 10,00 g |
| Z dolní komory (roztok aminokyselin) | v 1 000 ml | v 1 250 ml | v 1875 ml | ve 2 500 ml |
| Isoleucinum | 1,872 g | 2,340 g | 3,510 g | 4,680 g |
| Leucinum | 2,504 g | 3,130g | 4,695 g | 6,260 g |
| Lysini hydrochloridum | 2,272 g | 2,840 g | 4,260 g | 5,680 g |
| odp. lysinum | 1,818 g | 2,273 g | 3,410 g | 4,546 g |
| Methioninum | 1,568 g | 1,960 g | 2,940 g | 3,920 g |
| Phenylalaninum | 2,808 g | 3,510 g | 5,265 g | 7,020 g |
| Threoninum | 1,456 g | 1,820 g | 2,730 g | 3,640 g |
| Tryptophanum | 0,456 g | 0,570 g | 0,855 g | 1,140 g |
| Valinum | 2,080 g | 2,600 g | 3,900 g | 5,200 g |
| Argininum | 2,160 g | 2,700 g | 4,050 g | 5,400 g |
| Histidini hydrochloridum | 1,352 g | 1,690 g | 2,535 g | 3,380 g |
| monohydricum | ||||
| odp. histidinum | 1,000 g | 1,251 g | 1,876 g | 2,502 g |
| Alaninum | 3,880 g | 4,850 g | 7,275 g | 9,700 g |
| Acidum asparticum | 1,200 g | 1,500 g | 2,250 g | 3,000 g |
| Acidum glutamicum | 2,800 g | 3,500 g | 5,250 g | 7,000 g |
| Glycinum | 1,320 g | 1,650 g | 2,475 g | 3,300 g |
| Prolinum | 2,720 g | 3,400 g | 5,100 g | 6,800 g |
| Serinum | 2,400 g | 3,000 g | 4,500 g | 6,000 g |
| Natrii hydroxidum | 0,640 g | 0,800 g | 1,200 g | 1,600 g |
| Natrii chloridům | 0,865 g | 1,081 g | 1,622 g | 2,162 g |
| Natrii acetas trihydricus | 0,435 g | 0,544 g | 0,816 g | 1,088 g |
| Kalii acetas | 2,354 g | 2,943 g | 4,415 g | 5,886 g |
| Magnesii acetas tetrahydricus | 0,515 g | 0,644 g | 0,966 g | 1,288 g |
| Calcii chloridům dihydricum | 0,353 g | 0,441 g | 0,662 g | 0,882 g |
| Elektrolyty [mmol] | v 1 000 ml | v 1 250 ml | v 1875 ml | ve 2 500 ml |
| Sodík | 40 | 50 | 75 | 100 |
| Draslík | 24 | 30 | 45 | 60 |
| Hořčík | 2,4 | 3,0 | 4,5 | 6,0 |
| Vápník | 2,4 | 3,0 | 4,5 | 6,0 |
| Zinek | 0,024 | 0,03 | 0,045 | 0,06 |
| Chlorid | 38 | 48 | 72 | 96 |
| Acetát | 32 | 40 | 60 | 80 |
| Fosfát | 6,0 | 7,5 | 11,25 | 15,0 |
| v 1 000 ml | v 1 250 ml | v 1875 ml | ve 2 500 ml | |
| Obsah aminokyselin [g] | 32 | 40 | 60 | 80 |
| Obsah dusíku [g] | 4,6 | 5,7 | 8,6 | 11,4 |
| Obsah sacharidů [g] | 64 | 80 | 120 | 160 |
| Obsah lipidů [g] | 40 | 50 | 75 | 100 |
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Infuzní emulze
Roztoky aminokyselin a glukózy: čiré, bezbarvé až slámově zbarvené roztoky Tuková emulze: emulze typu olej ve vodě, mléčně bílá
| v 1 000 ml | v 1 250 ml | v 1875 ml | ve 2 500 ml | |
| Energie ve formě lipidů [kJ (kcal)] | 1 590 (380) | 1 990 (475) | 2 985 (715) | 3 980 (950) |
| Energie ve formě sacharidů [kJ (kcal)] | 1 075 (255) | 1 340 (320) | 2 010 (480) | 2 680 (640) |
| Energie ve formě aminokyselin [kJ (kcal)] | 535 (130) | 670 (160) | 1 005 (240) | 1 340 (320) |
| Neproteinová energie [kJ (kcal)] | 2 665 (635) | 3 330 (795) | 4 995 (1 195) | 6 660 (1 590) |
| Celková energie [kJ (kcal)] | 3 200 (765) | 4 000 (955) | 6 000 (1 435) | 8 000 (1 910) |
| Osmolalita [mosmol/kg] | 950 |
| Teoretická osmolarita [mosmol/l] | 840 |
| pH | 5,0–6,0 |
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Zdroj energie, esenciálních mastných kyselin včetně omega-3 a omega-6 mastných kyselin, aminokyselin, elektrolytů a tekutin pro parenterální výživu pacientů ve stavu mírného až středně závažného katabolismu, kdy perorální nebo enterální výživa není možná, není dostačující nebo je kontraindikována.
Přípravek Nutriflex Omega peri je indikován u dospělých.
4.2 Dávkování a způsob podání
Dávkování
Dávkování je třeba upravit podle individuální potřeby pacienta.
Doporučuje se, aby byl přípravek Nutriflex Omega peri podáván nepřetržitě. Možným komplikacím lze předejít postupným zvyšováním rychlosti infuze v prvních 30 minutách, dokud nebude dosaženo požadované rychlosti infuze.
Dospělí
Maximální denní dávka je 40 ml/kg tělesné hmotnosti, což odpovídá
1,28 g aminokyselin /kg tělesné hmotnosti za den,
2,56 g glukózy /kg tělesné hmotnosti za den,
-
1,6 g lipidů /kg tělesné hmotnosti za den.
Maximální rychlost podávání infuze je 2,5 ml/kg tělesné hmotnosti za hodinu, což odpovídá
0,08 g aminokyselin /kg tělesné hmotnosti za hodinu,
0,16 g glukózy /kg tělesné hmotnosti za hodinu,
0,1 g lipidů /kg tělesné hmotnosti za hodinu.
U pacienta s tělesnou hmotností 70 kg je tedy maximální rychlost infuze 175 ml za hodinu. V takovém případě je množství podaných látek 5,6 g aminokyselin za hodinu, 11,2 g glukózy za hodinu a 7,0 g lipidů za hodinu.
Pediatrická populace
Přípravek Nutriflex Omega peri je kontraindikován u novorozenců, kojenců a batolat < 2 roky (viz bod 4.3). Bezpečnost a účinnost u dětí ve věku od 2 let a dospívajících nebyla stanovena.
Pacienti s poruchou funkce ledvin/jater
U pacientů s jaterní nebo renální insuficiencí je nutno upravit dávkování individuálně (viz též bod 4.4).
Délka léčby
U uvedených indikací by délka léčby neměla překročit 7 dní prostřednictvím téhož periferního přístupu. Během podávání přípravku Nutriflex Omega peri je nezbytné zajistit pacientům přísun odpovídajícího množství stopových prvků a vitaminů.
Délka infuze z jednoho vaku
Doporučená délka infuze z jednoho vaku pro parenterální výživu je maximálně 24 hodin.
Způsob podání
Intravenózní podání. Infuze do periferní nebo centrální žíly.
4.3 Kontraindikace
- hypersenzitivita na léčivé látky, vejce, ryby, arašídy nebo sójovou bílkovinu nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1
- vrozené poruchy metabolismu aminokyselin
- těžká hyperlipidemie charakterizovaná hypertriglyceridemií (> 1 000 mg/dl nebo 11,4 mmol/l)
- těžká koagulopatie
- hyperglykemie nereagující na dávky inzulinu ve výši až 6 jednotek inzulinu/hodinu
- acidóza
- intrahepatální cholestáza
- těžká jaterní insuficience
- těžká renální insuficience bez možnosti použití náhrady funkce ledvin
- zhoršující se hemoragická diatéza
- akutní tromboembolické příhody, tuková embolie
- nestabilita oběhového systému s ohrožením života (stav kolapsu a šoku)
- akutní fáze infarktu myokardu a cévní mozkové příhody
- nestabilní metabolický stav (např. závažný postagresivní syndrom, kóma neznámého původu)
- nedostatečné zásobování buněk kyslíkem
- porušení bilance elektrolytů a tekutin
- akutní plicní edém
- dekompenzovaná srdeční insuficience
4.4 Zvláštní upozornění a opatření pro použití
-
V případě zvýšené sérové osmolarity je nutno postupovat s opatrností.
Porušení bilance tekutin a elektrolytů nebo acidobazické bilance je nutno vyřešit ještě před zahájením infuze.
Příliš rychlá infuze může způsobit převodnění s patologickými hodnotami koncentrace elektrolytů v séru, hyperhydratací a plicním edémem.
Jakékoli známky nebo symptomy anafylaktické reakce (jako je horečka, svalový třes, vyrážka či dušnost) by měly vést k okamžitému přerušení infuze.
Při infuzi přípravkem Nutriflex Omega peri je rovněž třeba monitorovat koncentraci triacylglycerolů v séru.
-
V závislosti na metabolickém stavu pacienta může občas dojít k výskytu hypertriglyceridemie. Jestliže koncentrace triacylglycerolů v plazmě během podávání lipidů překročí 4,6 mmol/l (400 mg/dl), doporučuje se snížit rychlost infuze. Infuzi je nutno přerušit také tehdy, pokud koncentrace triacylglycerolů v plazmě překročí
-
11,4 mmol/l (1 000 mg/dl), neboť hodnoty tohoto druhu často souvisejí s akutní pankreatitidou.
Pacienti s poruchou metabolismu lipidů
Přípravek Nutriflex Omega peri je třeba podávat opatrně pacientům s poruchami metabolismu lipidů spojenými se zvýšenou hladinou triacylglycerolů v séru, např. při renální insuficienci, diabetu mellitu, pankreatitidě, poruše funkce jater, hypotyreóze (s hypertriglyceridemií), sepsi a metabolickém syndromu. Pokud bude Nutriflex Omega peri použit u pacientů s uvedenými stavy, je u nich nutno hladinu triacylglycerolů v séru monitorovat častěji, aby bylo jisté, že dochází k eliminaci triacylglycerolů a že se jejich hladina stabilně pohybuje pod hodnotou 11,4 mmol/l (1 000 mg/dl).
U kombinovaných hyperlipidemií a metabolického syndromu reaguje hladina triacylglycerolů na přísun glukózy, lipidů a nadměrnou výživu. Dávku je pak třeba upravit odpovídajícím způsobem. Je také zapotřebí vyhodnotit a monitorovat další zdroje lipidů a glukózy a také léky ovlivňující jejich metabolismus.
Na poruchu metabolismu lipidů poukazuje rovněž přítomnost hypertriglyceridemie 12 hodin po podání lipidů.
Stejně jako všechny roztoky obsahující sacharidy může i přípravek Nutriflex Omega peri vyvolat hyperglykemii. Je proto nutno sledovat hladinu glukózy v krvi. Pokud k hyperglykemii dojde, rychlost infuze je nutno snížit nebo je třeba podat inzulin. V úvahu je nutno vzít i množství glukózy, která je navíc pacientovi současně intravenózně podávána jako součást dalších roztoků glukózy.
Pokud se během podávání koncentrace glukózy v krvi zvýší nad 14 mmol/l (250 mg/dl), je na místě zvážit přerušení podávání emulze.
Realimentace nebo nasycení u podvyživených nebo vyčerpaných pacientů může vyvolat hypokalemii, hypofosfatemii a hypomagnezemii. Je nutné pozorně sledovat hladinu elektrolytů v séru. V závislosti na odchylkách od normálních hodnot je nezbytné zajistit přísun dostatečného množství elektrolytů.
Je nutné kontrolovat hladinu elektrolytů v séru, bilanci vody, acidobazickou bilanci, krevní obraz, stav koagulace a funkci jater a ledvin.
Podle potřeby může být nezbytné doplňovat elektrolyty, vitaminy a stopové prvky. Protože Nutriflex Omega peri obsahuje zinek, hořčík, vápník a fosfát, je třeba při souběžném podávání s roztoky obsahujícími tyto látky postupovat opatrně.
Nutriflex Omega peri je přípravek s komplexním složením. Důrazně se proto doporučuje nepřidávat k němu žádné další roztoky (pokud není prokázána kompatibilita; viz bod 6.2).
Aditiva mohou zvýšit celkovou osmolaritu emulze. Jejich přidání je třeba zvážit s ohledem na periferní podání a sledovat místo aplikace injekce.
Kvůli nebezpečí pseudoaglutinace se přípravek Nutriflex Omega peri nemá podávat toutéž infuzní soupravou souběžně s krví (viz též bod 4.5).
Tak jako u všech intravenózních roztoků, zejména roztoků pro parenterální výživu, je rovněž u infuzí přípravku Nutriflex Omega peri nezbytné striktně dodržovat zásady aseptické manipulace.
Infuze do periferní žíly může vyvolat tromboflebitidu. Každý den je třeba kontrolovat, zda se v místě aplikace infuze neobjeví známky tromboflebitidy.
Pediatrická populace
S použitím přípravku Nutriflex Omega peri u dětí a dospívajících nejsou doposud žádné klinické zkušenosti.
Starší pacienti
Na tuto skupinu se vztahuje v zásadě totéž dávkování jako u dospělých, opatrně je však třeba postupovat u pacientů trpících dalšími onemocněními, která často pokročilý věk doprovázejí, jako je srdeční nebo renální insuficience.
Pacienti s diabetem mellitem a poruchami srdce nebo ledvin
Jako všechny infuzní roztoky o velkém objemu se má i přípravek Nutriflex Omega peri podávat opatrně pacientům s poruchou funkce srdce nebo ledvin.
U pacientů s diabetem mellitem nebo selháním ledvin jsou s použitím přípravku jen omezené zkušenosti.
Obsah tuku v přípravku může mít vliv na výsledky některých laboratorních vyšetření (např. bilirubinu, laktátdehydrogenázy, saturace kyslíkem), je-li vzorek krve odebrán předtím, než je tuk z krevního oběhu dostatečně vstřebán.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Některé léky, například inzulin, mohou ovlivňovat lipázový systém organismu. Zdá se ale, že tento typ interakce má jen omezený klinický význam.
Heparin podávaný v klinických dávkách způsobuje přechodné uvolňování lipoproteinové lipázy do oběhu. To může vést zprvu k zintenzivnění lipolýzy v plazmě a následně k přechodnému snížení clearance triacylglycerolů.
V sójovém oleji je přirozeně obsažen vitamin K1. To může mít dopad na léčivý účinek derivátů kumarinu, a proto je třeba u pacientů léčených těmito léčivy jejich hladinu pozorně sledovat.
U pacientů, jimž jsou podávány léky zvyšující koncentraci draslíku v séru, jako jsou draslík šetřící diuretika (triamteren, amilorid, spironolakton), inhibitory ACE (např. kaptopril, enalapril), antagonisté receptorů pro angiotenzin II (např. losartan, valsartan), cyklosporin a takrolimus, je třeba používat roztoky obsahující draslík, jako je Nutriflex Omega peri, s opatrností.
Kortikosteroidy a ACTH mohou způsobovat retenci sodíku a tekutin.
Kvůli nebezpečí pseudoaglutinace se přípravek Nutriflex Omega peri nemá podávat toutéž infuzní soupravou souběžně s krví. (viz též bod 4.4).
4.6 Fertilita, těhotenství a kojení
Těhotenství
Údaje o podávání přípravku Nutriflex Omega peri těhotným ženám jsou omezené nebo nejsou k dispozici. Studie reprodukční toxicity na zvířatech provedené s tukovou emulzí obsahující ve srovnání s přípravkem Nutriflex Omega peri dvojnásobné množství triacylglycerolů omega-3 kyselin a příslušně nižší množství omega-6 triacylglycerolů nenaznačují přímé nebo nepřímé škodlivé účinky (viz bod 5.3). Během těhotenství může být nutné podávat parenterální výživu; přípravek Nutriflex Omega peri lze tedy těhotným ženám podávat pouze po pečlivém zvážení.
Kojení
Složky/metabolity přípravku Nutriflex Omega peri se do lidského mateřského mléka vylučují, ale při podávání v terapeutických dávkách se žádné účinky na kojené novorozence/děti neočekávají. Matkám, jimž je podávána parenterální výživa, se však přesto kojení nedoporučuje.
Fertilita
Údaje o použití přípravku Nutriflex Omega peri nejsou k dispozici.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek Nutriflex Omega peri nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
I při správném používání přípravku ve smyslu sledování dávek a dodržování bezpečnostních opatření a pokynů se mohou vyskytnout nežádoucí účinky. Následující seznam zahrnuje řadu systémových reakcí, které mohou s používáním přípravku Nutriflex Omega peri souviset.
Nežádoucí účinky jsou seřazeny podle frekvence výskytu následovně:
| Velmi časté Časté Méně časté Vzácné Velmi vzácné Není známo | (> 1/10) (> 1/100 až < 1/10) (> 1/1 000 až < 1/100) (> 1/10 000 až < 1/1 000) (< 1/10 000) (frekvenci nelze z dostupných údajů určit) |
Poruchy krve a lymfatického systému
| Vzácné: | Hyperkoagulace |
| Není známo: | Leukopenie, trombocytopenie |
| Poruchy imunitního systému Vzácné: | Alergické reakce (např. anafylaktické reakce, kožní výsev, laryngeální, orální a faciální edém) |
| Poruchy metabolismu a výživy Velmi vzácné: | Hyperlipidemie, hyperglykemie, metabolická acidóza Frekvence těchto nežádoucích účinků závisí na dávce a může se zvýšit při absolutním nebo relativním předávkování lipidy. |
| Poruchy nervového systému Vzácné: | Bolest hlavy, ospalost |
| Cévní poruchy Vzácné: | Hypertenze nebo hypotenze, zrudnutí |
Respirační, hrudní a mediastinální poruchy
| Vzácné: | Dyspnoe, cyanóza |
| Gastrointestinální poruchy Méně časté: | Nauzea, zvracení |
| Poruchy metabolismu a výživy Méně časté: | Ztráta chuti k jídlu |
| Poruchy jater a žlučových cest Není známo: | Cholestáza |
| Poruchy kůže a podkožní tkáně Vzácné: | Erytém, pocení |
Poruchy svalové a kosterní soustavy a pojivové tkáně
Vzácné: Bolest zad, kostí, v hrudní a lumbální oblasti
Celkové poruchy a reakce v místě aplikace
Časté: Po několika dnech může dojít k podráždění žíly, flebitidě nebo
tromboflebitidě
Vzácné: Zvýšená tělesná teplota, pocit chladu, zimnice
Velmi vzácné: Syndrom přetížení tukem (podrobnosti níže)
Pokud se objeví známky podráždění žilní stěny, flebitidy nebo tromboflebitidy, je nutno zvážit změnu místa aplikace infuze.
Pokud se vyskytnou nežádoucí účinky, infuze musí být ukončena.
Infuzi je třeba ukončit i v případě, jestliže se hladina triacylglycerolů během infuze zvýší nad hodnotu
-
11,4 mmol/l (1 000 mg/dl). Pokud se jejich hladina pohybuje nad 4,6 mmol/l (400 mg/dl), je možno v infuzi pokračovat po snížení dávky (viz bod 4.4).
Pokud je infuze poté znovu zahájena, je třeba pacienta pečlivě sledovat, zejména na počátku, a stanovovat hladinu triacylglycerolů v séru v krátkých intervalech.
Nauzea, zvracení a ztráta chuti k jídlu jsou symptomy často vyplývající ze stavu, pro který je parenterální výživa indikována, mohou však současně souviset s podáváním parenterální výživy.
Syndrom přetížení tukem
Snížená schopnost organismu eliminovat triacylglyceroly může vést k „syndromu přetížení tukem“, jenž může být vyvolán předávkováním. Je nutné sledovat, zda se u pacienta nevyskytnou známky přetížení metabolismu. Příčiny mohou být genetické (individuálně odlišný typ metabolismu) nebo může být narušen metabolismus tuků probíhajícím nebo předchozím onemocněním. Tento syndrom může nastat také v průběhu těžké hypertriglyceridemie, a to i při doporučené rychlosti infuze, a v souvislosti s náhlou změnou klinického stavu pacienta, jako je porucha funkce ledvin nebo infekce. Syndrom přetížení tukem je charakterizován hyperlipidemií, horečkou, tukovou infiltrací, hepatomegalií s ikterem nebo bez něj, splenomegalií, anemií, leukopenií, trombocytopenií, koagulopatií, hemolýzou a retikulocytózou, abnormálními výsledky testů funkce jater a kómatem. Tyto příznaky jsou obvykle reverzibilní, pokud se infuze tukovou emulzí ukončí.
Jestliže se objeví známky syndromu přetížení tukem, je třeba infuzi přípravku Nutriflex Omega peri neprodleně ukončit.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky:
4.9 Předávkování
Symptomy předávkování tekutinou a elektrolyty
Hyperhydratace, porušená bilance elektrolytů a plicní edém
Symptomy předávkování aminokyselinami
Renální aminoacidurie s následnou porušenou bilancí aminokyselin, nauzea, zvracení a třes
Symptomy předávkování glukózou
Hyperglykemie, glykosurie, dehydratace, hyperosmolalita, hyperglykemické hyperosmolární kóma
Symptomy předávkování lipidy
Viz bod 4.8
Léčba
U předávkování je indikováno okamžité přerušení infuze. Další léčebná opatření závisí na specifických symptomech a jejich závažnosti. Pokud je infuze po odeznění symptomů opět zahájena, doporučuje se zvyšovat její rychlost postupně a pacienta v krátkých intervalech sledovat.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Roztoky pro parenterální výživu, kombinace
ATC kód: B05BA10
Mechanismus účinku
Účelem parenterální výživy je dodávat organismu veškeré nezbytné živiny a energii pro růst a/nebo regeneraci tkání, stejně jako i pro udržení všech tělesných funkcí.
Obzvláště důležité jsou aminokyseliny, protože některé z nich jsou základními složkami pro syntézu proteinů. Souběžné podávání zdrojů energie (sacharidů/lipidů) je nezbytné proto, aby byly aminokyseliny použity pro regeneraci tkáně a anabolické procesy, a nikoli jako zdroj energie.
Glukóza je metabolizována v rámci celého organismu. Některé tkáně a orgány, jako je CNS, kostní dřeň, erytrocyty či epitel ledvinných kanálků, pokrývají svou spotřebu energie výhradně z glukózy. Glukóza je navíc strukturálním stavebním blokem různých buněčných materiálů.
V důsledku vysoké energetické hustoty jsou lipidy efektivní formou zdroje energie. Triacylglyceroly s dlouhým řetězcem poskytují organismu esenciální mastné kyseliny pro syntézu buněčných složek. Pro tyto účely obsahuje tuková emulze triacylglyceroly se středně dlouhým a dlouhým řetězcem (odvozené ze sójového oleje a rybího oleje).
Frakce triacylglycerolů s dlouhým řetězcem obsahuje omega-6 a omega-3 triacylglyceroly, které jsou zdrojem polynenasycených mastných kyselin. Jejich hlavním účelem je prevence a léčba nedostatku esenciálních mastných kyselin, jsou ale i zdrojem energie. Přípravek Nutriflex Omega peri obsahuje esenciální omega-6 mastné kyseliny, zejména ve formě kyseliny linolové, a omega-3 mastné kyseliny ve formě kyseliny alfa-linolenové, kyseliny eikosapentaenové a kyseliny dokosahexaenové. Poměr omega-6/omega-3 mastných kyselin v přípravku Nutriflex Omega peri je přibližně 2,5:1.
Triacylglyceroly se středně dlouhým řetězcem se hydrolyzují, eliminují z oběhu a kompletně oxidují rychleji než triacylglyceroly s dlouhým řetězcem. Jsou preferovaným energetickým substrátem, a to zejména tehdy, pokud došlo k poruše procesu degradace a/nebo utilizace triacylglycerolů s dlouhým řetězcem, například při nedostatku lipoproteinové lipázy a/nebo kofaktorů lipoproteinové lipázy.
5.2 Farmakokinetické vlastnosti
Absorpce
Přípravek Nutriflex Omega peri se podává intravenózní infuzí. Všechny substráty jsou tedy okamžitě dostupné k metabolizaci.
Distribuce
Rozhodující význam pro dosažení maximální koncentrace triacylglycerolů má velikost dávky, rychlost infuze, metabolický stav a individuální faktory pacienta (hladina na lačno). Při použití v souladu s instrukcemi se zřetelem na pokyny týkající se dávkování nepřekročí hladina koncentrace triacylglycerolů obecně 4,6 mmol/l (400 mg/dl).
Mastné kyseliny se středně dlouhým řetězcem mají nízkou afinitu na albumin. Při pokusech se zvířaty, kdy byla podávána čistá emulze triacylglycerolů se středně dlouhým řetězcem, bylo prokázáno, že mastné kyseliny se středně dlouhým řetězcem mohou při předávkování prostoupit hematoencefalickou bariérou. U emulzí tvořených směsí triacylglycerolů se středně dlouhým a dlouhým řetězcem nebyly pozorovány žádné nežádoucí účinky, jelikož triacylglyceroly s dlouhým řetězcem mají inhibiční účinek na hydrolýzu triacylglycerolů se středně dlouhým řetězcem. Toxický účinek na mozek po podání přípravku Nutriflex Omega peri lze tedy vyloučit.
Aminokyseliny jsou součástí celé řady proteinů v různých orgánech těla. Navíc se každá aminokyselina nachází v krvi a uvnitř buněk jako volná aminokyselina.
Vzhledem k tomu, že glukóza je rozpustná ve vodě, je krví distribuována do celého těla. Roztok glukózy se nejdříve dostává do intravaskulárního prostoru, a pak je přepravován do intracelulárního prostoru.
Ve vztahu k transportu jednotlivých složek placentární bariérou nejsou k dispozici žádné údaje.
Biotransformace
Aminokyseliny, které se nepodílí na syntéze proteinů, jsou metabolizovány následovně. Aminoskupina se transaminací oddělí od uhlíkového skeletu. Uhlíkový řetězec je buď oxidován přímo na CO2 nebo slouží jako substrát pro glukoneogenezi v játrech. Aminoskupina může být rovněž metabolizována v játrech na močovinu.
Glukóza je metabolizována na CO2 a H2O známými metabolickými cestami. Část glukózy se využívá k syntéze lipidů.
Po podání infuze se triacylglyceroly hydrolyzují na glycerol a mastné kyseliny. Obě tyto složky jsou pak součástí fyziologických mechanismů tvorby energie, syntézy biologicky aktivních molekul, glukoneogeneze a resyntézy lipidů.
Omega-3 polynenasycené mastné kyseliny s dlouhým řetězcem konkrétně v buněčných membránách nahrazují kyselinu arachidonovou jako substrát pro tvorbu eikosanoidů a snižují tvorbu zánětlivých eikosanoidů a cytokinů v organismu. To může být prospěšné u pacientů s rizikem rozvoje hyperzánětlivých stavů a sepse.
Eliminace
Pouze malé množství aminokyselin se vylučuje v nezměněné formě močí.
Nadbytečná glukóza se vylučuje močí pouze tehdy, bylo-li dosaženo renálního prahu pro glukózu.
Jak triacylglyceroly ze sójového oleje, tak triacylglyceroly se středně dlouhým řetězcem se kompletně metabolizují na CO2 a H2O. Malé množství lipidů se ztrácí pouze při olupování buněk pokožky a dalších membrán epitelu. K renální exkreci prakticky nedochází.
5.3 Předklinické údaje vztahující se k bezpečnosti
Předklinické studie, včetně farmakologických studií bezpečnosti a studií reprodukční a vývojové toxicity, provedené s tukovou emulzí obsahující dvojnásobné množství triacylglycerolů omega-3 kyselin a příslušně nižší množství omega-6 triacylglycerolů neodhalily jiné účinky než ty, které je možno po podání vysokých dávek lipidů očekávat.
Toxické účinky směsi živin podávané jako substituční terapie v doporučených dávkách se neočekávají.
Reprodukční toxicita
Fytoestrogeny jako B-sitosterol se nacházejí v řadě rostlinných olejů, zejména pak v oleji sójovém. Po subkutánním a intravaginálním podání B-sitosterolu byly u potkanů a králíků zjištěny poruchy fertility. Po podání čistého B-sitosterolu byl u samců potkanů zaznamenán pokles hmotnosti varlat a snížená koncentrace spermatu a u samic králíků nižší počet březostí. V souladu se současným stavem vědomostí se však zdá, že účinky pozorované u zvířat nemají pro klinické použití význam.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Monohydrát kyseliny citronové (na úpravu pH)
Glycerol
Vaječný lecithin
Natrium-oleát
Hydroxid sodný (na úpravu pH)
Tokoferol-alfa
Voda na injekci
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky, u nichž nebyla potvrzena kompatibilita. Viz bod 6.6.
Nutriflex Omega peri nemá být podáván souběžně s krví; viz body 4.4 a 4.5.
6.3 Doba použitelnosti
Neotevřený vak
2 roky
Po odstranění ochranného přebalu a po smíchání obsahu vaku
Po smíchání obsahu jednotlivých komor je nutno použít finální emulzi okamžitě.
Po přimísení kompatibilních aditiv
Z mikrobiologického hlediska má být přípravek po přimísení aditiv použit okamžitě. Není-li po přimísení aditiv použit okamžitě, doba a podmínky uchování přípravku po otevření a před použitím jsou v odpovědnosti uživatele.
Po prvním otevření (propíchnutí infuzního portu)
Po otevření obalu je nutno použít emulzi okamžitě.
6.4 Zvláštní opatření pro uchovávání
Neuchovávejte při teplotě nad 25 °C.
Chraňte před mrazem. Pokud dojde k náhodnému zmrazení, vak zlikvidujte. Uchovávejte vak v ochranném přebalu, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
Přípravek Nutriflex Omega peri je dodáván ve flexibilních vícekomorových vacích z vícevrstvé fólie. Vnitřní vrstvu, která je v kontaktu s roztokem, tvoří polypropylen. Dvojitý port ve dnu vaku je vyroben z polypropylenu a styren-ethylen-butylen-styrenu. Vícekomorový vak obsahuje:
-
– 1 250 ml (500 ml roztoku aminokyselin + 250 ml tukové emulze + 500 ml roztoku glukózy)
-
– 1 875 ml (750 ml roztoku aminokyselin + 375 ml tukové emulze + 750 ml roztoku glukózy)
-
– 2 500 ml (1 000 ml roztoku aminokyselin + 500 ml tukové emulze + 1 000 ml roztoku glukózy)
w s £
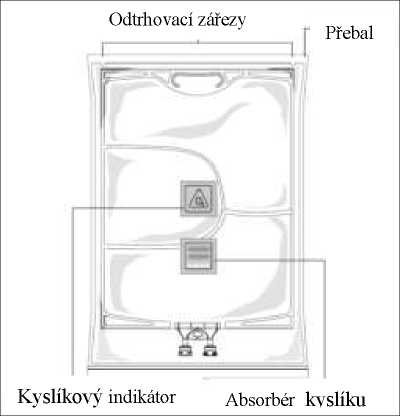
Odtrhovací zářezy
r
i Přebal
KysHkový indikátor Absorbér kyslíku
Držadlo/poutko
Glukóza
Tuková emulze
Roztok aminokyselin
Infuzní port -----
Port pro léčiva
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Žádné zvláštní požadavky na likvidaci.
Před použitím je třeba vizuálně zkontrolovat, zda přípravek pro parenterální výživu není poškozen, zda nemá jinou barvu, než je uvedeno, a zda je emulze stabilní.
Nepoužívejte poškozené vaky. Poškozen nesmí být ani přebal, ani samotný vak. Přípravek použijte jen tehdy, pokud jsou otevíratelné svary mezi komorami neporušené, roztok aminokyselin a roztok glukózy je čirý a bezbarvý až slámově zbarvený a emulze je homogenní tekutina mléčně bílé barvy. Přípravek nepoužívejte, pokud jsou roztoky zabarveny jinak, než se uvádí, nebo obsahují pevné částice. Nepoužívejte jej ani tehdy, pokud emulze vykazuje známky oddělení fází (olejové kapičky, vrstva oleje).
Před sejmutím přebalu zkontrolujte barvu kyslíkového indikátoru (viz obrázek A). Přípravek nepoužívejte, pokud má kyslíkový indikátor růžovou barvu. Použít přípravek lze jen tehdy, je-li kyslíkový indikátor žlutý.
Příprava emulze smíšením
Je nutno přísně dodržovat podmínky aseptické manipulace.
Otevření: Roztrhněte přebal. Začněte u odtrhovacích zářezů (obr. 1). Vyjměte vak z ochranného přebalu. Zlikvidujte přebal, kyslíkový indikátor a absorbér kyslíku.
Vizuálně zkontrolujte, zda nedošlo k úniku kapaliny z vaku s přípravkem. Netěsnící vaky je nutno zlikvidovat, protože u nich není možno zaručit sterilitu.
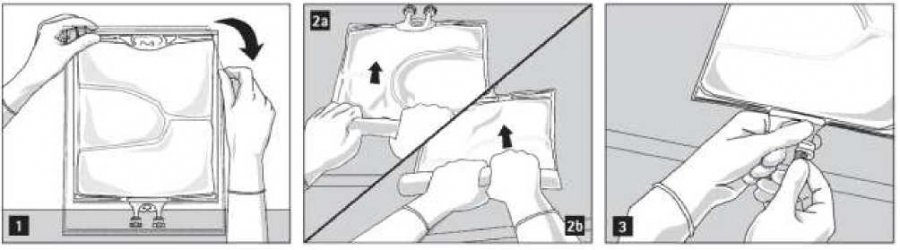
Pro otevření jednotlivých komor a postupné smíchání jejich obsahu začněte rolovat vak oběma rukama; nejdříve otevřete otevíratelný svar oddělující horní komoru (glukóza) od dolní komory (aminokyseliny) (obr. 2a). Potom pokračujte v rolování vaku tak, aby se otevřel otevíratelný svar oddělující střední komoru (lipidy) od dolní komory (obr. 2b).
Přimísení aditiv
Po odstranění aluminiového uzávěru (obr. 3) je možno portem pro léčiva přidat kompatibilní aditiva (obr. 4). Nutriflex Omega peri lze mísit s následujícími aditivy: Alanylglutamin
Voda na injekci
Monohydrát kalcium-glukonátu 10 %
Chlorid sodný 20 %
Chlorid draselný 14,9 %
Síran hořečnatý 50 % Dihydrogenfosforečnan draselný 1M
Tracutil (stopové prvky)
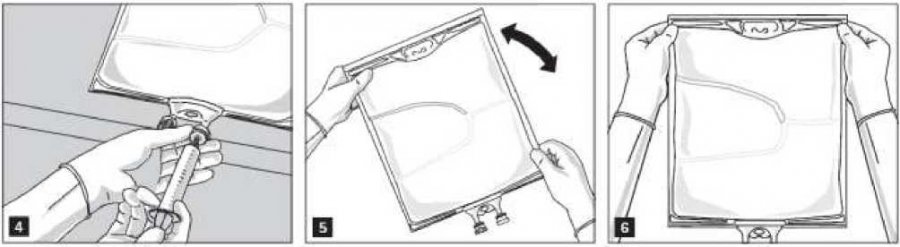
Promíchejte důkladně obsah vaku (obr. 5) a směs vizuálně zkontrolujte (obr. 6). Neměly by v ní být patrné žádné známky oddělení fází emulze.
Směs je mléčně bílá homogenní emulze typu olej ve vodě.
Příprava infuze
Emulze má mít vždy před infuzí pokojovou teplotu.
Z infuzního portu odstraňte aluminiovou fólii (obr. 7) a připojte infuzní soupravu (obr. 8). Použijte infuzní soupravu bez přívodu vzduchu nebo u soupravy s přívodem vzduchu zavřete ventil. Zavěste vak na infuzní stojan (obr. 9) a proveďte infuzi standardním způsobem.
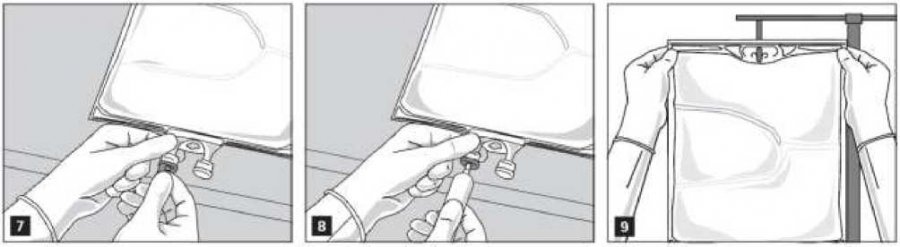
Pouze k jednorázovému použití. Po použití zlikvidujte obal i nepoužitý přípravek.
Obaly s částečně spotřebovaným obsahem znovu nenapojujte.
Používáte-li filtry, musí být propustné pro tuky (velikost pórů > 1,2 ^m).
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
B. Braun Melsungen AG
Carl-Braun-StraBe 1
34212 Melsungen
Německo
Poštovní adresa
B. Braun Melsungen AG
34209 Melsungen
Německo
Tel.: +49–5661–71–0
Fax: +49–5661–71–4567
8. REGISTRAČNÍ ČÍSLO(A)
76/463/14-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 26. 7. 2017
Datum posledního prodloužení registrace:
Další informace o léčivu NUTRIFLEX OMEGA PERI
Jak
se NUTRIFLEX OMEGA PERI
podává: intravenózní podání - infuzní emulze
Výdej
léku: na lékařský předpis
Balení: Vak
Velikost
balení: 5X1875ML
Držitel rozhodnutí o registraci daného léku v České republice:
B. Braun Melsungen AG, Melsungen
E-mail: vpois.cz@bbraun.com
Telefon: 271091450
