Souhrnné informace o léku - NUMETA G13%E
1. NÁZEV PŘÍPRAVKU
NUMETA G13%E, infuzní emulze
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Tento léčivý přípravek se dodává ve formě tříkomorového vaku. Každý vak obsahuje sterilní apyrogenní kombinaci roztoku glukózy, roztoku aminokyselin vhodných pro pediatrické použití, s elektrolyty a lipidovou emulzi, jak je popsáno níže.
| Velikost balení | 50% roztok glukózy | 5,9% roztok aminokyselin a elektrolytů | 12,5% lipidová emulze |
| 300 ml | 80 ml | 160 ml | 60 ml |
Pokud je nežádoucí podávání lipidů, konstrukce vaku umožňuje protržení pouze těsnících švů mezi komorami aminokyselin/elektrolytů a glukózy bez protržení těsnícího švu mezi komorou aminokyselin a lipidů, který zůstane intaktní. Následně lze obsah vaku infundovat s/ nebo bez lipidů. Složení léčivého přípravku, po smíchání dvou (aminokyseliny a glukóza, 2 komory vaku, 240 ml roztoku) nebo tří (aminokyseliny, glukóza a lipidy, 3 komory vaku, 300 ml emulze) komor, je uvedeno v následující tabulce.
| Složení | ||
| Léčivá látka | Aktivován 2KV (240 ml) | Aktivován 3KV (300 ml) |
| Komora s aminokyselinami | ||
| alaninum | 0,75 g | 0,75 g |
| argininum | 0,78 g | 0,78 g |
| acidum asparticum | 0,56 g | 0,56 g |
| cysteinům | 0,18 g | 0,18 g |
| acidum glutamicum | 0,93 g | 0,93 g |
| glycinum | 0,37 g | 0,37 g |
| histidinum | 0,35 g | 0,35 g |
| isoleucinum | 0,62 g | 0,62 g |
| leucinum | 0,93 g | 0,93 g |
| lysinum monohydricum | 1,15 g | 1,15 g |
| (ekvivalentní lysinum) | (1,03 g) | (1,03 g) |
| methioninum | 0,22 g | 0,22 g |
| ornithini hydrochloridum | 0,30 g | 0,30 g |
| (ekvivalentní ornithinum) | (0,23 g) | (0,23 g) |
| phenylalaninum | 0,39 g | 0,39 g |
| prolinum | 0,28 g | 0,28 g |
| serinum | 0,37 g | 0,37 g |
| taurinum | 0,06 g | 0,06 g |
| threoninum | 0,35 g | 0,35 g |
| tryptophanum | 0,19 g | 0,19 g |
Složení
| Léčivá látka | Aktivován 2KV (240 ml) | Aktivován 3KV (300 ml) |
| tyrosinum | 0,07 g | 0,07 g |
| valinum | 0,71 g | 0,71 g |
| kalii acetas | 0,61 g | 0,61 g |
| calcii chloridum dihydricum | 0,55 g | 0,55 g |
| magnesii acetas tetrahydricus | 0,10 g | 0,10 g |
| natrii glycerophosphas hydricus | 0,98 g | 0,98 g |
| Komora s glukózou | ||
| glucosum monohydricum (ekvivalentní | 44,00 g | 44,00 g |
| glucosum) | (40,00 g ) | (40,00 g ) |
| Komora s lipidy | ||
| olivae oleum raffinatum (cca 80 %) + sojae oleum raffinatum (cca 20 %) | – | 7,5 g |
| 2KV= 2komorový vak, 3KV = 3komorový vak | ||
Úplný seznam pomocných látek viz bod 6.1.
| Rekonstituovaný roztok/emulze obsahuje následující s | ložky: | |||
| Složení | ||||
| Aktivován 2KV | Aktivován 3KV | |||
| V objemových jednotkách (ml) | 240 | 100 | 300 | 100 |
| Dusík (g) | 1,4 | 0,59 | 1,4 | 0,47 |
| Aminokyseliny (g) | 9,4 | 3,9 | 9,4 | 3,1 |
| Glukóza(g) | 40,0 | 16,7 | 40,0 | 13,3 |
| Lipidy (g) | 0 | 0 | 7,5 | 2,5 |
| Energie | ||||
| Celkové kalorie (kcal) | 198 | 82 | 273 | 91 |
| Neproteinové kalorie (kcal) | 160 | 67 | 235 | 78 |
| Kalorie – glukóza (kcal) | 160 | 67 | 160 | 53 |
| Kalorie – lipidy (kcal) a | 0 | 0 | 75 | 25 |
| Neproteinové kalorie/dusík (kcal/g N) | 113 | 113 | 165 | 165 |
| Lipidové kalorie (% neproteinové | neuplatňuje | neuplatňuje | 32 | 32 |
| kalorie) | se | se | ||
| Lipidové kalorie (% celkové kalorie) | neuplatňuje se | neuplatňuje se | 28 | 28 |
| Elektrolyty | ||||
| Sodík (mmol) | 6,4 | 2,7 | 6,6 | 2,2 |
| Draslík (mmol) | 6,2 | 2,6 | 6,2 | 2,1 |
| Hořčík (mmol) | 0,47 | 0,20 | 0,47 | 0,16 |
| Vápník (mmol) | 3,8 | 1,6 | 3,8 | 1,3 |
| Fosfát b (mmol) | 3,2 | 1,3 | 3,8 | 1,3 |
| Acetát (mmol) | 7,2 | 3,0 | 7,2 | 2,4 |
| Malát (mmol) | 3,2 | 1,3 | 3,2 | 1,1 |
| Chlorid (mmol) | 9,3 | 3,9 | 9,3 | 3,1 |
| pH (přibl.) | 5,5 | 5,5 | 5,5 | 5,5 |
| |Osmolarita přibl. (mosm/l) | 1400 | 1400 | 1150 | 1150 |
| a Zahrnuje kalorie z vaječných fosfolipid | ů. | |||
b Zahrnuje fosfáty z vaječných fosfolipidů, které jsou složkou lipidové emulze.
3. LÉKOVÁ FORMA
Infuzní emulze
Vzhled před rekonstitucí:
- Roztoky v komorách aminokyselin a glukózy jsou čiré, bezbarvé nebo slabě žluté.
- Lipidová emulze je homogenní a mléčně bílá.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Přípravek Numeta G 13 % E je indikován pro parenterální výživu předčasně narozených novorozenců, pokud perorální nebo enterální výživa je nemožná, nedostatečná nebo kontraindikovaná.
4.2 Dávkování a způsob podání
Dávkování
Dávkování závisí na energetickém výdeji, hmotnosti pacienta, věku, klinickém stavu pacienta a jeho schopnosti metabolizovat složky přípravku Numeta, a také na další energii nebo proteinech podaných perorálně/enterálně. Celkové složení elektrolytů a makronutriční složení je závislé na počtu aktivovaných komor (viz bod 2).
Maximální denní dávka nemá být překročena. Kvůli předem stanovenému složení vícekomorového vaku nemusí být možné současně splnit všechny výživové potřeby pacienta. Mohou se vyskytovat klinické případy, kdy pacienti budou vyžadovat množství živin odlišné od složení příslušného vaku.
Maximální doporučená hodinová rychlost infuze a denní objem závisí na složkách infuze. První z těchto limitů, který má být dosažen, určuje maximální denní dávku. Pokyny pro maximální doporučenou hodinovou rychlost infuze a denní objem jsou následující:
| Aktivován 2KV (240 ml) | Aktivován 3KV (300 ml) | |
| Maximální rychlost podávání infuze v ml/kg/hod | 5,1 | 6,4 |
| Odpovídá: | ||
| Aminokyseliny v g/kg/hod | 0,20 a | 0,20 a |
| Glukóza v g/kg/hod | 0,85 | 0,85 |
| Lipidy v g/kg/hod | 0 | 0,16 |
| Maximální množství v ml/kg/den | 102,3 | 127,9 |
| Odpovídá: | ||
| Aminokyseliny v g/kg/den | 4,0 a | 4,0 a |
| Glukóza v g/kg/den | 17,1 | 17,1 |
| Lipidy v g/kg/den | 0 | 3,2 |
a Limitující parametr podle pokynů ESPEN-ESPGHAN.
Přípravek Numeta G 13 % E nemusí být vhodný pro některé předčasně narozené novorozence, jelikož klinický stav pacienta může vyžadovat podávání individuálně připravených přípravků, které splní specifické potřeby pacienta stanovené lékařem.
Způsob podání
Návod k přípravě a manipulaci s roztokem / infuzní emulzí je uveden v bodě 6.6.
Kvůli vysoké osmolaritě lze neředěný přípravek Numeta G 13 % E podávat pouze do centrální žíly. Nicméně dostatečné naředění přípravku Numeta G 13 % E vodou na injekci sníží osmolaritu a umožní podání periferní infuzí. Tabulka níže ukazuje, jak naředění ovlivní osmolaritu vaků.
Příklady osmolarity u aktivovaných 2KV a aktivovaných 3KV směsí po přidání stopových prvků, vitamínů a vody na injekci:
| Aminokyseliny a glukóza (aktivován 2KV) | Aminokyseliny, glukóza a lipidy (aktivován 3KV) | |
| Původní objem ve vaku (ml) | 240 | 300 |
| Původní osmolarita (přibližná, mosm/l) | 1400 | 1150 |
| Objem přidané vody (ml) | 240 | 300 |
| Přidané stopové prvky a | 2.5 ml TE1 | 2.5 ml TE1 |
| Přidané vitamíny a | % lahvičky V1 | % lahvičky V1 + % lahvičky V2 |
| Konečný objem po přidání (ml) | 485 | 605 |
| Osmolarita po přidání (přibližná, mosm/l) | 695 | 570 |
Složení přípravků s vitamíny a stopovými prvky je popsáno níže.
Složení běžně používaných přípravků se stopovými prvky
| Složení v jedné lahvičce | TE1 (10 ml) |
| Zinek | 38,2 ^mol nebo 2,5 mg |
| Selen | 0,253 ^mol nebo 0,02 mg |
| Měď | 3,15 ^mol nebo 0,2 mg |
| Jód | 0,0788 ^mol nebo 0,01 mg |
| Fluor | 30 ^mol nebo 0,57 mg |
| Mangan | 0,182 ^mol nebo 0,01 mg |
Složení běžně používaných vitamínových přípravků
| Složení v jedné lahvičce | V1 | V2 |
| Vitamín B1 | 2,5 mg | |
| Vitamín B2 | 3,6 mg | |
| Nikotinamid | 40 mg | |
| Vitamín B6 | 4,0 mg | |
| Kys. pantothenová | 15,0 mg | |
| Biotin | 60 Mg | |
| Kyselina listová | 400 Lig | |
| Vitamín B12 | 5,0 bg | |
| Vitamín C | 100 mg | |
| Vitamín A | – | 2300IU |
| Vitamín D | – | 400 IU |
| Vitamín E | – | 7 IU |
| Vitamín K | – | 200 gg |
Je nutné postupně zvyšovat rychlost podávání v průběhu první hodiny. Před ukončením podávání přípravku Numeta G 13 % E je nutné během poslední hodiny rychlost podávání postupně snižovat. Rychlost podávání je nutné upravit podle požadované podávané dávky, denního objemového příjmu infuzí a jejího trvání, viz bod 4.9.
U předčasně narozených novorozenců se obvykle doporučuje kontinuální parenterální podávání po dobu 24 hodin. Avšak stejný vak nesmí být aktivován, zavěšen ani podáván déle než 24 hodin. Infuze lze podávat opakovaně v souladu s pacientovou metabolickou tolerancí. Léčba pomocí parenterální výživy může pokračovat tak dlouho, jak vyžaduje klinický stav pacienta.
Tento přípravek obsahuje elektrolyty a lze jej dále obohatit komerčními elektrolytovými přípravky v souladu s posouzením lékaře a klinickými potřebami pacienta, viz bod 6.6.
Vitamíny a stopové prvky mohou být přidány podle zvážení lékaře a klinických potřeb pacienta, viz bod 6.6.
4.3 Kontraindikace
Obecné kontraindikace pro podávání přípravku Numeta ve formě aktivovaného 2komorového vaku v podobě intravenózní infuze jsou následující:
- hypersenzitivita na vaječné, sójové nebo arašídové proteiny nebo na kteroukoli léčivou nebo pomocnou látku uvedenou v bodě 6.1 nebo komponenty obalu
- vrozená abnormalita metabolismu aminokyselin
- patologicky zvýšené koncentrace sodíku, draslíku, hořčíku, vápníku a/nebo fosforu v plazmě
- souběžná léčba ceftriaxonem, i pokud se podají oddělenými infuzními sety. Viz body 4.4, 4.5 a 6.2
- závažná hyperglykémie
- závážná hyperlipidémie nebo závažné poruchy metabolizmu lipidů charakterizované hypertriglyceridémií
4.4 Zvláštní upozornění a opatření pro použití
Infuzi je nutné okamžitě zastavit, pokud se objeví jakékoli známky nebo příznaky alergické reakce (např. horečka, pocení, třes, bolest hlavy, kožní vyrážka nebo dyspnoe).
U předčasně narozených novorozenců byly popsány případy fatálních reakcí vápenato-ceftriaxonových precipitátů v plicích a ledvinách.
U předčasně narozených novorozenců je souběžná léčba s ceftriaxonem kontraindikována (viz bod 4.3).
U pacientů užívajících parenterální výživu byly hlášeny pulmonální vaskulární precipitáty způsobující pulmonální vaskulární embolii a dýchací obtíže. V některých případech došlo k úmrtí. Nadměrné přidání vápníku a fosfátu zvyšuje riziko tvorby vápenato fosfátových precipitátů (viz bod 6.2).
Byla také hlášeno podezření na tvorbu precipitátů v krevním řečišti.
Kromě kontroly roztoku se mají také pravidelně kontrolovat precipitáty také v infuzním setu a katétru.
Pokud se objeví dýchací potíže, musí se infuze zastavit a stav pacienta klinicky posoudit.
Nepřidávejte k vaku žádná aditiva bez předchozí kontroly kompatibility, protože případné utvoření precipitátu nebo destabilizace lipidové emulze může vést k cévní okluzi, viz body 6.2 a 6.6.
Jako důsledek použití intravenózních katétrů pro podávání parenterálních přípravků nebo nesprávné péče o katétry se mohou vyskytnout infekce a sepse. Imunosupresivní účinky choroby nebo léků mohou posílit infekci a sepsi. Odhalit časnou infekci napomohou důsledná symptomatická a laboratorní sledování teploty/zimnice, leukocytózy, technických komplikací s přístupovým zařízením a hyperglykémie. Pacienti, u kterých je nutná parenterální výživa, mají často dispozice k infekčním komplikacím kvůli malnutrici a/nebo základnímu chorobnému stavu. Výskyt septických komplikací lze snížit zvýšenou pozorností při dodržování aseptických technik při umístění katétru, jeho údržbě, stejně jako dodržení aseptické techniky při přípravě nutričních přípravků.
U jiných přípravků pro parenterální výživu byl hlášen syndrom přetížení tuky. Snížená nebo omezená schopnost metabolizovat tuky obsažené v přípravku Numeta může vést k „syndromu přetížení tuky”.
Realimentace vážně podvyživených pacientů může vést k rozvoji tzv. reperfúzního syndromu (refeeding syndrome), který je charakterizován posunem v intracelulárních hodnotách draslíku, fosforu a hořčíku, protože u pacientů začne převládat anabolická složka metabolismu. Může dojít i k rozvoji deficitu thiaminu a zadržování tekutin. Doporučuje se opatrné a pomalé zahájení parenterální výživy s důkladným sledováním tekutin, elektrolytů, stopových prvků a vitamínů.
Přípravek Numeta G 13 % E se musí podávat výhradně centrální žílou s výjimkou, pokud se provede příslušné naředění (viz bod 4.2). Při přidávání látek do přípravku je před podáním do periferní žíly nutné vypočítat konečnou osmolaritu směsi, aby se zabránilo podráždění žíly.
Nepřipojujte vaky do série, aby nedošlo k vzduchové embolii v důsledku možného reziduálního plynu obsaženého v primárním vaku.
Lipidy, vitamíny, další elektrolyty a stopové prvky mohou být podány podle potřeby.
K žádné z komor 3 komorového vaku nebo rekonstituovanému roztoku / emulzi nepřidávejte žádný jiný léčivý přípravek nebo látky bez předchozího ověření jejich kompatibility a stability výsledného přípravku (především stability lipidové emulze) (viz bod 6.2 a 6.6).
-
V průběhu léčby pravidelně sledujte rovnováhu vody a elektrolytů, včetně hořčíku, osmolaritu séra, sérové triglyceridy, acidobazickou rovnováhu, krevní glukózu, funkce jater a ledvin
a krevní obraz včetně trombocytů a koagulačních parametrů.
-
V případě nestabilních stavů (např. následkem vážných posttraumatických stavů, nekompenzované cukrovky, akutní fáze oběhového šoku, akutního infarktu myokardu, závážné metabolické acidózy, závážné sepse a hyperosmolárního kómatu) je třeba podávání přípravku Numeta G 13 % E sledovat a upravovat tak, aby vyhovovalo klinickým potřebám pacienta.
O podávání přípravku Numeta G 13 % E u předčasně narozených novorozenců gestačního věku nižšího než 28 týdnů jsou k dispozici pouze omezené údaje.
Kardiovaskulární
Používejte opatrně u pacientů s plicním edémem nebo srdečním selháním. Je třeba důkladně sledovat stav tekutin.
Renální
Používejte opatrně u pacientů s renální insuficiencí. U těchto pacientů je nutné důkladně sledovat stav tekutin a elektrolytů, včetně hořčíku.
Závážné poruchy rovnováhy vody a elektrolytů, závážné stavy přetížení tekutinami a závážné metabolické poruchy je nutné korigovat před zahájením infuze.
Hepatální/gastrointestinální
Opatrně používejte u pacientů s vážnou jaterní insuficiencí, která zahrnuje cholestázu nebo zvýšené hodnoty jaterních enzymů. Je třeba důkladně sledovat funkční jaterní parametry.
Endokrinní a metabolické
K metabolickým komplikacím může dojít v případě, že není nutriční příjem upraven požadavkům pacienta, nebo pokud není metabolická kapacita kterékoli dietní součásti správně vyhodnocena. Nežádoucí účinky na metabolismus mohou nastat podáním neodpovídající nebo nadbytečné výživy nebo v důsledku nevhodného složení směsi vzhledem k potřebám pacienta.
Je nutné pravidelně sledovat koncentrace triglyceridů v séru a schopnost organismu metabolizovat lipidy. Pokud existuje podezření na abnormality lipidového metabolismu, je doporučeno sledování sérových triglyceridů jako klinicky nezbytné.
V případě hyperglykémie musí být upravena infuzní rychlost podávání přípravku Numeta
G 13 % E a/nebo podán inzulín, viz bod 4.9.
Hematologické
Používejte opatrně u pacientů se závážnými poruchami krevní srážlivosti. Je třeba důkladně sledovat krevní obraz a koagulační parametry.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
S přípravkem Numeta G 13 % E nebyly provedeny žádné studie farmakodynamické interakce.
Přípravek Numeta G 13 % E nesmí být podáván současně s krví stejným infuzním setem, neboť hrozí riziko pseudoaglutinace.
Stejně jako u jiných vápník obsahujících roztoků je současná léčba ceftriaxonem
s přípravkem Numeta G 13 % E kontraindikovaná u předčasně narozených novorozenců (viz body 4.3, 4.4 a 6.2).
Olivový a sójový olej jsou přirozené zdroje vitamínu K1, který může narušit antikoagulační aktivitu kumarinu (nebo jeho derivátů včetně warfarinu).
Vzhledem k tomu, že přípravek Numeta G 13 % E obsahuje draslík, je třeba věnovat pozornost pacientům kteří jsou současně léčeni kalium šetřícími diuretiky (např. amilorid, spironolakton, triamteren) nebo inhibitory ACE, antagonisty receptoru angiotensinu II nebo imunosupresivy takrolimem a cyklosporinem z důvodu rizika vzniku hyperkalemie.
Lipidy obsažené v této emulzi mohou interferovat s výsledky určitých laboratorních testů (např. bilirubin, laktátdehydrogenáza, saturace kyslíkem, krevní hemoglobin), pokud je vzorek krve odebrán dříve, než se lipidy vyloučí. Lipidy jsou obecně odbourány po 5 až 6 hodinách v případě, pokud nejsou podány žádné další lipidy.
Viz také bod 6.2.
4.6 Fertilita, těhotenství a kojení
Těhotenství
Neuplatňuje se, jelikož je přípravek určen pro předčasně narozené novorozence.
Kojení
Neuplatňuje se, jelikož je přípravek určen pro předčasně narozené novorozence.
Fertilita
Přípravek obsahuje glukózu, pediatrický roztok aminokyselin, elektrolyty a lipidovou emulzi; vliv na fertilitu je nepravděpodobný.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Neuplatňuje se.
4.8 Vedlejší účinky
Bezpečnost a podání přípravku Numeta byla zjištována v jednorázové studii fáze III. Ve studii bylo zahrnuto sto padesát devět (159) pediatrických pacientů, kterým byl podáván přípravek Numeta.
Následující tabulka shrnuje nežádoucí účinky, které se během této studie vyskytly.
| Nežádoucí účinky v klinickém hodnocení | ||
| Třída orgánového systému (TOS) | Preferovaný termín podle MedDRA | Frekvenceb |
| PORUCHY METABOLISMU | Hypofosfatemiea | Časté |
| A VÝŽIVY | Hyperglykemiea | Časté |
| Hyperkalcemiea | Časté | |
| Hypertriglyceridemiea | Časté | |
| Hyperlipidemiea | Méně časté | |
| Hyponatremiea | Časté | |
| PORUCHY JATER A ŽLUČOVÝCH CEST | Cholestáza | Méně časté |
a Vzorky krve odebrané během infuze (ne nalačno).
bFrekvence je založena na následujících kategoriích: velmi časté (>1/10), časté (>1/100 až <1/10), méně časté (>1/1000 až <1/100), vzácné (>1/10000 až <1/1000), velmi vzácné (<1/10000).
Následující nežádoucí účinky byly hlášeny u dalších parenterálních výživových směsí:
- Syndrom přetížení tuky: může být způsoben nesprávným podáním (např. předávkováním a/nebo rychlostí infuze vyšší než doporučená rychlost infuze, viz bod 4.9); avšak ke známkám a příznakům tohoto syndromu může dojít i v případě podávání přípravku podle návodu. Snížená nebo omezená schopnost metabolizovat lipidy obsažené v přípravku Numeta G 13 % E provázená prodlouženou clearance plazmy může mít za následek „syndrom přetížení tuky“(„fat overload syndrome“). Tento syndrom je spojen s náhlým zhoršením klinického stavu pacienta a je charakterizován stavy, jako hyperlipidémie, horečka, jaterní steatóza (hepatomegalie), zhoršení jaterních funkcí, anémie, leukopenie, trombocytopenie, porucha koagulopatie a manifestace centrálního nervového systému (např. kóma). Tento syndrom je obvykle reverzibilní, pokud je infuze lipidové emulze zastavena.
- Pulmonální vaskulární precipitáty (pulmonální vaskulární embolie a dechová nedostatečnost) (viz bod 4.4).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu: Státní ústav pro kontrolu léčiv, Šrobárova 48, 100 41 Praha 10, webové stránky: www.sukl.cz/…douci-ucinek
4.9 Předávkování
Pokud rychlost infuze glukózy převyšuje clearance, může se vyvinout hyperglykémie, glykosurie a hyperosmolární syndrom.
Snížená nebo omezená schopnost metabolizovat lipidy může mít za následek syndrom přetížení tuky, jehož důsledky jsou obvykle reverzibilní po zastavení lipidové emulze (viz bod 4.8).
Je nutné pečlivé biochemické sledování a specifické abnormality mají být náležitě léčeny.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: roztoky pro parenterální výživu/kombinace
ATC kód: B05 BA10
Obsah dusíku (20 L-aminokyselin, zahrnující 8 esenciálních aminokyselin) a energie (glukóza a triglyceridy) v přípravku Numeta umožňuje udržování dostatečné rovnováhy dusíku/energie. Dusík a energie jsou potřebné k zajištění normálního fungování všech buněk v organismu a jsou důležité pro syntézu proteinů, růst, hojení ran, funkci imunitního systému, funkci svalů a mnoho dalších buněčných aktivit.
Tento přípravek obsahuje také elektrolyty.
Profil aminokyselin je následující:
- esenciální aminokyseliny/celkové aminokyseliny: 47,5 %
- aminokyseliny s rozvětveným řetězcem/celkové aminokyseliny: 24,0 %
- 15 % nasycených mastných kyselin (NMK),
- 65 % mononenasycených mastných kyselin (MNMK),
- 20 % polynenasycených mastných kyselin (PNMK).
Poměr fosfolipidů/triglyceridů je 0,06. Střední obsah esenciálních mastných kyselin (EMK) vylepšuje stav jejich vyšších derivátů při korekci deficitu EMK.
Olivový olej obsahuje významné množství alfa-tokoferolu, který v kombinaci se středním příjmem PNMK přispívá ke zlepšení hladiny vitamínu E a je důležitý pro omezení peroxidace lipidů.
Glukóza je zdroj sacharidů a je primárním zdrojem energie v organismu.
5.2 Farmakokinetické vlastnosti
Složky infuzní emulze (aminokyseliny, elektrolyty, glukóza, lipidy) jsou distribuovány, metabolizovány a vylučovány stejným způsobem, jako kdyby byly podány jednotlivě.
Přípravek se podává intravenózně, a tak je 100% biologicky dostupný a složky jsou distribuovány a metabolizovány všemi buňkami organismu.
5.3 Předklinické údaje vztahující se k bezpečnosti
Předklinické studie provedené na jednotlivých složkách 3komorového vaku neodhalily další rizika, než která byla již uvedena v jiných bodech SPC. Studie na zvířatech nebyly s přípravkem Numeta provedeny (dvou nebo tříkomorové kombinace).
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Pomocné látky:
Komora
s aminokyselinami
X
Komora s glukózou Komora s lipidy
kyselina jablečná L-formaa kyselina chlorovodíkováa
vaječné fosfolipidy přečištěné frakcionací
glycerol
k úpravě pH
6.2 Inkompatibility
Nepřidávejte jiné léčivé přípravky nebo léčivé látky do žádné ze tří komor vaku nebo k rekonstituovanému roztoku/emulzi bez předchozího ověření jejich kompatibility a stability výsledného složení (konkrétně stability lipidové emulze nebo vzniku precipitátů), viz bod 6.6.
Stejně jako při použití jakékoli parenterální nutriční směsi musí být sledovány hodnoty vápníku a fosfátů. Nadbytečné podávání vápníku a fosfátu, zejména ve formě minerálních solí, může vést k formaci vápenato-fosfátových precipitátů.
Stejně jako u jiných vápník obsahujících roztoků je současná léčba ceftriaxonem
s přípravkem Numeta G 13 % E kontraindikovaná u předčasně narozených novorozenců (viz body 4.3, 4.4 a 4.5).
Přípravek Numeta G 13 % E nesmí být podáván současně s krví prostřednictvím stejného infuzního setu, viz bod 4.5.
Přípravek Numeta G 13 % E obsahuje ionty vápníku, které představují další riziko koagulace a tvorby precipitátů v citrátem antikoagulačně ošetřené krvi nebo jejích složkách.
6.3 Doba použitelnosti
18 měsíců
Doba použitelnosti po rekonstituci
Je doporučeno použít přípravek ihned po protržení těsnicích švů mezi dvěma nebo třemi komorami. Stabilita rekonstituované směsi je 7 dnů při teplotách mezi 2 °C a 8 °C a následně 48 hodin při teplotě 30 °C.
Doba použitelnosti po suplementaci (elektrolyty, stopové prvky, vitamíny, voda):
Pro specifické směsi byla fyzikální stabilita přípravku Numeta prokázána po dobu 7 dnů v rozmezí mezi 2 °C a 8 °C a následně 48hodin při teplotě 30 °C. Informace o těchto dodatcích jsou uvedeny v bodě 6.6.
Z mikrobiologického hlediska má být přípravek použít okamžitě. Není-li použit okamžitě, zodpovídá za dobu použitelnosti a podmínky uchovávání před použitím uživatel. Tato doba by za běžných podmínek neměla být delší než 24 hodin při teplotě 2°C až 8°C, pokud rekonstituce/naředění/suplementace nebyly provedeny za kontrolovaných a validovaných aseptických podmínek.
6.4 Zvláštní opatření pro uchovávání
Chraňte před mrazem.
Uchovávejte v ochranném obalu.
6.5 Druh obalu a obsah balení
Tříkomorový vak, který neobsahuje PVC, se skládá z následujících součástí:
- Vícevrstevného plastového obalu.
- Portu v oddělení obsahující lipidovou emulzi, ten je po naplnění zataven k zamezení možnosti přidávání aditiv do této komory.
- Dvou portů u komor s roztoky aminokyselin a glukózy:
- Injekční port u komory s glukózou.
- Port pro aplikaci v komoře s aminokyselinami.
Všechny součásti jsou bez obsahu přírodní latexové pryže.
K zabránění kontaktu se vzduchem je vak vybaven ochranným obalem s kyslíkovou bariérou, který obsahuje sáček s absorbentem kyslíku a indikátor kyslíku.
Dostupné velikosti balení:
Vaky 300 ml: 10 kusů v kartonu
1 kus 300 ml
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Pouze k jednorázovému použití.
Doporučujeme použít přípravek ihned poté, co dojde k protržení těsnicích švů mezi komorami, a neskladovat jej pro následné infuze.
Nepřipojujte vaky do série, abyste zabránili vzduchové embolii vlivem možného obsahu zbytkového plynu obsaženého v prvním vaku.
Zkontrolujte, že vak a těsnící švy mezi komorami nejsou poškozené. Používejte pouze nepoškozený vak s neporušenými těsnícími švy (tzn. žádný obsah vaků není smísen), pokud je roztok vaku s aminokyselinami a vaku s glukózou čirý, bezbarvý nebo slabě žlutý bez viditelných částic a lipidová emulze je homogenní s mléčně bílým zabarvením.
Před otevřením ochranného obalu zkontrolujte barvu kyslíkového indikátoru (absorbentu). Porovnejte ji s referenční barvou vytištěnou vedle symbolu OK a vyobrazenou v potištěné části štítku indikátoru. Přípravek nepoužívejte, pokud barva kyslíkového indikátoru (absorbentu) neodpovídá referenční barvě vytištěné vedle symbolu OK.
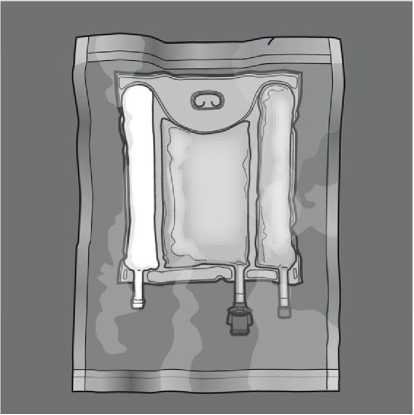
Otevření: Odstraňte ochranný obal. Zlikvidujte ochranný obal a absorbent kyslíku / sáček s kyslíkovým indikátorem.
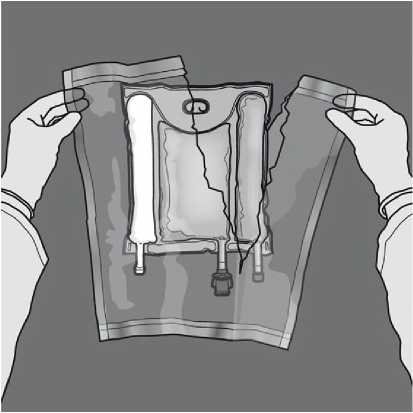
Smíchání: Při protržení těsnicích švů zkontrolujte, že má přípravek pokojovou teplotu. Umístěte vak na rovný čistý povrch. Nepoužívejte, pokud je obsah vaku smíchán kvůli náhodnému protržení dělicích švů během transportu.
Aktivace 3KV (protržení dvou dočasných těsnících švů) Začněte rolovat z horní strany se závěsem.
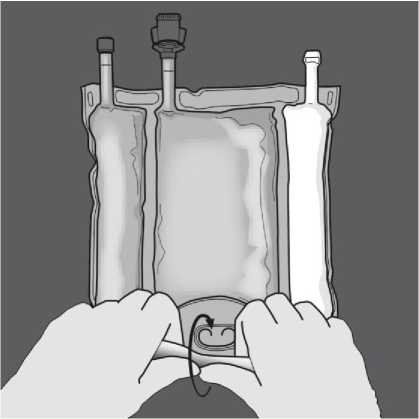
Tlakem otevřete švy.
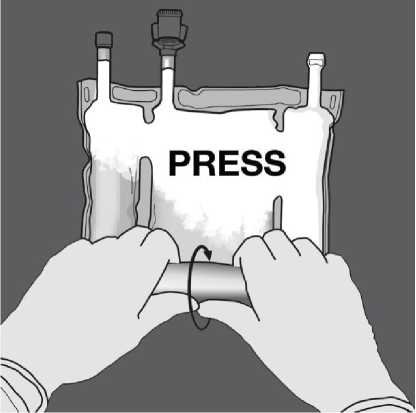
Poté změňte směr rolování vaku směrem k horní straně se závěsem, dokud se šev úplně neotevře.
Stejným způsobem pokračujte až do úplného otevření druhého švu.

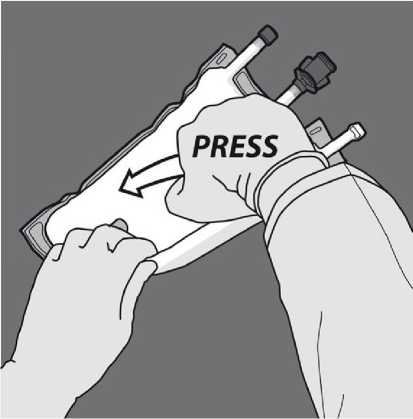
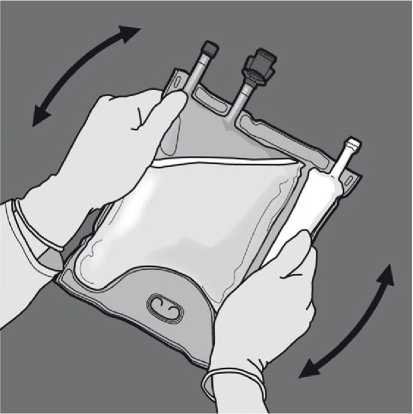
Obraťte vak nejméně třikrát, abyste důkladně promíchali obsah. Vzhled smíchaného roztoku musí být mléčně bílá emulze.
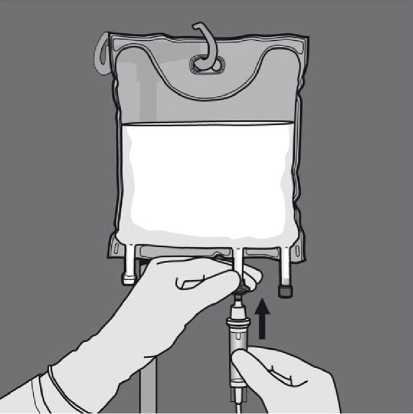
Odstraňte ochranný kryt v místě pro podávání a připojte infuzní soupravu.
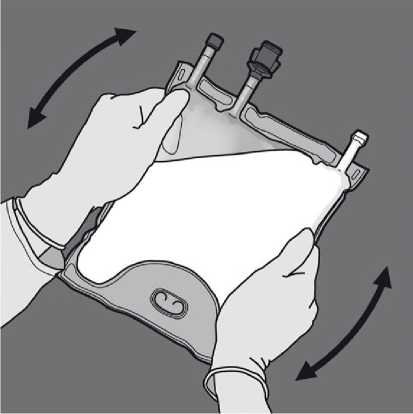
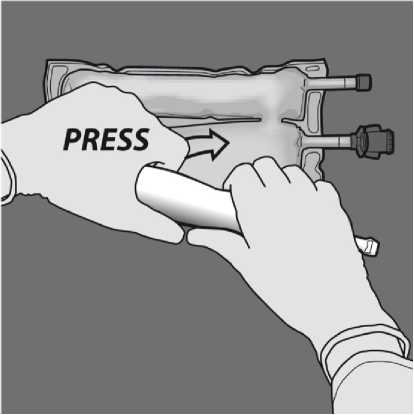
Aktivace 2KV (protržení dočasného těsnícího švu mezi komorami aminokyselin a glukózy)
Kprotržení dočasného těsnícího švu mezi aminokyselinami a glukózou začněte rolovat vak z horního (závěsného) rohu švu oddělujícího komory s aminokyselinami a glukózou. Použijte tlak pro otevření švu oddělujícího oddělení s glukózou a aminokyselinami.
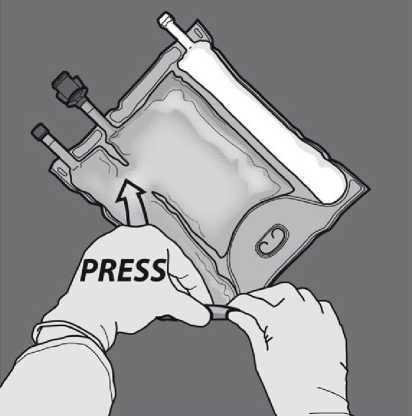
Nasměrujte vak tak, aby oddíl s lipidovou emulzí byl nejblíže k Vám, rolujte vak a oddíl s lipidovou emulzí zatím chraňte v dlaních rukou.
Jednou rukou použitím tlaku rolujte vak směrem k portům.
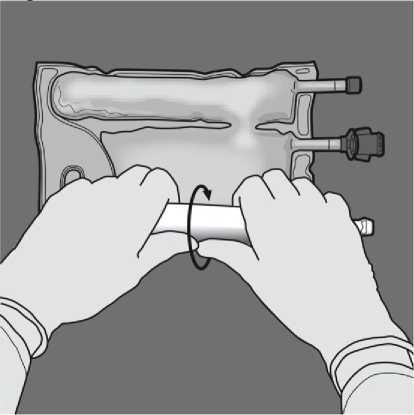
Změňte směr rolováním vaku směrem k vrcholu (závěsnému konci). Stlačte druhou rukou,

Obraťte vak nejméně třikrát, abyste důkladně promíchali obsah. Vzhled smíchaného roztoku musí být čirý, bezbarvý nebo slabě žlutý.
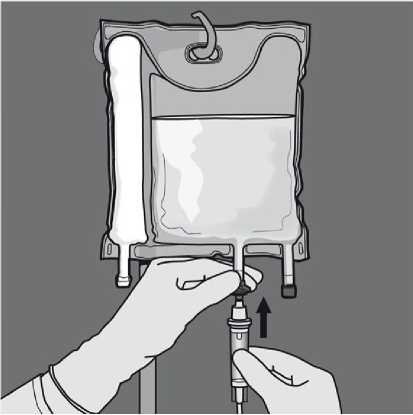
Odstraňte ochranný kryt v místě pro aplikaci a připojte infuzní soupravu.
Aditiva: Objem vaku je dostačující pro aditiva, jako jsou např. elektrolyty, stopové prvky, vitamíny a voda pro přípravu injekcí. Jakékoli přidání aditiva (včetně vitamínů) je možné provést do rekonstituované směsi (po protržení těsnicích švů a po smíchání obsahu dvou nebo tří komor). Před rekonstitucí směsi (před protržením těsnicích švů a před smícháním roztoků a emulze) je rovněž možné přidat vitamíny do komory s glukózou.
Při přidávání látek je třeba dbát množství již přítomných elektrolytů ve vaku, aby bylo dosaženo klinických potřeb pacienta. Maximální hladiny elektrolytů a komerčně dostupných vitamínů a stopových prvků, které mohou být přidány k přípravku Numeta s aktivovanými 2KV a 3KV jsou uvedeny níže. Složení vitamínů a stopových prvků je uvedeno v bodě 4.2.
| Aditiva | Maximální další dávka na vak | |
| Aminokyseliny a glukóza (aktivován 2KV) | Aminokyseliny, glukóza a lipidy (aktivován 3KV) | |
| Sodík | 17,6 mmol | 5,0 mmol |
| Draslík | 17,8 mmol | 4,2 mmol |
| Hořčík | 1,3 mmol | 0,0 mmol |
| Vápník | 3,5 mmol | 1,9 mmol |
| Fosfát3 | 4,0 mmol | 2,5 mmol |
| Stopové prvky | 2,5 ml TE1 | 2,5 ml TE1 |
| Vitamíny | % lahvičky V1 | % lahvičky V1 + % lahvičky V2 |
a: Organické fosfáty.
Přidání aditiv:
- Je nutné dodržovat aseptické podmínky.
- Připravte místo injekce na vaku.
- Propíchněte místo injekce a aplikujte aditiva pomocí injekční jehly nebo zařízení pro rekonstituci.
- Promíchejte obsah vaku a aditiva.
Příprava infuze:
- Je nutné dodržovat aseptické podmínky.
- Zavěste vak.
- Odstraňte plastový kryt z výstupu pro aplikaci.
- Pevně zaveďte infuzní set do výstupu pro aplikaci.
Podávání infuze:
- Pouze k jednorázovému použití
- Přípravek podávejte pouze po protržení těsnicích švů mezi dvěma nebo třemi komorami a smíchání obsahu dvou nebo tří vaků.
- Ujistěte se, že konečná, aktivovaná 3KV infuzní emulze nevykazuje stopy fázové separace nebo že konečný, aktivovaný 2KV infuzní roztok nevykazuje přítomnost částic.
- Po otevření vaku je nutné obsah ihned použít. Obsah nikdy neskladujte pro následné podání v infuzi.
- Částečně spotřebované vaky znovu nenapojujte.
- Nepřipojujte vaky do série, abyste zabránili vzduchové embolii vlivem možného obsahu zbytkového plynu obsaženého v prvním vaku.
- Veškerý nepoužitý přípravek nebo odpad a veškeré nezbytné vybavení pro jednorázové použití je nutné patřičně zlikvidovat a opakovaně nepoužívat.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
BAXTER CZECH spol. s r.o.
Karla Engliše 3201/6
150 00, Praha 5
Česká republika
8. REGISTRAČNÍ ČÍSLO
76/307/16-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 29.6.2016
Další informace o léčivu NUMETA G13%E
Jak
se NUMETA G13%E
podává: intravenózní podání - infuzní emulze
Výdej
léku: na lékařský předpis
Balení: Vak
Velikost
balení: 10X300ML
Držitel rozhodnutí o registraci daného léku v České republice:
BAXTER CZECH spol. s r.o., Praha
E-mail: magdalena_brunova@baxter.com; dana_sladeckova@baxter.com
Telefon: 225774141, 225774143
