Souhrnné informace o léku - MULTIBIC 2 MMOL/L DRASLÍKU
1. NÁZEV PŘÍPRAVKU
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘED SMÍSENÍM:
1000 ml roztoku obsahuje:
Kyselý roztok elektrolytů s glukosou (malá komora)
| multiBic bez draslíku | multiBic 2 mmol/l draslíku | multiBic 3 mmol/l draslíku | multiBic 4 mmol/l draslíku | |
| Kalii chloridum | – | 2,982 g | 4,473 g | 5,964 g |
| Calcii chloridum dihydricum | 4,410 g | 4,410 g | 4,410 g | 4,410 g |
| Magnesii chloridum hexahydricum | 2,033 g | 2,033 g | 2,033 g | 2,033 g |
| Glucosum monohydricum | 22,00 g | 22,00 g | 22,00 g | 22,00 g |
| (Glucosum) | (20,00 g) | (20,00 g) | (20,00 g) | (20,00 g) |
| K+ | 0 mmol/l | 40 mmol/l | 60 mmol/l | 80 mmol/l |
| Ca2+ | 30 mmol/l | 30 mmol/l | 30 mmol/l | 30 mmol/l |
| Mg2+ | 10 mmol/l | 10 mmol/l | 10 mmol/l | 10 mmol/l |
| Cl- | 82 mmol/l | 122 mmol/l | 142 mmol/l | 162 mmol/l |
| Glucosum | 111 mmol/l | 111 mmol/l | 111 mmol/l | 111 mmol/l |
Zásaditý roztok hydrogenuhličitanu (velká komora)
| multiBic bez draslíku | multiBic 2 mmol/l draslíku | multiBic 3 mmol/l draslíku | multiBic 4 mmol/l draslíku | |
| Natrii chloridum | 6,453 g | 6,453 g | 6,453 g | 6,453 g |
| Natrii hydrogenocarbonas | 3,104 g | 3,104 g | 3,104 g | 3,104 g |
| Na+ | 147 mmol/l | 147 mmol/l | 147 mmol/l | 147 mmol/l |
| Cl- | 110 mmol/l | 110 mmol/l | 110 mmol/l | 110 mmol/l |
| HCO3– | 37 mmol/l | 37 mmol/l | 37 mmol/l | 37 mmol/l |
PO SMÍSENÍ:
1000 ml roztoku připraveného k použití obsahuje:
| multiBic bez draslíku | multiBic 2 mmol/l draslíku | multiBic 3 mmol/l draslíku | multiBic 4 mmol/l draslíku | |
| Kalii chloridum | – | 0,1491 g | 0,2237 g | 0,2982 g |
| Natrii chloridum | 6,136 g | 6,136 g | 6,136 g | 6,136 g |
| Natrii hydrogenocarbonas | 2,940 g | 2,940 g | 2,940 g | 2,940 g |
| Calcii chloridum dihydricum | 0,2205 g | 0,2205 g | 0,2205 g | 0,2205 g |
| Magnesii chloridum hexahydricum | 0,1017g | 0,1017g | 0,1017g | 0,1017 g |
| Glucosum monohydricum | 1,100 g | 1,100 g | 1,100 g | 1,100 g |
| (Glucosum) | (1,000 g) | (1,000 g) | (1,000 g) | (1,000 g) |
| K+ | 0 mmol/l | 2,0 mmol/l | 3,0 mmol/l | 4,0 mmol/l |
| Na+ | 140 mmol/l | 140 mmol/l | 140 mmol/l | 140 mmol/l |
| Ca2+ | 1,5 mmol/l | 1,5 mmol/l | 1,5 mmol/l | 1,5 mmol/l |
| Mg2+ | 0,50 mmol/l | 0,50 mmol/l | 0,50 mmol/l | 0,50 mmol/l |
| Cl- | 109 mmol/l | 111 mmol/l | 112 mmol/l | 113 mmol/l |
| HCO3– | 35 mmol/l | 35 mmol/l | 35 mmol/l | 35 mmol/l |
| Glucosum | 5,55 mmol/l | 5,55 mmol/l | 5,55 mmol/l | 5,55 mmol/l |
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Roztok pro hemodialýzu/hemofiltraci
Roztok připravený k použití je čirý a bezbarvý.
Teoretická osmolarita:
| multiBic bez draslíku: | 292 mOsm/l |
| multiBic 2 mmol/l draslíku: | 296 mOsm/l |
| multiBic 3 mmol/l draslíku: | 298 mOsm/l |
| multiBic 4 mmol/l draslíku: | 300 mOsm/l |
pH « 7,4
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
multiBic bez draslíku/2/3/4 mmol/l draslíku je indikován pro intravenózní podávání jako substituční roztok při hemofiltraci a hemodiafiltraci a jako dialyzační roztok při hemodialýze a hemodiafiltraci.
Přípravek se používá u pacientů
-
– s akutním poškozením ledvin vyžadujícím kontinuální renální substituční terapii: kontinuální hemodialýzu, hemofiltraci nebo hemodiafiltrační léčbu.
-
– s chronickým onemocněním ledvin, u nichž je indikována přechodná terapie, např. během pobytu na jednotce intenzivní péče.
-
– podstupujících kontinuální renální substituční terapii, která je indikována jako součást léčby intoxikace ve vodě rozpustnými, filtrovatelnými/dialyzovatelnými toxiny.
multiBic bez draslíku/2/3/4 mmol/l draslíku je indikován k léčbě dospělých.
4.2 Dávkování a způsob podání
Kontinuální renální substituční terapie zahrnující předpis tohoto přípravku má být prováděna pod kontrolou lékaře, který má zkušenosti s tímto druhem terapie.
Dávkování
Při akutním poškození ledvin je k odstranění odpadních metabolitů u dospělých s tělesnou hmotností 70 kg vhodná kontinuální léčba přípravkem multiBic bez draslíku/2/3/4 mmol/l draslíku v dávce 2000 ml/h, v závislosti na metabolickém stavu pacienta. Dávka má být přizpůsobena tělesné velikosti pacienta.
Pokud není klinicky indikováno jinak, dávka přípravku multiBic bez draslíku/2/3/4 mmol/l draslíku u pacientů s chronickým onemocněním ledvin má být nejméně jedna třetina tělesné hmotnosti na léčebnou proceduru, při aplikaci tří procedur za týden. Může být potřeba zvýšit objem podávaný za týden nebo rozdělit tento týdenní objem do více než 3 léčebných procedur za týden.
Dávka a délka trvání hemodialýzy, hemofiltrace nebo hemodiafiltrace nutná u stavů akutní intoxikace závisí na toxinu a jeho koncentraci a závažnosti klinických příznaků a je nutné ji stanovit individuálně podle stavu pacienta.
Doporučená maximální dávka je 75 litrů denně.
Pediatrická populace
Bezpečnost a účinnost přípravku multiBic bez draslíku/2/3/4 mmol/l draslíku u dětí nebyla dosud stanovena (viz body 4.4 a 5.1).
Způsob podání
Intravenózní podání a hemodialýza.
Návod k použití přípravku viz bod 6.6.
4.3 Kontraindikace
Kontraindikace podmíněné složením roztoku:
multiBic bez draslíku/2/3 mmol/l draslíku:
-
– Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1
-
– Hypokalemie
-
– Metabolická alkalóza
-
– Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1
-
– Hyperkalemie
-
– Metabolická alkalóza
Kontraindikace podmíněné vlastním technickým postupem:
-
– Nedostatečný přítok krve z cévního přístupu.
-
– Jestliže je vysoké riziko hemoragie z důvodu systémové antikoagulace.
4.4 Zvláštní upozornění a opatření pro použití
Nepoužívejte přípravek před smísením obou roztoků.
multiBic bez draslíku/2/3/4 mmol/l draslíku je třeba před infuzí zahřát přibližně na tělesnou teplotu pomocí vhodného zařízení a nesmí být v žádném případě podáván o teplotě nižší, než je pokojová teplota.
Při ohřívání roztoku připraveného k použití na přibližně tělesnou teplotu je zapotřebí pečlivě ověřovat, že je roztok čirý a bez pevných částic.
Ve vzácných případech byla při použití roztoku připraveného k použití pozorována precipitace bílého uhličitanu vápenatého v setech, zejména v blízkosti pumpy a ohřívače roztoku připraveného k použití.
K precipitaci může dojít zejména v případě, že je teplota roztoku připraveného k použití v blízkosti pumpy vyšší než 30 °C.
Proto se během kontinuální renální substituční terapie musí roztok připravený k použití v setech pečlivě vizuálně zkontrolovat každých 30 minut, aby bylo zajištěno, že je roztok v systému čirý a bez sraženin. Precipitace může nastat i se značným zpožděním po zahájení léčby.
Pokud k precipitaci dojde, musí se roztok připravený k použití a sety používané při kontinuální renální substituční terapii okamžitě vyměnit a pacient musí být pečlivě sledován.
Koncentrace draslíku v séru musí být kontrolována pravidelně před a během kontinuální renální substituční terapie. U pacienta se musí zvážit stav draslíku a jeho vývoj během léčby:
-
V případě hypokalemie může být nutné doplnění draslíku a/nebo změna za roztok pro hemodialýzu/hemofiltraci s vyšší koncentrací draslíku.
-
V případě hyperkalemie může být indikováno zvýšení aplikované dávky a/nebo změna za roztok pro hemodialýzu/hemofiltraci s nižší koncentrací draslíku, stejně jako obvyklá opatření intenzivní péče.
Koncentrace sodíku v séru musí být kontrolována pravidelně před a během použití tohoto roztoku pro hemodialýzu/hemofiltraci pro kontrolu rizik spojených s hypo/hypernatremií. Roztok pro hemodialýzu/hemofiltraci může být zředěn odpovídajícím množstvím vody na injekci nebo může být v případě potřeby přidán koncentrovaný roztok chloridu sodného. Rychlost požadované úpravy musí být pečlivě naplánována, aby se zabránilo nežádoucím účinkům způsobeným rychlými změnami koncentrace sodíku v séru.
Před kontinuální renální substituční terapií a během ní musí být dále monitorovány následující parametry: Sérové kalcium, sérové magnézium, sérové fosfáty, sérová glukóza, acidobazický stav, hodnoty urey a kreatininu, tělesná hmotnost a bilance tekutin (pro včasné rozpoznání hyper- a dehydratace).
Klinicky významné látky mohou být odstraněny hemodialýzou, hemofiltrací a hemodiafiltrací a nejsou doplněny tímto léčivým přípravkem. Toto odstranění důležitých živin musí být kompenzováno vhodnou výživou, výživovými doplňky nebo přizpůsobenou parenterální výživou.
Pediatrická populace
Nejsou žádné klinické zkušenosti s použitím tohoto léčivého přípravku u dětí. Používání tohoto léčivého přípravku u dětí není doporučeno, dokud nebudou k dispozici další údaje (viz body 4.2 a 5.1).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Nebyly provedeny žádné studie interakcí.
Správné dávkování přípravku multiBic bez draslíku/2/3/4 mmol/l draslíku a přesné sledování klinických chemických parametrů a životních ukazatelů zabraňuje interakcím s dalšími léčivy.
Možné jsou následující interakce:
- Toxické účinky digitalisu mohou být zamaskovány hyperkalemií, hypermagnesemií a hypokalcemií. Úprava hladiny těchto elektrolytů při kontinuální renální substituční terapii může odkrýt známky a příznaky otravy digitalisem, např. srdeční arytmii.
- Náhrady elektrolytů, parenterální výživa a další infuzní roztoky obvykle podávané při intenzívní péči ovlivňují složení séra a stav tekutin pacienta. To je třeba zohlednit během kontinuální renální substituční terapie.
- Kontinuální renální substituční terapie může snížit koncentraci léčiv v krvi, speciálně léčiv s nízkou vazební kapacitou na bílkoviny, s malým distribučním objemem, s malou molekulární hmotností nižší než „cut-off“ hemofiltru a léčivých přípravků adsorbovaných na hemofiltr. Může být třeba vhodně upravit dávky takových léčivých přípravků.
4.6 Fertilita, těhotenství a kojení
Těhotenství
Údaje o podávání přípravku multiBic bez draslíku 2/3/4 mmol/l draslíku těhotným ženám jsou omezené nebo nejsou k dispozici. Studie reprodukční toxicity na zvířatech jsou nedostatečné (viz bod 5.3).
multiBic bez draslíku/2/3/4 mmol/l draslíku nemá být používán během těhotenství, pokud klinický stav ženy nevyžaduje kontinuální renální substituční léčbu.
Kojení
Informace o vylučování léčivých látek/metabolitů přípravku multiBic bez draslíku 2/3/4 mmol/l draslíku do lidského mateřského mléka jsou nedostatečné.
V průběhu léčby přípravkem multiBic bez draslíku 2/3/4 mmol/l draslíku se kojení nedoporučuje.
Fertilita
Nejsou k dispozici žádné údaje.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Není relevantní.
4.8 Nežádoucí účinky
Nežádoucí účinky mohou být výsledkem vlastní terapie nebo mohou být vyvolány tímto léčivým přípravkem:
Gastrointestinální poruchy – nauzea, zvracení
Cévní poruchy – hypertenze, hypotenze
Poruchy svalové a kosterní soustavy a pojivové tkáně – svalové křeče
Lze očekávat následující nežádoucí účinky léčby:
Poruchy metabolismu a výživy – hyper- nebo hypohydratace, elektrolytová nerovnováha (např. hypokalemie), hypofosfatemie, hyperglykemie a metabolická alkalóza.
Přesná četnost takových nežádoucích účinků není známa (z dostupných údajů nelze určit).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky:
4.9 Předávkování
Při dodržování doporučeného dávkování nebyly hlášeny žádné mimořádné stavy, mimo to je možné kdykoliv přerušit podávání roztoku. Jestliže není pečlivě počítána a sledována rovnováha tekutin, může se objevit hyperhydratace nebo dehydratace, spolu s přidruženými oběhovými reakcemi. Ty se mohou projevit v podobě odpovídajících změn krevního tlaku, centrálního žilního tlaku, srdečního rytmu a plicního arteriálního tlaku. V případech hyperhydratace může nastat městnavé srdeční selhání a/nebo plicní městnání.
Při hyperhydrataci je třeba zvýšit čistý objem odstraněné tekutiny pomocí přístroje pro kontinuální renální substituční terapii. V případě zřetelné dehydratace je třeba odstraňování čistého objemu tekutiny pomocí přístroje pro kontinuální renální substituční terapii snížit nebo přerušit, případně, odstraněné tekutiny mohou být použity k obnovení stavu hydratace.
Léčba příliš velkým objemem může vést k narušení koncentrace elektrolytů a acidobazické rovnováhy, např. předávkování bikarbonátem může nastat v případě podání nepřiměřeně velkého objemu roztoku pro hemodialýzu/hemofiltraci. To může vést k metabolické alkalóze, poklesu ionizovaného kalcia nebo k tetanii.
5.
FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: hemofiltrační roztoky, ATC kód: B05ZB
Mechanismus účinku
Základní principy hemodialýzy, hemofiltrace a hemodiafiltrace:
Při hemofiltraci jsou voda a rozpuštěné látky jako uremické toxiny, elektrolyty a bikarbonát odstraňovány z krve ultrafiltrací. Ultrafiltrát je nahrazen roztokem pro hemofiltraci s vyváženým složením elektrolytů a pufru.
Při hemodialýze dochází k výměně vody a rozpuštěných látek jako jsou uremické toxiny, elektrolyty, bikarbonát a další malé molekuly mezi krví pacienta a roztokem pro hemodialýzu difúzí. Směr a velikost difúzního procesu závisí na příslušném koncentračním gradientu mezi krví a roztokem pro hemodialýzu.
Při hemodiafiltraci se základní principy hemofiltrace a hemodialýzy kombinují.
Tento léčivý přípravek představuje bikarbonátem pufrovaný roztok určený pro intravenózní podání nebo jako hemodialyzační roztok pro náhradu vody a elektrolytů odstraněných při kontinuální renální substituční terapii, např. při terapii akutního poškození ledvin.
Elektrolyty Na+, K+, Mg2+, Ca2+, Cl- a bikarbonát jsou nezbytné pro zachování a úpravu homeostázy tekutin a elektrolytů (krevní objem, osmotická rovnováha, acidobazická rovnováha).
Pediatrická populace
Nejsou žádné klinické zkušenosti s použitím tohoto léčivého přípravku u dětí. Používání tohoto léčivého přípravku u dětí není doporučeno, dokud nebudou k dispozici další údaje (viz body 4.2 a 4.4).
5.2 Farmakokinetické vlastnosti
Tento léčivý přípravek musí být podáván pouze intravenózně nebo může být použit jako roztok pro hemodialýzu.
Distribuce/Biotransformace/Eliminace
Rozdělení elektrolytů a bikarbonátu je řízeno podle požadavků a metabolického stavu a zbytkové funkce ledvin. Léčivé látky substitučního roztoku se s výjimkou glukózy nemetabolizují. Eliminace vody a elektrolytů závisí na buněčných požadavcích, metabolickém stavu, zbytkové funkci ledvin a ztrátách tekutin jinými cestami (např. střevo, plíce a kůže).
5.3 Předklinické údaje vztahující se k bezpečnosti
Nejsou žádné předklinické údaje relevantní pro předepisujícího lékaře.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Malá komora:
Voda na injekci
Kyselina chlorovodíková 25%
Velká komora:
Voda na injekci
Oxid uhličitý
Dihydrát dihydrogenfosforečnanu sodného
6.2 Inkompatibility
Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě 6.6.
6.3 Doba použitelnosti
2 roky
Podmínky uchovávání po smísení obsahů dvou komor (roztok připravený k použití): Chemická a fyzikální stabilita roztoku připraveného k použití byla prokázána po dobu 48 hodin při teplotě 30 °C. Není doporučeno uchovávat roztok připravený k použití déle než 48 hodin včetně doby trvání léčby a při teplotě před vstupem do pumpového segmentu vyšší než 30 °C.
Z mikrobiologického hlediska, a vzhledem k obsahu hydrogenuhličitanu v roztoku, musí být přípravek, který byl již připojen na hemodialyzační, hemofiltrační nebo hemodiafiltrační okruh, okamžitě použit.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě nad +4 °C.
6.5 Druh obalu a obsah balení
Dvoukomorový vak s 4750 ml (zásaditý roztok hydrogenuhličitanu) + 250 ml (kyselý roztok elektrolytů s glukózou) = 5000 ml (roztok připravený k použití).
Fólie použitá u vaku je vyrobena z polyethylentereftalátu, oxidu křemíku, polyamidu a polyolefinů.
Každý vak je vybaven HF konektorem, Luer-Lock konektorem a injekčním vstupem, a je zakryt ochrannou fólií.
Velikost balení:
2 vaky po 5000 ml
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Nepoužívejte, pokud roztok připravený k použití není čirý a bezbarvý a/nebo jsou-li vak a konektory poškozené.
Pouze k jednorázovému použití. Veškerý nepoužitý roztok musí být zlikvidován.
Nutné používání dávkovacích pump.
Roztok pro hemodialýzu/hemofiltraci má být podáván ve třech krocích:
-
1. Odstranění ochranné fólie a pečlivá kontrola vaku
Ochranná fólie má být odstraněna bezprostředně před podáním.
Plastové vaky mohou být příležitostně poškozeny během transportu od výrobce na dialyzační středisko nebo i přímo na středisku. To může vést ke kontaminaci a k množení mikrobů nebo plísní v roztocích. Z toho důvodu je nezbytná pečlivá vizuální kontrola vaku a roztoků před smísením. Zvláštní pozornost má být věnována i nepatrným poškozením uzávěru, svarů ve švech a rohů vaku s ohledem na možnou kontaminaci.
-
2. Smísení dvou komor
Dvoukomorový vak – komora s hydrogenuhličitanem a komora s elektrolyty a s glukózou – se smísí bezprostředně před použitím, čímž se získá roztok připravený k použití.
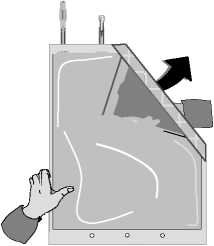
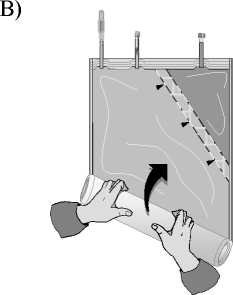

C)
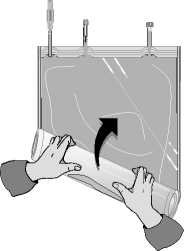
Odklopte malou komoru.
Začněte rolovat vak s roztokem počínaje rohem naproti malé komoře…
…až se středový šev mezi oběma komorami otevře v celé své délce a roztoky z obou komor se smíchají.
Po smísení obou komor je nutné zkontrolovat, že se středový šev zcela otevřel, roztok je čirý a bezbarvý a z vaku neprosakuje tekutina.
-
3. Aplikace roztoku připraveného k použití
7.
Fresenius Medical Care Deutschland GmbH
Else-Króner-StraBe 1
61352 Bad Homburg v.d.H., Německo
8. REGISTRAČNÍ ČÍSLO(A)
MULTIBIC BEZ DRASLÍKU
MULTIBIC 2 MMOL/L DRASLÍKU
MULTIBIC 3 MMOL/L DRASLÍKU
MULTIBIC 4 MMOL/L DRASLÍKU
87/270/05-C
87/271/05-C
87/272/05-C
87/273/05-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 24. 8. 2005
Datum posledního prodloužení registrace: 24. 8. 2007
Další informace o léčivu MULTIBIC 2 MMOL/L DRASLÍKU
Jak
se MULTIBIC 2 MMOL/L DRASLÍKU
podává: intravenózní podání - roztok pro hemofiltraci
Výdej
léku: na lékařský předpis
Balení: Vak
Velikost
balení: 2X5000ML
Držitel rozhodnutí o registraci daného léku v České republice:
Fresenius Medical Care Deutschland GmbH, Bad Homburg
E-mail: tomas.packa@fmc-ag.com
Telefon: 273037945, 739247738
