Příbalový leták - MONONINE
1. Co je přípravek Mononine a účinky
Co je přípravek Mononine?
Mononine je součást lidské plazmy (to je tekutá část krve) a obsahuje lidský koagulační faktor IX. Používá se k prevenci nebo zastavení krvácení, které je způsobeno vrozeným nedostatkem faktoru IX (hemofilie B) v krvi.
K čemu se přípravek Mononine používá
Faktor IX je velmi důležitý pro krevní srážlivost (koagulaci). Nedostatek faktoru IX způsobuje, že se krev dostatečně rychle nesráží, a že se zvyšuje možnost krvácení. Náhradou faktoru IX přípravkem Mononine se upraví mechanizmus krevní srážlivosti.
Připravený roztok se podává jako injekce nebo infuze do žíly.
2. Čemu musíte věnovat pozornost, než začnete přípravek Mononine používat
Následující část obsahuje informace, které byste Vy i Váš lékař měli uvážit před podáním přípravku Mononine.
Nepoužívejte přípravek Mononine:
- Jestliže jste alergický(á) na koagulační faktor IX nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6) nebo na myší bílkovinu. Informujte, prosím, svého lékaře pokud jste alergický(á) na některý léčivý přípravek nebo potravinu.
- Jestliže je u Vás riziko tvorby krevních sraženin (trombóza) nebo jestliže se u Vás tvoří krevní sraženiny častěji než normálně (diseminovaná intravaskulární koagulace).
Upozornění a opatření
Alergické reakce jsou možné. Časnými příznaky jsou kopřivka, generalizovaná vyrážka, pocit tíhy na prsou, sípot, prudké snížení krevního tlaku a anafylaxe (závažná alergická reakce, která způsobuje závažné dýchací potíže, nebo závratě). Pokud se tyto příznaky u Vás objeví, musíte přestat přípravek používat a informovat okamžitě svého lékaře. Mononine obsahuje stopy myší bílkoviny, které jsou používány při procesu jeho purifikace. I když hladiny myší bílkoviny jsou velmi nízké, infuze těchto bílkovin by mohla způsobit alergické reakce. Tvorba inhibitorů (neutralizačních protilátek) faktoru IX je známou komplikací léčby a může způsobit, že léčba není dostatečně účinná. Pokud Vaše krvácení po podávání přípravku Mononine není pod kontrolou, informujte okamžitě svého lékaře. Tvorba inhibitorů bude u Vás pečlivě sledována. Je zde riziko zvýšené tvorby krevní sraženiny ve Vašich cévách (tromboembolické komplikace), zvláště:-
> jestliže trpíte onemocněním jater
-
> jestliže jste právě po chirurgickém zákroku
-
> u novorozenců
-
> jestliže máte další trombotické rizikové faktory, např. těhotenství, perorální antikoncepce, obezita, kouření.
- Jste-li osoba s existujícími kardiovaskulárními rizikovými faktory, terapie s faktorem IX může zvýšit kardiovaskulární riziko.
- Pokud je požadován centrální žilní přístup, je třeba zvážit riziko komplikací souvisejících s katetrizací, včetně lokálních infekcí, bakteriemie a trombózy v místě zavedení katetru.
- Nejsou žádné údaje o bezpečnosti a účinnosti pro podávání kontinuální infuze dětem, zejména možnost rozvoje inhibitorů není známa.
Váš lékař bude pečlivě sledovat prospěch léčby přípravkem Mononine, oproti těmto možným komplikacím.
Virová bezpečnost
Při výrobě léčivých přípravků z lidské krve nebo plazmy jsou dodržována určitá opatření zabraňující přenosu infekce na pacienty. Ty zahrnují:
-
– pečlivý výběr dárců krve a plazmy, který vylučuje možné riziko přenosu infekčních onemocnění,
-
– testování každého odběru a poolu plazmy na přítomnost virů/infekcí,
-
– zařazení kroků do zpracování krve nebo plazmy, při nichž jsou viry inaktivovány nebo odstraněny.
Další léčivé přípravky a přípravek Mononine
- Informujte svého lékaře nebo lékárníka o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
- Faktor IX a s-aminokapronová kyselina (chemická látka která zabraňuje rozpadu krevních sraženin) se mohou používat k léčbě krvácení v ústech, buď po poranění nebo zubní chirurgii, jako je vytržení zubu. Avšak není mnoho informací, jestliže je s-aminokapronová kyselina a přípravek Mononine podáván současně.
- Mononine se nesmí mísit s jinými léčivými přípravky, ředidly a rozpouštědly s výjimkou těch, které jsou doporučeny výrobcem (viz bod 6).
Těhotenství, kojení a plodnost
- Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek dostávat.
- Během těhotenství a kojení by měl být Mononine podáván pouze tehdy, pokud jsou indikace zcela jasné.
- Nejsou dostupná žádná data týkající se plodnosti.
Řízení dopravních prostředků a obsluha strojů
Mononine nemá žádný vliv na schopnost řídit motorová vozidla a obsluhovat stroje.
Důležité informace o některých složkách přípravku Mononine
Standardní dávka 2000 IU přípravku Mononine obsahuje až 30,36 mg sodíku. Prosím berte toto na vědomí, pokud máte kontrolovanou sodíkovou dietu.
3. Jak se přípravek Mononine používá
Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem nebo lékárníkem.
Léčba hemofilie B by měla být zahájena pod dohledem lékaře zkušeného s léčbou tohoto onemocnění.
Dávkování
Množství faktoru IX, které potřebujete, a trvání léčby závisí na několika faktorech, jako je Vaše tělesná hmotnost, závažnost Vašeho onemocnění, místo a intenzita krvácení a potřeba prevence krvácení během operace nebo vyšetření.
Pokud Vám byl Mononine předepsán k domácímu použití, Váš lékař zabezpečí, že Vám bude předvedeno, jak si máte dávat injekci nebo infuzi a kolik přípravku máte použít.
Postupujte podle instrukcí Vašeho lékaře nebo sestry z centra hemofilie.
Jestliže jste použil(a) více přípravku Mononine 500 IU, než jste měl(a)
Nejsou známy žádné příznaky předávkování faktorem IX.
Rekonstituce a podání
Všeobecné pokyny:
- Rozpuštění přípravku a odebrání roztoku z lahvičky musí být prováděno za aseptických podmínek.
- Vzniklý roztok musí být čirý nebo lehce opalescentní, t.j. proti světlu může být jiskřivý, ale nesmí obsahovat viditelné částice. Po filtraci nebo natažení (viz níže) musí být roztok před podáním zkontrolován vizuálně, zda neobsahuje malé částečky nebo zda není zabarven. Nepoužívejte roztok, který je viditelně zakalený nebo obsahuje usazeniny nebo částečky.
- Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky a podle instrukcí Vašeho lékaře.
Rekonstituce
Bez otevření injekčních lahviček zahřejte přípravek Mononine a rozpouštědlo na pokojovou teplotu nebo tělesnou teplotu. To lze udělat buď ponecháním injekčních lahviček při pokojové teplotě po dobu jedné hodiny nebo podržením v rukou po dobu několika minut. NEVYSTAVUJTE injekční lahvičky přímému teplu. Injekční lahvičky se nesmí zahřát na vyšší teplotu, než je tělesná teplota (37°C).
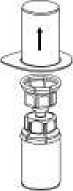
Sejměte opatrně vyklápěcí víčka z lahviček s přípravkem a s rozpouštědlem a očistěte pryžové zátky tamponem s alkoholem. Nechte lahvičky oschnout, než otevřete balení Mix2Vial, potom se řiďte instrukcemi uvedenými níže.

1



4

5

-
1. Otevřete balení Mix2Vial tím, že vyklopíte víčko. NevytahujteMix2Vial z blistru!
-
2. Postavte injekční lahvičku s rozpouštědlem na rovný a čistý povrch, držte ji pevně. Uchopte Mix2Vial společně s blistrem a zatlačte hrot modrého konce adaptéru rovně dolůskrz pryžovou zátku injekční lahvičky s rozpouštědlem.
-
3. Opatrně odstraňte blistr ze soupravy Mix2Vial tak, že ho držíte za okraj a táhnete svislevzhůru. Přesvědčte se, že jste vytáhli jen blistrový obal a ne soupravu Mix2Vial.
-
4. Postavte injekční lahvičku s přípravkem na rovný a pevný povrch. Obraťte injekční lahvičku s rozpouštědlem spolu s nasazenou soupravou Mix2Vial a zatlačte hrot průhledného konce adaptéru přímo dolůskrz pryžovou zátku injekční lahvičky s přípravkem. Rozpouštědlo se samo automaticky nasaje do injekční lahvičky
s přípravkem.____________________________________
-
5. Uchopte jednou rukou tu část soupravy Mix2Vial, kde je injekční lahvička s přípravkem a druhou rukou tu část, kde je injekční lahvička od rozpouštědla a odšroubujte je od sebe opatrně proti směru hodinových ručiček na dvě části. Odstraňte injekční lahvičku od rozpouštědla
-
6. Jemně otáčejte injekční lahvičkou s přípravkem s připojeným průhledným adaptérem, dokud se prášek zcela nerozpustí. Netřepejte s injekční lahvičkou.

-
7. Nasajte vzduch do prázdné sterilní injekční stříkačky. Zatímco je injekční lahvička s přípravkem dnem dolů, spojte injekční stříkačku pomocí koncovky Luer lock šroubováním ve směru hodinových ručiček se soupravou Mix2Vial. Vstříkněte vzduch do injekční lahvičky s přípravkem.
Natáhnutí a aplikace:


-
8. Zatímco držíte píst stříkačky stlačený, obraťte celý systém dnem vzhůru. Pomalým vytahováním pístu natáhněte roztok do stříkačky.
-
9. Po natažení roztoku do stříkačky uchopte pevně válec stříkačky (píst stále směřuje dolů) a odpojte průhledný adaptér soupravy Mix2Vial od stříkačky odšroubováním proti směru hodinových ručiček.
I,
Jednotlivá intravenózm injekce
Použijte venepunkční set přiložený k tomuto přípravku, vpíchněte jehlu do žíly. Nechte krev natéci do konce hadičky. Připevněte injekční stříkačku na konec venepunkčního setu se závitem. Připravený roztok aplikujte pomalu do žíly,podle instrukcí Vašeho lékaře. Dávejte pozor, aby se žádná krev nedostala do injekční stříkačky, která obsahuje připravený roztok. Maximální rychlost podání je 2 mililitry za minutu.
Kontinuální infuze
Mononine může být též podáván dlouhodobou (kontinuální) infuzí po dobu několika hodin nebo dnů. To musí být provedeno a kontrolováno Vašim lékařem.
Kontrolujte se, zda nemáte nežádoucí účinky, které by mohly nastat okamžitě. Pokud máte nějaké nežádoucí účinky, které by mohly souviset s podáním přípravku Mononine, injekce nebo infuze se musí okamžitě zastavit (viz také bod „Upozornění a opatření“).
Máte-li jakékoli další otázky týkající se používání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Vedlejší účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Pokud se u Vás objeví jakýkoli z následujících příznaků, kontaktujte se okamžitě se svým lékařem nebo jděte na pohotovost do nejbližší nemocnice nebo do Centra pro léčbu hemofilie:
- náhlá alergická reakce (jako je kožní vyrážka nebo kopřivka, svědění, otok tváře, rtů, jazyka nebo jiných částí těla),
- dušnost, sípot nebo dýchací potíže,
- záchvaty,
- ztráta účinku (krvácení pokračuje).
Další nežádoucí účinky:
Alergické reakce, které mohou zahrnovat:-
> pálení a píchání, zarudnutí a otoky žíly v místě vpichu injekce nebo infuze,
-
> otok tváře, krku nebo jiných částí těla, zimnice, návaly horka, kožní vyrážka po celém těle, kopřivkové pupeny
-
> bolesti hlavy,
-
> pokles krevního tlaku, neklid, rychlá srdeční činnost, tlak na prsou, sípot,
-
> únava (letargie),
-
> pocit na zvracení/zvracení,
-
> mravenčení.
Tyto nežádoucí účinky byly pozorovány vzácně, a mohou se v některých případech rozvinout až k závažným alergickým reakcím (anafylaxi) včetně šoku (to je obyčejně úzce spjato s tvorbou inhibitorů faktoru IX).
- Ve vzácných případech byla pozorována horečka.
- Velmi vzácně bylo po léčbě referováno o zvláštní formě zánětu ledvin (nefrotický syndrom) u pacientů u nichž byly prokázány inhibitory faktoru IX. U těchto pacientů byly známy alergické reakce v anamnéze.
- Po podání přípravků s faktorem IX je potenciální riziko tvorby krevních sraženin, které mohou vést k srdečnímu záchvatu (infarktu myokardu), krevních sraženin v končetinách (žilní trombóza) a sraženin v plicích (plicní embolie). Použití přípravku Mononine je vzácně spojeno s těmito nežádoucími účinky.
- Velmi vzácně se u Vás může projevit tvorba inhibitorů (neutralizačních protilátek) faktoru IX, v těchto případech nebude faktor IX správně účinkovat. Pokud se toto stane, doporučuje se kontaktovat speciální centrum pro hemofilii.
Nežádoucí účinky u dětí a dospívajících
U dětí se očekává, že frekvence, typ a závažnost nežádoucích účinků budou stejné jako u dospělých.
Hlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci.
Nežádoucí účinky můžete hlásit také přímo na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
webové stránky:
Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak přípravek Mononine uchovávat
Nepoužívejte přípravek Mononine po uplynutí doby použitelnosti uvedené na obalu.
- Chraňte před mrazem.
- Uchovávejte injekční lahvičku ve vnějším obalu, aby byl přípravek chráněn před světlem.
- Uchovávejte v chladničce (2°C-8°C).
- Během doby použitelnosti se přípravek (pokud je ve vnějším obalu) může uchovávat při pokojové teplotě (do 25°C) po dobu l měsíce bez opětovného uchovávání v chladničce během této doby. Datum počátku uchovávání při pokojové teplotě a konec měsíčního období musí být vyznačeno na vnějším obalu. Na konci této doby musí být přípravek použit nebo znehodnocen.
- Připravený roztok musí být okamžitě použit.
- Jestliže je roztok naředěný (v poměru l:10) musí být roztok použit okamžitě, i když fyzikálně-chemická stabilita je prokázána na 24 hodin.
- Váš lékař Vás bude informovat jak znehodnotit nespotřebovaný roztok a materiál.
6. Obsah balení a další informace
Co přípravek Mononine obsahuje
Léčivou látkou přípravku Mononine je factor IX coagulationis humanus 500 IU v l injekční lahvičce.
Po rozpuštění v 5 ml rozpouštědla, připravený roztok obsahuje přibližně 100 IU lidského koagulačního faktoru IX v 1 ml.
Pomocnými látkami jsou: histidin, mannitol, chlorid sodný, kyselina chlorovodíková nebo hydroxid sodný (v malém množství na úpravu pH)
Rozpouštědlo: voda pro injekci
Jak přípravek Mononine vypadá a co obsahuje toto balení
Mononine je bílý prášek a je dodáván s vodou na injekci jako rozpouštědlem.
Připravený roztok musí být čirý nebo slabě opalescentní, tj. že může proti světlu jiskřit, ale nesmí obsahovat viditelné částice.
Obsah balení
Krabička s 500 IU obsahuje:
-
– 1 injekční lahvičku s práškem
-
– 1 injekční lahvičku s 5 ml vody pro injekci
-
– l přepouštěcí adaptér s filtrem 20/20
-
– 1 injekční stříkačku 10 ml k jednorázovému použití
-
– l venepunkční set
-
– 2 alkoholové tampony
-
– 1 nesterilní náplast
Držitel rozhodnutí o registraci a výrobce
CSL Behring GmbH
Emil-von-Behring-Strasse 76
35041 Marburg, Německo
Tento léčivý přípravek je v členských státech EHP registrován pod těmito názvy:
Mononine: ______________________________________ Itálie, Polsko, Švédsko
Mononine, Poeder en oplosmiddel voor oplossing voor injectie of infusie 500 IE:______________ Nizozemsko
Mononine 500: ___________________________________ Francie, Německo, Lucembursko,
Portugalsko
Mononine 500 i.e. prašek in
vehikel za raztopino za injiciranje/infundiranje: _______ Slovinsko
Mononine 500 I.E. Pulver und
Losungsmittel zur Herstellung einer
Injektions- oder Infusionslosung: ____________________Rakousko
Mononine 500 IU: ________________________________ Česká republika, Slovenská republika
Mononine 500 UI polvo y disolvente para
solución inyectable o perfusión: _____________________ Španělsko
Mononine 500 NE por és oldószer
oldatos injekcióhoz vagy infúzióhoz: Maďarsko
Tato příbalová informace byla naposledy revidována: 25. 8. 2017
Následující informace jsou určeny pouze pro zdravotnické pracovníky:
Dávkování
Množství faktoru IX, které potřebujete, a trvání léčby závisí na několika faktorech, jako je Vaše tělesná hmotnost, závažnost Vašeho onemocnění, místo a intenzita krvácení a potřeba prevence krvácení během operace nebo vyšetření.
Pokud Vám byl Mononine předepsán k domácímu použití, Váš lékař zabezpečí, že Vám bude předvedeno, jak si máte dávat injekci nebo infuzi a kolik přípravku máte použít.
Postupujte podle instrukcí Vašeho lékaře nebo sestry z centra hemofilie.
Jestliže jste použil(a) více přípravku Mononine 500 IU, než jste měl(a)
Nejsou známy žádné příznaky předávkování faktorem IX.
Rekonstituce a podání
Všeobecné pokyny:
- Rozpuštění přípravku a odebrání roztoku z lahvičky musí být prováděno za aseptických podmínek.
- Vzniklý roztok musí být čirý nebo lehce opalescentní, t.j. proti světlu může být jiskřivý, ale nesmí obsahovat viditelné částice. Po filtraci nebo natažení (viz níže) musí být roztok před podáním zkontrolován vizuálně, zda neobsahuje malé částečky nebo zda není zabarven. Nepoužívejte roztok, který je viditelně zakalený nebo obsahuje usazeniny nebo částečky.
- Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky a podle instrukcí Vašeho lékaře.
Rekonstituce
Bez otevření injekčních lahviček zahřejte přípravek Mononine a rozpouštědlo na pokojovou teplotu nebo tělesnou teplotu. To lze udělat buď ponecháním injekčních lahviček při pokojové teplotě po dobu jedné hodiny nebo podržením v rukou po dobu několika minut. NEVYSTAVUJTE injekční lahvičky přímému teplu. Injekční lahvičky se nesmí zahřát na vyšší teplotu, než je tělesná teplota (37°C).
Sejměte opatrně vyklápěcí víčka z lahviček s přípravkem a s rozpouštědlem a očistěte pryžové zátky tamponem s alkoholem. Nechte lahvičky oschnout, než otevřete balení Mix2Vial, potom se řiďte instrukcemi uvedenými níže.

1




4

5

-
1. Otevřete balení Mix2Vial tím, že vyklopíte víčko. NevytahujteMix2Vial z blistru!
-
2. Postavte injekční lahvičku s rozpouštědlem na rovný a čistý povrch, držte ji pevně. Uchopte Mix2Vial společně s blistrem a zatlačte hrot modrého konce adaptéru rovně dolůskrz pryžovou zátku injekční lahvičky s rozpouštědlem.
-
3. Opatrně odstraňte blistr ze soupravy Mix2Vial tak, že ho držíte za okraj a táhnete svislevzhůru. Přesvědčte se, že jste vytáhli jen blistrový obal a ne soupravu Mix2Vial.
-
4. Postavte injekční lahvičku s přípravkem na rovný a pevný povrch. Obraťte injekční lahvičku s rozpouštědlem spolu s nasazenou soupravou Mix2Vial a zatlačte hrot průhledného konce adaptéru přímo dolůskrz pryžovou zátku injekční lahvičky s přípravkem. Rozpouštědlo se samo automaticky nasaje do injekční lahvičky
s přípravkem.____________________________________
-
5. Uchopte jednou rukou tu část soupravy Mix2Vial, kde je injekční lahvička s přípravkem a druhou rukou tu část, kde je injekční lahvička od rozpouštědla a odšroubujte je od sebe opatrně proti směru hodinových ručiček na dvě části. Odstraňte injekční lahvičku od rozpouštědla
-
6. Jemně otáčejte injekční lahvičkou s přípravkem s připojeným průhledným adaptérem, dokud se prášek zcela nerozpustí. Netřepejte s injekční lahvičkou.

-
7. Nasajte vzduch do prázdné sterilní injekční stříkačky. Zatímco je injekční lahvička s přípravkem dnem dolů, spojte injekční stříkačku pomocí koncovky Luer lock šroubováním ve směru hodinových ručiček se soupravou Mix2Vial. Vstříkněte vzduch do injekční lahvičky s přípravkem.
Natáhnutí a aplikace:


-
8. Zatímco držíte píst stříkačky stlačený, obraťte celý systém dnem vzhůru. Pomalým vytahováním pístu natáhněte roztok do stříkačky.
-
9. Po natažení roztoku do stříkačky uchopte pevně válec stříkačky (píst stále směřuje dolů) a odpojte průhledný adaptér soupravy Mix2Vial od stříkačky odšroubováním proti směru hodinových ručiček.
I,
Jednotlivá intravenózm injekce
Použijte venepunkční set přiložený k tomuto přípravku, vpíchněte jehlu do žíly. Nechte krev natéci do konce hadičky. Připevněte injekční stříkačku na konec venepunkčního setu se závitem. Připravený roztok aplikujte pomalu do žíly,podle instrukcí Vašeho lékaře. Dávejte pozor, aby se žádná krev nedostala do injekční stříkačky, která obsahuje připravený roztok. Maximální rychlost podání je 2 mililitry za minutu.
Kontinuální infuze
Mononine může být též podáván dlouhodobou (kontinuální) infuzí po dobu několika hodin nebo dnů. To musí být provedeno a kontrolováno Vašim lékařem.
Kontrolujte se, zda nemáte nežádoucí účinky, které by mohly nastat okamžitě. Pokud máte nějaké nežádoucí účinky, které by mohly souviset s podáním přípravku Mononine, injekce nebo infuze se musí okamžitě zastavit (viz také bod „Upozornění a opatření“).
Máte-li jakékoli další otázky týkající se používání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka.
4. Možné nežádoucí účinky
Podobně jako všechny léky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Pokud se u Vás objeví jakýkoli z následujících příznaků, kontaktujte se okamžitě se svým lékařem nebo jděte na pohotovost do nejbližší nemocnice nebo do Centra pro léčbu hemofilie:
- náhlá alergická reakce (jako je kožní vyrážka nebo kopřivka, svědění, otok tváře, rtů, jazyka nebo jiných částí těla),
- dušnost, sípot nebo dýchací potíže,
- záchvaty,
- ztráta účinku (krvácení pokračuje).
- Alergické reakce, které mohou zahrnovat:
-
> pálení a píchání, zarudnutí a otoky žíly v místě vpichu injekce nebo infuze,
-
> otok tváře, krku nebo jiných částí těla, zimnice, návaly horka, kožní vyrážka po celém těle, kopřivkové pupeny
-
> bolesti hlavy,
-
> pokles krevního tlaku, neklid, rychlá srdeční činnost, tlak na prsou, sípot,
-
> únava (letargie),
-
> pocit na zvracení/zvracení,
-
> mravenčení.
- Ve vzácných případech byla pozorována horečka.
- Velmi vzácně bylo po léčbě referováno o zvláštní formě zánětu ledvin (nefrotický syndrom) u pacientů u nichž byly prokázány inhibitory faktoru IX. U těchto pacientů byly známy alergické reakce v anamnéze.
- Po podání přípravků s faktorem IX je potenciální riziko tvorby krevních sraženin, které mohou vést k srdečnímu záchvatu (infarktu myokardu), krevních sraženin v končetinách (žilní trombóza) a sraženin v plicích (plicní embolie). Použití přípravku Mononine je vzácně spojeno s těmito nežádoucími účinky.
- Velmi vzácně se u Vás může projevit tvorba inhibitorů (neutralizačních protilátek) faktoru IX, v těchto případech nebude faktor IX správně účinkovat. Pokud se toto stane, doporučuje se kontaktovat speciální centrum pro hemofilii.
- Chraňte před mrazem.
- Uchovávejte injekční lahvičku ve vnějším obalu, aby byl přípravek chráněn před světlem.
- Uchovávejte v chladničce (2°C-8°C).
- Během doby použitelnosti se přípravek (pokud je ve vnějším obalu) může uchovávat při pokojové teplotě (do 25°C) po dobu l měsíce bez opětovného uchovávání v chladničce během této doby. Datum počátku uchovávání při pokojové teplotě a konec měsíčního období musí být vyznačeno na vnějším obalu. Na konci této doby musí být přípravek použit nebo znehodnocen.
- Připravený roztok musí být okamžitě použit.
- Jestliže je roztok naředěný (v poměru l:10) musí být roztok použit okamžitě, i když fyzikálně-chemická stabilita je prokázána na 24 hodin.
- Váš lékař Vás bude informovat jak znehodnotit nespotřebovaný roztok a materiál.
6. Obsah balení a další informace
Co přípravek Mononine obsahuje
Léčivou látkou přípravku Mononine je factor IX coagulationis humanus 500 IU v l injekční lahvičce.
Po rozpuštění v 5 ml rozpouštědla, připravený roztok obsahuje přibližně 100 IU lidského koagulačního faktoru IX v 1 ml.
Pomocnými látkami jsou: histidin, mannitol, chlorid sodný, kyselina chlorovodíková nebo hydroxid sodný (v malém množství na úpravu pH)
Rozpouštědlo: voda pro injekci
Jak přípravek Mononine vypadá a co obsahuje toto balení
Mononine je bílý prášek a je dodáván s vodou na injekci jako rozpouštědlem.
Připravený roztok musí být čirý nebo slabě opalescentní, tj. že může proti světlu jiskřit, ale nesmí obsahovat viditelné částice.
Obsah balení
Krabička s 500 IU obsahuje:
-
– 1 injekční lahvičku s práškem
-
– 1 injekční lahvičku s 5 ml vody pro injekci
-
– l přepouštěcí adaptér s filtrem 20/20
-
– 1 injekční stříkačku 10 ml k jednorázovému použití
-
– l venepunkční set
-
– 2 alkoholové tampony
-
– 1 nesterilní náplast
Držitel rozhodnutí o registraci a výrobce
CSL Behring GmbH
Emil-von-Behring-Strasse 76
35041 Marburg, Německo
Tento léčivý přípravek je v členských státech EHP registrován pod těmito názvy:
Mononine: ______________________________________ Itálie, Polsko, Švédsko
Mononine, Poeder en oplosmiddel voor oplossing voor injectie of infusie 500 IE:______________ Nizozemsko
Mononine 500: ___________________________________ Francie, Německo, Lucembursko,
Portugalsko
Mononine 500 i.e. prašek in
vehikel za raztopino za injiciranje/infundiranje: _______ Slovinsko
Mononine 500 I.E. Pulver und
Losungsmittel zur Herstellung einer
Injektions- oder Infusionslosung: ____________________Rakousko
Mononine 500 IU: ________________________________ Česká republika, Slovenská republika
Mononine 500 UI polvo y disolvente para
solución inyectable o perfusión: _____________________ Španělsko
Mononine 500 NE por és oldószer
oldatos injekcióhoz vagy infúzióhoz: Maďarsko
Tato příbalová informace byla naposledy revidována: 25. 8. 2017
Následující informace jsou určeny pouze pro zdravotnické pracovníky:
Dávkování
Počet podaných jednotek faktoru IX je vyjádřen v mezinárodních jednotkách (IU), které se vztahují k současnému standardu WHO pro přípravky obsahující faktor IX. Plazmatická aktivita faktoru IX je vyjádřena buď v procentech (vzhledem k normální lidské plazmě) nebo v mezinárodních jednotkách (vztaženo na mezinárodní standard pro faktor IX v plazmě).
Jedna mezinárodní jednotka (IU) aktivity faktoru IX je ekvivalentní množství faktoru IX v 1 ml normální lidské plazmy.
Požadovaná léčba
Výpočet požadované dávky faktoru IX je založen na empirickém zjištění, že 1 IU faktoru IX na kg tělesné hmotnosti zvýší aktivitu plazmatického faktoru IX o 1,0 % normální aktivity. Požadovaná dávka je určena pomocí následujícího vzorce:
Potřebný počet jednotek
= tělesná hmotnost (kg) x požadovaný vzestup faktoru IX (% nebo IU/dl) x 1,0
Množství, které má být podáno, metoda a frekvence podávání by vždy měla být přizpůsobena klinické účinnosti v individuálním případě.
V případě následujících hemoragických příhod by aktivita faktoru IX neměla klesnout pod stanovenou hladinu plazmatické aktivity (v % normálu anebo IU/dl) v odpovídajícím období. Následující tabulky mohou být použity jako vodítko pro stanovení dávky při krvácivých příhodách a chirurgických výkonech:
| Tabulka 1: jednorázová intravenózní injekce. | ||
| Stupeň krvácení / Typ chirurgického výkonu | Požadovaná hladina faktoru IX v plazmě (% nebo IU/dl) | Četnost dávek (v hodinách)/ Trvání léčby (dny) |
| Krvácení | ||
| Časná hemartróza, krvácení do svalů nebo do dutiny ústní | 20–40 | Opakovat každých 24 hodin. Nejméně 1 den, dokud nedojde k zástavě krvácení indikované skončením bolestí, nebo ke zhojení. |
| Rozsáhlejší hemartróza, krvácení do svalů nebo hematom | 30–60 | Opakovat infuzi každých 24 hodin po 3–4 dny nebo déle, dokud nevymizí bolest a akutní postižení. |
| Život ohrožující krvácení | 60–100 | Opakovat infuzi každých 8 až 24 hodin, dokud nepomine ohrožení života. |
| Chirurgický zákrok | ||
| Menší včetně extrakce zubu | 30–60 | Každých 24 hodin. Nejméně jeden den, až je dosaženo zhojení. |
| Velké chirurgické výkony | 80–100 (před a po operaci) | Opakovat infuzi každých 8–24 hodin až do adekvátního zhojení rány, pak pokračovat v léčbě přinejmenším po dalších 7 dnů, aby byla udržena aktivita faktoru IX od 30 % do 60 % (IU/dl). |
| Tabulka 2: kontinuální infuze při chirurgických zákrocích | |
| Hladiny faktoru IX potřebné pro hemostázu | 40–100% (nebo IU/dl) |
| Počáteční dávka potřebná k dosažení potřebné hladiny | Počáteční nárazová dávka 90 IU na kg (rozsah 75–100 IU/kg) tělesné hmotnosti nebo dávkování řízené podle hladiny pyruvátkinázy (pK -guided dosing). |
| Frekvence podávání | Kontinuální i.v. infuze v závislosti na clearance a na změřených hladinách faktoru IX |
| Trvání léčby | Až 5 dnů. Podle povahy chirurgického zákroku může být potřebná i delší léčba. |
Profylaxe
Na dlouhodobou profylaxi krvácení u pacientů se závažnou hemofilií B se obvykle používají dávky 20 až 40 IU faktoru IX na kg tělesné hmotnosti v intervalech 3–4 dnů. V některých případech, zvláště u mladších pacientů, může být nutné použít kratší intervaly nebo vyšší dávky.
V průběhu léčby se doporučuje patřičné stanovování hladin faktoru IX, aby bylo možno řídit dávku, která má být podána a frekvenci opakovaných infuzí. Zvláště v případě větších chirurgických zákroků je nezbytné přesné monitorování substituční léčby pomocí koagulační analýzy (aktivity plazmatického faktoru IX). Odpověď na aplikaci faktoru IX se může u jednotlivých pacientů lišit. Může u nich docházet k různým hodnotám recovery in vivo a různé mohou být i poločasy.
U pacientů je třeba sledovat rozvoj inhibitorů faktoru IX.
Dříve neléčení pacienti
Bezpečnost a účinnost přípravku Mononine u dříve neléčených pacientů nebyla dosud stanovena.
Pediatrická populace
Dávkování u dětí je založeno na tělesné hmotnosti, a proto je obecně založeno na stejných pokynech jako u dospělých. Četnost podávání má být vždy orientována na klinickou účinnost v konkrétním případě.
Způsob podávání
Mononine se může podávat jako jednotlivá injekce (viz instrukce v bodě 3) nebo kontinuální infuzí (viz instrukce níže).
Kontinuální infuze
Mononine musí být rekonstituován vodou na injekci, jak je popsáno v bodě „Rekonstituce a podání“. Po rekonstituci se může Mononine podávat kontinuální infuzí buď nezředěný nebo zředěnýpomocí injekční pumpy nebo schváleným infuzním setem.
Síla neředěného, rekonstituovaného přípravku Mononine je přibližně 100 IU/ml.
Zředěný roztoklze připravit následovně:
- Zřeďte rekonstituovaný, zfiltrovaný roztok převedením vhodného množství přípravku Mononine do požadovaného objemu fyziologického roztoku s použitím aseptické techniky.
- U ředění do 1:10 (koncentrace 10 IU faktoru IX/ml) zůstává aktivita faktoru IX stabilní po dobu 24 hodin.
- Redukce aktivity faktoru IX nastává při vyšších ředěních. Aktivita faktoru IX musí být monitorována k udržení požadované hladiny v krvi.
Příklad ředění 500 IU rekonstituovaného přípravku Mononine:
| Požadovaná síla po naředění | 10 IU/ml | 20 IU/ml |
| Objem rekonstituovaného přípravku Mononine | 5,0 ml | 5,0 ml |
| Objem potřebného fyziologického roztoku | 45,0ml | 20,0 ml |
| Dosažené ředění | 1:10 | 1:5 |
- Doporučuje se používat polyvinylchloridové (PVC) IV vaky a hadičky
- Důkladně promíchejte a zkontrolujte, zda vak nemá trhliny.
- Doporučuje se vyměnit vaky s čerstvě naředěným přípravkem Mononine každých 12–24 hodin.
Další informace o léčivu MONONINE
Jak
se MONONINE
podává: intravenózní podání - prášek a rozpouštědlo pro injekční/infuzní roztok
Výdej
léku: na lékařský předpis
Balení: Injekční lahvička
Velikost
balení: 1+1X5ML
Držitel rozhodnutí o registraci daného léku v České republice:
CSL Behring GmbH, Marburg
E-mail: maly.josef@gmail.com
Telefon: 607 906 111
