Příbalový leták - MAGNEVIST
Příbalová informace: informace pro uživatele
Magnevist
Injekční roztok
Dimeglumini gadopentetas
V naleznete v této příbalové informaci
-
-
1. Co je Magnevist a k čemu se používá
-
2. Čemu musíte věnovat pozornost, než Vám bude Magnevist podán
-
3. Jak Vám bude Magnevist podán
-
4. Možné nežádoucí účinky
-
5 Jak Magnevist uchovávat
6. Obsah balení a další informace
7. Doplňujícím informace určená pouze pro zdravotnické pracovníky
-
1. Co je Magnevist a k čemu se používá
Magnevist je kontrastní látka, používá se při magnetické rezonanci (MR) mozku, páteře, cév, a dalších částí těla.
Tento lék je dodáván ve formě roztoku pro intravenózní injekci, je určen pouze k diagnostickým účelům.
MR je způsob lékařského diagnostického zobrazení, při kterém se vytvářejí obrázky pomocí detekce molekul vody v normálních a abnormálních tkáních. K tomuto se používá komplex magnetů a radiovln. Počítač zaznamenává aktivitu a transformuje ji do obrázků.
2. Čemu musíte věnovat pozornost, než Vám bude Magnevist podán
Magnevist Vám nesmí být podán
Přípravek Magnevist Vám nesmí být podán, jestliže máte vážné problémy s ledvinami a/nebo akutní poškození ledvin, nebo se chystáte podstoupit transplantaci jater, nebo jste v nedávné době transplantaci jater podstoupili, a to proto, že u pacientů v takovém stavu bylo po použití Magnevistu pozorováno onemocnění zvané nefrogenní systémová fibróza (NSF). NSF je onemocnění, při kterém dochází k zesílení kůže a podkožních tkání. NSF může vést k vážnému znehybnění kloubů, svalové slabosti nebo může ovlivnit funkci vnitřních orgánů, to může vést až k ohrožení života. Dále Magnevist nesmí být podáván novorozencům ve věku do 4 týdnů.
Dále Vám Magnevist nesmí být podán, jestliže máte v těle srdeční pacemakernebo nějaký implantát nebo svorku obsahující železo. V těchto případech nesmíte být vystaveni působení silného magnetického pole.
Zvláštní opatrnosti při použití Magnevistu je zapotřebí v níže uvedených případech:
– jestliže jste alergický/(á) na dimeglumini gadopentetas nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6)
– jestliže jste dříve měl(a) reakci na kontrastní látku
– jestliže trpíte nyní nebo jste v minulosti trpěl(a) alergií (např. sennou rýmou, kopřivkou) nebo astmatem
– jestliže máte onemocnění srdce nebo máte oběhové potíže. Důvodem je, že se u Vás ve vzácném případě může vyskytnout alergická reakce, která může být s vyšší pravděpodobností vážná nebo život ohrožující
– jestliže Vaše ledviny nepracují správně a/nebo máte akutní poškození ledvin
– jestliže jste nedávno podstoupil(a) nebo se chystáte podstoupit transplantaci jater
– jestliže máte epilepsii, případně onemocnění mozku, které je doprovázeno záchvaty, nebo jiné poškození mozku. Ve vzácných případech se u pacientů s takovým onemocněním vyskytly záchvaty nebo křeče.
Předtím, než Vám bude Magnevist podán, podstoupíte krevní testy pro kontrolu funkce ledvin.
- Pokud se Vás týká některý z výše uvedených případů, řekněte to svému lékaři, radiologovi nebo personálu MR pracoviště. Váš lékař rozhodne, zda je vyšetření možné či nikoliv.
Po podání Magnevistu se mohou objevit alergii podobné reakce. Tyto reakce mohou být vážné. Většina z těchto reakcí se objeví během 30 minut od podání. Proto budete minimálně 30 minut po podání injekce sledováni.
Mohou se objevit opožděné reakce (po hodinách nebo dokonce po dnech) (viz bod „Možné nežádoucí účinky“).
Než podstoupíte jakékoli krevní testy, informujte svého lékaře, že Vám byl podán Magnevist. A to proto, že některé testy na stanovení hladiny železa v krvi mohou být po dobu 24 hodin od podání Magnevistu ovlivněny.
Děti a dospívající
Magnevist se nesmí používat u novorozenců ve věku do 4 týdnů. U kojenců ve věku do 1 roku se, vzhledem k nezralosti ledvin, smí Magnevist použít pouze po pečlivé lékařské úvaze.
Kromě vyšetření mozku a páteře je u dětí mladších než 2 roky zkušenost s použitím Magnevistu omezená.
Novorozencům a malým dětem se má dávka podávat manuálně.
Další léčivé přípravky a Magnevist
Informujte svého lékaře, radiologa nebo personál MR pracoviště o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat.
Informujte svého lékaře především v případě, jestliže užíváte beta-blokátory (přípravky užívané k léčbě vysokého krevního tlaku nebo nepravidelného srdečního rytmu).
Těhotenství a kojení
Poraďte se se svým lékařem před tím, než začnete užívat jakýkoli lék.
Těhotenství
Musíte informovat svého lékaře, pokud jste těhotná, nebo se domníváte, že můžete být těhotná. Přípravek Magnevist se nemá podávat během těhotenství, jestliže to není zcela nezbytné.
Kojení
Informujte svého lékaře, jestliže kojíte nebo se chystáte kojit. Poté, co Vám bude Magnevist podán, bude třeba kojení přerušit minimálně na dobu 24 hodin.
Řízení dopravních prostředků a obsluha strojů
Není známo, že by Magnevist ovlivňoval schopnost řídit a obsluhovat stroje.
3. Jak se Magnevist podává
Magnevist je podáván lékařem do žíly pomocí jehly nebo katetru. Okamžitě poté můžete podstoupit MR vyšetření.
Přesná dávka Magnevistu, která je pro Vás vhodná, bude určena na základě Vaší tělesné hmotnosti a na vyšetřované části těla:
U dospělých je obvykle dostatečné podání jedné injekce s dávkou 0,2 ml na kg tělesné hmotnosti (tzn. pro osobu s tělesnou hmotností 70 kg bude dávka 14 ml). Ve speciálních případech může být dávka zvýšena až na 0,6 ml na kg tělesné hmotnosti pro dospělé a na 0,4 ml na kg tělesné hmotnosti pro děti. Dávku Magnevistu, která je pro Vaše vyšetření potřebná, určí radiolog.
Kromě vyšetření mozku a páteře je u pacientů ve věku do dvou let s použitím Magnevistu omezená zkušenost.
Dávkování u speciálních skupin pacientů
Jestliže máte vážně sníženou funkci ledvin a/nebo akutní poškození ledvin, chystáte se podstoupit transplantaci jater nebo jste transplantaci jater nedávno podstoupili, Magnevist Vám podán nebude. Magnevist také nesmí být podáván novorozencům ve věku do 4 týdnů.
Jestliže máte středně sníženou funkci ledvin, může Vám být během jednoho vyšetření podána pouze jedna dávka. Vzhledem k nedostatku informací o opakovaném podání může být další dávka podána nejdříve po 7 dnech.
U kojenců ve věku do 1 roku se vzhledem k nezralosti renálních funkcí smí během jednoho vyšetření podat pouze jedna dávka přípravku Magnevist, druhá injekce může být podána nejdříve po 7 dnech.
Jestliže je Vám 65 let nebo více, není třeba dávku upravovat, bude však třeba, abyste podstoupili krevní testy na kontrolu funkce ledvin.
Další informace týkající se podávání a zacházení s Magnevistem jsou uvedeny na konci příbalové informace (viz bod „Obsah balení a další informace“).
Jestliže jste dostal(a) více Magnevistu, než jte měl(a)
Žádné příznaky předávkování zatím zaznamenány nebyly. Dojde-li k náhodnému předávkování, Váš lékař bude léčit všechny příznaky, které se objeví, a bude kontrolovat funkci ledvin. V případě, že Vaše ledviny správně nepracují, může lékař k odstranění Magnevistu použít přístroj pro dialýzu ledvin.
Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo radiologa.
4. Možné nežádoucí účinky
Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého.
Většinou jsou tyto nežádoucí účinky mírné až středně závažné.
U pacientů, kterým byl Magnevist podán, byly nejčastěji pozorovanými nežádoucími účinky (mohou se projevit u 4 nebo více pacientů z 1000) různé reakce v místě injekce, bolest hlavy a nenevolnost.
Nejvážnějšími nežádoucími účinky, které se u pacientů po podání mMagnevistu vyskytují, jsou nefrogenní systémová fibróza (NSF) a anafylaktoidní reakce (alergii podobná reakce) včetně vážných reakcí jako je šok. NSF je vážná reakce, převážně zahrnující zhrubnutí kůže a podkožních tkání a může mít za náledek závažné znehybnění kloubů, svalovou slabost nebo může poškodit funkci vnitřních orgánů, což může být případně život ohrožující.
Ve vzácných případech se mohou vyskytnout alergii podobné reakce, které mohou zahrnovat i šok a mohou vyžadovat okamžitý zásah lékaře. Jesliže zaznamenáte mírný otok obličeje, jazyka nebo krku, kašel, nebo kýchání, obtíže s dýcháním, svědění, výtok z nosu nebo kopřivku, informujte okamžitě svého lékaře, radiologa, nebo personál MR pracoviště.Může se jednat o první projevy závažné reakce. Je možné, že vyšetření bude muset být přerušeno a budete potřebovat další léčbu.
Po podání Magnevistu byly ve vzácných případech pozorovány opožděné reakce, po několika hodinách až dnech. Jestliže k tomu dojde, informujte svého lékaře nebo radiologa.
Níže jsou uvedené nežádoucí účinky, které byly hlášené/pozorované, jsou seřazeny dle četnosti výskytu.
Méně časté(mohou se projevit u 1 až 10 pacientů z 1000)
– bolesti hlavy; závrať; porucha chuti
– zvracení; nevolnost
– bolest; pocit chladu; pocit horka,
– citlivost nebo reakce v místě injekce, jako jsou:
pocit chladu v místě vpichu, parestezie (mravenčení), zduření, pocit horka, bolest, otok, podráždění, krvácení, bolestivé zarudnutí kůže, nepříjemné pocity, nekróza (odumírání tkáně), tromboflebitida (zánět žíly způsobený krevní sraženinou nebo s krevní sraženinou spojený), flebitida (zánět žíly), zánět, extravazace (krvácení do tkání v místě injekce), bolest, podlitina, změna barvy kůže
Vzácné (mohou postihnout 1 až 10 pacientů z 10 000)
– hypersenzitivita (alergie)/anafylaktoidní (alergii podobná) reakce např.: anafylaktoidní šok (vážná alergii podobná reakce), šok (oběhový kolaps), hypotenze (nízký krevní tlak), zánět spojivek, ztráta vědomí, stažení hrdla, kýchání, kopřivka, pruritus (silné svědění), vyrážka, erytém (zarudnutí kůže), dušnost (potíže s dýcháním), dechová zástava, bronchospasmus (potíže s dýcháním), sípání, laryngospasmus (stažení hlasivek), laryngeální edém (otok hlasivek), faryngeální edém (otok krku), cyanóza (modré rty), rýma (výtok z nosu), angioedém (např. otok obličeje, krku, úst, rtů a/nebo jazyka), otok obličeje, reflexní tachykardie (abnormálně rychlý srdeční rytmus)
– dezorientace
– křeče (záchvaty); parestezie (mravenčení); pocit pálení; třes
– tachykardie (abnormálně rychlý srdeční rytmus); arytmie (nepravidelný srdeční rytmus)
– tromboflebitida (zánět žíly spojený s krevní sraženinou nebo vyvolaný krevní sraženinou); návaly horka; vazodilatace (rozšíření cév)
– podráždění hrdla; faryngeální bolest/nepříjemné pocity (bolest nebo nepříjemné pocity v hrdle); kašel
– bolest žaludku (břicha) nebo nepříjemné pocity; průjem; bolest zubů; sucho v ústech, bolest měkkých tkání úst a parestézie (mravenčení v ústech)
– bolest paží, dlaní, nohou a chodidel
– bolest na hrudi; horečka; otok paží, rukou, chodidel a nohou (periferní otok); celkově nepříjemné pocity (malátnost); únava; žízeň; slabost (asténie)
Není známo(z dostupných údajů nemůže být frekvence výskytu stanovena):
– zvýšení sérového železa (změna hladiny může být zaznamenána při krevních testech)
– neklid; zmatenost
– koma; ospalost; problém s řečí; parosmie (porucha čichu)
– problémy se zrakem; slzení očí (lakrimace); bolest očí
– problémy se sluchem; bolest uší
– srdeční zástava (náhlá zástava srdce); bradykardie (snížený srdeční rytmus)
– synkopa (omdlévání); vasovagální reakce (přechodný rychlý pokles krevního tlaku; bledost, může končit bezvědomím); vysoký krevní tlak,
– obtížné dýchání; zvýšení nebo snížení rychlosti dechu; otok plic (tekutina v plicích)
– slinění (salivace)
– zvýšení bilirubinu; zvýšení jaterních enzymů (změna hladin může být zaznamenána při krevních testech)
– nefrogenní systémová fibróza (NSF je vážná reakce zahrnující především zhrubnutí kůže a podkožních tkání, může také mít za následek vážné snížení pohyblivosti kloubů, svalovou slabost nebo může poškodit funkci vnitřních orgánů, což může být případně život ohrožující)
– bolest zad; atralgie (bolest kloubů)
– selhání ledvin u pacientů, kteří již mají s ledvinami potíže; zvýšení kreatininu v séru (látka v krvi, z krevní hladiny se určuje funkce ledvin; změna hladiny může být zjištěna při krevních testech), inkontinence; akutní nucení na močení
– pocit chladu; pocení; změny tělesné teploty
U pacientů se selháním ledvin, kteří jsou závislí na dialýze, jsou běžně po podání Magnevistu pozorovány opožděné a přechodné zánět připomínající reakce jako jsou horečka, třesavka a zvýšení C-reaktivního proteinu (látka v krvi, používaná při testech k identifikaci zánětlivých reakcí). Tito pacienti by měli podstoupit MR vyšetření s podáním Magnevistu den před hemodialýzou.
Byly hlášeny případy nefrogenní systémové fibrózy (která způsobuje zhrubnutí kůže a může také postihnout měké tkáně a vnitřní orgány).
Dále uvedené nežádoucí účinky byly v některých případech život ohrožující, nebo měly za následek smrt: nefrogenní systémová fibróza (NSF, vážná reakce zahrnující především zhrubnutí kůže a podkožních tkání); anafylaktoidní šok (vážná, alergii podobná reakce); anafylaktoidní (alergii podobná) reakce; hypersenzitivní (alergická) reakce; šok (oběhový kolaps); hypotenze (nízký krevní tlak); ztráta vědomí; stažení hrdla; dušnost (obtížné dýchání); zástava dechu; bronchospasmus (obtížné dýchání); laryngospasmus (stažení hlasivek); laryngeální edém (otok hlasivek); faryngeální edém (otok krku); cyanóza (modré rty); angioedém (např. otok obličeje, krku, úst, rtů a/nebo jazyka); otok obličeje; křeče (záchvaty); tachykardie (abnormálně rychlý srdeční rytmus), vzestup hladiny železa v séru; koma; ospalost; srdeční zástava (náhlá zástava srdce); bradykardie (zpomalení srdečního rytmu), synkopa (omdlévání) a otok plic (tekutina v plicích).
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo radiologovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky: www.sukl.cz/…douci-ucinek
Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
5. Jak Magnevist uchovávat
Magnevist je citlivý na světlo. Uchovávejte vnitřní obal v krabičce, aby byl přípravek chráněn před světlem. Při manipulaci není ochrana před světlem nutná.
Poté, co je lahvička/láhev otevřena nebo předplněná stříkačka připravena k použití, zůstává Magnevist chemicky, fyzikálně a mikrobiologicky stabilní 1 vyšetřovací den. Stanovená doba není dána fyzikálně chemickou stabilitou, ale možností mikrobiální kontaminace přípravku.
6. Obsah balení a další informace
Co Magnevist obsahuje
Léčivou látkou je dimeglumini gadopentetas. Každý ml injekčního roztoku obsahuje 0,5 mmol dimeglumini gadopentetas (to odpovídá 469 mg/1 dimeglumini gadopentetas).
Pomocnými látkami jsou meglumin, kyselina pentetová, voda na injekci.
Návod k použití přípravku a zacházení s ním
Vizuální kontrola
Tento léčivý přípravek musí být před použitím vizuálně zkontrolován. Magnevist je dodáván jako čirý, bezbarvý roztok.
Magnevist nepoužívejte v případě silného zabarvení, výskytu částic nebo poškození vnitřního obalu.
Skleněné lahvičky
Magnevist musí být natažen do stříkačky až těsně před podáním.
Pryžová zátka nesmí nikdy být propíchnuta více než jednou.
Veškerý kontrastní roztok nepoužitý při jednom vyšetření musí být zlikvidován.
Předplněné injekční stříkačky:
Stříkačka musí být vyjmuta z obalu a připravena pro použití až těsně před vyšetřením.
Kryt jehly musí být odstraněn až těsně před použitím.
Veškerý kontrastní roztok nespotřebovaný během jednoho vyšetření musí být zlikvidován.
Vnitřní obal většího objemu
Níže jsou uvedeny doplňující informace k použití lahví o objemu 100 ml:
Kontrastní látka musí být aplikována schváleným postupem, který zajišťuje sterilitu kontrastní látky.
Při použití zařízení musí být dodrženy pokyny výrobce tohoto zařízení.
U novorozenců a batolat se zařízení používat nesmí.
Dětem ve věku do dvou let musí být požadovaná dávka podávána manuálně a ne pomocí autoinjektoru, aby se předešlo poranění.
Oddělitelnou část štítku z lahviček/stříkaček je třeba vlepit do dokumentace pacienta, aby byl přesně zaznamenán použitý kontrastní přípravek s obsahem gadolinia. Též je nutno poznamenat podanou dávku. Pokud je vedena elektronická dokumentace, měl by být rovněž do záznamů pacienta uveden název podaného léčivého přípravku, číslo šarže a dávka.
Nepoužitý Magnevist zbylý v lahvičce musí být zlikvidovány na konci vyšetřovacího dne (maximálně po 24 hodinách). Další informace viz bod „Jak Magnevist uchovávat“
Inkompatibility
Protože studie kompatibility nejsou k dispozici, nesmí být tento léčivý přípravek mísen s žádnými dalšími léčivými přípravky.
Jak Magnevist vypadá a co obsahuje toto balení
Balení:
Skleněné lahvičky:
Velikosti balení: 1 × 5 ml, 1 × 10 ml, 1 × 15 ml, 1 × 20 ml, 1 × 30 ml, 1 × 100 ml, 10 × 20 ml
Předplněné injekční stříkačky:
Velikosti balení: 5 × 10 ml, 5 × 15 ml, 5 × 20 ml
Držitel rozhodnutí o registraci
Bayer AG
Kaiser-Wilhelm-Allee 1
51373 Leverkusen
Německo
Výrobce
Bayer AG, Mullerstrasse 178, 133 53 Berlín, Německo
Tato příbalová informace byla naposledy revidována 31. 5. 2017
7. Doplňující informace určená pouze pro zdravotnické pracovníky
Následující doplňující informace je určena pouze pro zdravotnické pracovníky.
Čtěte, prosím, také informace uvedené v bodech 1 až 6.
Způsob podání
Tento léčivý přípravek je určen pouze k intravenóznímu podání (viz bod „ Jak Vám bude Magnevist podán“).
Dávkování
Dospělí
Kraniální a spinální MR (viz bod „Co je Magnevist a k čemu se používá“)
Obvykle je podání Magnevistu v dávce 0,2 ml na kg tělesné hmotnosti (odpovídá 0,1 mmol gadopentate dimeglumine na kg tělesné hmotnosti) dostatečné pro dobré zesílení a k získání odpovědi na klinické otázky.
Jestliže přes normální nález na kontrastem zesílené MR přetrvává silné klinické podezření na existující lézi, může další injekce 0,2 ml nebo u dospělých až 0,4 ml Magnevistu na kg tělesné hmotnosti během 30 minut s bezprostředně následujícím vyšetřením MR poskytnout zřetelnější diagnostický výsledek.
Pro vyloučení metastáz nebo recidivujícího tumoru je u dospělých diagnosticky spolehlivější injekce 0,6 ml Magnevistu na kg tělesné hmotnosti.
Maximální jednotlivá dávka: 0,6 ml Magnevistu na kg tělesné hmotnosti.
Celotělová MR (viz bod „Co je Magnevist a k čemu se používá“)
Obvykle je podání Magnevistu v dávce 0,2 ml na kg tělesné hmotnosti dostatečné pro dobré zesílení a k získání odpovědi na klinické otázky.
Ve zvláštních případech, například u lézí s chudou vaskularizací a/nebo s malým extracelulárním prostorem, může být nezbytné podat 0,4 ml Magnevistu na kg tělesné hmotnosti pro získání potřebného kontrastního efektu zvláště při použití poměrně tence T1-vážených zobrazení.
Pro vyloučení lézí nebo recidivy tumoru může být u dospělých diagnosticky spolehlivější injekce 0,6 ml Magnevistu na kg tělesné hmotnosti.
Pro zobrazení cév může být v závislosti na vyšetřované oblasti a zobrazovací technice u dospělých nutná dávka 0,6 ml Magnevistu na kg tělesné hmotnosti.
Maximální jednotlivá dávka: 0,6 ml Magnevistu na kg tělesné hmotnosti.
Další informace o zvláštních skupinách pacientů
Pediatrická populace
Novorozenci ve věku do 4 týdnů a kojenci ve věku do 1 roku
Použití Magnevistu je u novorozenců ve věku do 4 týdnů kontraindikováno (viz bod 4.3). U kojenců ve věku do 1 roku se vzhledem k nezralosti renálních funkcí smí Magnevist použít pouze po pečlivé úvaze a to v dávce nepřekračující 0,2 ml/kg tělesné hmotnosti. Během jednoho vyšetření může být použita pouze jedna dávka.
Vzhledem k nedostatku informací o opakovaném podání není možné injekce Magnevistu opakovat dříve, než interval mezi injekcemi dosáhne alespoň 7 dní.
Všechny indikace (viz bod „Co je Magnevist a k čemu se používá“) Děti: 0,2 ml Magnevistu na kg tělesné hmotnosti.
Maximální jednotlivá dávka: 0,4 ml Magnevistu na kg tělesné hmotnosti.
Děti mladší než 2 roky: zkušenosti s indikací „Celotělová MR“ jsou omezené.
Dětem ve věku do dvou let musí být požadovaná dávka podávána manuálně a ne pomocí autoinjektoru, aby se předešlo poranění.
Starší pacienti
U starších pacientů může být renální clearance kyseliny gadopentetové zhoršená, proto je velmi důležité, aby byl u pacientů ve věku 65 let a starších proveden skrínink zaměřený na poruchy funkce ledvin.
Pacienti se sníženou funkcí ledvin
Magnevist se nesmí podávat pacientům se závažnou poruchou funkce ledvin (GFR < 30 ml/min/1,73 m2) a pacientům v perioperačním období transplantace jater (viz bod 4.3).
Pouze po pečlivém zvážení přínosu/rizika může být Magnevist použit u pacientů se středně závažnou poruchou funkce ledvin (GFR 30–59 ml/min/1.73m2), a to v dávce nepřekračující 0,2 ml/kg tělesné hmotnosti (viz bod 4.4). Během jednoho vyšetření může být podána pouze jedna dávka. Vzhledem k nedostatku informací o opakovaném podání není možné injekce Magnevistu opakovat dříve, než interval mezi injekcemi dosáhne alespoň 7 dní.
Zvláštní upozornění a zvláštní opatření pro použití
Přecitlivělost
U pacientů s dispozicí k alergiím musí být rozhodnutí o podání Magnevistu podloženo obzvláště pečlivým posouzením poměru rizika/přínosu.
Postprocedurální sledování pacienta je doporučováno.
Je třeba mít připravené prostředky umožňující v případě nebezpečí okamžitý zásah a medikaci k léčbě hypersenzitivní reakce (viz také bod „Zvláštní opatrnosti je zapotřebí“).
Vzácně byly pozorovány opožděné reakce, po několika hodinách až dnech (viz bod „Nežádoucí účinky“).
Pacienti s poruchou funkce ledvin
Před aplikací přípravku Magnevist musí být u všech pacientů proveden pomocí laboratorních testů skrínink zaměřený na poruchy funkce ledvin.
U pacientů s akutní nebo chronickou závažnou poruchou funkce ledvin (GFR < 30 ml/min/1,73 m2) a/nebo akutním poškozením ledvin byly v souvislosti s použitím přípravku Magnevist a některých dalších kontrastních látek s obsahem gadolinia hlášeny případy nefrogenní systémové fibrózy (NSF). Přípravek Magnevist je u těchto pacientů kontraindikován. Ve zvýšené míře jsou ohroženi pacienti, kteří podstupují transplantaci jater, a to proto, že incidence akutního selhání ledvin je v této skupině vysoká. Proto se Magnevist nesmí používat u pacientů se závažnou renální insuficiencí, v perioperačním období transplantace jater.
Magnevist se nesmí podávat novorozencům ve věku do 4 týdnů.
Riziko vzniku NSF u pacientů se středně závažnou poruchou funkce ledvin (GFR 30–59 ml/min/1.73 m2) není známo. Proto se u pacientů se středně závažnou poruchou funkce ledvin může Magnevist použít pouze po pečlivém zvážení rizika/prospěchu v dávce nepřekračující 0,2 ml/kg tělesné hmotnosti. Během jednoho vyšetření může být podána pouze jedna dávka. Vzhledem k nedostatku informací o opakovaném podání není možné injekce Magnevistu opakovat dříve, než interval mezi injekcemi dosáhne alespoň 7 dní.
Hemodialýza krátce po podání Magnevistu může být vhodným postupem k odstranění Magnevistu z těla. Neexistují důkazy na podporu zahájení hemodialýzy k prevenci nebo k léčbě NSF u pacientů, kteří hemodialýzu dosud nepodstupují.
Záchvatová onemocnění
Jak bylo ve spojitosti s podáním Magnevistu vzácně popsáno, mohou mít pacienti se záchvatovými onemocněními nebo s intrakraniálními lézemi zvýšené riziko výskytu křečí.
Interakce s jinými léčivými přípravky a jiné formy interakce
Interference s diagnostickými testy
Stanovení sérového železa komplexometrickými metodami (například batofenantrolinem) může v důsledku obsahu volného DTPA v kontrastní látce až do 24 hodin od vyšetření prokázat zkresleně nízké hodnoty.
Těhotenství
Magnevist se nemá používat během těhotenství, pokud klinický stav ženy nevyžaduje použití kyseliny gadopentetové.
Kojení
Kojení má být přerušeno minimálně po dobu 24 hodin od podání přípravku Magnevist.
Nežádoucí účinky
Celkový bezpečnostní profil Magnevistu je podložen daty z postmarketingového sledování a z klinických studií, prováděných s více než 11 000 pacienty (viz také bod „Možné nežádoucí účinky“).
Předávkování
Doposud nebyly při klinickém použití pozorovány nebo popsány žádné příznaky intoxikace jako následek neúmyslného předávkování.
V případě neúmyslného předávkování musí být u pacientů s poškozením ledvin monitorovány renální funkce.
Magnevist je možné odstranit hemodialýzou (viz bod Zvláštní upozornění a zvláštní opatření pro použití). Neexistuje však žádný důkaz podporující předpoklad, že hemodialýza je vhodná k prevenci nefrogenní systémové fibrózy (NSF) (viz bod „Zvláštní upozornění a zvláštní opatření pro použití“).
Oddělitelnou část štítku z lahviček/stříkaček je třeba vlepit do dokumentace pacienta, aby byl přesně zaznamenán použitý kontrastní přípravek s obsahem gadolinia. Též je nutno poznamenat podanou dávku. Pokud je vedena elektronická dokumentace, měl by být rovněž do záznamů pacienta uveden název podaného léčivého přípravku, číslo šarže a dávka.
Předplněná skleněná injekční stříkačka
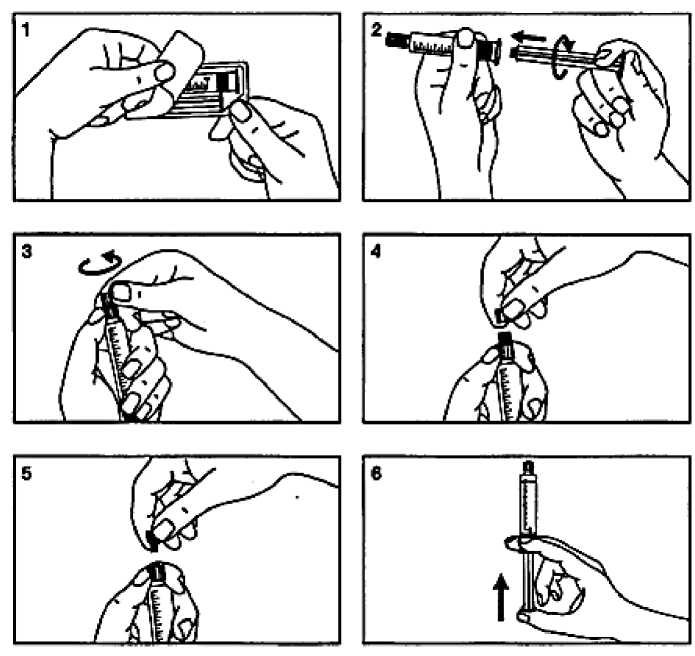
1. Otevřete balení.
2. Přišroubujte píst ke stříkačce.
3. Odlomte ochranný kryt.
4. Odstraňte ochranný kryt.
5. Vyjměte pryžovou zátku.
6. Odstraňte vzduch ze stříkačky.
Předplněná plastová injekční stříkačka
MANUÁLNÍ PODÁNÍ
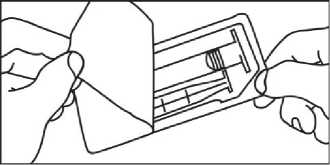
1. Otevřete balen
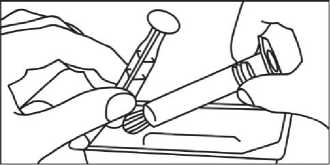
2. Vyjměte stříkačku a píst z obalu
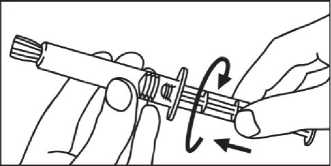
3. Píst zašroubujte ve směru hodinových ručiček do stříkačky
4. Otevřete víčko kroucením
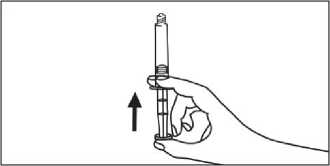
5. Odstraňte vzduch ze stříkačky
PODÁNÍ S INJEKTOREM

1. Otevřete balení
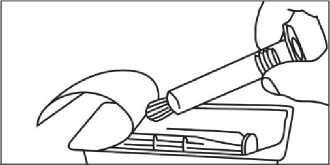
2. Vyjměte stříkačku z obalu
3. Otevřete víčko kroucením
4. Hrot stříkačky připojte ve směru hodinových ručiček k prodlužovací hadičce a dále pokračujte dle pokynů výrobce zdravotnického prostředku
Další informace o léčivu MAGNEVIST
Jak
se MAGNEVIST
podává: intravenózní podání - injekční roztok
Výdej
léku: na lékařský předpis
Balení: Injekční lahvička
Velikost
balení: 1X5ML
Držitel rozhodnutí o registraci daného léku v České republice:
Bayer Pharma AG, Berlín
E-mail: info.cz@bayer.com
