Souhrnné informace o léku - FLUARIX TETRA
1. NÁZEV PŘÍPRAVKU
Fluarix Tetra injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený virion, inaktivovaný)
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Virus chřipky (inaktivovaný, štěpený) obsahující následující kmeny*:
A/Michigan/45/2015 (H1N1)pdm09 – varianta kmene (A/Singapore/GP1908/2015, IVR-180)
15 mikrogramů HA
15 mikrogramů HA
15 mikrogramů HA
15 mikrogramů HA
A/Singapore/INFIMH-16–0019/2016 (H3N2) – varianta kmene (A/Singapore/INFIMH-16–0019/2016, NIB-104)
B/Colorado/06/2017 – varianta kmene (B/Maryland/15/2016, NYMC
BX-69A)
B/Phuket/3073/2013 – varianta kmene (B/Phuket/3073/2013, divoký kmen) v jedné 0,5ml dávce
* připraveno na oplodněných slepičích vejcích ze zdravých kuřecích chovů
**hemaglutinin
Tato vakcína splňuje doporučení Světové zdravotnické organizace (SZO) (pro severní polokouli) a doporučení EU pro sezónu 2018/2019.
Pomocné látky se známým účinkem
Tento přípravek obsahuje v jedné dávce přibližně 3,75 mg chloridu sodného a přibližně 1,3 mg dodekahydrátu hydrogenfosforečnanu sodného (viz bod 4.4).
Tento přípravek obsahuje v jedné dávce přibližně 0,2 mg dihydrogenfosforečnanu draselného a přibližně 0,1 mg chloridu draselného (viz bod 4.4).
Vakcína Fluarix Tetra může obsahovat stopy vaječné bílkoviny (jako je ovalbumin, kuřecí proteiny), formaldehyd, gentamicin-sulfát a natrium-deoxycholát, které se používají v průběhu výrobního postupu (viz bod 4.3).
Úplný seznam pomocných látek viz bod 6.1.
3.
LÉKOVÁ FORMA
Injekční suspenze v předplněné injekční stříkačce.
Suspenze je bezbarvá a slabě opaleskující.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Vakcína Fluarix Tetra je indikována k aktivní imunizaci dospělých a dětí od 6 měsíců věku k prevenci chřipky způsobené dvěma subtypy viru chřipky A a dvěma typy viru chřipky B obsaženými ve vakcíně (viz bod 5.1).
Vakcína Fluarix Tetra se používá na základě oficiálních doporučení.
Protože imunita v průběhu roku po vakcinaci klesá a cirkulující kmeny chřipky se mohou rok od roku měnit, doporučuje se každý rok revakcinace aktuální vakcínou.
4.2 Dávkování a způsob podání
Dávkování
Dospělí: 0,5 ml
Pediatrická populace
Děti od 6 měsíců věku: 0,5 ml.
U dětí ve věku < 9 let, které nebyly dosud očkovány proti chřipce, je třeba podat druhou dávku s odstupem nejméně 4 týdnů.
Děti do 6 měsíců věku: bezpečnost a účinnost vakcíny Fluarix Tetra u dětí do 6 měsíců věku nebyly stanoveny.
Způsob podání
Imunizace se provádí intramuskulární injekcí.
Opatření, která je třeba dodržet před manipulací s léčivým přípravkem nebo před jeho podáním
Návod k přípravě tohoto léčivého přípravku před jeho podáním je uveden v bodě 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1 nebo na kteroukoli složku přípravku, která v něm může být přítomna ve stopovém množství, jako jsou vejce (ovalbumin, kuřecí proteiny), formaldehyd, gentamicin-sulfát a natrium-deoxycholát.
U pacientů s horečnatým onemocněním a s akutním infekčním onemocněním se musí imunizace odložit.
4.4 Zvláštní upozornění a opatření pro použití
Podle postupů správné klinické praxe předchází očkování shrnutí lékařské anamnézy (zejména s ohledem na předchozí očkování a možný výskyt nežádoucích příhod) a klinické vyšetření.
Stejně jako u všech injekčních vakcín má být pro případ anafylaktické příhody po podání vakcíny vždy okamžitě k dispozici odpovídající lékařská léčba a dohled.
Protilátková odpověď u pacientů s endogenní nebo iatrogenní imunosupresí může být nedostatečná.
Vakcína Fluarix Tetra není účinná proti všem možným kmenům chřipky. Vakcína Fluarix Tetra má poskytovat ochranu proti kmenům virů, ze kterých je připravená, a proti kmenům blízce příbuzným.
Stejně jako u jiných vakcín nemusí být imunitní odpověď vyvolána u všech očkovaných osob.
Vakcína Fluarix Tetra se za žádných okolností nesmí podat intravaskulárně.
Stejně jako jiné intramuskulárně podávané vakcíny se i vakcína Fluarix Tetra musí podávat s opatrností osobám s trombocytopenií nebo jakoukoli poruchou koagulace, protože u těchto osob může po intramuskulárním podání dojít ke krvácení.
Po jakémkoli očkování, nebo dokonce i před ním, může u některých osob dojít k synkopě (ztrátě vědomí), a to zejména u dospívajících pacientů s psychogenní reakcí na injekční jehlu. Tato reakce může být v období rekonvalescence doprovázena závažnými neurologickými příznaky, jako je přechodná porucha zraku, parestezie a tonicko-klonické záškuby končetin. Je důležité, aby očkování probíhalo za takových podmínek, aby se předcházelo poranění v průběhu případné ztráty vědomí.
Interference se sérologickými testy
Viz bod 4.5.
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) v jedné dávce, je tedy prakticky bez sodíku.
Tento léčivý přípravek obsahuje méně než 1 mmol draslíku (39 mg) v jedné dávce, je tedy prakticky bez draslíku.
-
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Vakcína Fluarix Tetra může být u jedinců od 50 let věku podána současně s pneumokokovými polysacharidovými vakcínami (viz bod 5.1).
Pokud je potřeba vakcínu Fluarix Tetra podávat současně s jinou injekční vakcínou, je třeba tyto vakcíny podat vždy do různých injekčních míst.
Četnost výskytu bolesti v místě vpichu hlášené u osob očkovaných současně inaktivovanou kvadrivalentní chřipkovou vakcínou (D-QIV) a 23valentní pneumokokovou polysacharidovou vakcínou (PPV23) je podobná četnosti pozorované při očkování samotnou PPV23 vakcínou a vyšší než při očkování samotnou D-QIV vakcínou.
Po očkování proti chřipce byly pozorovány falešně pozitivní výsledky sérologických testů používajících metodu ELISA k detekci protilátek proti viru HIV1, hepatitidy C a zejména HTLV1. Falešně pozitivní výsledky testů ELISA lze vyvrátit pomocí techniky Western Blot. Přechodné falešně pozitivní reakce se mohou objevit v důsledku protilátkové IgM odpovědi na vakcínu.
4.6 Fertilita, těhotenství a kojení
Těhotenství
Inaktivované vakcíny proti chřipce lze použít ve všech stadiích těhotenství. Rozsáhlá databáze týkající se bezpečnosti je dostupná pro druhý a třetí trimestr (ve srovnání s prvním trimestrem), údaje z používání z celého světa však nenaznačují, že by inaktivovaná vakcína proti chřipce negativně ovlivňovala fetální vývoj nebo zdravotní stav matky.
Kojení
Vakcínu Fluarix Tetra lze použít v průběhu kojení.
Fertilita
Údaje týkající se fertility nejsou k dispozici.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Vakcína Fluarix Tetra nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Klinické studie
Souhrn bezpečnostního profilu
Ve všech věkových skupinách byla nejčastěji hlášeným lokálním nežádoucím účinkem po očkování bolest v místě vpichu injekce (15,6 % až 40,9 %).
U dospělých ve věku 18 let a starších byly nejčastěji hlášenými nežádoucími účinky po očkování únava (11,1 %), bolest hlavy (9,2 %) a myalgie (11,8 %).
U subjektů ve věku od 6 do 17 let byly nejčastěji hlášenými nežádoucími účinky po očkování únava (12,6 %), myalgie (10,9 %) a bolest hlavy (8,0 %).
U subjektů ve věku od 3 do 5 let byly nejčastěji hlášenými obecnými nežádoucími účinky po očkování ospalost (9,8 %) a iritabilita (11,3 %).
U subjektů ve věku od 6 měsíců do 3 let byly nejčastěji hlášenými obecnými nežádoucími účinky po očkování podrážděnost/úzkostlivost (14,9 %) a ztráta chuti k jídlu (12,9 %).
Tabulkový seznam nežádoucích účinků
Nežádoucí účinky hlášené u vakcíny Fluarix Tetra v různých věkových skupinách jsou uvedeny podle následujících kategorií četností na jednu dávku:
Velmi časté: (> 1/10)
Časté: (> 1/100 až < 1/10)
Méně časté: (> 1/1 000 až < 1/100)
Vzácné: (> 1/10 000 až < 1/1 000)
Velmi vzácné: (< 1/10 000)
Dospělí
Klinická studie s vakcínou Fluarix Tetra u dospělých hodnotila výskyt nežádoucích účinků u subjektů ve věku > 18 let, které dostaly jednu dávku vakcíny Fluarix Tetra (N = 3 036) nebo vakcíny Fluarix (N = 1 010).
Byly hlášeny následující nežádoucí účinky na jednu dávku:
| Třídy orgánových systémů | Četnost | Nežádoucí účinky |
| Poruchy nervového systému | časté | bolest hlavy |
| méně časté | závrať1 | |
| Gastrointestinální poruchy | časté | gastrointestinální příznaky (zahrnující nauzeu, zvracení, průjem a/nebo bolest břicha) |
| Poruchy kůže a podkožní tkáně | časté | '2 pocení2 |
| Poruchy svalové a kosterní soustavy a pojivové tkáně | velmi časté | myalgie |
| časté | artralgie | |
| Celkové poruchy a reakce v místě aplikace | velmi časté | bolest v místě vpichu injekce, únava |
| časté | zarudnutí v místě vpichu injekce, otok v místě vpichu injekce, třesavka, horečka, zatvrdnutí v místě vpichu injekce2 | |
| méně časté | hematom v místě vpichu injekce1, pruritus v místě vpichu injekce1 |
1Nežádoucí účinek hlášený spontánně
2Nežádoucí účinek hlášený v předchozích studiích s vakcínou Fluarix
Děti od 6 měsíců do < 18 let věku
Reaktogenita a bezpečnost vakcíny Fluarix Tetra byly hodnoceny ve dvou klinických studiích u dětí, kterým byla podána nejméně jedna dávka vakcíny Fluarix Tetra nebo kontrolní vakcíny.
První studie zahrnovala děti od 3 do < 18 let věku, které dostaly Fluarix Tetra (N = 915) nebo Fluarix (N = 912). Druhá studie zahrnovala děti od 6 měsíců do < 36 měsíců věku, které dostaly Fluarix Tetra (N =6 006) nebo nechřipkovou kontrolní vakcínu (N = 6 012) (viz Farmakodynamické vlastnosti).
Byly hlášeny následující nežádoucí účinky na jednu dávku:
| Třídy orgánových systémů | Nežádoucí účinky | Četnost | ||
| 6 až <36 (měsíců) | 3 až <6 (let) | 6 až <18 (let) | ||
| Poruchy metabolismu a výživy | ztráta chuti k jídlu | velmi časté | časté | N/A |
| Psychiatrické poruchy | podrážděnost/úzkostlivost | velmi časté | velmi časté | N/A |
| Poruchy nervového | ospalost | velmi časté | časté | N/A |
| systému | bolest hlavy | N/A | N/A | časté |
| Gastrointestinální poruchy | gastrointestinální příznaky (zahrnující nauzeu, průjem, zvracení a/nebo bolest břicha) | N/A | N/A | časté |
| Poruchy kůže | vyrážka1 | N/R | méně časté | méně časté |
| a podkožní tkáně | ||||
| Poruchy svalové a kosterní soustavy a pojivové tkáně | myalgie | N/A | N/A | velmi časté |
| artralgie | N/A | N/A | časté | |
| Celkové poruchy a reakce v místě aplikace | horečka (> 38,0 °C) | časté | časté | časté |
| únava | N/A | N/A | velmi časté | |
| bolest v místě vpichu injekce | velmi časté | velmi časté | velmi časté | |
| zarudnutí v místě vpichu injekce | velmi časté | velmi časté | velmi časté | |
| otok v místě vpichu injekce | časté | velmi časté | velmi časté | |
| třesavka | N/A | N/A | časté | |
| pruritus v místě vpichu injekce1 | N/R | méně časté | méně časté | |
| zatvrdnutí v místě vpichu injekce2 | N/A | časté | časté |
N/A = V této věkové skupině nebylo vyžadováno
N/R = Nehlášeno
1Nežádoucí účinek hlášený spontánně
2Nežádoucí účinek hlášený v předchozích studiích s vakcínou Fluarix
Údaje po uvedení přípravku na trh
Následující nežádoucí účinky byly pozorovány po uvedení vakcín Fluarix a/nebo Fluarix Tetra na trh1.
| Třídy orgánových systémů | Četnost | Nežádoucí účinky |
| Poruchy krve a lymfatického systému | vzácné | přechodná lymfadenopatie |
| Poruchy imunitního systému | vzácné | alergické reakce (včetně anafylaktických reakcí) |
| Poruchy nervového systému | vzácné | neuritida, akutní diseminovaná encefalomyelitida, Guillainův-Barréův syndrom 2* |
| Poruchy kůže a podkožní tkáně | vzácné | kopřivka, pruritus, erytém, angioedém |
| Celkové poruchy a reakce v místě aplikace | vzácné | onemocnění podobné chřipce, malátnost |
1 Tři kmeny obsažené ve vakcíně Fluarix jsou rovněž součástí vakcíny Fluarix Tetra.
2Po očkování vakcínami Fluarix a Fluarix Tetra byla zaznamenána spontánní hlášení Guillainova-Barréova syndromu, kauzální vztah mezi vakcinací a Guillainovým-Barréovým syndromem však nebyl stanoven.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
webové stránky: .
4.9 Předávkování
Neočekává se, že by předávkování mělo nějaké nepříznivé účinky.
5.
FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: vakcína proti chřipce, ATC kód: J07BB02
Mechanismus účinku
Vakcína Fluarix Tetra poskytuje aktivní imunizaci proti čtyřem kmenům viru chřipky (dva subtypy A dva typy B) obsaženým v této vakcíně.
Vakcína Fluarix Tetra indukuje tvorbu humorálních protilátek proti hemaglutininům. Tyto protilátky neutralizují viry chřipky.
Specifické hladiny titru hemaglutinačně inhibičních (HI) protilátek po očkování inaktivovaným virem chřipky nebyly korelovány s ochranou proti chřipce, ale titry HI protilátek byly použity k měření aktivity vakcíny. V některých studiích vystavení antigenu u člověka byl titr HI protilátek > 1:40 spojován s ochranou proti onemocnění chřipkou až u 50 % subjektů.
Farmakodynamické účinky
Účinnost u dětí od 6 do 35 měsíců věku:
Účinnost vakcíny Fluarix Tetra byla hodnocena v klinické studii D-QIV-004, randomizované, pro pozorovatele zaslepené, kontrolované nechřipkovou vakcínou, provedené v chřipkových sezónách 2011 až 2014. Zdravé subjekty od 6 měsíců do 35 měsíců věku byly randomizovány (1:1) do skupin, kterým byla podána buď vakcína Fluarix Tetra (N = 6 006), nebo nechřipková kontrolní vakcína (N = 6 012). Zúčastněným subjektům byla podána 1 dávka (pokud byly již v minulosti očkovány proti chřipce) nebo 2 dávky s odstupem přibližně 28 dní.
Účinnost vakcíny Fluarix Tetra byla hodnocena v prevenci chřipky A a/nebo B (středně závažné až závažné a jakkoli závažné) způsobené jakýmkoli sezónním virem chřipky, potvrzené polymerázovou řetězovou reakcí s reverzní transkripcí (RT-PCR). V období od 2 týdnů po očkování do konce chřipkové sezóny (přibližně za 6 měsíců) byly v případě onemocnění s podezřením na chřipku prováděny výtěry z nosu, které byly testovány na chřipku A a/nebo B pomocí RT-PCR. U všech vzorků s pozitivním výsledkem RT-PCR bylo dále provedeno testování životaschopnosti na buněčné kultuře a stanovení, jestli virové kmeny odpovídají kmenům obsaženým ve vakcíně.
Vakcína Fluarix Tetra dosáhla předem určených kritérií primární a sekundární účinnosti vakcíny uvedených v Tabulce 1.
Tabulka 1: Fluarix Tetra: výskyt onemocnění a účinnost vakcíny u dětí od 6 do 35 měsíců věku [ATP (according to protocol = podle protokolu) kohorta pro testování účinnosti – doba do onemocnění]
| Fluari | Tetra | Aktivní komparátor1 | Účinnost vakcíny | |||||
| N2 | n3 | Výskyt onemocnění (n/N) (%) | N2 | n3 | Výskyt onemocnění (n/N) (%) | % | CI | |
| Chřipka jakékoli závažnosti6 | ||||||||
| Potvrzená RT-PCR | 5 707 | 344 | 6,03 | 5 697 | 662 | 11,62 | 49,8 | 41,8; 56,84 |
| Potvrzená kultivací | 5 707 | 303 | 5,31 | 5 697 | 602 | 10,57 | 51,2 | 44,1; 57,65 |
| Kmeny odpovídající kmenům ve vakcíně potvrzené kultivací | 5 707 | 88 | 1,54 | 5 697 | 216 | 3,79 | 60,1 | 49,1; 69,05 |
| Středně závažná až závažná chřipka7 | ||||||||
| Potvrzená RT -PCR | 5 707 | 90 | 1,58 | 5 697 | 242 | 4,25 | 63,2 | 51,8; 72,34 |
| Potvrzená kultivací | 5 707 | 79 | 1,38 | 5 697 | 216 | 3,79 | 63,8 | 53,4; 72,25 |
| Kmeny odpovídající kmenům ve vakcíně potvrzené kultivací | 5 707 | 20 | 0,35 | 5 697 | 88 | 1,54 | 77,6 | 64,3; 86,65 |
| Onemocnění dolních cest dýchacích potvrzeno RT-PCR | 5 707 | 28 | 0,49 | 5 697 | 61 | 1,07 | 54,0 | 28,9; 71,05 |
| Akutní otitis media potvrzená RT PCR | 5 707 | 12 | 0,21 | 5 697 | 28 | 0,49 | 56,6 | 16,7; 78,85 |
CI: Interval spolehlivosti
1Dětem byla podána nechřipková kontrolní vakcína odpovídající jejich věku
2Počet subjektů zahrnutých v ATP kohortě pro testování účinnosti – doba do onemocnění. Tato kohorta zahrnovala subjekty, které splnily všechna kritéria pro zařazení, které byly sledovány z pohledu účinnosti a byly v souladu s protokolem až do propuknutí onemocnění.
3Počet subjektů, u kterých byl ve sledovaném období nahlášen alespoň jeden případ.
4Oboustranný 97,5% interval spolehlivosti
5Oboustranný 95% interval spolehlivosti
6Chřipka jakékoli závažnosti byla definována jako epizoda onemocnění podobného chřipce (tj. horečka > 38 °C s jakýmkoli z následujících příznaků: kašel, rýma, nazální překrvení nebo dýchací obtíže) nebo následek onemocnění virem chřipky [akutní otitis media (AOM) nebo onemocnění dolních cest dýchacích].
7Středně závažná až závažná chřipka byla podskupinou jakékoli chřipky s jakýmkoli z následujících příznaků: horečka > 39 °C, AOM diagnostikovaná lékařem, infekce dolních cest dýchacích diagnostikovaná lékařem, závažné extrapulmonální komplikace diagnostikované lékařem, hospitalizace na jednotce intenzivní péče nebo nutnost podpůrného podávání kyslíku po dobu více než 8 hodin.
U kohorty všech očkovaných subjektů zahrnující 12 018 subjektů (N = 6 006 Fluarix Tetra, N = 6 012 kontrola) byly provedeny explorační analýzy. Vakcína Fluarix Tetra byla účinná v prevenci středně závažné až závažné chřipky způsobené jakýmkoli ze 4 kmenů (Tabulka 2), a to i přes významný antigenní nesoulad mezi 2 vakcínovými kmeny (A/H3N2 a B/Victoria).
Tabulka 2: Fluarix Tetra: výskyt onemocnění a účinnost vakcíny u středně závažné až závažné chřipky subtypu A chřipky linie B u dětí od 6 do 35 měsíců věku potvrzené RT-PCR (kohorta všech očkovaných subjektů)
| Fluarix | Tetra | Aktivní komparátor1 | Účinnost vakcíny | |||||
| Kmen | N2 | n3 | Výskyt onemocnění (n/N) (%) | N2 | n3 | Výskyt onemocnění (n/N) (%) | % | 95% CI |
| A | ||||||||
| H1N14 | 6 006 | 13 | 0,22 | 6 012 | 46 | 0,77 | 72,1 | 49,9; 85,5 |
| H3N25 | 6 006 | 53 | 0,88 | 6 012 | 112 | 1,86 | 52,7 | 34,8; 66,1 |
| B | ||||||||
| Victoria6 | 6 006 | 3 | 0,05 | 6 012 | 15 | 0,25 | 80,1 | 39,7; 95,4 |
| Yamagata7 | 6 006 | 22 | 0,37 | 6 012 | 73 | 1,21 | 70,1 | 52,7; 81,9 |
1Dětem byla podána nechřipková kontrolní vakcína odpovídající jejich věku
2Počet subjektů zahrnutých v kohortě všech očkovaných subjektů
3Počet subjektů, u kterých byl ve sledovaném období nahlášen alespoň jeden případ
4 až 7Podíl antigenně shodných kmenů byl 84,8 % pro A/H1N1, 2,6 % pro A/H3N2, 14,3 % pro B/Victoria a 66,6 % pro B/Yamagata.
U případů jakékoli závažnosti potvrzených RT-PCR navíc vakcína Fluarix Tetra snížila riziko nutnosti návštěvy praktického lékaře o 47 % [relativní riziko (RR): 0,53 (95% CI: 0,46; 0,61), tj. 310 návštěv proti 583 návštěvám] a návštěvy pohotovosti o 79 % [RR: 0,21 (95% CI: 0,09; 0,47), tj. 7 návštěv proti 33 návštěvám]. Podání antibiotik bylo sníženo o 50 % [RR: 0,50 (95% CI: 0,42; 0,60), tj.
172 subjektů proti 341 subjektům].
Účinnost u dospělých ve věku 18 až 64 let
Klinická studie provedená u více než 7 600 subjektů v České republice a Finsku hodnotila účinnost vakcíny Fluarix v prevenci případů kultivačně potvrzené chřipky typu A a/nebo B pro kmeny antigenně shodné s kmeny ve vakcíně.
Subjekty byly monitorovány s ohledem na onemocnění podobné chřipce, aby mohlo být potvrzeno kultivačně (výsledky viz Tabulka 3). Onemocnění podobné chřipce bylo definováno jako alespoň jeden obecný příznak (horečka > 37,8°C a/nebo myalgie) a alespoň jeden respirační příznak (kašel a/nebo bolest v krku).
Tabulka 3: Výskyt onemocnění a účinnost vakcíny proti onemocnění souvisejícímu s průkazem infekce chřipky typu A nebo B u dospělých ve věku od 18 do 64 let (kohorta všech očkovaných subjektů)
| Výskyt onemocnění (n/N)1 | Účinnost vakcíny (95% CI2) | |||||
| N | n | % | % | LL3 | UL | |
| Antigenní shoda, kultivačně potvrzená chřipka4 | ||||||
| Fluarix™ | 5 103 | 49 | 1,0 | 66,9 | 51,9 | 77,4 |
| Placebo | 2 549 | 74 | 2,9 | - | - | - |
| Všechny chři | pky potvrzené kultivačně (se shodou, bez shody nebo bez stanovení typu | viru)5 | ||||
| Fluarix™ | 5 103 | 63 | 1,2 | 61,6 | 46,0 | 72,8 |
| Placebo | 2 549 | 82 | 3,2 | – | – | – |
1n/N: počet případů/celkový počet subjektů
2CI: interval spolehlivosti
3LL: dolní limit
4Nebyly kultivačně potvrzené případy chřipky odpovídající kmenům chřipky typu A/New Caledonia/20/1999 (H1N1) nebo B/Malaysia/2506/2004 ve skupině s vakcínou Fluarix nebo placebem 5Z 22 dalších případů bylo 18 bez shody a 4 bez určení typu; 15 z 22 případů bylo A (H3N2) (11 případů ve skupině s vakcínou Fluarix a 4 případy ve skupině s placebem).
V této studii byla hodnocena rovněž imunogenicita.
Tabulka 4: Postvakcinační GMT a výskyt sérokonverze
| Dospělí ve věku od 18 do 64 let | Fluarix1 N = 291 |
| GMT (95% CI) | |
| A/H1N1 | 541,0 (451,0; 649,0) |
| A/H3N2 | 133,2 (114,6; 154,7) |
| B (Victoria) | 242,8 (210,7; 279,7) |
| Výskyt sérokonverze (95% CI) | |
| A/H1N1 | 76,3 % (71,0; 81,1) |
| A/H3N2 | 73,9 % (68,4; 78,8) |
B (Victoria)_____________________________
85,2 % (80,6; 89,1)
1obsahuje A/H1N1, A/H3N2 a B (linie Victoria)
Výskyt séroprotekce byl 97,6 % proti A/H1N1, 86,9 % proti A/H3N2 a 96,2 % proti B (Victoria).
Imunogenicita u dětí a u dospělých:
Imunogenicita vakcíny Fluarix Tetra byla hodnocena na základě geometrického průměru titrů HI protilátek (GMT) stanovených 28 dní po poslední dávce (u dětí) nebo v den 21 (u dospělých) a na základě míry sérokonverze HI (4násobné zvýšení recipročního titru nebo změna z nedetekovatelného [< 10] na reciproční titr > 40).
Ve studii D-QIV-004 (děti od 6 do 35 měsíců věku) bylo provedeno hodnocení u podskupiny 1 332 dětí (753 ze skupiny s vakcínou Fluarix Tetra a 579 z kontrolní skupiny). Výsledky jsou uvedeny v Tabulce 5.
Účinek dvoudávkového základního očkovacího schématu ze studie D-QIV-004 byl hodnocen posouzením imunitní odpovědi po revakcinaci vakcínou Fluarix Tetra s odstupem 1 roku v rámci studie D-QIV-009. Tato studie prokázala, že u dětí od 6 do 35 měsíců věku byla 7 dní po očkování vyvolána imunitní paměť na všechny čtyři kmeny obsažené ve vakcíně.
Imunogenicitní non-inferiorita vakcíny Fluarix Tetra byla hodnocena proti vakcíně Fluarix u dětí ve studii D-QIV-003 (přibližně 900 dětí od 3 do < 18 let věku v každé léčebné skupině, ve které dostaly jednu nebo dvě dávky jedné nebo druhé vakcíny) a u dospělých ve studii D-QIV-008 (přibližně 1 800 subjektů od 18 let věku, které dostaly 1 dávku vakcíny Fluarix Tetra a přibližně 600 subjektů, které dostaly 1 dávku vakcíny Fluarix). V obou studiích vyvolala vakcína Fluarix Tetra imunitní odpověď na tři společné kmeny, která byla non-inferiorní k vakcíně Fluarix a superiorní imunitní odpověď na dodatečný kmen B obsažený ve vakcíně Fluarix Tetra. Výsledky jsou uvedeny v Tabulce 5.
Tabulka 5: Fluarix Tetra: postvakcinační GMT a míra sérokonverze (SCR) u dětí (6–35 měsíců věku; 3 až < 18 let věku) a dospělých od 18 let věku (kohorta podle protokolu)
| Děti od 6 do 35 měsíců věku (D-QIV-004) | ||||
| Fluarix Tetra | Kontrola1 | |||
| N = 750–753 | N'= 742–746 | N = 578–579 | N' = 566–568 | |
| GMT2 (95% CI) | Míra sérokonverze2 (95% CI) | GMT2 (95% CI) | Míra sérokonverze2 (95% CI) | |
| A/H1N1 | 165,3 (148,6; 183,8) | 80,2 % (77,2; 83,0) | 12,6 (11,1; 14,3) | 3,5 % (2,2; 5,4) |
| A/H3N2 | 132,1 (119,1; 146,5) | 68,8 % (65,3; 72,1) | 14,7 (12,9; 16,7) | 4,2 % (2,7; 6,2) |
| B (Victoria) | 92,6 (82,3; 104,1) | 69,3 % (65,8; 72,6) | 9,2 (8,4; 10,1) | 0,9 % (0,3; 2,0) |
| B (Yamagata) | 121,4 (110,1; 133,8) | 81,2 % (78,2; 84,0) | 7,6 (7,0; 8,3) | 2,3 % (1,2; 3,9) |
| Děti od 3 do < 18 let věku (D-QIV-003) | ||||
| Fluarix Tetra | Fluarix3 | |||
| N = 791 | N' = 790 | N = 818 | N' = 818 | |
| GMT (95% CI) | Míra sérokonverze (95% CI) | GMT (95% CI) | Míra sérokonverze (95% CI) | |
| A/H1N1 | 386,2 (357,3; 417,4) | 91,4 % (89,2; 93,3) | 433,2 (401,0; 468,0) | 89,9 % (87,6; 91,8) |
| A/H3N2 | 228,8 (215,0; 243,4) | 72,3 % (69,0; 75,4) | 227,3 (213,3; 242,3) | 70,7 % (67,4; 73,8) |
| B (Victoria) | 244,2 (227,5; 262,1) | 70,0 % (66,7; 73,2) | 245,6 (229,2; 263,2) | 68,5 % (65,2; 71,6) |
| B (Yamagata) | 569,6 (533,6; 608,1) | 72,5 % (69,3; 75,6) | 224,7 (207,9; 242,9) | 37,0 % (33,7; 40,5) |
| Dospělí od 18 let věku (D-QIV-008) | ||||
| Fluarix Tetra | Fluarix3 | |||
| N = 1809 | N' = 1801 | N = 608 | N' = 605 | |
| GMT (95% CI) | Míra sérokonverze (95% CI) | GMT (95% CI) | Míra sérokonverze (95% CI) | |
| A/H1N1 | 201,1 (188,1; 215,1) | 77,5 % (75,5; 79,4) | 218,4 (194,2; 245,6) | 77,2 % (73,6; 80,5) |
| A/H3N2 | 314,7 (296,8; 333,6) | 71,5 % (69,3; 73,5) | 298,2 (268,4; 331,3) | 65,8 % (61,9; 69,6) |
| B (Victoria) | 404,6 (386,6; 423,4) | 58,1 % (55,8; 60,4) | 393,8 (362,7; 427,6) | 55,4 % (51,3; 59,4) |
| B (Yamagata) | 601,8 (573,3; 631,6) | 61,7 % (59,5; 64,0) | 386,6 (351,5; 425,3) | 45,6 % (41,6; 49,7) |
N = Počet subjektů s dostupnými postvakcinačními výsledky (pro GMT)
N' = Počet subjektů s dostupnými jak prevakcinačními, tak postvakcinačními výsledky (pro SCR) 1nechřipková kontrolní vakcína 2výsledky z podskupiny pro imunogenicitu 3B (Yamagata) kmen není součástí vakcíny Fluarix
Současné podávání s pneumokokovými polysacharidovými vakcínami
V klinické studii D-QIV-010, do které bylo zahrnuto 356 dospělých > 50 let věku, u kterých bylo riziko komplikací chřipky a pneumokokových onemocnění, byly subjektům podány vakcína Fluarix Tetra a 23valentní pneumokoková polysacharidová vakcína (PPV23), a to buď obě vakcíny současně, nebo každá zvlášť. Imunitní odpověď na všechny čtyři kmeny obsažené ve vakcíně Fluarix Tetra a šest pneumokokových sérotypů (1, 3, 4, 7F, 14 a 19A) obsažených ve vakcíně PPV23, která byla hodnocena v předem specifikované primární analýze, byla mezi oběma léčebnými skupinami non-inferiorní. Podle deskriptivní analýzy provedené pro šest dalších pneumokokových sérotypů obsažených ve vakcíně (5, 6B, 9V, 18C, 19F a 23F) byla imunitní odpověď u obou skupin srovnatelná, a to 91,7 % až 100 % subjektů s dosaženou séroprotektivní hladinou proti uvedeným sérotypům ve skupině se samostatným podáním a 90,7 % až 100 % ve skupině se současným podáním obou vakcín.
5.2 Farmakokinetické vlastnosti
Neuplatňuje se.
5.3 Předklinické údaje vztahující se k bezpečnosti
Neklinické údaje získané na základě konvenčních farmakologických studií akutní toxicity, lokální snášenlivosti, toxicity po opakovaném podávání a reprodukční/vývojové toxicity neodhalily žádné zvláštní riziko pro člověka.
6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek
Chlorid sodný, dodekahydrát hydrogenfosforečnanu sodného, dihydrogenfosforečnan draselný, chlorid draselný, hexahydrát chloridu hořečnatého, tokoferol-hydrogen-sukcinát alfa, polysorbát 80, oktoxinol 10 a voda pro injekci.
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
1 rok.
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C – 8 °C).
Chraňte před mrazem.
Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení 0,5 ml injekční suspenze v předplněné injekční stříkačce (sklo třídy I) s pístem (šedá butylová pryž), s jehlami nebo bez jehel v následujících velikostech balení:
-
– s 1 jehlou: v balení po 1 nebo po 10;
-
– se 2 jehlami: v balení po 1;
-
– bez jehel: v balení po 1 nebo po 10.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Vakcína má mít před aplikací pokojovou teplotu.
Před aplikací protřepejte. Před podáním vizuálně zkontrolujte.
Pokyny k podání vakcíny v předplněné injekční stříkačce
Připojení jehly k injekční stříkačce viz níže přiložený nákres.
Jehla
Ochranný kryt jehly
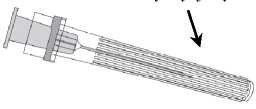
Injekční stříkačka
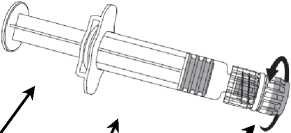
Tělo stříkačky Kryt stfíkačky
-
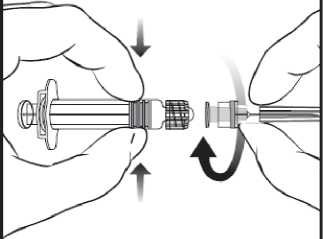
1. V jedné ruce držte tělo stříkačky (aniž byste držel(a) píst stříkačky) a kryt stříkačky odšroubujte otáčením proti směru hodinových ručiček.
-
2. Jehlu ke stříkačce připevníte tak, že budete jehlou nasazenou na stříkačku otáčet po směru hodinových ručiček, dokud se nezamkne (viz obrázek).
-
3. Pak odstraňte ochranný kryt jehly, což může jít někdy poněkud ztuha.
-
4. Aplikujte vakcínu.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Biologicals s.a.
Rue de Tlnstitute 89,
1330 Rixensart, Belgie.
8. REGISTRAČNÍ ČÍSLO(A)
59/145/14-C
Další informace o léčivu FLUARIX TETRA
Jak
se FLUARIX TETRA
podává: intramuskulární podání - injekční suspenze v předplněné injekční stříkačce
Výdej
léku: na lékařský předpis
Balení: Předplněná injekční stříkačka
Velikost
balení: 1X0,5ML I
Držitel rozhodnutí o registraci daného léku v České republice:
GlaxoSmithKline Biologicals S.A., Rixensart
E-mail: cz.info@gsk.com
Telefon: 222 001 111
