Souhrnné informace o léku - ERLOTINIB TEVA B. V.
1. NÁZEV PŘÍPRAVKU
Erlotinib Teva B. V. 100 mg potahované tablety
Erlotinib Teva B. V. 150 mg potahované tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna potahovaná tableta obsahuje erlotinibum 100 mg (jako erlotinibi hydrochloridum). Jedna potahovaná tableta obsahuje erlotinibum 150 mg (jako erlotinibi hydrochloridum).
Pomocné látky se známým účinkem:
100 mg: Jedna potahovaná tableta obsahuje 83,77 mg laktózy.
150 mg: Jedna potahovaná tableta obsahuje 125,65 mg laktózy.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Potahovaná tableta.
100 mg: Bílé, kulaté, bikonvexní potahované tablety o průměru 10 mm s jednotným vzhledem a neporušenými hranami, s vyraženým „A116“ na jedné straně.
150 mg: Bílé, kulaté, bikonvexní potahované tablety o průměru 11 mm s jednotným vzhledem a neporušenými hranami, s vyraženým „A127“ na jedné straně.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Nemalobuněčný karcinom plic (NSCLC):
Přípravek Erlotinib Teva B. V. je indikován v první linii léčby pacientů s lokálně pokročilým nebo metastazujícím nemalobuněčným karcinomem plic (NSCLC) s aktivujícími mutacemi EGFR. Přípravek Erlotinib Teva B. V. je také indikován k převedení na udržovací léčbu pacientů s lokálně pokročilým nebo metastazujícím NSCLC s aktivujícími mutacemi EGFR a stabilizací nemoci po standardní chemoterapii první linie.
Přípravek Erlotinib Teva B. V. je také indikován k léčbě pacientů s lokálně pokročilým nebo metastazujícím NSCLC v případě, že alespoň jednou došlo k selhání předchozí chemoterapeutické léčby.
Při předepisování přípravku Erlotinib Teva B. V. mají být brány v úvahu faktory spojené s prodloužením doby přežití.
U pacientů s nádory s IHC (imunohistochemickou) negativitou receptoru pro epidermální růstový faktor (epidermal growth factor receptor – EGFR) nebyl prokázán pozitivní efekt léčby na dobu přežití ani jiný klinicky významný účinek léčby (viz bod 5.1).
Karcinom pankreatu:
Přípravek Erlotinib Teva B. V. v kombinaci s gemcitabinem je indikován u pacientů s metastazujícím karcinomem pankreatu.
Při předepisování přípravku Erlotinib Teva B. V. je nutno vzít v úvahu faktory související s delším přežitím (viz body 4.2 a 5.1).
Výhoda delšího přežití nebyla prokázána u nemocných s lokálně pokročilým onemocněním.
4.2 Dávkování a způsob podání
Léčba přípravkem Erlotinib Teva B. V. má probíhat pod dohledem lékaře, který má zkušenosti s používáním protinádorových terapií.
Dávkování
Pacienti s nemalobuněčným karcinomem plic
Před zahájením léčby přípravkem Erlotinib Teva B. V. u pacientů s pokročilým nebo metastazujícím NSCLC dosud neléčených chemoterapií má být provedeno testování mutací EGFR.
Doporučená denní dávka přípravku Erlotinib Teva B. V. je 150 mg užitá nejméně jednu hodinu před nebo dvě hodiny po jídle.
Pacienti s karcinomem pankreatu
Doporučená denní dávka přípravku Erlotinib Teva B. V. je 100 mg užitá nejméně jednu hodinu před nebo dvě hodiny po jídle, v kombinaci s gemcitabinem (viz souhrn údajů o přípravku pro gemcitabin v indikaci karcinom pankreatu). U pacientů, u kterých se během prvních 4 – 8 týdnů léčby neobjeví kožní vyrážka, je nutno znovu zvážit další léčbu přípravkem Erlotinib Teva B. V. (viz bod 5.1). Pokud je nutné snížit dávkování, dávka by měla být snižována postupně po 50 mg (viz bod 4.4). Přípravek Erlotinib Teva B. V. je dostupný v silách 100 mg a 150 mg. Přípravek Erlotinib Teva B. V. není dostupný v silách 25 mg a 50 mg. V případě těchto dávek musíte použít jiné přípravky dostupné na trhu.
Při současném užívání substrátů a modulátorů CYP3A4 může být zapotřebí upravit dávkování (viz bod 4.5).
Pacienti s poruchou funkce jater
Erlotinib je metabolicky eliminován v játrech a vylučován do žluči. Přestože expozice erlotinibu byla u nemocných se středně těžkou poruchou funkce jater (skóre Child-Pugh 7– 9) podobná jako u nemocných s adekvátní funkcí jater, je nutná při podávání přípravku Erlotinib Teva B. V. nemocným s poruchou funkce jater zvýšená opatrnost. V případě výskytu těžkých nežádoucích účinků je nutno zvážit snížení dávky nebo přerušení léčby přípravkem Erlotinib Teva B. V. Bezpečnost a účinnost erlotinibu nebyla u pacientů s těžkou jaterní dysfunkcí (AST/SGOT a ALT/SGPT > 5 x horní hranice normy) dosud studována. Podávání přípravku Erlotinib Teva B. V. pacientům s těžkou jaterní dysfunkcí se nedoporučuje (viz bod 5.2).
Pacienti s poruchou funkce ledvin
Bezpečnost a účinnost erlotinibu u pacientů s poruchou funkce ledvin (koncentrace kreatininu v séru > 1,5násobek horní hranice normálních hodnot) nebyla dosud studována. Na základě údajů o farmakokinetice přípravku není u pacientů s lehkou nebo středně těžkou poruchou funkce ledvin nutné upravovat dávkování (viz bod 5.2). Užití přípravku Erlotinib Teva B. V. se nedoporučuje u pacientů s těžkou poruchou funkce ledvin.
Pediatrická populace
Bezpečnost a účinnost erlotinibu u dětí do 18 let nebyla dosud stanovena. Přípravek Erlotinib Teva B. V. se nedoporučuje podávat pediatrickým pacientům.
Kuřáci
Ukázalo se, že kouření cigaret snižuje expozici erlotinibu o 50–60 %. Maximální tolerovaná dávka erlotinibu u nemocných s NSCLC, kteří v současné době kouří cigarety, byla 300 mg. Účinnost a dlouhodobá bezpečnost dávky vyšší než je doporučená úvodní dávka dosud nebyla u nemocných, kteří nadále kouří cigarety, stanovena (viz bod 4.5 a 5.2). Stávajícím kuřákům proto má být doporučeno, aby přestali kouřit, protože plazmatické koncentrace erlotinibu jsou u kuřáků ve srovnání s nekuřáky redukovány.
4.3 Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Stanovení stavu mutace EGFR
Je důležité, aby při hodnocení stavu mutace EGFR u pacienta byla zvolena dobře validovaná a robustní metoda a byly tak vyloučeny falešně pozitivní nebo falešně negativní výsledky.
Kuřáci
Kuřákům je třeba doporučit přerušit kouření, protože u kuřáků jsou plazmatické koncentrace erlotinibu nižší než u nekuřáků. Toto snížení je pravděpodobně klinicky významné (viz bod 4.5).
Intersticiální plicní onemocnění
Případy podobné intersticiálnímu plicnímu onemocnění (interstitial lung disease, ILD), včetně fatálních případů, byly méně často popsány u pacientů užívajících erlotinib k léčbě nemalobuněčného karcinomu plic (NSCLC), karcinomu pankreatu nebo u jiných pokročilých solidních nádorů. V pivotní studii BR.21 u NSCLC byla incidence intersticiálního plicního onemocnění (0,8 %) u skupiny léčené erlotinibem stejná jako u skupiny, jíž bylo podáváno placebo. V metaanalýze randomizované kontrolované klinické studie nemalobuněčného plicního karcinomu (studie po vyloučení studií fáze I a jednoramenné fáze II kvůli nedostatku kontrolních skupin) byla incidence případů podobných ILD u pacientů léčených erlotinibem 0,9 % v porovnání s 0,4 % pacientů v kontrolním rameni. Ve studii karcinomu pankreatu, kdy byl podáván gemcitabin, byla u skupiny léčené erlotinibem a gemcitabinem incidence příhod podobných intersticiálnímu plicnímu onemocnění 2,5 %, ve srovnání s 0,4 % u skupiny, které bylo podáváno placebo a gemcitabin. U pacientů s podezřením na příhody podobné ILD byly hlášeny diagnózy zahrnující pneumonitidu, radiační pneumonitidu, hypersenzitivní pneumonitidu, intersticiální pneumonii, intersticiální plicní onemocnění, obliterující bronchiolitidu, plicní fibrózu, syndrom akutní respirační tísně (ARDS), alveolitidu a infiltraci plic. Příznaky se objevily po několika dnech až měsících po zahájení léčby erlotinibem. Časté byly doprovodné faktory přispívající ke zhoršení stavu onemocnění, jako současná nebo v předchozí době probíhající chemoterapie, předchozí radioterapie, preexistující parenchymatózní onemocnění plic, metastazující onemocnění plic nebo plicní infekce. Vyšší výskyt závažné ILD (přibližně 5 % s mortalitou 1,5 %) je zaznamenán ve studiích provedených v Japonsku.
U pacientů, u nichž došlo k akutnímu výskytu nových a/nebo progresivních nevysvětlených plicních symptomů jako dyspnoe, kašel a horečka, má být terapie erlotinibem přerušena až do vyhodnocení diagnózy. Pacienti léčeni současně erlotinibem a gemcitabinem mají být pečlivě sledováni z důvodu možnosti rozvoje toxicity připomínající intersticiální plicní onemocnění. Pokud je diagnostikováno ILD, je třeba podávání erlotinibu přerušit a zahájit potřebnou léčbu (viz bod 4.8).
Průjem, dehydratace, elektrolytová nerovnováha a renální selhání
Přibližně u 50 % pacientů užívajících erlotinib se vyskytl průjem (včetně velmi vzácných případů, které končily úmrtím), který by ve středně těžké až těžké formě měl být léčen např. loperamidem. V některých případech může být nutné snížit dávku. V klinických studiích se dávky snižovaly postupně v krocích po 50 mg. Snižování dávek v krocích po 25 mg nebylo zkoumáno. V případě těžkého nebo přetrvávajícího průjmu, nauzey, anorexie nebo zvracení spojeného s dehydratací má být terapie erlotinibem přerušena a k léčbě dehydratace je třeba provést vhodná opatření (viz bod 4.8). Byly zaznamenány vzácné případy výskytu hypokalemie a renálního selhání (včetně fatálního). V některých případech se jednalo o následek těžké dehydratace při průjmu, zvracení a/nebo anorexii, jiné souvisely se souběžnou chemoterapií. V těžších nebo přetrvávajících případech průjmu, nebo v případech vedoucích k dehydrataci, zejména u pacientů s vyšším počtem rizikových faktorů (obzvlášť konkomitantní chemoterapie a další medikace, symptomy nebo onemocnění, nebo jiné predispozice včetně pokročilého věku), má být podávání přípravku Erlotinib Teva B. V. přerušeno, a mají být přijata odpovídající opatření k intenzivní intravenózní rehydrataci pacientů. Kromě toho mají být u nemocných s rizikem dehydratace sledovány funkce ledvin a sérové elektrolyty včetně koncentrací draslíku.
Hepatitida, jaterní selhání
Vzácně byly během podávání erlotinibu hlášeny případy jaterního selhání (včetně fatálního). Přitěžujícími faktory byly preexistující jaterní onemocnění nebo souběžná hepatotoxická léčba. U takových nemocných je proto nutné zvažovat pravidelné vyšetření jaterních testů. Při těžkých změnách jaterních funkcí je nutno přerušit podávání přípravku Erlotinib Teva B. V. (viz bod 4.8). Podávání přípravku Erlotinib Teva B. V. pacientům s těžkou jaterní dysfunkcí se nedoporučuje.
Perforace gastrointestinálního traktu
U pacientů, kterým je podáván erlotinib, je zvýšené riziko vzniku perforace gastrointestinálního traktu, která byla pozorována méně často (včetně několika případů, které končily úmrtím). Zvýšené riziko je u pacientů, kteří současně dostávají antiangiogenní léčivé přípravky, kortikosteroidy, nesteroidní protizánětlivé léčivé přípravky a/nebo chemoterapii s taxany, nebo kteří mají anamnézu peptického vředu nebo divertikulární nemoci. U pacientů, u kterých dojde k perforaci gastrointestinálního traktu, má být podávání přípravku Erlotinib Teva B. V. trvale ukončeno (viz bod 4.8).
Bulózní a exfoliativní poruchy kůže
Byly hlášeny bulózní, puchýřnaté nebo exfoliativní kožní změny, včetně velmi vzácných případů podezření na Stevensův-Johnsonův syndrom / toxickou epidermální nekrolýzu, které v některých případech byly fatální (viz bod 4.8). U pacientů, u kterých se rozvinou těžké bulózní, puchýřnaté nebo exfoliativní změny, má být léčba přípravkem Erlotinib Teva B. V. přerušena nebo ukončena. Pacienti s bulózními a exfoliativními poruchami kůže mají podstoupit vyšetření na kožní infekce a následné léčení dle místních doporučení.
Poruchy oka
Pacienti se známkami a symptomy vzbuzujícími podezření na keratitidu, jako jsou akutní nebo zhoršující se: zánět oka, slzení, citlivost na světlo, rozmazané vidění, bolest a/nebo zarudnutí oka, mají být neodkladně odesláni k oftalmologovi. Pokud je potvrzena diagnóza ulcerózní keratitidy, má být léčba přípravkem Erlotinib Teva B. V. přerušena nebo ukončena. Pokud je diagnostikována keratitida, má být pečlivě zvážen prospěch a rizika pokračující léčby. U pacientů s anamnézou keratitidy, ulcerózní keratitidy nebo těžké suchosti očí má být přípravek Erlotinib Teva B. V. používán s opatrností. Rizikovým faktorem keratitidy a ulcerace je rovněž používání kontaktních čoček. Při podávání erlotinibu byly hlášeny velmi vzácné případy perforace nebo ulcerace rohovky (viz bod 4.8).
Interakce s jinými léčivými přípravky
Silné induktory CYP3A4 mohou snižovat účinnost erlotinibu, zatímco silné inhibitory CYP3A4 mohou navodit jeho zvýšenou toxicitu. Je třeba se vyvarovat současné léčby látkami tohoto typu (viz bod 4.5).
Jiné formy interakcí
Pro erlotinib je charakteristická snížená rozpustnost při pH vyšším než 5. Léčivé přípravky, které ovlivňují pH v horní části trávicího traktu, jako jsou inhibitory protonové pumpy, H2 antagonisté a antacida, mohou ovlivnit rozpustnost erlotinibu, a tím jeho biologickou dostupnost. Není pravděpodobné, že by zvýšení dávky erlotinibu při současném podávání takových léků mohlo kompenzovat ztrátu expozice. Kombinace erlotinibu s inhibitory protonové pumpy se nemá používat. Dopady současného podávání erlotinibu s H2 antagonisty a antacidy nejsou známy, snížení biologické dostupnosti je však pravděpodobné. Tyto kombinace by se proto neměly používat (viz bod 4.5). Pokud je použití antacid během léčby přípravkem Erlotinib Teva B. V. považováno za nezbytné, antacida by se měla podávat nejméně 4 hodiny před nebo 2 hodiny po podání denní dávky přípravku Erlotinib Teva B. V.
Tablety obsahují laktózu a pacienti se vzácnými dědičnými problémy s intolerancí galaktózy, vrozeným nedostatkem laktázy nebo malabsorpcí glukózy a galaktózy by tento přípravek neměli užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Studie interakcí byly provedeny pouze u dospělých.
Erlotinib a jiné substráty CYP
Erlotinib je silným inhibitorem CYP1A1, středně silným inhibitorem CYP3A4 a CYP2C8 a současně silným inhibitorem glukuronidace účinkem UGT1A1 in vitro.
Fyziologický dopad silné inhibice CYP1A1 je z důvodu velmi omezené exprese CYP1A1 v lidských tkáních nejasný.
Pokud byl erlotinib podáván současně s ciprofloxacinem, středně účinným inhibitorem CYP1A2, významně vrostla expozice [AUC] erlotinibem o 39 %, nebyly však zjištěny významné změny Cmax. Podobně expozice aktivním metabolitem (AUC) vzrostla asi o 60 % a Cmax o 48 %. Klinický význam tohoto zvýšení nebyl stanoven. Při kombinaci erlotinibu s ciprofloxacinem nebo silným inhibitorem CYP1A2 (např. fluvoxamin) je třeba postupovat s opatrností. Pokud se vyskytnou nežádoucí účinky erlotinibu, jeho dávka může být snížena.
Předchozí nebo současné podávání erlotinibu nevedlo ke změnám clearance prototypických substrátů CYP3A4 midazolamu a erythromycinu, ale vedlo ke snížení perorální biologické dostupnosti midazolamu až o 24 %. V další klinické studii bylo prokázáno, že při současném podávání neovlivňuje erlotinib farmakokinetiku paklitaxelu, který je substrátem CYP3A4/2C8. Významné interakce s clearance jiných substrátů CYP3A4 nejsou proto pravděpodobné.
Inhibice glukuronidace může vyvolat interakce látek, které jsou substráty UGT1A1 a jsou odstraňovány výhradně touto cestou. U pacientů s nízkou expresí UGT1A1 nebo s geneticky podmíněnými poruchami glukuronidace (např. Gilbertova nemoc) může dojít ke zvýšení koncentrace bilirubinu v séru a musí být léčeni se zvýšenou opatrností.
U člověka je erlotinib metabolizován v játrech jaterními cytochromy, zejména CYP3A4 a v menší míře CYP1A2. Mimojaterní metabolizmus CYP3A4 ve střevě, CYP1A1 v plicích a CYP1B1 v nádorové tkáni rovněž teoreticky přispívá k metabolické clearance erlotinibu. Teoreticky může dojít k interakcím s léčivými látkami, které jsou metabolizovány pomocí těchto enzymů, eventuálně které jsou jejich inhibitory nebo induktory.
Silné inhibitory aktivity CYP3A4 snižují metabolismus erlotinibu a zvyšují jeho koncentrace v plazmě. V klinické studii, kdy byl podáván erlotinib společně s ketokonazolem (200 mg perorálně dvakrát denně po dobu 5 dní), který je silným inhibitorem CYP3A4, vedly ke zvýšení expozice erlotinibu (86 % AUC a 69 % Cmax). Proto je třeba postupovat se zvýšenou opatrností při kombinování erlotinibu a silných CYP3A4 inhibitorů, např. azolových antifungálních látek (např. ketokonazol, itrakonazol, vorikonazol), proteázových inhibitorů, erythromycinu nebo klarithromycinu. V případě nutnosti je možné dávku erlotinibu snížit, zejména pokud dochází k projevům toxicity.
Silné induktory aktivity CYP3A4 zvyšují metabolismus erlotinibu a signifikantně snižují koncentraci erlotinibu v plazmě. V klinické studii, kdy byl podáván erlotinib společně se silným induktorem CYP3A4 rifampicinem (600 mg perorálně jedenkrát denně po dobu 7 dnů), bylo zjištěno 69% snížení mediánu AUC erlotinibu. Po současném podání rifampicinu a jednorázové dávky 450 mg erlotinibu činila průměrná expozice (AUC) vůči erlotinibu 57,5 % hodnoty naměřené po jednorázovém podání 150 mg erlotinibu bez současného podání rifampicinu. Je proto nutné se vyvarovat současného podání přípravku Erlotinib Teva B. V. a induktorů CYP3A4. U nemocných, u kterých je nutná souběžná léčba přípravkem Erlotinib Teva B. V. a silnými induktory CYP3A4, jako je například rifampicin, je nutno zvážit zvýšení dávky erlotinibu na 300 mg při současném pečlivém sledování bezpečnosti (včetně sledování ledvinných a jaterních funkcí a elektrolytů v séru). V případě dobré tolerance po dobu delší než 2 týdny, může být zváženo zvýšení dávky na 450 mg při současném pečlivém sledování bezpečnosti. Ke snížení expozice erlotinibu může rovněž dojít s jinými induktory, např. s fenytoinem, karbamazepinem, s barbituráty nebo s přípravky obsahujícími třezalku tečkovanou (Hypericum perforatum). Při kombinování těchto léčivých látek s erlotinibem je třeba postupovat s opatrností. Měla by být zvážena alternativní léčba bez použití silných induktorů aktivity CYP3A4.
Erlotinib a kumarinová antikoagulancia
U pacientů léčených erlotinibem byly hlášeny interakce s antikoagulancii odvozenými od kumarinu, včetně warfarinu, vedoucí ke zvýšení mezinárodního normalizovaného poměru (INR, international normalized ratio) a krvácivé příhody, které v některých případech vedly k úmrtí. U pacientů užívajících od kumarinu odvozená antikoagulancia mají být pravidelně kontrolovány protrombinový čas a INR, zda nedošlo k jakýmkoli změnám v jejich hodnotách.
Erlotinib a statiny
Kombinace erlotinibu se statiny může zvýšit možnost vzniku statinem indukované myopatie, včetně rhabdomyolýzy, která byla pozorována vzácně.
Erlotinib a kuřáci
Výsledky farmakokinetické interakční studie naznačují, že po podání erlotinibu dochází u kuřáků ve srovnání s nekuřáky k signifikantnímu snížení AUCinf 2,8×, Cmax 1,5× a plazmatické koncentrace erlotinibu za 24 hodin 9násobně (viz bod 5.2). Proto je třeba pacientům, kteří nadále kouří, doporučit přestat s kouřením co možná nejdříve před zahájením léčby erlotinibem, jinak dojde k poklesu plazmatické koncentrace. Klinický efekt snížené expozice dosud nebyl formálně zhodnocen, ale je pravděpodobné, že je klinicky významný.
Erlotinib a inhibitory P-glykoproteinu Erlotinib je substrátem pro P-glykoprotein, transportní protein přenášející léčivé látky. Současné podávání inhibitorů P-glykoproteinu, např. cyklosporinu a verapamilu, může vést k pozměněné distribuci a/nebo eliminaci erlotinibu. Význam této interakce např. pro toxicitu k CNS nebyl dosud stanoven. V těchto situacích je třeba postupovat se zvýšenou opatrností.
Erlotinib a léčivé přípravky ovlivňující pH
Pro erlotinib je charakteristická snížená rozpustnost při pH vyšším než 5. Léčivé přípravky, které ovlivňují pH v horní části trávicího traktu tedy mohou ovlivnit rozpustnost erlotinibu, a tím jeho biologickou dostupnost. Současné podání erlotinibu s inhibitorem protonové pumpy omeprazolem vedlo ke snížení expozice [AUC] erlotinibu o 46 % a maximální koncentrace [Cmax] o 61 %. Nedošlo ke změně Tmax nebo poločasu. Souběžné podávání erlotinibu s 300 mg ranitidinu, antagonisty H2-receptorů, snížilo expozici erlotinibu [AUC] o 33 % a maximální koncentraci [Cmax] o 54 %. Toto snížení expozice při současném podávání s takovými látkami pravděpodobně nelze kompenzovat zvýšením dávky erlotinibu. Pokud však byl erlotinib podáván střídavě 2 hodiny před nebo 10 hodin po ranitidinu v dávce 150 mg 2× denně, klesly expozice erlotinibu [AUC] jen o 15 % a maximální koncentrace [Cmax] jen o 17 %. Účinek antacid na absorpci erlotinibu není znám, může však dojít ke zhoršení absorpce a tím ke snížení plazmatických hladin. V souhrnu, neměla by se užívat kombinace erlotinibu s inhibitory protonové pumpy. Pokud je použití antacid během léčby přípravkem Erlotinib Teva B. V. považováno za nezbytné, antacida by se měla podávat nejméně 4 hodiny před nebo 2 hodiny po podání denní dávky přípravku Erlotinib Teva B. V. Pokud je zvažováno použití ranitidinu, měl by být podáván střídavě, tedy přípravek Erlotinib Teva B. V. je nutno podat nejméně 2 hodiny před nebo 10 hodin po podání ranitidinu.
Erlotinib a gemcitabin
Ve studii fáze Ib nebyl pozorován žádný signifikantní vliv gemcitabinu na farmakokinetiku erlotinibu ani signifikantní vliv erlotinibu na farmakokinetiku gemcitabinu.
Erlotinib a karboplatina/paklitaxel
Erlotinib zvyšuje koncentraci platiny. V klinické studii vedlo současné podávání erlotinibu, karboplatiny a paklitaxelu ke zvýšení celkové AUC0–48 platiny o 10,6 %. Ačkoli je rozdíl statisticky významný, jeho velikost není považována za klinicky významnou. V klinické praxi se však mohou vyskytovat další faktory, které by mohly vést ke zvýšené expozici karboplatiny, jako je například porucha funkce ledvin. Nebyly pozorovány významné účinky karboplatiny a paklitaxelu na farmakokinetiku erlotinibu.
Erlotinib a kapecitabin
Kapecitabin může zvýšit koncentraci erlotinibu. Pokud byl erlotinib podáván současně s kapecitabinem, došlo ke statisticky významnému zvýšení AUC erlotinibu a hraničnímu zvýšení Cmax při porovnání s hodnotami zjištěnými v jiné studii při podávání samotného erlotinibu. Nebyly zaznamenány významné účinky erlotinibu na farmakokinetiku kapecitabinu.
Erlotinib a proteazomové inhibitory
Na základě mechanismu účinku proteazomových inhibitorů, včetně bortezomibu, lze očekávat vliv na účinek EGFR inhibitorů, zahrnujících také erlotinib. Tento vliv je doložen na základě omezených klinických údajů a preklinických studií, které prokazují EGFR degradaci prostřednictvím proteazomu.
4.6 Fertilita, těhotenství a kojení
Těhotenství
Nejsou k dispozici žádné adekvátní údaje týkající se použití erlotinibu u těhotných žen. Studie na zvířatech neprokázaly teratogenitu nebo abnormální porody. Negativní vliv na těhotenství však nelze vyloučit, protože studie na potkanech a králících ukázaly zvýšenou letalitu embryí/plodů (viz bod 5.3). Možné riziko pro člověka není známo.
Ženy ve fertilním věku
Ženy ve fertilním věku musí být upozorněny, že při užívání přípravku Erlotinib Teva B. V. nesmí dojít k otěhotnění. Během terapie a nejméně dva týdny po jejím ukončení je zapotřebí používat vhodné antikoncepční metody. V léčbě těhotných žen by mělo být pokračováno jen tehdy, jestliže možný prospěch z léčby pro matku převáží riziko pro plod.
Kojení
Není známo, zda se erlotinib vylučuje do lidského mateřského mléka. Kvůli možnému riziku pro kojence má být ženám užívajícím přípravek Erlotinib Teva B. V. doporučeno během terapie nekojit.
Fertilita
Studie na zvířatech neprokázaly zhoršenou fertilitu. Negativní vliv na fertilitu však nelze vyloučit, protože studie na zvířatech ukázaly vliv na reprodukční parametry (viz bod 5.3). Možné riziko pro člověka není známo.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Studie hodnotící vliv přípravku na schopnost řídit a obsluhovat stroje nebyly dosud provedeny; užívání erlotinibu však není spojeno se zhoršením mentálních schopností.
4.8 Nežádoucí účinky
Nemalobuněčný karcinom plic (erlotinib podávaný v monoterapii)
V randomizované dvojitě zaslepené studii (BR.21; erlotinib podáván jako léčba druhé linie) byly nejčastěji hlášenými nežádoucími účinky vyrážka (75 %) a průjem (54 %). Většina těchto nežádoucích účinků byla stupně závažnosti 1/2 bez nutnosti lékařské intervence. Vyrážka a průjem stupně 3/4 se vyskytly u 9 % resp. 6 % pacientů léčených erlotinibem a každý z těchto nežádoucích účinků byl příčinou přerušení léčby u 1 % nemocných. Snížení dávky kvůli vyrážce a průjmu bylo třeba provést u 6 % resp. 1 % pacientů. Ve studii BR.21 byl zjištěn medián časového období do výskytu vyrážky 8 dní a medián časového období do výskytu průjmu 12 dní. Obecně se kožní změny projevují jako lehká až středně těžká erytematózní nebo papulopustulózní vyrážka, která se může objevit nebo zhoršit v oblastech vystavených slunci. Pacientům vystaveným slunci je možno doporučit ochranný oděv nebo použití krémů chránících před sluncem (např. s minerálními filtry).
Nežádoucí účinky, které se u pacientů léčených v pivotní studii BR.21 s erlotinibem vyskytly častěji (> 3 %) než ve skupině, jíž bylo podáváno placebo a jejichž výskyt byl zaznamenán nejméně u 10 % pacientů ve skupině léčené erlotinibem, jsou podle NCI-CTC („National Cancer Institute-Common Toxicity Criteria“) shrnuty v tabulce 1.
Následující termíny vyjadřují frekvenci výskytu nežádoucích účinků: velmi časté (>1/10); časté (>1/100 až <1/10); méně časté (>1/1000 až <1/100); vzácné (>1/10000 až <1/1000); velmi vzácné (<1/10000) včetně ojedinělých hlášených případů.
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Tabulka 1: Velmi časté nežádoucí účinky zaznamenané ve studii BR.21
| erlotinib n = 485 | placebo n = 242 | |||||
| Stupeň dle NCI-CTC | Jakýkoli | 3 | 4 | Jakýkoli | 3 | 4 |
| stupeň | stupeň | |||||
| Preferovaný termín podle MedDRA | % | % | % | % | % | % |
| Celkový počet pacientů s jakýmkoli nežádoucím účinkem | 99 | 40 | 22 | 96 | 36 | 22 |
| Infekce a infestace Infekce* | 24 | 4 | 0 | 15 | 2 | 0 |
| Poruchy metabolismu a výživy Anorexie | 52 | 8 | 1 | 38 | 5 | <1 |
| Poruchy oka Keratoconjunctivitis sicca | 12 | 0 | 0 | 3 | 0 | 0 |
| Konjunktivitida | 12 | <1 | 0 | 2 | <1 | 0 |
| Respirační, hrudní a mediastinální poruchy Dyspnoe | 41 | 17 | 11 | 35 | 15 | 11 |
| Kašel | 33 | 4 | 0 | 29 | 2 | 0 |
| Gastrointestinální poruchy Průjem | 54 | 6 | <1 | 18 | <1 | 0 |
| Nauzea | 33 | 3 | 0 | 24 | 2 | 0 |
| Zvracení | 23 | 2 | <1 | 19 | 2 | 0 |
| Stomatitida | 17 | <1 | 0 | 3 | 0 | 0 |
| Bolest břicha | 11 | 2 | <1 | 7 | 1 | <1 |
| Poruchy kůže a podkožní tkáně Vyrážka | 75 | 8 | <1 | 17 | 0 | 0 |
| Svědění | 13 | <1 | 0 | 5 | 0 | 0 |
| Suchá kůže | 12 | 0 | 0 | 4 | 0 | 0 |
| Celkové poruchy a reakce v místě aplikace Únava | 52 | 14 | 4 | 45 | 16 | 4 |
* Závažné infekce (s neutropenií nebo bez neutropenie) zahrnovaly pneumonii, sepsi a celulitidu. Může vést k dehydrataci, hypokalemii a selhání ledvin.
Vyrážka zahrnovala akneiformní dermatitidu.
Ve dvou dalších dvojitě zaslepených, randomizovaných, placebem kontrolovaných studiích fáze III BO18192 (SATURN) a BO25460 (IUNO) byl erlotinib podáván jako udržovací léčba po chemoterapii první linie. Do těchto studií bylo zařazeno 1532 pacientů s pokročilým rekurentním nebo metastazujícím nemalobuněčným karcinomem plic následně po standardní chemoterapii první linie s platinou, přičemž v této studii nebyly zjištěny žádné nové signály týkající se bezpečnosti.
Nejčastějšími nežádoucími účinky pozorovanými u pacientů léčených ve studiích BO18192 a BO25460 erlotinibem byly vyrážka a průjem (viz tabulka 2). Nebyly pozorovány vyrážka a průjem stupně 4 ani v jedné ze studií. Ve studii BO181192 vedla vyrážka k ukončení léčby erlotinibem u 1 % pacientů, průjem u <1 %, zatímco ve studii BO25460 vyrážka ani průjem nevedly u pacientů k ukončení léčby. Modifikace dávky (přerušení léčby nebo snížení dávky) ve studii BO18192 byly nutné u 8,3 % pacientů pro vyrážku a u 3 % pro průjem a ve studii BO25460 byly nutné u 5,6 % pacientů pro vyrážku a u 2,8 % pro průjem.
Tabulka 2: Nejčastější nežádoucí účinky ze studií BO18192 (SATURN) a BO25460 (IUNO)
| BO18192 (SATURN) | BO25460 (IUNO) | |||
| erlotinib n = 433 | placebo n=445 | erlotinib n=322 | placebo n=319 | |
| % | % | % | % | |
| Vyrážka, všechny stupně | 49,2 | 5,8 | 39,4 | 10,0 |
| Stupeň 3 | 6,0 | 0 | 5,0 | 1,6 |
| Průjem, všechny stupně | 20,3 | 4,5 | 24,2 | 4,4 |
| Stupeň 3 | 1,8 | 0 | 2,5 | 0,3 |
Populační analýza bezpečnosti.
V otevřené randomizované studii fáze III ML 20650 provedené u 154 pacientů byla bezpečnost erlotinibu v první linii léčby pacientů s NSCLC s aktivujícími mutacemi EGFR hodnocena u 75 pacientů; u těchto pacientů nebyly pozorovány žádné nové bezpečnostní signály.
Nejčastější nežádoucí účinky pozorované u pacientů léčených erlotinibem ve studii ML 20650 byly vyrážka (všechny stupně 80 %) a průjem (všechny stupně 57 %), většinou stupně závažnosti 1/2 a zvládnutelné bez intervence. Vyrážka stupně 3 se projevila u 9 % pacientů, průjem stupně 3 u 4 %. Nebyly pozorovány vyrážka ani průjem stupně 4. Jak vyrážka, tak průjem vedly k ukončení léčby erlotinibem u 1 % pacientů. Modifikace dávkování (přerušení léčby nebo redukce) byla nutná pro vyrážku u 11 % a pro průjem u 7 % pacientů.
Karcinom pankreatu (erlotinib podáván současně s gemcitabinem)
Nejčastější nežádoucí účinky zjištěné v pivotní studii PA.3 u pacientů s karcinomem pankreatu léčených erlotinibem v dávce 100 mg a gemcitabinem byly únava, vyrážka a průjem. V léčebné skupině, jíž byl podáván erlotinib a gemcitabin, byly jak vyrážka, tak průjem stupně 3/4 hlášena u 5 % pacientů. Medián časového období do výskytu vyrážky a průjmu byl 10 resp. 15 dní. Výskyt vyrážky nebo průjmu vedl ke snížení dávky u 2 % pacientů a k přerušení léčby až u 1 % pacientů dostávajících erlotinib a gemcitabin.
Nežádoucí účinky, které se v rámci pivotní studie PA.3 vyskytly u pacientů léčených 100 mg erlotinibu a gemcitabinem častěji (> 3 %) než ve skupině, jíž bylo podáváno placebo a gemcitabin, a jejichž výskyt byl zaznamenán nejméně u 10 % pacientů ve skupině léčené 100 mg erlotinibu a gemcitabinem, jsou s využitím kritérií NCI-CTC („National Cancer Institute-Common Toxicity Criteria“) shrnuty v tabulce 3.
Následující termíny vyjadřují frekvenci výskytu nežádoucích účinků: velmi časté (>1/10); časté (>1/100 až <1/10); méně časté (>1/1000 až <1/100); vzácné (>1/10000 až <1/1000); velmi vzácné (<1/10000) včetně ojedinělých hlášených případů.
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Tabulka 3: Velmi časté nežádoucí účinky zaznamenané ve studii PA.3 (kohorta pacientů léčených dávkou 100 mg)
| erlotinib n = 259 | placebo n = 256 | |||||
| Stupeň dle NCI-CTC | Jakýkoli | 3 | 4 | Jakýkoli | 3 | 4 |
| stupeň | stupeň | |||||
| Preferovaný termín podle MedDRA | % | % | % | % | % | % |
| Celkový počet pacientů s jakýmkoli nežádoucím účinkem | 99 | 48 | 22 | 97 | 48 | 16 |
| Infekce a infestace Infekce | 31 | 3 | <1 | 24 | 6 | <1 |
| Poruchy metabolismu a výživy Úbytek tělesné hmotnosti | 39 | 2 | 0 | 29 | <1 | 0 |
| Psychiatrické poruchy Deprese | 19 | 2 | 0 | 14 | <1 | 0 |
| Poruchy nervového systému Neuropatie | 13 | 1 | <1 | 10 | <1 | 0 |
| Bolest hlavy | 15 | <1 | 0 | 10 | 0 | 0 |
| Respirační, hrudní a mediastinální poruchy Kašel | 16 | 0 | 0 | 11 | 0 | 0 |
| Gastrointestinální poruchy Průjem | 48 | 5 | <1 | 36 | 2 | 0 |
| Stomatitida | 22 | <1 | 0 | 12 | 0 | 0 |
| Dyspepsie | 17 | <1 | 0 | 13 | <1 | 0 |
| Flatulence | 13 | 0 | 0 | 9 | <1 | 0 |
| Poruchy kůže a podkožní tkáně Vyrážka | 69 | 5 | 0 | 30 | 1 | 0 |
| Alopecie | 14 | 0 | 0 | 11 | 0 | 0 |
| Celkové poruchy a reakce v místě aplikace Únava | 73 | 14 | 2 | 70 | 13 | 2 |
| Pyrexie | 36 | 3 | 0 | 30 | 4 | 0 |
| Ztuhlost | 12 | 0 | 0 | 9 | 0 | 0 |
* Závažné infekce (s neutropenií nebo bez neutropenie) zahrnovaly pneumonii, sepsi a celulitidu.
Může vést k dehydrataci, hypokalemii a selhání ledvin.
Vyrážka zahrnovala akneiformní dermatitidu.
Další pozorování
Vyhodnocení bezpečnosti erlotinibu je založeno na datech od více než 1500 pacientů léčených nejméně jednou dávkou 150 mg erlotinibu v monoterapii a více než 300 pacientů léčených erlotinibem v dávce 100 mg nebo 150 mg v kombinaci s gemcitabinem.
Následující nežádoucí účinky byly popsány jak u pacientů léčených erlotinibem podávaným samostatně, tak u pacientů, kterým byl podáván erlotinib současně s chemoterapií.
Velmi časté nežádoucí účinky ze studií BR.21 a PA.3 jsou shrnuty v tabulkách 1 a 3, další nežádoucí účinky včetně nežádoucích účinků pozorovaných v jiných studiích jsou shrnuty v tabulce 4.
V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti.
Tabulka 4: Souhrn nežádoucích účinků dle kategorií četností:
| Třídy orgánových systémů | Velmi časté (>1/10) | Časté (>1/100 až <1/10) | Méně časté (>1/1000 až <1/100) | Vzácné (>1/10000 až <1/1000) | Velmi vzácné (<1/10000) |
| Poruchy oka | Keratitida Konjunktivitida1 | Změny řas2 | Perforace rohovky Ulcerace rohovky Uveitida | ||
| Respirační, hrudní a mediastináln í poruchy | Epistaxe | Intersticiální plicní onemocnění3 | |||
| Gastrointesti nální poruchy | Průjem7 | Gastrointestináln í krvácení4 | Perforace gastrointesti-nálního traktu7 | ||
| Poruchy jater a žlučových cest | Abnormalit y funkčních jaterních testů5 | Jaterní selhání6 | |||
| Poruchy kůže a podkožní tkáně | Alopecie Suchá kůže1 Paronychie Folikulitida Akné/akneiformn í dermatitida Kožní fisury | Hirsutismus Změny obočí Lámavost a ztráta nehtů Lehké kožní reakce jako hyperpigmentac e | Syndrom palmoplantárn í erytrodys-estezie | Stevensův-Johnsonův syndrom/toxick á epidermální nekrolýza7 | |
| Poruchy ledvin a močových cest | Renální insuficience1 | Nefritida1 Proteinurie1 |
1V klinické studii PA.3.
-
2 Včetně vrůstání řas, nadměrného růstu a zesílení řas.
-
3 Včetně úmrtí pacientů léčených erlotinibem pro nemalobuněčný karcinom plic nebo jiné pokročilé solidní nádory (viz bod 4.4). Vyšší výskyt byl pozorován u pacientů japonského původu (viz bod 4.4).
-
4 V klinických studiích některé případy souvisely se souběžným podáním warfarinu a některé se souběžným podáním nesteroidních antiflogistik (viz bod 4.5).
-
5 Včetně zvýšené alaninaminotransferázy [ALT], aspartátaminotransferázy [AST] a bilirubinu. Tyto změny byly velmi časté v klinické studii PA.3 a časté v klinické studii BR.21. Většinou byly lehkého až středně těžkého stupně, přechodného charakteru nebo souvisely s jaterními metastázami.
-
6 Včetně úmrtí. Přitěžujícími faktory byly preexistující jaterní onemocnění nebo souběžná hepatotoxická léčba (viz bod 4.4).
-
7 Včetně úmrtí (viz bod 4.4).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu: Státní ústav pro kontrolu léčiv, Šrobárova 48, 100 41 Praha 10, webové stránky: .
4.9 Předávkování
Příznaky
Erlotinib je snášen při podávání v jednotlivých dávkách perorálně až do 1000 mg u zdravých jedinců a až do 1600 mg u pacientů s nádorovým onemocněním. Opakované podávání jednotlivých dávek 200 mg erlotinibu dvakrát denně bylo u zdravých jedinců po několika dnech tolerováno hůře. Podle údajů z těchto klinických studií se při dávkování vyšším než je doporučená dávka mohou vyskytnout vážné nežádoucí účinky, např. průjem, vyrážka a pravděpodobně též může dojít ke zvýšení aktivity jaterních aminotransferáz.
Léčba
V případě podezření na předávkování je třeba přestat s podáváním přípravku Erlotinib Teva B. V. a zahájit symptomatickou léčbu.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: cytostatika, inhibitor proteinkinázy, ATC kód: L01XE03
Mechanismus účinku
Erlotinib je inhibitor tyrozinkinázy, receptoru pro epidermální růstový faktor / receptoru pro lidský epidermální růstový faktor typu 1 (EGFR, rovněž známý jako HER1). Erlotinib silně inhibuje intracelulární fosforylaci EGFR. EGFR je exprimován na povrchu normálních i nádorových buněk. V neklinických modelech navozuje inhibice fosfotyrozinu EGFR zastavení vývoje buněk a/nebo jejich smrt.
Mutace genu EGFR může vést ke konstituční aktivaci antiapoptotických a proliferačních signálních cest. Vysoká účinnost erlotinibu při blokádě EGFR signalizace u těchto nádorů s pozitivitou mutace EGFR je dána pevnou vazbou erlotinibu na vazebné místo ATP mutované kinázové domény EGFR. Vzhledem k blokádě sestupné signalizační dráhy je zastavena proliferace a je indukována smrt buněk prostřednictvím vlastní signální dráhy. Na modelu u myši s nádorem s vysokou expresí těchto aktivujících mutací EGFR je pozorována regrese nádoru.
Klinická účinnost
Léčba první linie nemalobuněčného karcinomu plic (NSCLC) u pacientů s aktivujícími mutacemi
EGFR (erlotinib podávaný v monoterapii):
Účinnost erlotinibu v první linii léčby pacientů s NSCLC s aktivujícími mutacemi EGFR byla prokázána v randomizované otevřené studii fáze III (ML20650, EURTAC). Tato studie byla provedena u pacientů bílé rasy s metastazujícím nebo lokálně pokročilým NSCLC (stadium IIIB a IV), kteří dosud nebyli léčeni chemoterapií nebo jakoukoli systémovou protinádorovou léčbou pro pokročilé onemocnění a u kterých byla přítomna mutace tyrosinkinázové domény genu EGFR (delece v exonu 19 nebo mutace v exonu 21). Pacienti byli randomizováni v poměru 1:1 k léčbě erlotinibem v dávce 150 mg denně nebo k léčbě 4 cykly s chemoterapeutickým dubletem s platinou.
Primární cílový parametr účinnosti byla řešiteli stanovená doba přežití bez progrese. Výsledky účinnosti jsou shrnuty v tabulce 5.
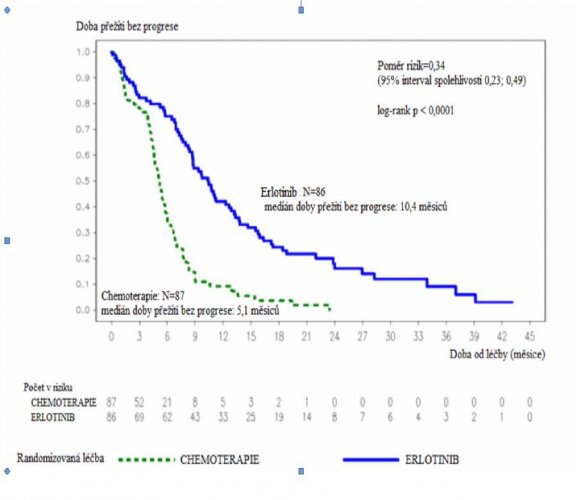
Obrázek 1: Kaplan-Meierova křivka doby přežití bez progrese stanovená řešiteli v klinické studii ML20650 (EURTAC) (ukončení sběru údajů duben 2012)
Doba přežiti bez progrese
24 27 30 33 36 39 42 45
Doba od léčby (měsíce)
--------- ERLOTINIB
Randomizovaná léčba
....... CHEMOTERAPIE
Počet v traku
CHEMOTERAPIE 8
ERLOTINIB
log-rank p < 0,0001
Erlotinib N=8ó
medián doby přežiti bez progrese 10,4 měsíců
Poměr rizjk=0,34
(95% interval spolehlivosti 0,23; 0,49)
11
■
- "k
-
w
-
* V.
<. li
1 1
'■ w
1 W
- ¥
■ k
<
-
* X
-
* H
-
1 1
i %
i
■»
- – – % Chemoterapie: N=87
medián doby přežiti bez progrese: 5,1 mésicu
Tabulka 5: Výsledky účinnosti erlotinibu versus chemoterapie v klinické studii ML20650 (EURTAC)
| erlotinib | Chemoterapie | Poměr rizik (95% CI) | p-hodnota | ||
| Předem | n=77 | n=76 |
| plánovaná průběžná analýza (35 % dat nutných pro analýzu celkového přežití) (n=153) Ukončení sběru údajů: srpen 2010 | Primární cílový parametr: Doba přežití bez progrese (medián v měsících) Hodnoceno řešiteli Nezávislé hodnocení | 9,4 10,4 | 5,2 5,4 | 0,42 [0,27; 0,64] 0.47 [0,27; 0,78] | p<0,0001 p=0,003 |
| Četnost objektivní odpovědi (CR/PR) | 54,5 % | 10,5 % | p<0,0001 | ||
| Celkové přežití (měsíce) | 22,9 | 18,8 | 0,80 [0,47; 1,37] | p=0,4170 | |
| Explorativní analýza (40 % dat nutných pro analýzu celkového přežití) (n=173) Ukončení sběru údajů: leden 2011 | n=86 | n=87 | |||
| Doba přežití bez progrese (medián v měsících), Hodnoceno řešiteli | 9,7 | 5,2 | 0,37 [0,27; 0,54] | p<0,0001 | |
| Četnost objektivní odpovědi (CR/PR) | 58,1 % | 14,9 % | p<0,0001 | ||
| Celkové přežití (měsíce) | 19,3 | 19,5 | 1,04 [0,65; 1,68] | p=0,8702 | |
| Aktualizovaná analýza (62 % dat nutných pro analýzu celkového přežití) (n=173) Ukončení sběru údajů: duben 2012 | n=86 | n=87 | |||
| Doba přežití bez progrese (medián v měsících) | 10,4 | 5,1 | 0,34 [0,23; 0,49] | p<0,0001 | |
| Celkové přežití *** (měsíce) | 22,9 | 20,8 | 0,93 [0,64; 1,36] | p=0,7149 |
CR=úplná odpověď; PR=částečná odpověď
* Bylo pozorováno 58% snížení rizika progrese nemoci nebo úmrtí
** Celková shoda mezi hodnocením doby přežití bez progrese řešiteli a při nezávislém hodnocení byla 70 %
*** V rameni s chemoterapií byla zaznamenána vysoká četnost překřížení, když 82 % pacientů mělo následnou léčbu inhibitorem tyrosinkinázy EGFR, přičemž všichni kromě dvou pacientů měli následnou léčbu erlotinibem.
Udržovací léčba NSCLC po chemoterapii první linie (erlotinib podávaný v monoterapii):
Účinnost a bezpečnost erlotinibu v udržovací léčbě po chemoterapii první linie u pacientů s nemalobuněčným karcinomem plic byly prověřovány v randomizované, dvojitě zaslepené, placebem kontrolované studii (BO18192, SATURN). Do této studie bylo zařazeno 889 pacientů s lokálně pokročilým nebo metastazujícím nemalobuněčným karcinomem plic, který neprogredoval po 4 cyklech chemoterapie s platinovým dubletem. Pacienti byli randomizováni v poměru 1:1 k léčbě erlotinibem v dávce 150 mg nebo k podávání placeba perorálně jednou denně až do progrese nemoci. Primární cílový parametr studie zahrnoval přežití bez progrese (PFS) u všech pacientů. Vstupní demografické charakteristiky a charakteristiky onemocnění byly mezi oběma léčebnými rameny dobře vyváženy. Do studie nebyli zařazeni pacienti se stavem výkonnosti (PS) >1 dle ECOG nebo s významnou jaterní či ledvinnou komorbiditou.
V této studii byl u celkové populace ukázán prospěch primárního cílového parametru účinnosti přežití bez progrese (poměr rizik = 0,71, p<0,0001) a sekundárního cílového parametru účinnosti celkového přežití (poměr rizik = 0,81, p=0,0088). Největší prospěch však byl v předem definované explorativní analýze pozorován u pacientů s aktivujícím typem EGFR mutací (n=49), u kterých byl prokázán významný přínos v cílovém parametru účinnosti přežití bez progrese (poměr rizik=0,10; 95% interval spolehlivosti 0,04–0,25; p<0,0001) a v parametru celkového přežití poměr rizik=0,83 (95% interval spolehlivosti; 0,34–2,02). 67 % pacientů v rameni s placebem, v podskupině s aktivující mutací EGFR, bylo ve druhé nebo další linii léčeno inhibitory TKI.
Studie BO25460 (IUNO) byla provedena u 643 pacientů s pokročilým NSCLC, u kterých nebyly prokázány EGFR-aktivující mutace (delece exonu 19 nebo mutace exonu 21 L858R) a u kterých nedošlo k progresi onemocnění po 4 cyklech chemoterapie (platinový dublet).
Cílem studie bylo porovnání celkového přežití po udržovací léčbě erlotinibem navazující na léčbu v 1. linii ve srovnání s erlotinibem podaným až při progresi onemocnění. Primární cílový parametr účinnosti studie nebyl potvrzen. Celkové přežití u pacientů léčených erlotinibem v udržovací léčbě nepotvrdilo superioritu ve srovnání s erlotinibem podaným ve 2. linii léčby u pacientů bez EGFR aktivujících mutací (poměr rizik= 1,02; 95% interval spolehlivosti, 0,85–1,22; p=0,82). Sekundárním cílovým parametrem účinnosti studie bylo přežití bez progrese a ani v tomto případě nebyl prokázán rozdíl mezi léčbou erlotinibem a placebem v udržovací léčbě (poměr rizik=0,94; 95% interval spolehlivosti 0,80–1,11; p=0,48).
Na základě výsledků studie BO25460 (IUNO) není doporučeno erlotinib používat u pacientů bez EGFR-aktivujících mutací v udržovací léčbě navazující na léčbu v 1. linii.
Léčba NSCLC po selhání nejméně, jednoho předchozího režimu chemoterapie (erlotinib podávaný v monoterapii):
Účinnost a bezpečnost erlotinibu jako léčby druhé/třetí linie byla stanovena v randomizované, dvojitě zaslepené, placebem kontrolované klinické studii (BR.21) u 731 pacientů s lokálně pokročilým nebo metastazujícím nemalobuněčným karcinomem plic po selhání alespoň jednoho režimu chemoterapie. Pacienti byli randomizováni v poměru 2:1 do skupiny, jíž byl perorálně podáván erlotinib v dávce 150 mg jednou denně a do skupiny, jíž bylo podáváno placebo. Cílové parametry studie zahrnovaly: celkovou dobu přežití, dobu bez známek progrese onemocnění (PFS), celkovou četnost odpovědí, délku trvání odpovědi, čas do zhoršení příznaků spojených s nádorem plic (kašel, dyspnoe a bolest) a bezpečnost. Primárním cílovým parametrem studie byla doba přežití.
Demografické charakteristiky mezi oběma léčebnými skupinami byly dobře vyvážené. Přibližně dvě třetiny pacientů byli muži, přibližně jedna třetina pacientů měla výchozí status stupně 2 dle ECOG a 9 % mělo výchozí status stupně 3. Ve skupinách léčených erlotinibem a placebem bylo 93 % resp. 92 % všech pacientů v předchozím režimu léčeno platinou a 36 % resp. 37 % všech pacientů mělo předchozí terapii s taxanem.
Dosažený poměr rizik (HR) úmrtí ve skupině léčené erlotinibem ve vztahu ke skupině, jíž bylo podáváno placebo, byl 0,73 (95% interval spolehlivosti: 0,60 až 0,87) (p=0,001). Procentuální zastoupení pacientů s dobou přežití 12 měsíců bylo 31,2 % ve skupině léčené erlotinibem, resp. 21,5 % ve skupině, jíž bylo podáváno placebo. Medián celkové doby přežití ve skupině léčené erlotinibem byl 6,7 měsíce (95% interval spolehlivosti: 5,5 až 7,8 měsíce) ve srovnání se 4,7 měsíce (95% interval spolehlivosti: 4,1 až 6,3 měsíce) ve skupině, jíž bylo podáváno placebo.
U různých podskupin pacientů byl zkoumán účinek přípravku na celkové přežití. Účinek erlotinibu na celkové přežití byl obdobný u pacientů, kteří měli výchozí stav výkonnosti stupně 2–3 (dle ECOG) (HR = 0,77, 95% interval spolehlivosti: 0,6–1,0) nebo 0–1 (HR = 0,73, 95% interval spolehlivosti: 0,6–0,9), u mužů (HR = 0,76, 95% interval spolehlivosti: 0,6–0,9) i žen (HR = 0,80, 95% interval spolehlivosti: 0,6–1,1), u pacientů mladších 65 let (HR = 0,75, 95% interval spolehlivosti: 0,6–0,9) nebo starších pacientů (HR = 0,79, 95% interval spolehlivosti: 0,6–1,0), u pacientů s jedním předchozím léčebným režimem (HR = 0,76, 95% interval spolehlivosti: 0,6–1,0) nebo více než jedním předchozím léčebným režimem (HR = 0,75, 95% interval spolehlivosti: 0,6–1,0), u populace kavkazského typu (HR = 0,79, 95% interval spolehlivosti: 0,6–1,0) nebo asijského typu (HR = 0,61, 95% interval spolehlivosti: 0,4–1,0), u pacientů s adenokarcinomem (HR = 0,71, 95% interval spolehlivosti: 0,6–0,9) nebo spinocelulárním karcinomem (HR = 0,67, 95% interval spolehlivosti: 0,5–0,9), ne však u pacientů s jinými histologickými nálezy (HR 1,04, 95% interval spolehlivosti: 0,7–1,5), pacientů ve stadiu choroby IV při stanovení diagnózy (HR = 0,92, 95% interval spolehlivosti: 0,7–1,2) nebo ve stadiu nižším než stadium IV (HR = 0,65, 95% interval spolehlivosti: 0,5–0,8). U pacientů, kteří nikdy nekouřili, byla léčba erlotinibem mnohem přínosnější (přežití HR = 0,42, 95% interval spolehlivosti: 0,28–0,64) v porovnání s kuřáky nebo s pacienty, kteří již kouřit přestali (HR = 0,87, 95% interval spolehlivosti: 0,71–1,05).
Ze 45 % pacientů se známou expresí EGFR byly hodnoty poměru rizik 0,68 (95% interval spolehlivosti: 0,49–0,94) u pacientů s nádory s EGFR-pozitivitou a 0,93 (95% interval spolehlivosti: 0,63–1,36) u pacientů s nádory s EGFR-negativitou (určeno imunohistochemicky použitím soupravy pharmDx ke stanovení EGFR, přičemž vzorek byl považován za EGFR negativní při označení méně než 10 % nádorových buněk). U zbývajících 55 % pacientů, u kterých nebyla exprese EGFR známa, byla hodnota poměru rizik 0,77 (95% interval spolehlivosti: 0,61–0,98).
Medián doby bez známek progrese onemocnění (PFS) ve skupině léčené erlotinibem byl 9,7 týdne (95% interval spolehlivosti: 8,4 až 12,4 týdne) ve srovnání s 8 týdny ve skupině, jíž bylo podáváno placebo (95% interval spolehlivosti: 7,9 až 8,1 týdne).
Objektivní odpověď na léčbu podle kritérií RECIST byla ve skupině léčené erlotinibem 8,9 % (95% interval spolehlivosti: 6,4 až 12,0). Prvních 330 pacientů bylo hodnoceno centrálně (léčebná odpověď 6,2 %), 401 pacientů bylo hodnoceno zkoušejícími (léčebná odpověď 11,2 %).
Medián doby trvání odpovědi byl 34,3 týdne, v rozmezí hodnot od 9,7 týdne do 57,6 týdne a vyšších. Podíl pacientů, u nichž byla nastolena kompletní léčebná odpověď, částečná léčebná odpověď nebo stabilizace choroby, byl ve skupině léčené erlotinibem 44,0 % resp. 27,5 % ve skupině s placebem (p=0,004).
Prospěšný vliv léčby erlotinibem na dobu přežití byl rovněž pozorován u pacientů, u nichž nebylo dosaženo objektivní odpovědi nádoru (dle kritérií RECIST). Tuto skutečnost dokládá poměr rizik úmrtí 0,82 (95% interval spolehlivosti: 0,68 až 0,99) dosažený u pacientů, kde nejlepší odpovědí byla stabilní fáze choroby nebo progrese onemocnění.
Podávání erlotinibu vedlo ke zlepšení příznaků ve smyslu signifikantně prodloužené doby do zhoršení kašle, dyspnoe a bolesti oproti placebu.
Karcinom pankreatu (ve studii PA.3 byl erlotinib podáván současně s gemcitabinem):
Účinnost a bezpečnost erlotinibu v kombinaci s gemcitabinem jako léčby první linie byla stanovena v randomizované, dvojitě zaslepené, placebem kontrolované klinické studii u pacientů s lokálně pokročilým, neresekovatelným nebo metastazujícím nádorem pankreatu. Pacienti byli randomizováni k podávání erlotinibu nebo placeba v kontinuálním režimu se souběžným intravenózním podáváním gemcitabinu (1000 mg/m2, cyklus 1 – v den 1, 8, 15, 22, 29, 36 a 43 osmitýdenního cyklu; cyklus 2 a následující cykly – ve dnech 1, 8 a 15 čtyřtýdenního cyklu [schválené dávkování a harmonogram pro karcinom pankreatu viz SmPC pro gemcitabin]). Erlotinib nebo placebo byly podávány perorálně jednou denně, dokud nedošlo k progresi onemocnění nebo k nepřijatelným projevům toxicity. Primárním cílovým parametrem studie byla celková doba přežití.
Pacienti dvou srovnávaných skupin, dostávající 100 mg erlotinibu a gemcitabin nebo placebo a gemcitabin, vykazovali obdobné výchozí demografické vlastnosti a charakteristiku onemocnění, s výjimkou mírně vyššího zastoupení žen ve skupině léčené erlotinibem a gemcitabinem oproti skupině, jíž bylo podáváno placebo a gemcitabin:
| Vstupní charakteristiky | erlotinib | placebo |
| Ženy | 51 % | 44 % |
| Stav tělesné výkonnosti (ECOG PS)=0 | 31 % | 32 % |
| Stav tělesné výkonnosti (ECOG PS)=1 | 51 % | 51 % |
| Stav tělesné výkonnosti (ECOG PS)=2 | 17 % | 17 % |
| Metastazující onemocnění | 77 % | 76 % |
Přežití bylo hodnoceno u všech registrovaných nemocných („intent-to-treat“ analýza) na základě údajů získaných během následného sledování. Výsledky jsou uvedeny v tabulce (výsledky skupiny s metastazujícím onemocněním a s lokálně pokročilým onemocněním jsou odvozeny z analýzy podskupin).
| Proměnná | erlotinib (měsíce) | placebo (měsíce) | Rozdíl (měsíce) | Interval spolehlivosti rozdílu | HR | Interval spolehlivosti HR | P-hodnota |
| Celková populace | |||||||
| Střední doba celkového přežití | 6,4 | 6,0 | 0,41 | –0,54–1,64 | 0,82 | 0,69–0,98 | 0,028 |
| Průměrná doba celkového přežití | 8,8 | 7,6 | 1,16 | –0,05–2,34 | |||
| Nemocní s metastazujícím onemocněním | |||||||
| Střední doba celkového přežití | 5,9 | 5,1 | 0,87 | –0,26–1,56 | 0,80 | 0,66–0,98 | 0,029 |
| Průměrná doba celkového přežití | 8,1 | 6,7 | 1,43 | 0,17–2,66 | |||
| Nemocní s lokálně pokročilým onemocněním | |||||||
| Střední doba celkového přežití | 8,5 | 8,2 | 0,36 | –2,43–2,96 | 0,93 | 0,65–1,35 | 0,713 |
| Průměrná doba celkového přežití | 10,7 | 10,5 | 0,19 | –2,43–2,69 | |||
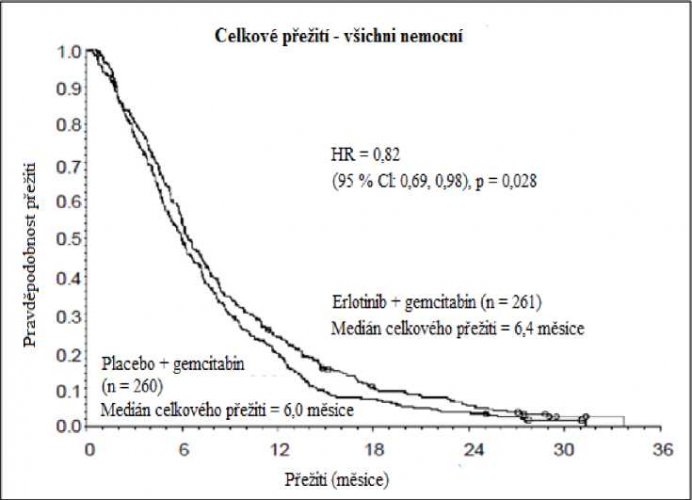
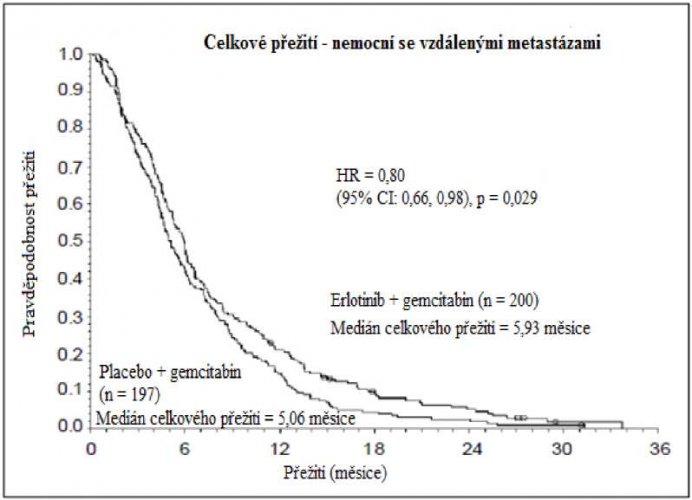
Retrospektivní analýza ukazuje, že nemocným s příznivým klinickým stavem při vstupu do studie (nízká intenzita bolesti, dobrá kvalita života a dobrá tělesná kondice) může být léčba erlotinibem více prospěšná. Pro prospěšnost léčby je většinou určujícím faktorem nízké skóre intenzity bolesti.
Retrospektivní analýza ukazuje, že pacienti, kterým je podáván erlotinib a u kterých se objevila vyrážka, měli delší dobu celkového přežití než nemocní bez projevů kožní vyrážky (medián celkového přežití 7,2 měsíce versus 5 měsíců, poměr rizik úmrtí 0,61). U 90 % pacientů došlo k výskytu vyrážky během prvých 44 dnů léčby erlotinibem, střední doba do výskytu vyrážky byla 10 dní.
Pediatrická populace
Evropská agentura pro léčivé přípravky rozhodla o zproštění povinnosti předložit výsledky studií s erlotinibem u všech podskupin pediatrické populace v indikaci nemalobuněčný karcinom plic a karcinom pankreatu (informace o použití u dětí viz bod 4.2).
5.2 Farmakokinetické vlastnosti
Absorpce
Po perorálním podání jsou maximální hladiny erlotinibu v plazmě dosahovány přibližně po 4 hodinách od užití. Ve studii prováděné u zdravých dobrovolníků byl získán odhad absolutní biologické dostupnosti 59 %. Po perorálním podání dávky může být expozice zvýšena požitím jídla.
Distribuce
Erlotinib má zdánlivý průměrný distribuční objem 232 l a je distribuován do lidských nádorových tkání. Ve studii u 4 pacientů (3 pacienti s diagnózou nemalobuněčného karcinomu plic [NSCLC] a jeden pacient s nádorem hrtanu), kterým bylo perorálně podáváno 150 mg erlotinibu jednou denně, byla ve vzorcích nádorové tkáně chirurgicky vyjmuté 9. den léčby nalezena koncentrace erlotinibu v průměru 1185 ng/g tkáně. Tento údaj odpovídá celkovému průměru 63 % (rozmezí 5–161 %) maximální koncentrace v plazmě pozorované v ustáleném stavu. Primární aktivní metabolity se v nádoru vyskytovaly v průměrných koncentracích 160 ng/g tkáně, což odpovídá celkovému průměru 113 % (rozmezí 88–130 %) maximální koncentrace v plazmě pozorované v ustáleném stavu. Vazba na plazmatické proteiny je přibližně 95 %. Erlotinib se váže na sérový albumin a alfa-1 kyselý glykoprotein (AAG).
Biotransformace
Erlotinib je u člověka metabolizován v játrech pomocí jaterních cytochromů, zejména CYP3A4 a v menší míře také CYP1A2. Mimojaterní metabolismus CYP3A4 ve střevu, CYP1A1 v plicích a 1B1 v nádorové tkáni se potenciálně podílí na metabolické clearance erlotinibu. Byly identifikovány tři hlavní metabolické dráhy: 1) O-demetylace postranního řetězce nebo obou řetězců následovaná oxidací na karboxylové kyseliny; 2) oxidace acetylenové části molekuly následovaná hydrolýzou na aryl karboxylové kyseliny a 3) aromatická hydroxylace na fenylu a acetylenové části molekuly. V neklinických stanoveních in vitro a na modelech nádorů in vivo bylo prokázáno, že primární metabolity erlotinibu OSI-420 a OSI-413 vznikající O-demetylací na postranních řetězcích mají potenci srovnatelnou s erlotinibem. Jsou přítomné v plazmě v koncentraci odpovídající <10 % erlotinibu a mají podobnou farmakokinetiku jako erlotinib.
Eliminace
Erlotinib je vylučován ve formě metabolitů ve stolici (>90 %), přičemž v ledvinách se z perorálně podané dávky eliminuje pouze malé množství (přibližně 9 %). Méně než 2 % perorálně podané dávky je vyloučeno ve formě původní látky. Farmakokinetické populační analýzy, které byly prováděny u 591 pacientů léčených erlotinibem, ukázaly průměrnou zdánlivou clearance 4,47 l/h a medián poločasu eliminace 36,2 hodiny. Proto je možno očekávat dosažení stabilní plazmatické koncentrace přibližně po 7 až 8 dnech.
Farmakokinetika ve vybraných populacích
Na základě populačních farmakokinetických analýz nebyl zaznamenán žádný klinický významný vztah mezi předpokládanou zdánlivou clearance a věkem, tělesnou hmotností, pohlavím a etnickou příslušností pacienta. Faktory, které korelovaly s farmakokinetikou erlotinibu, byly: celková koncentrace bilirubinu v séru pacienta, AAG a kouření v současné době. Zvýšené koncentrace celkového bilirubinu v séru a koncentrace AAG byly spojeny s nižší rychlostí clearance erlotinibu. Klinický význam těchto rozdílů není jasný. U kuřáků však byla vyšší clearance erlotinibu. Tato skutečnost byla potvrzena ve farmakokinetické studii srovnávající zdravé nekuřáky a zdravé kuřáky cigaret, kterým byla perorálně podána jednorázová dávka 150 mg erlotinibu. Hodnota geometrického průměru Cmax byla 1056 ng/ml u nekuřáků a 689 ng/ml u kuřáků, což je u kuřáků průměrně 65,2 % hodnoty nalezené u nekuřáků (95% interval spolehlivosti: 44,3 až 95,9, p = 0,031). Geometrický průměr AUC0_mf byl 18726 ng^h/ml u nekuřáků a 6718 ng^h/ml u kuřáků, tedy průměrně 35,9 % hodnoty u nekuřáků (95% interval spolehlivosti: 23,7 až 54,3, p < 0,0001). Geometrický průměr C24h byl 288 ng/ml u nekuřáků a 34,8 ng/ml u kuřáků, což je 12,1 %, hodnoty u nekuřáků (95% interval spolehlivosti: 4,82 až 30,2, p = 0,0001).
V pivotní studii fáze III u NSCLC byla minimální plazmatická koncentrace erlotinibu v ustáleném stavu, které bylo dosaženo u stávajících kuřáků, 0,65 ^g/ml (n=16), což bylo přibližně 2× méně než u bývalých kuřáků či nemocných, kteří nikdy nekouřili (1,28 ^g/ml, n=108). Tento účinek byl doprovázen 24% zvýšením zdánlivé plazmatické clearance erlotinibu. Ve studii fáze I s eskalací dávky u nemocných s NSCLC, kteří byli stávajícími kuřáky, ukazovaly farmakokinetické analýzy v ustáleném stavu proporcionální vzestup expozice erlotinibu, pokud byla dávka erlotinibu zvýšena ze 150 mg na maximální tolerovanou dávku 300 mg. Minimální plazmatická koncentrace v ustáleném stavu dosáhla u kuřáků při dávce 300 mg hodnoty 1,22 ^g/ml (n=17).
Na základě výsledků těchto farmakokinetických studií je třeba doporučit kuřákům přestat s kouřením v době léčby erlotinibem, jinak může dojít ke snížení plazmatických hladin přípravku.
Na základě populačních farmakokinetických analýz se zdá, že v přítomnosti opioidů se expozice erlotinibu zvyšuje přibližně o 11 %.
Druhá studie populační farmakokinetiky byla provedena s využitím údajů o léčbě erlotinibem u 204 pacientů s karcinomem pankreatu, kterým byl podáván erlotinib a gemcitabin. Tato analýza ukázala, že proměnné ovlivňující clearance erlotinibu ve studii u pacientů s karcinomem pankreatu byly velmi podobné proměnným v předchozí farmakokinetické analýze jednotlivého léčiva. Nebyly identifikovány žádné nové účinky těchto proměnných. Současné podávání gemcitabinu nemělo na plazmatickou clearance erlotinibu žádný vliv.
Pediatrická populace
U pediatrických pacientů nebyly dosud provedeny žádné specifické studie.
Starší pacienti
U starších pacientů nebyly dosud provedeny žádné specifické studie.
Porucha funkce jater
Erlotinib je primárně zpracováván v játrech. U nemocných se solidními nádory a středně těžkou poruchou funkce jater (skóre Child-Pugh 7–9) dosáhly geometrický průměr AUC0-t erlotinibu 27 000 ng^h/ml a Cmax 805 ng/ml ve srovnání s 29 300 ng^h/ml a 1 090 ng/ml u nemocných s přiměřenou funkcí jater, včetně nemocných s primárním jaterním nádorem nebo jaterními metastázami. Ačkoli hodnota Cmax byla u nemocných se středně těžkou poruchou funkce jater statisticky významně nižší, není tento rozdíl považován za klinicky významný. Nejsou k dispozici údaje týkající se vlivu těžké jaterní dysfunkce na farmakokinetiku erlotinibu. Farmakokinetické populační analýzy prokázaly spojitost mezi zvýšenou koncentrací celkového bilirubinu v séru a nižší rychlostí clearance erlotinibu.
Porucha funkce ledvin
Erlotinib a jeho metabolity nejsou signifikantně vylučovány ledvinami, do moči se vyloučí méně než 9 % jednotlivé dávky. Ve farmakokinetických populačních analýzách nebyl pozorován žádný statisticky významný vztah mezi clearance erlotinibu a clearance kreatininu, ale nejsou dostupné údaje pro pacienty s clearance kreatininu menší než 15 ml/min.
5.3 Předklinické údaje vztahující se k bezpečnosti
Účinky chronického podávání pozorované u nejméně jednoho živočišného druhu nebo alespoň v jedné studii zahrnovaly: postižení rohovky (atrofie, ulcerace), kůže (degenerace a zánět folikulů, zčervenání a alopecie), vaječníků (atrofie), jater (jaterní nekróza), ledvin (papilární nekróza a tubulární dilatace) a gastrointestinálního traktu (prodloužená doba vyprázdnění žaludku a průjem). Parametry erytrocytů byly sníženy a počet leukocytů, především neutrofilů, se zvýšil. V souvislosti s léčbou se projevilo zvýšení ALT, AST a bilirubinu. Tyto nálezy byly zaznamenány při nižších než klinicky významných expozicích.
Vzhledem k mechanismu účinku má erlotinib teratogenní potenciál. Údaje získané v reprodukčních toxikologických testech prováděných u potkanů a králíků při podávání dávek blížících se maximu tolerovaných dávek a/nebo dávce toxické pro matku potvrdily jeho reprodukční (embryotoxicita u potkanů, resorpce embrya a toxicita pro plod u králíků) a vývojovou (omezení růstu potomstva a přežívání u potkanů) toxicitu, avšak bez teratogenních účinků a bez ovlivnění fertility. Tyto nálezy byly zaznamenány při klinicky relevantních expozicích.
Erlotinib byl konvenčními testy ve studiích genotoxicity vyhodnocen jako negativní. Dvouleté studie kancerogenity provedené s erlotinibem na potkanech a myších byly negativní až do expozicí vyšších, než je léčebná expozice u člověka (expozice až 2krát, respektive 10krát vyšší dle Cmax a/nebo AUC). U potkanů byla po UV iradiaci pozorována mírná fototoxická kožní reakce.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Jádro tablety:
Laktóza
Mikrokrystalická celulóza
Sodná sůl karboxymethylškrobu (typ A)
Natrium-lauryl-sulfát Natrium-stearyl-fumarát
Hydrofobní koloidní oxid křemičitý
Potahová vrstva tablety:
Hypromelóza (E 434)
Oxid titaničitý (E 171)
Makrogol (E 1521)
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25 °C.
6.5 Druh obalu a obsah balení
Al/PVC blistry obsahujících 30 tablet.
6.6 Zvláštní opatření pro likvidaci přípravku
Žádné zvláštní požadavky na likvidaci.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Teva B. V., Swensweg 5, 2031GA Haarlem, Nizozemsko
8. REGISTRAČNÍ ČÍSLO(A)
100 mg: 44/367/17-C
150 mg: 44/368/17-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 4. 4. 2018
Další informace o léčivu ERLOTINIB TEVA B. V.
Jak
se ERLOTINIB TEVA B. V.
podává: perorální podání - potahovaná tableta
Výdej
léku: na lékařský předpis
Balení: Blistr
Velikost
balení: 30
Držitel rozhodnutí o registraci daného léku v České republice:
Teva B.V., Haarlem
E-mail: vois@teva.cz
Telefon: +420 251 007 111
