Příbalový leták - CLINIMIX N9G20E
Co je v této příbalové informaci
-
1. Co je přípravek CLINIMIX N9G20E a k čemu se používá
-
2. Čemu musíte věnovat pozornost, než začnete přípravek CLINIMIX N9G20E používat
-
3. Jak se přípravek CLINIMIX N9G20E používá
-
4. Možné nežádoucí účinky
1. Co je přípravek CLINIMIX N9G20E a účinky
Přípravek CLINIMIX N9G20E je infuzní roztok. Dodává se ve dvoukomorovém vaku.
V první komoře je roztok aminokyselin s elektrolyty, druhá komora obsahuje roztok glukózy s chloridem vápenatým. Obě komory vaku jsou od sebe odděleny těsnicími švy. Před podáním tohoto přípravku se vak sroluje směrem shora, čímž se švy mezi jednotlivými komorami vaku protrhnou a jejich obsah se promíchá.
Přípravek CLINIMIX N9G20E se používá k výživě dospělých a dětí podávané infuzí (hadičkou) do žíly v případě, že normální výživa ústy není vhodná.
Přípravek CLINIMIX N9G20E se podává pouze pod lékařským dohledem.
2. Čemu musíte věnovat pozornost, než začnete přípravek CLINIMIX N9G20E používat
Nepoužívejte přípravek CLINIMIX N9G20E jestliže:
jste alergický(á) na některou léčivou látku nebo na kteroukoli pomocnou látku obsaženou v tomto léku (uvedenou v bodu 6) Váš organismus nesnáší určité aminokyseliny máte příliš mnoho cukru v krvi (těžká hyperglykémie) je Vaše krev nadměrně kyselá (metabolická acidóza z přebytku laktátu) hladiny sodíku, draslíku, hořčíku, vápníku a/nebo fosforu ve Vaší krvi jsou příliš vysoké (hypernatrémie, hyperkalémie, hypermagnezémie, hyperkalcémie a/nebo hyperfosfatémie) u novorozenců mladších 28 dní se nesmí ceftriaxon současně podávat s i.v. roztoky obsahujícími vápník z důvodu možného vzniku částic.Ve všech případech bude lékař zvažovat své rozhodnutí, zda Vám přípravek podat či nikoli, podle faktorů jako je například Váš věk, hmotnost a klinický stav, jakož i podle výsledků provedených testů.
Upozornění a opatření
Před podáním přípravku CLINIMIX poraďte se se svým lékařem nebo zdravotní sestrou.
Výskyt jakýchkoli abnormálních projevů a příznaků rozvoje alergické reakce, jako je horečka, zimnice, kožní vyrážka, svědění, zarudnutí kůže, nebo dušnost, nadměrné pocení, nevolnost, zvracení a bolest hlavy sdělte svému lékaři nebo zdravotní sestře: infuze bude okamžitě ukončena. V průběhu podávání přípravku bude lékař sledovat Váš stav a může upravit dávkování nebo přidat další živiny, jako jsou tuky, vitamíny a stopové prvky, pokud to bude považovat za vhodné.
Roztoky obsahující glukózu budou podány s opatrností, pokud vůbec, u pacientů se známou alergií na obilí nebo obilné produkty.
Některé léčivé přípravky a nemoci mohou zvyšovat riziko rozvoje infekce nebo sepse (přítomnost baktérií v krvi). Umístění hadičky (intravenózního katetru) do Vaší žíly představuje zvláštní riziko vzniku infekce nebo sepse. Ošetřující lékař bude pečlivě sledovat jakékoli známky infekce, které by se mohly u Vás vyskytnout. Aseptickou technikou („bez choroboplodných zárodků) při umísťování katétru a jeho údržbě a také při přípravě nutriční směsi lze riziko infekce snížit.
Přípravek CLINIMIX N N9G20E obsahuje vápník. Nesmí se podávat společně s antibiotikem ceftriaxon z důvodu možného vzniku částic.
Pokud jste ve stavu těžké podvýživy a potřebujete přijímat živiny žilou, doporučuje se začít s parenterální výživou pomalu a opatrně.
Pokud máte problémy s játry, ledvinami, nadledvinami, srdcem nebo oběhem, bude ošetřující lékař sledovat Váš stav během zahájení infuze. Lékař si má být vědom závažných stavů ovlivňujících způsob, jakým Váš organismus zpracovává cukry, tuky, bílkoviny nebo soli (poruchy metabolismu).
Pokud se objeví jakékoli abnormální příznaky včetně podráždění žíly, musí být infuze okamžitě ukončena.
Účinnost a bezpečnost v průběhu podávání přípravku bude lékař kontrolovat klinickými a laboratorními testy. Bude-li Vám přípravek podáván několik týdnů, bude Vaše krev pravidelně testována. Rutinní kontrola glukózy v moči a v krvi se má provádět zvláště v případě intolerance a pokud jste diabetik, dávky inzulínu mohou být upraveny.
Další léčivé přípravky a přípravek CLINIMIX N9G20E
Informujte svého lékaře o všech lécích, které užíváte, které jste užíval(a) nebo mohl(a) v nedávné době užívat.
Přípravek CLINIMIX N9G20E obsahuje vápník. Proto se nesmí podávat současně
s antibiotikem ceftriaxon, protože se mohou tvořit částice (precipitáty).
Přípravek CLINIMIX N9G20E obsahuje draslík, proto má být podáván z důvodu rizika vzniku hyperkalémie opatrně pacientům, kteří se léčí draslík šetřícími diuretiky
(např.amilorid, spironolakton, triamteren), inhibitory angiotenzin konvertujícího enzymu (ACE), antagonisty receptoru angiotensinu II nebo imunosupresivy takrolimus a cyklosporin.
Těhotenství, kojení a fertilita
Sdělte svému lékaři, že jste těhotná, případně že kojíte, nebo pokud se domníváte, že byste mohla být těhotná nebo těhotenství plánujete, a požádejte ho před podáním přípravku o radu.
3. Jak se přípravek CLINIMIX N9G20E používá
Přípravek podávejte až po protržení těsnících švů mezi oběma komorami a promíchání obsahů obou komor.
Přípravek CLINIMIX N9G20E lze podávat dospělým i dětem.
Tento přípravek je infuzní roztok, který se podává plastovou hadičkou do žíly na Vaší paži nebo do velké žíly na hrudníku.
Dávkování - dospělí a děti
Ošetřující lékař rozhodne, jakou dávku a jak dlouho budete přípravek dostávat. Bude to záviset na věku, hmotnosti a výšce, klinickém stavu, denním příjmu tekutin a na potřebě energie a dusíku.
Vždy užívejte přípravek CLINIMIX N9G20E přesně podle doporučení lékaře. Pokud si nejste jistý/á, konzultujte to se svým lékařem.
Podávání přípravku může trvat tak dlouho, jak bude potřeba vzhledem k Vašemu klinickému stavu.
Infuze jednoho vaku obvykle trvá 8 až 24 hodin.
Jestliže bylo podáno více přípravku CLINIMIX N9G20E, než mělo být
Je-li Vám podáno příliš velké množství tohoto přípravku nebo je-li infuze příliš rychlá, může se zvýšit objem cirkulující krve a její kyselost. Obsah glukózy může zvýšit hladinu glukózy (cukru) ve Vaší krvi a moči. Podání příliš velkého objemu může způsobit nevolnost, zvracení, třes a poruchy rovnováhy elektrolytů. V těchto situacích bude infuze ihned ukončena.
V některých závažných případech bude možná nutné přistoupit k přechodné dialýze ledvin, která pomůže ledvinám odbourat odpadní látky.
Ošetřující lékař bude pravidelně sledovat Váš stav a krevní parametry, aby se předešlo těmto případům.
Pokud máte další otázky k použití tohoto přípravku, zeptejte se svého lékaře.
4. Vedlejší účinky
Podobně jako všechny léčivé přípravky, může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého. Pokud si všimnete, že na sobě pociťujete změny v průběhu nebo po léčbě, sdělte to ihned svému lékaři nebo zdravotní sestře .
Testy, které bude ošetřující lékař provádět během podávání tohoto přípravku mají minimalizovat riziko nežádoucích účinků.
Pokud se rozvinou abnormánlní příznaky a symptomy alergické reakce jako je abnormálně nízký nebo vysoký krevní tlak, modré nebo fialové zbarvení kůže, abnormálně vysoká tepová frekvence, dušnost, zvracení, nevolnost, kožní vyrážka, svědění, zarudnutí kůže, zvýšená tělesná teplota, nadměrné pocení, zimnice a třes, bude infuze okamžitě přerušena.
Byly zaznamenány další nežádoucí účinky vyskytující se více či méně často:
Anafylaxe (závažná alergická reakce s prudkým nástupem) Vysoká hladina glukózy a látek obsahujících amoniak a dusík v krvi Poruchy jaterních funkcí, abnormální krevní testy funkce jater Zánět žlučníku, žlučníkové kameny Žilní zánět v místě vpichu, podráždění žíly (bolest, zarudnutí kůže, horkost, otok) Nález glukózy v moči Diabetické koma Tvorba malých částic ucpávajících cévy plicHlášení nežádoucích účinků
Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo zdravotní sestře. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo na níže uvedenou adresu . Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.
Státní ústav pro kontrolu léčiv, Šrobárova 48, 100 41 Praha 10. Webové stránky:
5. Jak přípravek CLINIMIX N9G20E uchovávat
Uchovávejte při teplotě do 25 °C. Chraňte před mrazem.
Uchovávejte mimo dohled a dosah dětí.
Vak uchovávejte ve vnějším kartonu.
Přípravek CLINIMIX N9G20E nepoužívejte po uplynutí doby použitelnosti, uvedené na obalu za “Použitelné do”. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce.
Přípravek nevyhazujte do komunálního odpadu ani do odpadních vod. Pokud nebudete přípravek dále používat, zeptejte se svého lékárníka na způsob likvidace. Tato opatření pomáhají chránit životní prostředí.
6. Obsah balení a další informace
Co přípravek CLINIMIX N9G20E obsahuje
Léčivé látky ve jednom vaku rekonstituovaného roztoku jsou:
| Léčivé látky | 1 l | 1,5 l | 2 l |
| Alaninum | 5,70 g | 8,54 g | 11,38 g |
| Argininum | 3,17 g | 4,75 g | 6,32 g |
| Glycinum | 2,84 g | 4,25 g | 5,66 g |
| Histidinum | 1,32 g | 1,98 g | 2,64 g |
| Isoleucinum | 1,65 g | 2,48 g | 3,30 g |
| Leucinum | 2,01 g | 3,02 g | 4,02 g |
| Lysinum | 1,60 g | 2,39 g | 3,19 g |
| (jako L-lysini hydrochloridum) | (2,00 g) | (2,99 g) | (4,00 g) |
| Methioninum | 1,10 g | 1,65 g | 2,20 g |
| Phenylalaninum | 1,54 g | 2,31 g | 3,08 g |
| Prolinum | 1,87 g | 2,81 g | 3,74 g |
| Serinum | 1,38 g | 2,06 g | 2,75 g |
| Threoninum | 1,16 g | 1,73 g | 2,31 g |
| Tryptophanum | 0,50 g | 0,74g | 0,99 g |
| Tyrosinum | 0,11 g | 0,17 g | 0,22 g |
| Valinum | 1,60 g | 2,39 g | 3,19 g |
| Natrii acetas trihydricus | 2,16 g | 3,23 g | 4,31 g |
| Kalii hydrogenophosphas | 2,61 g | 3,92 g | 5,22 g |
| Natrii chloridum | 1,12 g | 1,68 g | 2,24 g |
| Magnesii chloridum hexahydricum | 0,51 g | 0,77 g | 1,02 g |
| Glucosum | 100 g | 150 g | 200 g |
| (Glucosum jako monohydricum) | (110 g) | (165 g) | (220 g) |
| Calcii chloridum dihydricum | 0,33 g | 0,50 g | 0,66 g |
Pomocné látky: kyselina octová, kyselina chlorovodíková (k úpravě pH roztoku), voda pro injekci
Jak přípravek CLINIMIX N9G20E vypadá a co obsahuje toto balení
Přípravek CLINIMIX N9G20E je infuzní roztok ve dvoukomorovém vícevrstevném plastovém vaku. Materiál vnitřní (kontaktní) vrstvy vaku je navržen tak, aby byl kompatibilní se složkami i schválenými aditivy.
Před rekonstitucí jsou roztoky aminokyselin a glukózy čiré a bezbarvé nebo světle žluté.
Po rekonstituci je roztok také čirý a bezbarvý nebo světle žlutý.
Aby se zabránilo kontaktu se vzdušným kyslíkem, je vak balen do ochranného přebalu, který obsahuje sáček s absorbentem kyslíku.
Velikost balení:
8 × 1 000 ml
6 × 1 500 ml
4 × 2 000 ml
Na trhu nemusí být k dispozici všechny velikosti balení.
Držitel rozhodnutí o registraci a výrobce
Držitel rozhodnutí o registraci
Karla Engliše 3201/6
150 00 Praha 5
Česká republika
Výrobce
Baxter Healthcare Ltd.
Caxton Way Thetford
Velká Británie
Tato příbalová informace byla naposledy revidována: 20. 6. 2018
Následující informace jsou určeny pouze pro zdravotnické pracovníky:
1. KVANTITATIVNÍ SLOŽENÍ
Po smíchání obsahu obou komor je složení binární směsi všech dostupných velikostí balení následující:
| CLINIMIX N9G20E | 1 l | 1,5 l | 2 l |
| Dusík (g) | 4,6 | 6,8 | 9,1 |
| Aminokyseliny (g) | 28 | 41 | 55 |
| Glukóza (g) | 100 | 150 | 200 |
| Celková energetická hodnota (kcal) | 510 | 765 | 1020 |
| Energetická hodnota glukózy (kcal) | 400 | 600 | 800 |
| Sodík (mmol) | 35 | 53 | 70 |
| Draslík (mmol) | 30 | 45 | 60 |
| Hořčík (mmol) | 2,5 | 3,8 | 5,0 |
| Vápník (mmol) | 2,3 | 3,4 | 4,5 |
| Acetáty (mmol) | 50 | 75 | 100 |
| Chloridy (mmol) | 40 | 60 | 80 |
| Fosfáty jako HPO 4” (mmol) | 15 | 23 | 30 |
| pH | 6 | ||
| Osmolarita (mOsm/l) | 980 |
2. DÁVKOVÁNÍ A ZPŮSOB PODÁNÍ
Přípravek podávejte až po protržení těsnících švů mezi oběma komorami a smíchání obsahů obou komor.
Dávkování a rychlost infuze
Dávkování se stanovuje podle metabolických potřeb, výdeje energie a klinického stavu pacienta.
U dospělých kolísá potřeba dusíku od 0,16 g/kg/den (přibližně 1g aminokyselin/kg/den) do 0,35 g dusíku/kg/den (přibližně 2 g aminokyselin/kg/den).
U dětí se pohybuje potřeba mezi 0,35 g dusíku/kg/den (přibližně 2g aminokyselin/kg/den) do 0,45 g dusíku/kg/den (přibližně 3g aminokyselin/kg/den).
Potřeba energie se pohybuje od 25 kcal/kg/den do 40 kcal/kg/ den a je závislá na stavu výživy nemocného a stupni katabolismu.
Rychlost podání se má přizpůsobit dávkování, vlastnostem infuzního roztoku, celkovému požadovanému příjmu tekutin za 24 hodin a trvání infuze.
Doba trvání infuze by měla být delší než 8 hodin. Zpravidla se rychlost zvyšuje postupně během první hodiny a nepřekročí 2,5 ml/kg tělesné hmotnosti za den.
Způsob podání
Výběr periferní nebo centrální žíly závisí na konečné osmolaritě směsi. Obecně přijatelný limit pro periferní infuzi je přibližně 800 mOsm/l, je však závislý na věku pacienta, jeho celkovém stavu a na stavu periferních žil.
3. ZVLÁŠTNÍ UPOZORNĚNÍ A OPATŘENÍ PRO POUŽITÍ
UPOZORNĚNÍ
U přípravků řady CLINIMIX byly zaznamenány hypersenzitivní reakce/reakce na infuzi zahrnující hypotenzi, hypertenzi, periferní cyanózu, tachykardii, dyspnoi, zvracení, nauzeu, kopřivku, vyrážku, svědění, erytém, pocení, horečku a zimnici.
U jiných parenterálních nutričních přípravků byla zaznamenána anafylaxe.
Na počátku jakékoli intravenózní infuze je třeba pacienta klinicky sledovat. Při výskytu jakýchkoli abnormálních projevů a příznaků, např. hypersenzitivity nebo reakce na infuzi, je nutné infuzi okamžitě přerušit.
Roztoky obsahující glukózu se používají s opatrností, pokud vůbec, u pacientů se známou alergií na obilí nebo obilní výrobky.
U pacientů přijímajících parenterální výživu byly hlášeny pulmonální vaskulární precipitáty.
-
V některých případech došlo k úmrtí. Nadměrné doplňování vápníku a fosforu zvyšuje riziko tvorby precipitátů fosforečnanu vápenatého. Precipitáty byly zaznamenány i v roztoku bez fosfátové soli. Byly také hlášeny precipitáty na konečném filtru infuzního setu a suspektní in vivo tvorba precipitátů. Pokud se objeví pulmonální obtíže, infuze má být ihned zastavena a zahájeno vyhodnocení klinického stavu. Kromě kontroly roztoku se má také pravidelně provádět kontrola precipitátů u infuzního setu a katétru.
-
V důsledku použití intravenózních katétrů k podání parenterálních roztoků, špatné péče o katétry nebo u kontaminovaných roztoků se mohou objevit infekce a sepse.
Imunosuprese a další faktory jako hyperglykémie, malnutrice a /nebo základní onemocnění mohou pacienty predisponovat ke vzniku infekčních komplikací.
Rozpoznání časné infekce může usnadnit pečlivé symptomatické a laboratorní sledování horečky/třesavky, leukocytózy, technických komplikací v místě aplikace a hyperglykémie. Výskyt septických komplikací lze snížit zvýšeným důrazem na aseptickou techniku při umísťování katétru a jeho údržbě, a také při přípravě nutričního přípravku.
Realimentace vážně podvyživených pacientů může vést k realimentačnímu (refeeding) syndromu, při kterém dochází k intracelulárnímu přesunu draslíku, fosforu a hořčíku v důsledku počínajícího anabolismu pacienta. Může se rovněž rozvinout deficit thiaminu a retence tekutin. Důkladným sledováním a pomalým navyšování příjmu živin, aniž by se podávalo nadbytečné množství (overfeeding) lze těmto komplikacím zabránit.
Hypertonické roztoky mohou při infuzi do periferní žíly vyvolat venózní iritaci. Výběr periferní nebo centrální žíly závisí na výsledné osmolaritě směsi.
Obecně přijatý limit pro periferní infuzi je přibližně 800 mOsm/l, je však závislý na věku pacienta a jeho celkovém stavu a na stavu periferních žil.
Nepropojujte vaky do série, aby nedošlo ke vzduchové embolii způsobené případným reziduálním vzduchem v primárním vaku.
OPATŘENÍ
Před zahájením infuze musí být korigovány těžké poruchy rovnováhy vody a elektrolytů, těžké stavy hyperhydratace a těžké metabolické poruchy.
Metabolické komplikace mohou nastat v případě, že příjem živin není přizpůsoben potřebám pacienta nebo není přesně posouzena metabolická kapacita podávaných složek výživy. Metabolické nežádoucí účinky mohou být zesíleny nedostatečným nebo nadměrným podáváním živin nebo nevhodným složením příměsí vzhledem k potřebám konkrétního pacienta.
Pro správné monitorování průběhu infuze jsou zapotřebí časté klinické a laboratorní kontroly. Ty by měly zahrnovat iontogram a funkční testy jater a ledvin.
Intolerance glukózy je častá metabolická komplikace u pacientů v těžkém šoku. Během infuze se může objevit hyperglykémie, glykosurie a hyperosmolární syndrom. Proto by měla být pravidelně vyšetřována hladina glukózy v krvi a v moči a u diabetiků by mělo být v případě potřeby upraveno dávkování inzulínu.
U pacientů s renální insuficiencí používejte přípravek s opatrností, zejména v případě hyperkalémie, protože existuje riziko rozvoje nebo zhoršení metabolické acidózy a hyperazotémie, pokud se neprovádí extrarenální odstraňování odpadních látek. U těchto pacientů je potřeba důsledně monitorovat stav tekutin a elektrolytů. V případě těžkého poškození ledvin přednostně podávejte speciálně navržené roztoky aminokyselin.
Opatrnosti je třeba při současném podávání přípravků CLINIMIX pacientům s adrenální insuficiencí.
Je třeba se vyvarovat oběhového přetížení, zejména u nemocných s plicním edémem, srdeční nedostatečností a srdečním selháním. Stav tekutin musí být pečlivě sledován.
U nemocných s preexistujícím onemocněním jater nebo jaterní insuficiencí kontrolujte kromě rutinních jaterních funkcí i možné příznaky hyperamonémie.
U některých pacientů s parenterální výživou se mohou rozvinout hepatobiliární onemocnění včetně cholestázy, jaterní steatózy, fibrózy a cirhózy, které mohou vyústit v selhání jater, podobně jako cholecystitida a cholelitiáza. Předpokládá se, že etiologie těchto poruch je multifaktorová a může se mezi pacienty lišit. Pacienti s abnormálně rozvinutými laboratorními parametry nebo s jinými příznaky hepatobiliárních poruch by měli být včas posouzeni lékařem hepatologem, aby se mohly identifikovat příčinné a další faktory a stanovit možné terapeutické a profylaktické zákroky
U pacientů, kteří přijímají roztoky aminokyselin, se mohou objevit zvýšené hladiny amoniaku a hyperamonémie. U některých pacientů může tento stav indikovat vrozenou poruchu metabolismu aminokyselin nebo jaterní selhání.
Časté kontroly hladiny plazmatického amoniaku se mají provádět u novorozenců a kojenců. Těmito kontrolami lze zjistit hyperamonémii, která může indikovat vrozenou poruchu metabolismu aminokyselin.
Podle závažnosti a etiologie může hyperamonémie vyžadovat okamžitou intervenci.
Příliš rychlá infuze aminokyselin může způsobit nevolnost, zvracení a zimnici. V těchto případech musí být infuze okamžitě zastavena.
Obecně by mělo být dávkování u starších pacientů stanoveno s opatrností, aby reflektovalo vyšší frekvenci výskytu snížených funkcí jater, ledvin nebo srdce a souběžná onemocnění nebo léčbu.
Pediatrická populace:
- U pediatrické populace nebyly provedeny žádné studie.
- Sledování hyperamonémie u pediatrických pacientů, viz výše.
4. PRAKTICKÉ INFORMACE PRO PŘÍPRAVUA ZACHÁZENÍ S PŘÍPRAVKEM
Varování:
Přípravek podávejte až po protržení těsnícího švu mezi komorami a promíchání jejich obsahu.
1.

Ochranný obal roztrhněte od horního konce a otevřete jej.
4.

Zdvihněte oblast závěsu a odstraňte roztok z horní části vaku. Pevně srolujte horní část vaku, dokud se těsnicí šev zcela neprotrhne (přibližně na polovinu délky).
2.

Odstraňte přední stranu ochranného obalu vaku CLINIMIX. Zlikvidujte ochranný obal a sáček s absorbentem kyslíku.
3.

Položte vak rovně na vodorovný a čistý povrch tak, aby závěsným koncem směřoval k Vám.
5.

Promíchejte minimálně trojím převrácením vaku.
6.
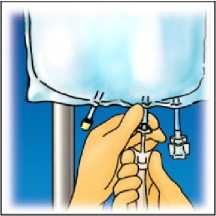
Zavěste vak. Z aplikačního vstupu odšroubujte kryt. Pevně zapojte konektor s hrotem.
Používejte pouze čiré, bezbarvé nebo lehce nažloutlé roztoky v neporušeném obalu.
Před použitím má mít přípravek pokojovou teplotu.
Aktivaci přípravku CLINIMIX lze provést v přebalu anebo po jeho odstranění.
Pouze k jednorázovému podání.
Částečně použité vaky a veškeré příslušenství po použití zlikvidujte.
Částečně použité vaky znovu nenapojujte.
Vaky nepropojujte do série.
Suplementace:
Pacientovi na dlouhodobé parenterální výživě mají být podávány lipidy, vitamíny a stopové prvky.
Pokud jsou zapotřebí aditiva, je třeba ověřit jejich kompatibilitu a stabilitu směsi.
Aditiva mohou být přidávána po protržení švu mezi komorami (po smíchání obou roztoků). K přípravku CLINIMIX N9G20E lze přidávat:
Emulze lipidů (např. ClinOleic) v množství 50 – 250 ml / 1000 ml přípravku CLINIMIX N9G20E
| CLINIMIX N9G20E 1 l+100 ml 20% lipidů | CLINIMIX N9G20E 1,5 l+250 ml 20% lipidů | CLINIMIX N9G20E 2 l+250 ml 20% lipidů | |
| Dusík (g) | 4,6 | 6,8 | 9,1 |
| Aminokyseliny (g) | 28 | 41 | 55 |
| Glukóza (g) | 100 | 150 | 200 |
| LiPidy (g) | 20 | 50 | 50 |
| Celková energetická hodnota (kcal) | 710 | 1265 | 1520 |
| Energetická hodnota glukózy (kcal) | 400 | 600 | 800 |
| Energetická hodnota lipidů (kcal) | 200 | 500 | 500 |
| Poměr glukóza / lipidy | 67/33 | 55/45 | 62/38 |
| Sodík (mmol) | 35 | 53 | 70 |
| Draslík (mmol) | 30 | 45 | 60 |
| Hořčík (mmol) | 2,5 | 3,8 | 5,0 |
| Vápník (mmol) | 2,3 | 3,4 | 4,5 |
| Acetáty (mmol) | 50 | 75 | 100 |
| Chloridy (mmol) | 40 | 60 | 80 |
| Fosfáty jako HPO 4–(mmol) | 15 | 23 | 30 |
| pH | 6 | 6 | 6 |
| Osmolarita (mOsm/l) | 915 | 880 | 900 |
Elektrolyty: na 1000 ml přípravku CLINIMIX N9G20E
| Sodík | Draslík | Hořčík | Vápník | |
| Až do výsledné koncentrace | 80 mmol | 60 mmol | 5,6 mmol | 3,0 mmol |
Stopové prvky: na1000 ml přípravku CLINIMIX , N9G20E
| Až do výsledné koncentrace | Měď | 10 Limol | Zinek | 77 Limol |
| Chróm | 0,14 Limol | Mangan | 2,5 Limol | |
| Fluor | 38 pmol | Kobalt | 0,0125 pmol | |
| Selen | 0,44 Limol | Molybden | 0,13 Limol | |
| Jód | 0,5 pmol | Železo | 10 pmol |
| na 1000 ml příprav | ku CLINIMIX N9G20E | ||
| Až do výsledné | Vitamín A | 1750 IU | Biotin | 35 Lig |
| koncentrace | Vitamín B6 | 2,27 mg | Vitamín B1 | 1,76 mg |
| Vitamín D | 110 IU | Kys. listová | 207 pg | |
| Vitamín B12 | 3,0 pg | Vitamín B2 | 2,07 mg | |
| Vitamín E | 5,1 mg | Vitamín C | 63 mg | |
| Vitamín PP | 23 mg | Vitamín B5 | 8,63 mg | |
| Vitamín K | 75 pg |
Údaje o stabilitě po přidání jiných tukových emulzí a dalších aditiv k přípravku CLINIMIX N9G20E jsou k dispozici na vyžádání.
Pokud zpozorujete mírně krémovitou konzistenci, směs pečlivě promíchejte mírnými pohyby, abyste před podáním získali homogenní emulzi.
Přidání aditiv má probíhat za aseptických podmínek.
Aditiva lze přidávat do injekčního vstupu injekční stříkačkou nebo převodním setem.
Přidání aditiva stříkačkou nebo převodním setem vybaveným jehlou:
-
– Připravte injekční vstup (samostatný vstup, viz obr. 2 SPC).
-
– Propíchněte jej a injikujte aditivum.
-
– Dobře promíchejte roztok s aditivem
Přidání aditiv převodním setem vybaveným hrotem:
-
– Prosím postupujte podle návodu k použití příslušného převodního setu pro lipidy.
-
– Nasaďte hrot převodního setu do vstupu pro přidání lipidů (nejdelší vstup).
Inkompatibility
Aditiva mohou být inkompatibilní, obraťte se na jejich výrobce pro další podrobnosti.
Pokud jsou aditiva nezbytná, musí být ověřena jejich kompatibilita a stabilita směsi musí být kontrolována.
Roztok nesmí být podáván před, během nebo po transfuzi krve tímtéž infuzním zařízením, protože by mohlo dojít k pseudoaglutinaci.
Přípravek CLINIMIX NN9G20E obsahuje ionty vápníku, které představují další riziko vzniku sraženiny u krve nebo jejich komponentů ošetřených citrátovými antikoagulanty.
Podobně jako u jiné parenterální směsi se musí vzít v úvahu poměr vápníku a fosfátu. Nadměrné přidání vápníku a fosfátu, zejména ve formě minerálních solí, mohou vést ke tvorbě sraženiny fosforečnanu vápenatého.
Podobně jako u jiných infuzních roztoků obsahujících vápník je u novorozenců (ve věku <28 dní) kontraindikovaná současná léčba ceftriaxonem, i pokud se použije samostatný infuzní set (fatální riziko precipitace ceftriaxonové soli v krevním oběhu novorozence).
U pacientů starších 28 dní (včetně dospělých) se nesmí ceftriaxon podávat současně s intravenózními roztoky obsahujícími vápník stejným infuzním setem (viz odstavec Upozornění).
Jestliže se použije stejný set pro sekvenční podání, musí být set mezi infuzemi důkladně propláchnut kompatibilní tekutinou.
-
5. DOBA POUŽITELNOSTI
2 roky při uchovávání v zevním přebalu
Doporučuje se použít přípravek okamžitě po protržení těsnícího švu mezi 2 komorami. Avšak po rekonstituci (tj. po protržení těsnícího švu) byla stabilita rekonstituované emulze prokázána na 7 dní při 2 až 8 °C a následně 48 hodin při teplotě do 25 °C.
Po přidání aditiv má být směs z mikrobiologického hlediska ihned použita. Není-li ihned použita, zodpovídá za dobu a podmínky uchovávání před použitím uživatel. Doba použitelnosti by neměla překročit 24 hodin při teplotě 2 až 8 °C, pokud přidání aditiv neproběhlo za kontrolovaných a validovaných aseptických podmínek. Pokud je za výjimečných okolností požadována delší doba uchovávání, lze kontaktovat výrobce, protože jsou k dispozici údaje o stabilitě před použitím po dobu 7 dnů při 2–8 °C a následně 48 hodin při teplotě do 25 °C pro přípravky uvedené v předchozím bodu.
12
Další informace o léčivu CLINIMIX N9G20E
Jak
se CLINIMIX N9G20E
podává: intravenózní podání - infuzní roztok
Výdej
léku: na lékařský předpis
Balení: Vak
Velikost
balení: 8X1000ML
Držitel rozhodnutí o registraci daného léku v České republice:
Baxter Healthcare Limited, Thetford
E-mail: magdalena_brunova@baxter.com; dana_sladeckova@baxter.com
Telefon: 225774141, 225774143
