Souhrnné informace o léku - AFLURIA
1. NÁZEV PŘÍPRAVKU
AFLURIA, injekční suspenze v předplněné injekční stříkačce
Vakcína proti chřipce (štěpený virion, inaktivovaná)
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ"
Virus chřipky* (inaktivovaný P-propiolaktonem, štěpený) obsahující následující kmeny:
A/Michigan/45/2015 (H1N1) pdm09 – varianta kmene 15 mikrogramů HA
(A/Singapore/GP1908/2015, IVR-180A)
A/Hong Kong/4801/2014 (H3N2) – varianta kmene 15 mikrogramů HA
(A/Hong Kong/4801/2014, NYMC X-263B)
B/Brisbane/60/2008 – varianta kmene 15 mikrogramů HA
(B/Brisbane/46/2015, divoký typ)
V dávce 0,5 ml.
* připraveno v oplodněných slepičích vejcích ze zdravých kuřecích chovů
hemaglutinin
Vakcína vyhovuje doporučení WHO (pro severní polokouli) a rozhodnutí EU pro sezónu 2017/2018.
Úplný seznam pomocných látek viz bod 6.1.
Přípravek AFLURIA může obsahovat stopy vajec jako ovalbumin, zbytky neomycinu a polymixinu, které jsou použity v průběhu výrobního procesu (viz bod 4.3).
3. LÉKOVÁ FORMA
Injekční suspenze v předplněné injekční stříkačce.
Čirá až slabě opalescentní suspenze s možným sedimentem, který se po protřepání rozpustí.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Profylaxe chřipky, zejména u osob se zvýšeným rizikem přidružených komplikací.
Přípravek AFLURIA je indikován u dospělých a dětí od 5 let.
Přípravek AFLURIA se má používat podle oficiálních doporučení.
4.2 Dávkování a způsob podání
Dávkování
Dospělí: 0,5 ml
Pediatrická populace
Děti od 5 let a starší: 0,5 ml.
Dětem do 9 let věku, které dosud nebyly očkovány, má být podána druhá dávka. Interval mezi dávkami musí být nejméně 4 týdny.
Způsob podání
Vakcína se má aplikovat buď intramuskulárně nebo hluboko subkutánně.
Návod na přípravu tohoto léčivého přípravku před jeho podáním je uveden v bodě 6.6.
4.3 Kontraindikace
Hypersenzitivita na léčivé látky, na kteroukoli pomocnou látku uvedenou v bodě 6.1 nebo na kteroukoli složku uvedenou jako stopová, např. vejce (ovalbumin, kuřecí bílkovina), neomycin, polymyxin.
Očkování má být odloženo u osob trpících horečnatým onemocněním nebo akutní infekcí.
4.4 Zvláštní upozornění a opatření pro použití
Pediatrická populace
V průběhu chřipkové sezóny jižní polokoule v roce 2010 byl zaznamenán nečekaný nárůst případů horečky a febrilních křečí u dětí mladších 5 let očkovaných proti sezónní chřipce tímto přípravkem. Febrilní křeče byly hlášeny méně často (tj. frekvence hlášení se pohybovala v rozmezí >1/1000 až < 1/100)*.
Zvýšený výskyt horečky byl hlášen i ve věkové skupině 5 až 9 let. Proto by mělo být rozhodnutí o vakcinaci jedinců této věkové skupiny přípravkem AFLURIA pečlivě zváženo s ohledem na poměr přínosu a rizik u každého jednotlivce.
Na základě zvýšeného rizika febrilních křečí u dětí mladších 5 let byla indikace omezena na věkovou skupinu dospělých a dětí od 5 let věku.
(*odhad z epidemiologických šetření)
Podobně jako u všech injekčních vakcín musí být pro případ, že se po aplikaci vakcíny vyvine anafylaktická reakce, okamžitě dostupná odpovídající lékařská péče a dohled.
Přípravek AFLURIA nelze v žádném případě aplikovat intravaskulárně.
U pacientů s endogenní nebo iatrogenní imunosupresí může být protilátková odpověď na vakcinaci nedostatečná.
Interference se sérologickými testy
(viz bod 4.5)
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Přípravek AFLURIA lze podat současně s jinými vakcínami, tyto vakcíny však musí být aplikovány do různých končetin. Nežádoucí účinky však mohou být výraznější.
Imunologická odpověď na vakcinaci může být snížena při současné imunosupresivní terapii.
Po vakcinaci proti chřipce byly pozorovány falešně pozitivní výsledky sérologických testů užívající ELISA metodu na stanovení protilátek proti HIV1, hepatitidě C a zejména proti HTLV1. Tyto falešně pozitivní výsledky v ELISA testech lze vyloučit technikou Western Blot. Přechodné falešné pozitivní reakce mohou být způsobeny odpovědí IgM na vakcinaci.
4.6 Fertilita, těhotenství a kojení
Těhotenství
Inaktivované vakcíny proti chřipce mohou být použity ve všech stádiích těhotenství. Ve srovnání s prvním trimestrem existuje pro druhý a třetí trimestr větší soubor dat o bezpečnosti; avšak údaje o používání očkování inaktivovanými vakcínami proti chřipce celosvětově nenaznačují žádný nežádoucí vliv na plod ani matku, který by bylo možné přičíst vakcíně. Studie na zvířatech prováděné přípravkem AFLURIA neprokázaly reprodukční toxicitu (viz bod 5.3).
Kojení
Přípravek AFLURIA může být aplikován v období kojení.
Fertilita
Studie na zvířatech prováděná s přípravkem AFLURIA neprokázala nežádoucí vliv na fertilitu žen (viz bod 5.3).
4.7 Účinky na schopnost řídit a obsluhovat stroje
AFLURIA nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Nežádoucí účinky pozorované v klinických studiích
Dospělí a starší pacienti
Souhrn bezpečnostního profilu
V klinických studiích byla podána jednorázová dávka přípravku AFLURIA a informace o bezpečnosti byly získány od 11 104 dospělých ve věku od 18 do 65 let a 630 starších pacientů od 65 let věku. Klinické údaje jsou prezentovány ze 3 klinických studií; dvou placebem kontrolovaných studií u dospělých (CSLCT-FLU-05–09 a CSLCT-USF-06–28) a jedné srovnávací kontrolované studie u starších pacientů (CSLCT-USF-07–41).
Hodnocení bezpečnosti bylo pro všechny tři studie podobné. Lokální nežádoucí účinky (v místě vpichu) a systémové nežádoucí účinky byly vyžádány po 5 dnech od očkování. Nevyžádané nežádoucí účinky byly shromážděny po 21 dnech po očkování.
Frekvence vyžádaných lokálních nežádoucích účinků a systémových nežádoucích účinků a souvisejících nevyžádaných nežádoucích účinků je uvedena podle tříd orgánových systémů slovníku medicínské terminologie pro regulační činnosti (MedDRA) a frekvence pro dospělé od 18 let (tabulka 1). Mezi těmito studiemi nebylo hlášeno žádné úmrtí související s podáním vakcíny nebo vážné nežádoucí účinky související s očkováním.
U dospělých a starších pacientů nejčastěji hlášenými souvisejícími nevyžádanými nežádoucími účinky ve třech klinických studiích byly příhoda reaktogenicity (3,0%), bolest hlavy (1,1%) a artralgie (1,1%).
Tabulkový seznam nežádoucích účinků
Tabulka 1: Vyžádané lokální nežádoucí účinky, vyžádané systémové nežádoucí účinky a související nevyžádané nežádoucí účinky podle tříd orgánových systémů MedDRA a frekvence výskytu u dospělých od 18 let věku
| Třídy orgánových systémů | Velmi časté >1/10 | Časté >1/100 až <1/10 | Méně časté >1/1 000 až <1/100 |
| Poruchy nervového systému | Bolest hlavy a | Bolest hlavy b,c | |
| Gastrointestinální poruchy | Nauzea a,b | Zvracení a,b | |
| Poruchy svalové a kosterní soustavy a pojivové tkáně | Myalgie/general izované svalové bolesti a | Myalgie/generalizované svalové bolesti b Artralgie c |
| Celkové poruchy a reakce v místě aplikace | Citlivost v místě vpichu a,b Bolest v místě vpichu a,b Malátnost a | Erytém/zarudnutí v místě vpichu a,b Otok/indurace v místě vpichu a, b Zimnice/třes a,b Pyrexie/horečka a Ekchymóza/podlitina v místě vpichu a Malátnost b Příhoda reaktogenicity c | Pyrexie/horečka b Ekchymóza/podliti na v místě vpichu b |
Žádné vyžádané lokální nežádoucí účinky nebo systémové nežádoucí účinky nebyly zařazeny jako vzácné (>1/10 000 až <1/1 000) nebo velmi vzácné (<1/10 000).
a Vyžádaný lokální nežádoucí účinek nebo systémový nežádoucí účinek u dospělých od 18 do < 65 let.
b Vyžádaný lokální nežádoucí účinek nebo systémový nežádoucí účinek u starších pacientů ve věku > 65 let.
c Související nevyžádaný nežádoucí účinek.
Pediatrická populace
Souhrn bezpečnostního profilu
V klinických studiích byl přípravek AFLURIA podán a informace o bezpečnosti byly získány od 3 009 dětí ve věku od 6 měsíců do méně než 18 let. Expozice zahrnuje 1 601 dětí ve věku od 6 měsíců do méně než 5 let, 756 dětí ve věku od 5 let do méně než 9 let a 652 dětí ve věku od 9 let do méně než 18 let. Klinické údaje o bezpečnosti přípravku AFLURIA u dětí byly vyhodnoceny ze 3 klinických studií; srovnávací kontrolované studie (CSLCT-USF-07–36) a dvou otevřených nekontrolovaných studií (CSLCT-USF-06–29 a CSLCT-FLU-04–05). Děti ve věku od 6 měsíců do méně než 9 let obdržely jedno nebo dvě očkování podle předchozí anamnézy očkování.
Hodnocení bezpečnosti bylo podobné u tří pediatrických studií. Místní (v místě vpichu) a systémové nežádoucí účinky byly vyžádány po 7 dnech od očkování. Nevyžádané nežádoucí účinky byly shromážděny po 30 dnech po očkování.
U dětí ve věku od 5 do méně než 9 let, které dostaly přípravek AFLURIA ve srovnávacím kontrolovaném klinickém hodnocení, byla míra výskytu malátnosti po podání 1. dávky 24 % ve srovnání s 13 % u dětí, které dostaly srovnávací léčbu a míra výskytu průjmu po 2.dávce byla 13 % ve srovnání s 6 % u dětí, které dostaly srovnávací léčbu. Ve stejné studii byla míra výskytu horečky po podání 1. dávky přípravku AFLURIA u dětí ve věku od 5 do méně než 9 let 16 % ve srovnání s 8 % u dětí, které dostaly srovnávací léčbu. Míra výskytu horečky u dětí ve věku od 9 do méně než 18 let po podání jedné dávky přípravku AFLURIA byla 6 % ve srovnání s 4 % u dětí, které dostaly srovnávací léčbu.
Během pediatrických klinických studií byl erytém hlášen častěji u dětí ve věku od 5 do méně než 9 let ve srovnání s dětmi od 9 do méně než 18 let po jednorázové dávce (23 % oproti 17 % ve srovnávací kontrolované studii, 24 % oproti 17 % v otevřené studii). Naproti tomu bolesti hlavy byly méně často hlášeny u dětí od 5 do méně než 9 let ve srovnání s dětmi od 9 do méně než 18 let po jednorázové dávce (21 % oproti 27 % ve srovnávací kontrolované studii, 16 % oproti 27 % v otevřené studii). U dětí od 5 do méně než 9 let byly systémové nežádoucí účinky hlášeny méně často po podání 2. dávky než u 1. dávky. Mezi pediatrickými studiemi v této věkové skupině nebylo hlášeno úmrtí související s očkováním nebo vážné nežádoucí účinky související s očkováním.
Frekvence vyžádaných lokálních nežádoucích účinků a systémových nežádoucích účinků a souvisejících nevyžádaných nežádoucích účinků je uvedena podle tříd orgánových systémů MedDRA a frekvence (tabulka 2) u dětí od 5 let věku, což je v souladu s aktuální věkovou indikací pro přípravek AFLURIA.
U dětí ve věku od 5 do méně než 9 let nejčastěji hlášenými souvisejícími nevyžádanými nežádoucími účinky ve třech klinických studiích byly kašel (3,5%), infekce horních cest dýchacích (2,9%), rýma (2,2%) a rinorea (2,2%). U dětí ve věku od 9 do méně než 18 let nejčastěji hlášenými souvisejícími nevyžádanými nežádoucími účinky ve třech klinických studiích byly kašel (2,8%), orofaryngeální bolest (2,4%) a nosní kongesce (2,4%).
Tabulkový seznam nežádoucích účinků
Tabulka 2: Vyžádané lokální nežádoucí účinky, vyžádané systémové nežádoucí účinky a související nevyžádané nežádoucí účinky podle tříd orgánových systémů MedDRA a frekvence výskytu u dětí ve věku od 5 do méně než 18 let
| Třídy orgánových systémů | Velmi časté >1/10 | Časté >1/100 až <1/10 |
| Infekce a infestace | Infekce horních cest dýchacích c Rinitida c Nazofaryngitida c | |
| Poruchy nervového systému | Bolest hlavy | Bolest hlavy c |
| Respirační, hrudní a mediastinální poruchy | Kašel c d Orofaryngeální bolest c, d Nosní kongesce c Rinorea c Faryngolaryngeální bolest c | |
| Gastrointestinální poruchy | Nauzea/zvracení a Průjem a Ztráta chuti k jídlu b Zvracení/průjem b Bolest horní části břicha c Bolest břicha c | |
| Poruchy svalové a kosterní soustavy a pojivové tkáně | Myalgie/generalizované svalové bolesti | |
| Celkové poruchy a reakce v místě aplikace | Bolest v místě vpichu Erytém/zarudnutí v místě vpichu Malátnosta Podrážděnost b Otok/indurace v místě vpichu Pyrexie/horečka | Svědění v místě vpichu c Pyrexie c Onemocnění podobné chřipce c Podrážděnost c |
Žádné vyžádané lokální nežádoucí účinky nebo systémové nežádoucí účinky nebyly zařazeny jako méně časté (>1/1 000 až <1/100), vzácné (>1/10 000 až <1/1 000) nebo velmi vzácné (<1/10 000).
a Vyžádané systémové nežádoucí účinky shromážděné v klinických studiích CSLCT-USF-07–36 a CSLCT-USF-06–29. b Vyžádané systémové nežádoucí účinky shromážděné v klinických studiích CSLCT-FLU-04–05.
c Související nevyžádaný nežádoucí účinek u dětí ve věku od 5 do < 9 let. d Související nevyžádaný nežádoucí účinek u dětí ve věku od 9 do < 18 let.
Nežádoucí účinky hlášené při postmarketingovém sledování
Následující nežádoucí účinky byly spontánně hlášeny během postmarketingového sledování přípravku AFLURIA a jsou doplňkem k účinkům pozorovaným během klinických studií. Hlášené nežádoucí účinky jsou uvedeny níže podle tříd orgánových systémů:
Poruchy krve a lymfatického systému:
Trombocytopenie, přechodná lymfadenopatie.
Poruchy imunitního systému:
Alergická nebo okamžitá hypersenzitivní reakce včetně anafylaktického šoku.
Poruchy nervového systému:
Neuralgie, parestézie, křeče (včetně febrilních křečí), encefalomyelitida, neuritida nebo neuropatie a syndrom Guillain-Barré.
Cévní poruchy:
Vaskulitida, která může být spojená s přechodným postižením ledvin.
Poruchy kůže a podkožní tkáně:
Pruritus, kopřivka a vyrážka.
Celkové poruchy a reakce v místě aplikace:
Celulitida a velké otoky v místě vpichu, onemocnění podobné chřipce.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:.
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky:
4.9 Předávkování
Je velmi nepravděpodobné, že by předávkování mělo za následek nežádoucí účinky.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: vakcína proti chřipce, ATC kód: J07B B02.
Séroprotekce je obvykle dosaženo během 2 až 3 týdnů. Trvání postvakcinační imunity ke kmenům homologním nebo kmenům blízce příbuzným těm, které byly použity ve vakcíně, se liší, ale obvykle se pohybuje od 6 do 12 měsíců.
5.2 Farmakokinetické vlastnosti
U vakcín není hodnocení farmakokinetických vlastností požadováno.
5.3 Předklinické údaje vztahující se k bezpečnosti
V reproduční a vývojové toxikologické studii byl hodnocen vliv přípravku AFLURIA na embryofetální a postnatální (do konce laktačního období) vývoj březích samic potkanů. Nebyly pozorovány žádné nežádoucí účinky na páření, fertilitu, březost, porod, laktační parametry a embryofetální nebo postnatální (do konce laktačního období) vývoj. Nebyly zjištěny žádné malformace plodu nebo jiné důkazy teratogenity způsobené vakcinací.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Chlorid sodný
Bezvodý hydrogenfosforečnan sodný
Dihydrát dihydrogenfosforečnanu sodného
Chlorid draselný
Dihydrogenfosforečnan draselný
Chlorid vápenatý
Voda na injekci
6.2 Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky.
6.3 Doba použitelnosti
15 měsíců
6.4 Zvláštní opatření pro uchovávání
Uchovávejte v chladničce (2 °C až 8 °C). Nezmrazujte.
Uchovávejte injekční stříkačku v krabičce, aby byl přípravek chráněn před světlem.
6.5 Druh obalu a obsah balení
0,5 ml injekční suspenze v předplněné injekční stříkačce (sklo třídy I) s pístovou zátkou (chlorobutylová pryž), s jehlou nebo bez jehly. Velikost balení: 1 nebo 10 injekčních stříkaček. Injekční stříkačka s jehlou může být dodávána s ochranným krytem jehly nebo bez ochranného krytu jehly.
Na trhu nemusí být všechny velikosti balení.
Viz bod 6.6 návod k použití.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Vakcína má mít před aplikací pokojovou teplotu. Před použitím protřepejte. Po protřepání se má vakcína jevit jako homogenní suspenze. Před podáním je nutné vizuálně zkontrolovat suspenzi. V případě jakékoliv odchylky od fyzického vzhledu (viz bod 3), vakcína nesmí být použita.
Přípravek AFLURIA je dodáván jako jednorázová injekční stříkačka a veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky.
Pro podání pomocí injekční stříkačky s jehlou a s ochranným krytem jehly postupujte podle následujícího schématu.
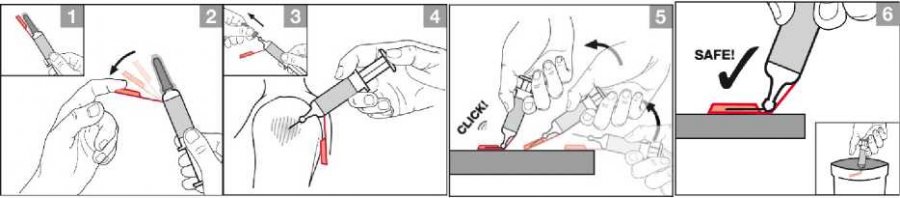
1–2: Ohněte oranžový plastový ochranný kryt jehly směrem na bok.
3–4: Sejměte průhledný plastový kryt jehly a šedý kryt jehly a aplikujte injekci. Intramuskulární podání vakcíny proti chřipce by mělo být provedeno injekcí do deltového svalu v horní části paže.
5: Umístěte oranžový ochranný kryt jehly proti stabilnímu, tvrdému povrchu a poté zatlačte do krytu ohnutím injekční stříkačky. Pokračujte v pohybu, dokud se jehla neohne přibližně o 90 stupňů a pak slyšitelně zapadne do krytu.
6: Jehla je nyní zabezpečena pro bezpečnou likvidaci v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Seqirus GmbH
Emil-von-Behring-StraBe 76
35041 Marburg
Německo
8. REGISTRAČNÍ ČÍSLO(A)
59/241/14-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
2. 7. 2014
Další informace o léčivu AFLURIA
Jak
se AFLURIA
podává: subkutánní/intramuskulární podání - injekční suspenze v předplněné injekční stříkačce
Výdej
léku: na lékařský předpis
Balení: Předplněná injekční stříkačka
Velikost
balení: 1X0,5ML+1J II
Držitel rozhodnutí o registraci daného léku v České republice:
Seqirus GmbH, Marburg
E-mail: info@pharmazet.com
Telefon: +420 774 559 969, +420 220 990 139
